基因测序结合传统微生物培养用于胀罐酱油中产气菌的检测
杨卓,杨欢岚,姚泓,周晓伟,唐书泽,吴希阳*
1(暨南大学 食品科学与工程系,广东 广州,510632) 2(岭南国际企业集团有限公司,广东 广州,510064)
基因测序结合传统微生物培养用于胀罐酱油中产气菌的检测
杨卓1,杨欢岚1,姚泓1,周晓伟2,唐书泽1,吴希阳1*
1(暨南大学 食品科学与工程系,广东 广州,510632) 2(岭南国际企业集团有限公司,广东 广州,510064)
以工厂胀罐酱油为研究对象,对导致酱油胀罐的产气菌进行分离和鉴定。使用高盐MRS培养基 (含6% NaCl)分离到一种厌氧菌,经产气实验证明该菌是导致酱油产气胀罐的原因,经16S rDNA基因测序以及高通量测序确证该厌氧产气菌为破布子乳酸杆菌 (Lactobacilluspobuzihii);采用高盐PDA培养基没有分离到酵母菌,且用多对18S rRNA引物对提取的基因组DNA进行PCR扩增阴性,证明酱油胀罐的原因为污染了破布子乳酸菌且没有酵母菌或其他真菌污染。该研究显示了基因测序方法对于食品中未知、难培养微生物污染的检测具有优越性。
胀罐酱油;高通量测序;分离鉴定;破布子乳酸杆菌(Lactobacilluspobuzihii)
酱油是我国常用调味品,其中若存在腐败微生物则会出现不良风味,并影响口感[1]。若是酱油出现产气、胀罐(胀袋)、爆瓶现象,均可能导致酱油的营养成分被破坏、pH值发生改变、产生有毒物质等,进而造成经济损失[2]。酱油中导致胀罐产气的微生物主要有肠杆菌、乳酸菌、酵母以及丁酸梭菌等[3-4]。酱油的生产常用酵母作为发酵菌,若发酵完成后对酱油的灭菌不彻底,造成酵母菌的残留,或者酵母的二次生长,将成为安全隐患导致酱油出现胀罐等不利现象[5-6]。在酱油发酵过程中,乳酸菌对酱油风味物质的形成有着重要的作用[7]。在酱油生产过程中如果还残留有乳酸菌,某些种的乳酸菌的产气特性也会造成酱油的胀罐[8]。
传统微生物分离和鉴定主要通过形态观察、选择性培养基及生化反应等,但其特异性低、周期较长[9-10]。尤其对于未知、难培养微生物污染的检测极其困难,影响了食品生产过程中的质量与安全的检控。现代生物技术和分子生物学的蓬勃发展,16S rRNA、18S rRNA序列测定技术、高通量测序技术等新方法出现,研究人员可不再完全依赖传统方法来研究微生物[11]。微生物的rRNA在碱基组成、碱基的序列、生物功能及高级结构等方面表现出的高度保守性以及部分可变性[12-13],人们通常利用恒定区序列设计出通用引物从微生物标本中扩增出16S rRNA的基因片段,通过克隆测序、探针杂交、酶切片段多态性分析等方法获得16S rRNA序列信息并与数据库进行比对来鉴定菌种[14]。这种耗时短、更精确的特点使16S rRNA序列测定技术成为细菌分类和鉴定的一个有力工具[15]。同样具有相同原理的18S rRNA序列测定技术,也成为真菌鉴定的有力工具[16-19]。高通量测序被称为新一代测序,不仅通量高,而且能够同时分析上百个不同的样品,能解析复杂环境中微生物群落物种组成和相对丰度,包括细菌、真菌、酵母以及古菌,因而被广泛应用在食品中微生物多样性和群落结构组成的研究中[20-22]。本研究以2016年广州某酱油工厂出现胀罐的酱油为研究对象,分析导致胀罐的原因。在传统培养鉴定方法的基础上,结合16S rDNA高通量测序来分离和鉴定胀罐酱油样品中的产气菌,以及酱油的微生物组成,为酱油的安全检测和质量控制提供依据。
1 材料与方法
1.1材料及设备
1.1.1 实验样品
2批次胀罐酱油以及正常酱油样品来自广州某酱油厂。均为发酵生抽,1 L PPV罐包装,常温保存,胀罐酱油与正常酱油pH平均值分别为4.83、5.03,检测日期为生产日期的第35天。
1.1.2 实验试剂
MRS固体培养基、MRS肉汤培养基、磷酸盐缓冲液,广东陆桥微生物科技有限公司;分析纯NaCl,天津大茂化学试剂厂;0X TBE液、DL2000DNA maker、RR01AM TaKaRa ExTaq,大连宝生物工程有限公司;琼脂糖,广州英潍捷基贸易有限公司;粪便基因组DNA提取试剂盒,天根生化科技有限公司天根;Tap PCR Master Mix(2X,Blue dye)、引物,生工生物(上海)股份有限公司;PDA培养基,青岛高科园海博生物技术有限公司。
1.1.3 实验设备
SW-CJ-1B型单人单面净化工作台,苏州净化设备有限公司;高速冷冻离心机、冷冻高速离心机,赛默飞世尔科技(中国)有限公司;LDZX-50KBS型立式高压蒸汽灭菌器,上海申安医疗器械厂公司;XW-80A型涡旋混合器,其林贝尔仪器制造有限公司;AY6907型厌氧培养罐,美国GeneScience公司;恒温金属浴,上海博通化学科技有限公司;PYX-250S-A生化培养箱,科力实验仪器有限公司;微量移液器、Mastercycler Pro PCR扩增仪,德国Eppendorf公司;C-22厌氧指示剂、C-1厌氧产气袋,日本三菱株式会社;PL602-S电子天平,METTLER TPLEDO;Tocan/Tocan240凝胶成像仪,Bio-rad;DYCZ-24DN核酸电泳仪,北京市六一仪器厂。
1.2方法
1.2.1 培养基及配制
MRS培养基购自广东陆桥微生物科技有限公司,高盐MRS培养基在MRS培养基里添加6% NaCl,121 ℃灭菌15 min。
灭菌酱油:取胀罐的酱油15 mL,105 ℃灭菌15 min。
PDA培养基购自青岛高科园海博生物技术有限公司,高盐PDA培养基在PDA培养基里添加6% NaCl,121 ℃灭菌15 min。
1.2.2 分离培养
胀罐酱油样品用磷酸盐缓冲液(PBS,pH=7.2)进行10倍稀释。选择合适的稀释倍数吸取1 mL菌悬液倒板MRS、高盐MRS、高盐PDA培养基。将MRS、高盐MRS平板置于37 ℃厌氧与好氧培养3 d,高盐PDA平板置于28 ℃生化培养箱中好氧培养5 d,观察结果并计数得到菌落总数。
1.2.3 酱油总基因组DNA的提取
取20 mL样品于50 mL离心管中离心(12 000 g,5 min),弃上清液,加入6 mL PBS置于涡旋混合器中重悬,重复离心与涡旋3次得到前处理液。 取2 mL前处理液使用天根公司的粪便基因组DNA提取试剂盒提取酱油总基因组DNA。将提取得到的DNA用nanodrop确定其浓度和纯度后置于-20 ℃冰箱中备用。
1.2.4 PCR扩增
使用1对细菌通用引物和3对真菌通用引物对酱油总基因组DNA进行PCR扩增。根据表1不同引物配制体系,再依据表2设置相应的程序进行扩增。扩增产物经1.5%的琼脂糖凝胶电泳分离。

表1 引物序列

表2 PCR反应程序
1.2.5 DNA测序
将得出特异性条带的产物和提取的DNA样品委托广州生工生物工程有限公司以及广州美吉生物医药科技有限公司分别进行16S rRNA测序以及高通量测序。
1.2.6 产气试验
将从高盐MRS培养基中分离得到的细菌接种到高盐MRS肉汤、灭菌酱油以及正常酱油中加入杜氏小管37 ℃厌氧培养3 d,观察结果。
2 结果与分析
2.1传统分离培养
本研究初期为了分离导致酱油胀罐的产气菌,采用传统的微生物培养法将酱油样品接种到常规的细菌营养培养基和MRS培养基,在好氧和厌氧条件下均无菌落生长。表明该未知的产气菌无法在普通的培养基上生长。鉴于酱油是一种高盐含量的调味品,能在这种高盐环境中生长判断该菌是一种嗜盐菌。将胀罐酱油样品接种到高盐MRS培养基,好氧培养结果为阴性,厌氧培养3 d后有菌落长出,2批胀罐酱油菌落平均数分别为370 CFU/mL和610 CFU/mL,菌落形态均一,而正常酱油样品中未检测出菌落。2004年吴瑞华等、2006年欧阳友生等在胀罐的酱油中发现产气酵母[5-6],因此为了探究是否存在产气的酵母,使用高盐PDA培养基进行培养,在28 ℃下培养5 d未观察到菌落。
2.2分子生物学鉴定
2.2.1 PCR扩增
挑取高盐MRS培养基上的菌落进行细菌DNA提取,与胀罐酱油中提取得到的DNA分别进行PCR扩增,采用细菌通用引物27F/1492R在1 500 bp左右有目标条带出现,这表明胀罐酱油中有细菌的污染。使用3对真菌通用引物未得到PCR产物,表明胀罐酱油中没有真菌的污染。未胀罐的正常酱油中无法提取到细菌基因组DNA。
2.2.2 BLAST比对结果
为了鉴定该细菌,将PCR扩增产物委托广州生工生物工程有限公司进行DNA测序。将得到的序列在NCBI上进行比对,结果显示相似度最高的菌种名称为破布子乳酸菌(Lactobacilluspobuzihii)(见表3)。
2.2.3 高通量测序
为了探究胀罐酱油中微生物群落结构,将其中3瓶胀罐的酱油提取得到的DNA(编号为1、4、4-3)送至广州美吉生物医药科技有限公司进行宏基因组测序,得到微生物群落结构图(图1)。显示4-3号胀罐酱油中主要污染了破布子乳酸菌,而其他2个样品中除了含有破布子乳酸菌,还存在普雷沃菌属(Prevotella)、粪球菌属(Faecalibacterium)、小杆菌属(Dialister)、假丁酸弧菌属(Pseudobutyrivibrio)。3个样品中破布子乳酸菌的丰度各不相同,且4号样品中普雷沃菌属的丰度超过了破布子乳酸菌。基于4-3号样品的生产日期最早,1号样品次之,4号最末,结合正常酱油中没有提取到微生物的DNA,可能原因是作为优势菌群的破布子乳酸菌在胀罐酱油中不断增殖,也与酱油中的其他菌群存在竞争,随着时间推移,最终在胀罐酱油中占主导地位。对比1号样品与4号样品可以发现,破布子乳酸菌对普雷沃菌属的抑制相较于其他细菌更加明显,具体原因有待探究。
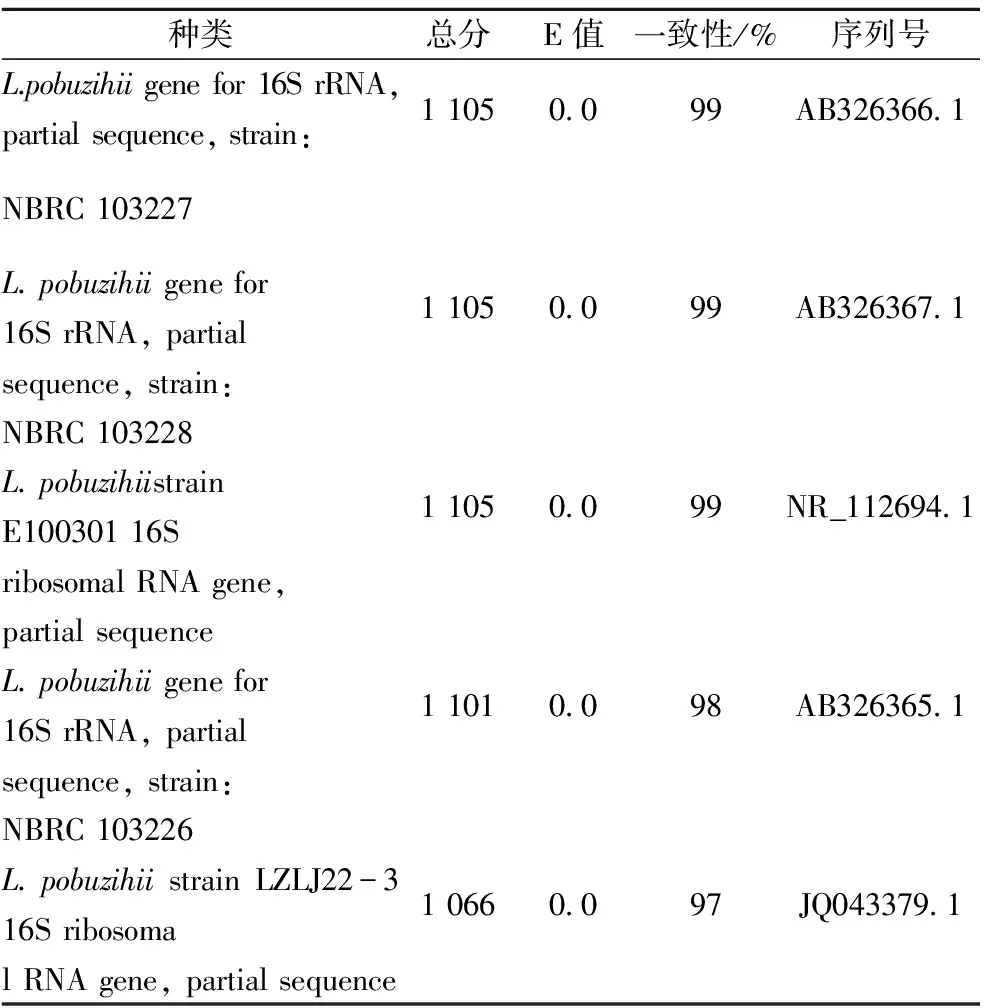
表3 目标菌株的16S rDNA序列BLAST比对结果
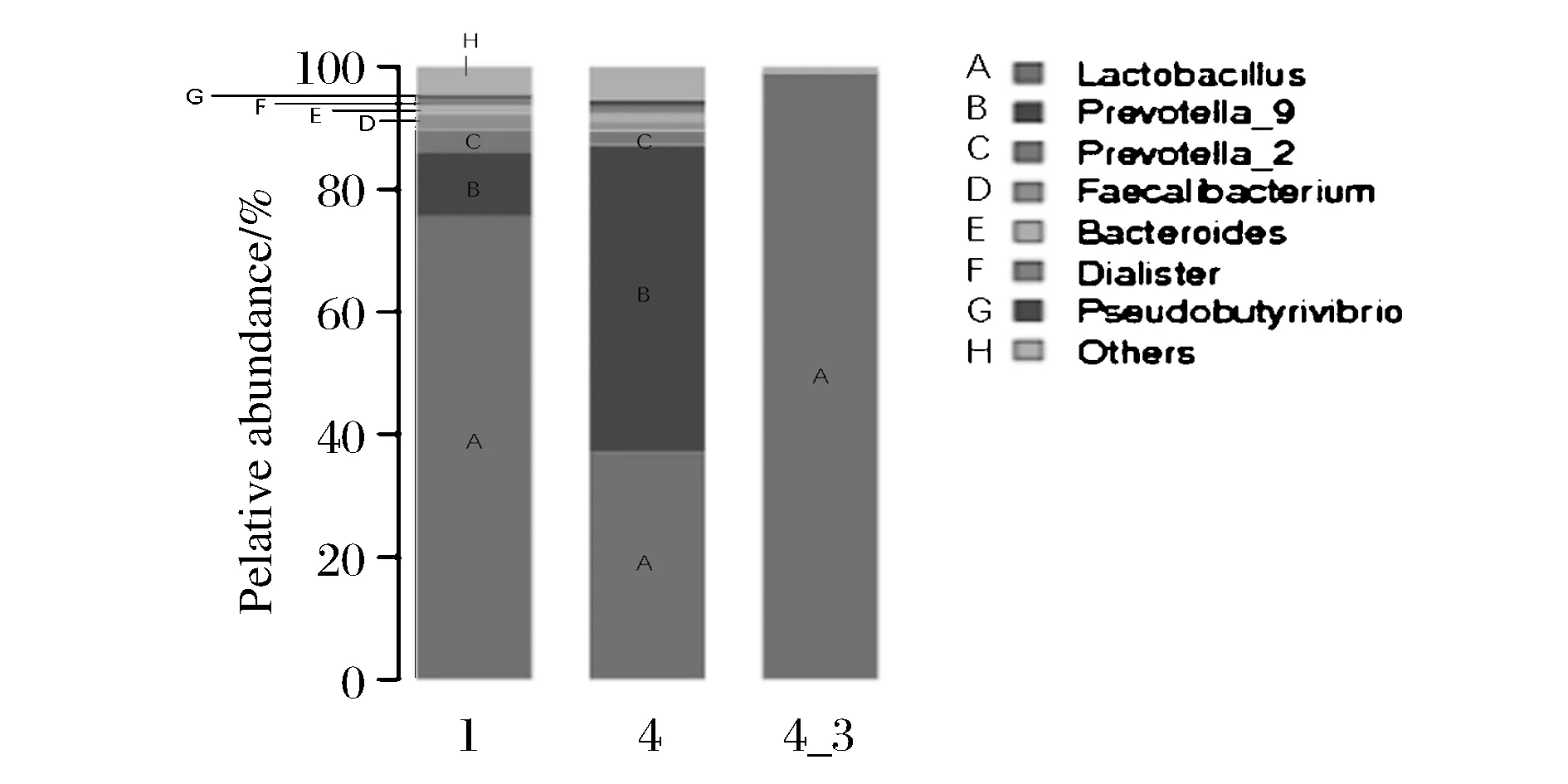
图1 微生物群落组分图Fig.1 Microbial community composition map
2.3产气检验
为了验证破布子乳酸菌是导致酱油胀罐的原因,将该分离菌接种到高盐MRS肉汤中厌氧培养3 d,杜氏小管里没有观测到气泡,在管底部仅有菌体沉淀生成。阴性对照管中没有菌体沉淀表明不存在其他细菌的污染,这说明破布子乳酸菌不能在高盐MRS肉汤中产气。本研究所用胀罐酱油样品均在工厂生产过程经过巴氏杀菌后发现胀罐现象,因此为了尽可能在杀灭细菌的同时维持酱油的营养成分不受干扰,将胀罐酱油在105 ℃下灭菌作为液体培养基,虽然有部分美拉德反应,但是大部分的营养成分保留能够提供破布子乳酸菌的生长需要,同时将正常酱油作为补充参照组。而将该分离菌接种到正常酱油以及灭菌的酱油中厌氧培养3 d后,接种了破布子乳酸菌的灭菌酱油和正常酱油中的杜氏小管里观测到气泡,阴性对照管中杜氏小管里没有观测到气泡。表明破布子乳酸菌导致了酱油的胀罐,同时破布子乳酸菌需要处于酱油的理化与营养环境中才能产气,在高盐MRS肉汤中不能产气。
3 讨论
在对广州某酱油厂的胀罐酱油进行产气菌研究时,因为不了解未知产气菌的营养要求,导致使用传统培养方法无法分离到目标菌。经提取胀罐酱油的总DNA并通过细菌16S rDNA测序分析发现该产气菌为破布子乳酸菌。该细菌的首次报道是从台湾高盐发酵食品破布子中用6%NaCl的盐度分离出来的一种耐高盐厌氧乳酸菌[32],本实验据此改用含6% NaCl的MRS培养基形成高盐环境,在厌氧环境培养成功,从胀罐酱油中分离得到破布子乳酸菌。在对该菌进行产气验证时,发现该细菌仅能在酱油中产气,在高盐MRS肉汤中仅能生长而不产气,具体原因有待进一步探究。
2004年吴瑞华等,2006年欧阳友生等在胀气的酱油中发现产气酵母[5-6],说明酵母污染的可能性。本实验结合18S rRNA测序以及传统分离培养方法排除了酵母或其他产气真菌的存在,最终确认导致酱油胀气的产气菌为破布子乳酸菌。显示DNA测序分析技术能快速、准确地鉴定细菌的特性,结合传统培养方法,能极大地便利未知食品腐败菌的检测。
破布子乳酸菌主要用于食品破布子的发酵[32],这是国内第1次在胀罐酱油中发现。破布子乳酸菌虽然不是致病菌,但其本身具有产气性,大量存在于酱油中,导致酱油胀罐,影响酱油的外形美观及质量。在微生物群落结构分析中发现,胀罐酱油中除了存在大量破布子乳酸菌外,还有其他细菌的存在,很可能是灌装酱油灭菌不彻底的原因。因此在酱油的生产中,应当严格把控灭菌环节,同时严格区分无菌区和有菌区,避免交叉污染,导致不合格产品的出现。
[1] 李娜.胀罐酱油污染微生物的分离鉴定与性质研究[D].广州:华南理工大学, 2015.
[2] 郭天文,叶红.解决酱油货架期涨袋、爆瓶的探讨[J].中国酿造,2010,29(3):138-140.
[3] 张小丽.胀袋酱油中产气微生物的分离鉴定与特性研究[D].杭州:浙江工商大学, 2015.
[4] 邹敏娟.造成酱油产气的微生物分离和鉴定[J].中国调味品,2013,38(9):52-55.
[5] 欧阳友生,谢小保,陈仪本,等.酱油胀罐原因分析及控制技术研究[J].微生物学通报,2005,32(4):120-123.
[6] 吴瑞华, 赵青.酱油涨袋原因及其预防措施[J].江苏调味副食品, 2004, 21(6):12-13.
[7] 赵国忠,王梦颖,姚云平,等.酱油发酵过程中的耐盐乳酸菌筛选及对低盐固态酱油品质的影响[J].食品工业科技,2015,36(13):184-188.
[8] 王瑞芝.浅述酱油产气与防范[J].中国酿造,2005, 24(8):1-4.
[9] 杨霞,陈陆,王川庆.16S rRNA基因序列分析技术在细菌分类中应用的研究进展[J].西北农林科技大学学报(自然科学版),2008,36(2):55-58.
[10] 罗雯,万雅各.采用16S rRNA基因PCR检测病原菌的研究进展[J].南昌大学学报:(理科版),2000,24(3):302-306.
[11] 周琳,张杰.群落分析中的16S rRNA及其基因16S rDNA优化扩增[J].微生物学报,2010,50(1):7-14.
[12] 叶乃芳.16S rRNA及相关技术用于临床细菌鉴定的研究进展[J].国际检验医学杂志,2015,36(4):520-522.
[13] 刘驰,李家宝,芮俊鹏,等.16S rRNA基因在微生物生态学中的应用[J].生态学报,2015,35(9):2 769-2 788.
[14] 邓卫东,成玉梅,陈静,等.基于16S/18S rRNA/rDNA的分子技术在定量瘤胃微生物中的研究进展[J].中国畜牧兽医,2006,33(12):8-13.
[15] 刘玮琦,茆振川,杨宇红,等.应用16S rRNA基因文库技术分析土壤细菌群落的多样性[J].微生物学报,2008,48(10):1 344-1 350.
[16] 耿佳靖,鲁辛辛,袁梁,等.18S rRNA基因序列分析法鉴定临床常见酵母样真菌[C].微生物实用技术生态环境应用学术研讨会,2008.
[17] 兰楠,祁高富,喻子牛,等.油菜内生真菌的分离鉴定及抑茵作用[J].华中农业大学学报,2011,30(3):270-275.
[18] 赵志祥,肖敏,郑芬,等.热带雨林土壤真菌18S rRNA基因基因多样性分析[J].安徽农业科学,2012,40(11) : 6 378-6 382.
[19] 刘宁,刘延琳.核糖体RNA基因在酵母分类鉴定中的应用[J].中国农业科学,2010,43(22):4 701-4 708.
[20] 米其利,李雪梅,管莹,等.高通量测序在食品微生物生态学研究中的应用[J].食品科学,2016,37(23):302-308.
[21] WALTER F, ALBERSMEIER A, KALINOWSKI J, et al. Complete genome sequence ofCorynebacteriumcasei, LMG S-19264 T, (=DSM 44701 T ), isolated from a smear-ripened cheese[J]. Journal of Biotechnology, 2014, 189:76-77.
[22] 王兴春,杨致荣,王敏,等.高通量测序技术及其应用[J].中国生物工程杂志,2012,32(1):109-114.
[23] YU Hao,TANG Hong-zhi,ZHU Xiong-yu, et al. Molecular mechanism of nicotine degradation by a newly isolated strain,Ochrobactrumsp. strain SJY1[J]. Applied amp; Environmental Microbiology, 2015, 81(1):272.
[24] INNISETAL M.PCR protocols: a guide to methods and applications[M]. Academic Press,Inc,1990:315-322.
[25] ROUSK J,BÅÅTH E,Brookes P C,et al. Soil bacterial and fungal communities across a pH gradient in an arable soil[J].Isme Journal,2010, 4(10):3-4.
[26] DAS M, ROYER T V, LEFF L G. Diversity of fungi, bacteria, and actinomycetes on leaves decomposing in a stream[J]. Applied amp; Environmental Microbiology, 2007, 73(3):756-767.
[27] FUENTES S, EGERT M, JIMENEZ-VALERA M, et al. A strain ofLactobacillusplantarumaffects segmented filamentous bacteria in the intestine of immunosuppressed mice[J]. Fems Microbiology Ecology, 2008, 63(1):65-72.
[28] 滕超,范园园,王雅珍,等.高产耐热木聚糖酶嗜热真菌F1208的筛选与鉴定[J].2013,13(8):231-238.
[29] 郭鹏豪,刘秀丽,崔颖鹏,等.真菌通用引物Its1和 Its4在丝状真菌鉴定中的价值评价[J].中国微生态学,2013,25(8):922-924.
[30] UYAGUARIDIAZ M I, CHAN M, CHABAN B L, et al. A comprehensive method for amplicon-based and metagenomic characterization of viruses, bacteria, and eukaryotes in freshwater samples[J]. Microbiome, 2016, 4(1):1-19.
[31] 赵辉, 李世国, 孙红炜,等. 玉米叶面微生物DNA提取方法及PCR引物的筛选[J]. 山东农业科学, 2012, 44(2):9-14.
[32] CHEN YI-SHENG, MIYASHITA M, SUZUKI K I, et al.Lactobacilluspobuzihiisp. nov. isolated from pobuzihi (fermented cummingcordia). [J]. International Journal of Systematic amp; Evolutionary Microbiology, 2010, 60(8):1 914-1 917.
Genesequencingandtraditionalmicrobialcultureforthedetectionofaerogeninswelledpackingsoysauce
YANG Zhuo1, YANG Huan-lan1, YAO Hong1, ZHOU Xiao-wei2, TANG Shu-ze1, WU Xi-yang1*
1(Department of Food Science amp; Engineering, Jinan University, Guangzhou 510632,China) 2(Lingnan International Enterprise Group Co., Ltd, Guangzhou 510064,China)
In order to identify the aerogen which causes the packing soy sauce swelled, two swelled packing soy sauce from a factory in Guangzhou were analyzed. Using MRS medium with 6% NaCl to cultivate the bacteria in swelled soy sauce, an anaerobic bacteria was isolated. It was further identified asLactobacilluspobuzihiiby using 16S sequencing and high-throughput sequencing. Yeast or fungus contamination was not detected in the swelled packing soy sauce by using high-salt PDA medium cultivation and PCR amplification with 18S rRNA primers. Therefore,Lactobacilluspobuzihiicontamination was validated as the reason causing the packing soy sauce swelled. Result of this study showed the superiority of gene sequencing method in detecting the unknown and hard-cultivated microorganism in food contamination.
Swelled packing soy sauce; high-throughput sequencing; isolation and identification;Lactobacilluspobuzihii
10.13995/j.cnki.11-1802/ts.015065
硕士(吴希阳教授为通讯作者,E-mail:tkentwu@jnu.edu.cn)。
广东省科技计划项目(2015A050502030,2016A050503031)
2017-06-29,改回日期:2017-07-12

