转化生长因子β1基因多态性与我国乙型肝炎肝硬化相关性的Meta分析
张琳 李世平 赵典朋 王蒙 耿超
转化生长因子β1基因多态性与我国乙型肝炎肝硬化相关性的Meta分析
张琳 李世平 赵典朋 王蒙 耿超
作者单位:261000 潍坊 潍坊医学院附属医院肝胆胰外科
目的探讨转化生长因子β1(transforming growth factor-β,TGF-β1)基因多态性与我国乙型肝炎肝硬化的相关性。方法检索PubMed、Cochrane Library、EMbase、中国知识资源总库(CNKI)、中国生物医学文献数据库(CBM)和万方数据库(WanFang Data),筛选TGF-β1-509及-869位点基因多态性与我国乙型肝炎肝硬化的病例对照研究,应用RevMan 5.3软件进行Meta分析。结果共纳入文献5篇,共586例乙型肝炎肝硬化患者,对照病例551例。Meta分析结果显示:FGF-β1-509位点基因型和-509位点 T等位基因与乙型肝炎肝硬化均无相关性(OR=1.04,95%CI:0.79~1.36;OR=1.09,95%CI:0.92~1.28);FGF-β1-869 位点基因型和-869 位点 C 等位基因与乙型肝炎肝硬化亦无相关性(OR=1.61,95%CI:1.17~2.21;OR=1.02,95%CI:0.82~1.27)。结论TGF-β1-509及-869位点基因型与等位基因均与我国乙型肝炎肝硬化无关联。
转化生长因子β1;基因多态性;乙型肝炎;肝硬化;Meta分析
乙型肝炎是世界性公共卫生难题,难以有效控制,肝硬化由乙型肝炎病毒对肝脏组织功能损害引发,表现为肝细胞坏死、结缔纤维组织增生、假小叶形成,后期因肝脏由代偿期转为失代偿期而出现门脉高压、多器官受累,甚至癌变,但其发病机制尚未清楚[1-3]。肝硬化具有一定“体质性”,同一症状不同患者预后可能不同,可能受遗传因素影响[4-5]。转化生长因子β1(transforming growth factor-β,TGF-β1)参与肝纤维化的形成,通过刺激胞外基质合成且阻碍降解发挥作用[6]。多项研究表明 TGF-β1-509、TGF-β1-869 位点的基因多态性均可影响TGF-β1的血液浓度,同时影响肝纤维化进展[7-8]。但众多研究结果并不一致,本研究通过对相关文献的研究结果进行合并分析,以期探讨TGF-β1基因多态性与我国乙型肝炎肝硬化的关系。
1 资料与方法
1.1 研究对象
检索已发表的关于TGF-β1基因多态性与我国乙型肝炎肝硬化相关性的病例对照研究,病例组为乙型肝炎肝硬化患者,均为符合中华医学会诊断标准[9]的我国乙型肝炎肝硬化患者;对照组为健康人群。纳入文献均为全文文献,发表语种限定中文和英文。
1.2 评价指标
主要结局指标为TGF-β1-509位点各基因型及各等位基因、TGF-β1-869位点各基因型及各等位基因。
1.3 文献检索
检索 PubMed、Cochrane Library、EMbase、中国知识资源总库(CNKI)、中国生物医学文献数据库(CBM)和万方数据(WanFang Data)等数据库,文献检索时限均为建库至2016年10月。中文关键词为“转化生长因子-β1(TGF-β1)”、“基因多态性”、“乙型肝炎”、“肝硬化”和“中国”。英文关键词为“Polymorphism”、“Hepatitis B”、“Cirrhosis”和“China”。
1.4 资料提取
由两名评价员独立评价所有纳入研究文献的质量并提取资料,如存在分歧则通过征求第三方意见解决。
1.5 统计学处理
采用Cochrane协作网提供的RevMan5.2软件进行统计分析。若研究间无异质性用固定效应模型合并效应量,若有异质性则采用随机效应模型合并效应量,再对异质性原因作进一步分析。处理效应量用优势比(ORs)和 95%可信区间(95%CI)表示,Plt;0.05为差异有统计学意义。
2 结果
2.1 纳入研究基本情况
共检索到相关英文文献54篇,中文文献33篇。经逐一筛选、评价,排除不合格或重复文献,最后纳入文献5篇,共586例乙型肝炎肝硬化患者符合入选标准进入研究,对照病例551例。纳入文献的基本情况见表1。
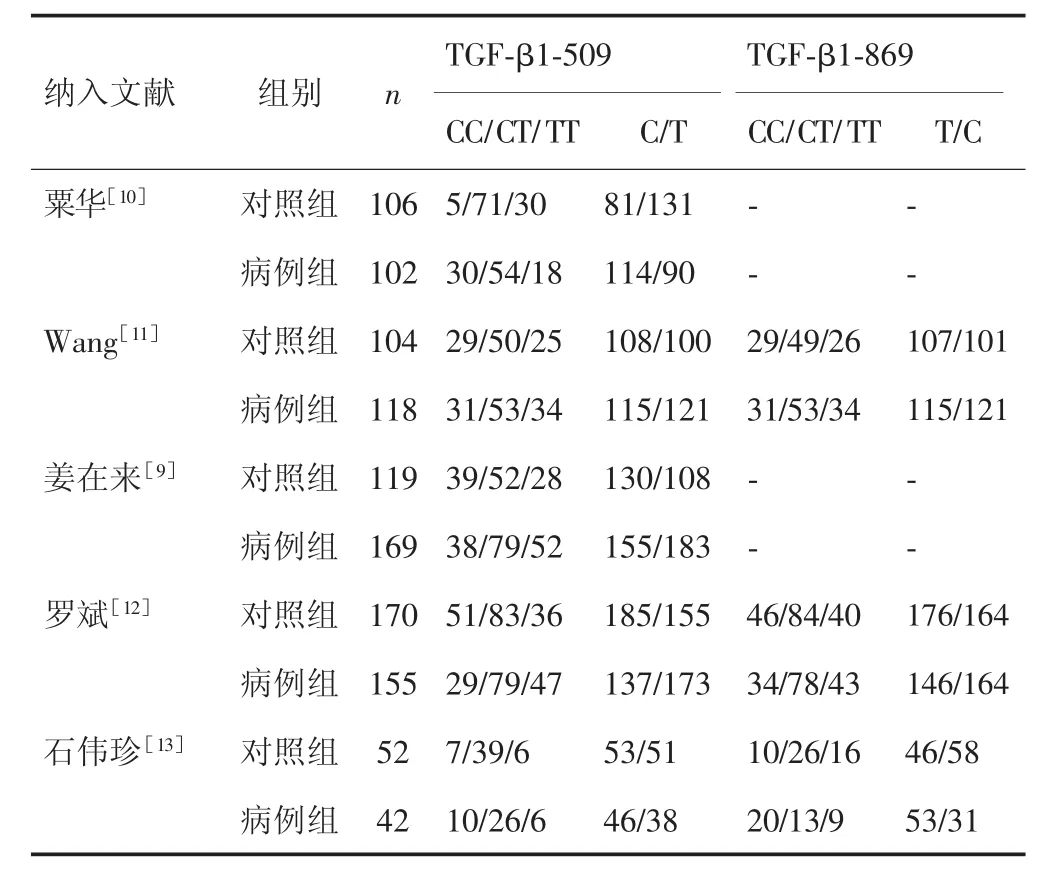
表1 纳入文献的基本情况
2.2 Meta分析结果
2.2.1 TGF-β1-509位点基因型与乙型肝炎肝硬化的关系 异质性检验结果显示存在异质性(χ2=28.18,Plt;0.001,I2=86%),故采用随机效应模型。将 TGF-β1-509位点TT及CT基因型设定为危险因素进行Meta分析,结果显示FGF-β1-509位点基因型与乙型肝炎肝硬化无相关性(OR=1.04,95%CI:0.79~1.36),见图 1。
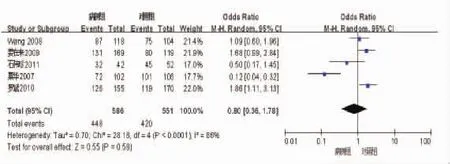
图1 TGF-β1-509基因型森林图
2.2.2 TGF-β1-509位点等位基因与乙型肝炎肝硬化关系 异质性检验结果显示存在异质性(χ2=23.54,Plt;0.001,I2=83%),故采用随机效应模型。将TGF-β1-509位点T等位基因设定为危险因素进行Meta分析,结果显示TGF-β1-509位点T等位基因与乙型肝炎肝硬化无相关性(OR=1.09,95%CI:0.92~1.28),见图 2。
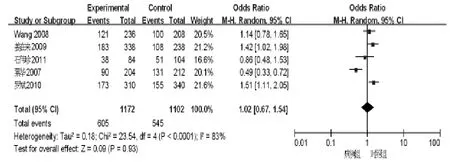
图2 TGF-β1-509等位基因森林图
2.2.3 TGF-β1-869位点基因型与乙型肝炎肝硬化的关系 异质性检验结果显示存在异质性(χ2=24.91,Plt;0.001,I2=92%),采用随机效应模型。将 TGF-β1-869位点CC及TC基因型设定为危险因素进行Meta分析,结果显示TGF-β1-509位点基因型与乙型肝炎肝硬化无相关性(OR=1.61,95%CI:1.17~2.21),见图 3。
2.2.4 TGF-β1-869位点等位基因与乙型肝炎肝硬化的关系 异质性检验结果显示存在异质性(χ2=8.23,Plt;0.001,I2=76%),故采用随机效应模型。将TGF-β1-869位点C等位基因设定为危险因素进行Meta分析,结果显示TGF-β1-869位点C等位基因与乙型肝炎肝硬化没有相关性(OR=1.02,95%CI:0.82~1.27),见图 4。
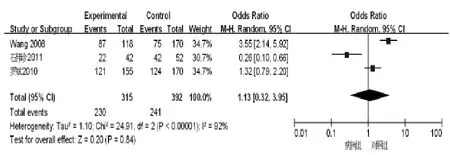
图3 TGF-β1-869基因型森林图
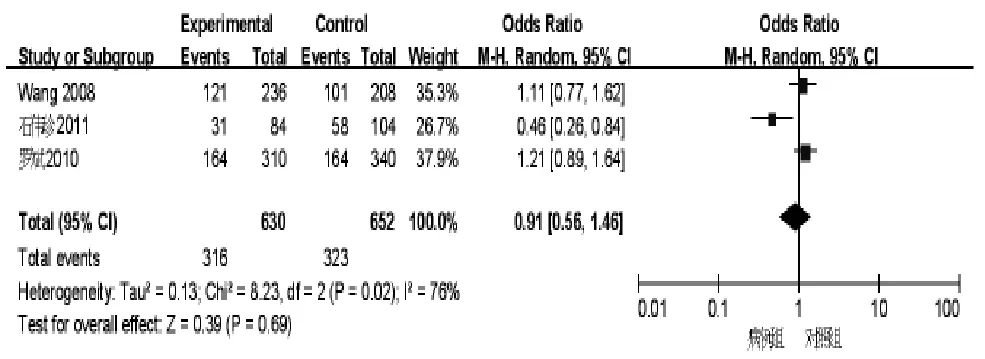
图4 TGF-β1-869等位基因森林图
3 讨论
TGF-β1是与肝纤维化发生发展密切相关的重要分子,定位于染色体19q13,存在8个SNP位点。在国外人群研究中发现 TGF-β1-509、TGF-β1-869 和 TGF-β1-988等位点可能存在基因多态性。而国内研究发现 TGF-β1-509、TGF-β1-869 两个位点亦可能存在基因多态性[14-15]。研究显示,TGF-β1-509 CT 基因多态性与阿尔茨海默病、乳腺癌、慢性乙型肝炎肝癌有关[16]。近年有关基因多态性与乙型肝炎肝硬化关系的研究较多,但结果存在较大差异。本研究通过质量评估筛选了近年 5 篇文献,探讨 TGF-β1-509、TGF-β1-869 位点与中国人群乙型肝炎肝硬化的相关性。结果发现TGF-β1-509、TGF-β1-869 位点基因多态性与乙型肝炎肝硬化无相关性,与张志强等[17]研究结果存在差异,可能由文献选择及质量评估存在差异所致。本次纳入文献亦存在相悖结论,在异质性分析中各结局指标均存在较大的异质性,因此采用随机效应模型。在TGF-β1-509 位点分析中,粟华等[10]及罗斌等[12]两篇文献得出了对立的结论,是造成异质性较大的原因,而TGF-β1-869位点异质性较大的主要原因与石伟珍等[13]的研究结论存在差异有关。但引起不同研究的结论存在差异性的原因尚不明确。
韩国一项研究发现 TGF-β1-509、TGF-β1-869 位点存在基因多态性[18]。对波西米亚人群的研究发现TGF-β1-988位点仅存在C等位基因而无A等位基因,可见在不同人群、种族之间亦存在差异性[19]。这种差异可能来自于TGF-β1在血浆中的浓度。有研究显示,TGF-β1-509 CT基因多态性对健康人群血浆浓度无影响,但在乙型肝炎肝硬化人群中,则与血浆浓度水平显著相关,TGF-β1-509 CC基因型可导致更高的TGF-β1血浆浓度[20]。同时,其他物质胶原、透明质酸等也可能影响TGF-β1的血浆浓度[21]。由此推测,TGF-β1基因多态性可能通过影响血浆浓度水平影响乙肝肝硬化的发生。
本研究发现 TGF-β1-509、TGF-β1-869 位点基因多态性与我国乙肝肝硬化无相关性,但未考虑到其他外界因素的影响、其他因子的协同作用,因此有关结论尚需进一步研究加以论证。
[1]Tana MM,Shums Z,Milo J,et al.The significance of autoantibody changes over time in primary biliary cirrhosis[J].Am J Clin Pathol,2015,144(4):601-606.
[2]Grammatikos G,Ferreiròs N,Waidmann O,et al.Serum sphingolipid variations associate with hepatic decompensation and survival in patients with cirrhosis[J].PLoS One,2015,10(9):e0138130.
[3]Nakayama H,Takayama T.Management before hepatectomy for hepatocellular carcinoma with cirrhosis[J].World J Hepatol,2015,7(20):2292-2302.
[4]丁明剑,杨文华,白杨,等.三阴型乳腺癌患者癌组织及血清转化生长因子 β1 检测的临床意义[J].山东医药,2016,56(28):58-60.
[5]何泽宝,朱坚胜,陈智,等.血清转化生长因子β1水平在慢性乙型肝炎与乙型肝炎肝硬化患者中差异的意义[J].世界华人消化杂志,2007,15(29):3104-3106.
[6]陈汇,许冰.内皮素受体拮抗剂对肝硬化大鼠转化生长因子β1和Ⅰ型胶原mRNA表达的影响[J].郑州大学学报(医学版),2011,46(5):745-747.
[7]Bosco P,Ferri R,Salluzzo MG,et al.Role of the transforminggrowth-factor-β1 gene in late-onset Alzheimer's disease:implications for the treatment[J].Curr Genomics,2013,14(2):147-156.
[8]颜蕴,李红梅.稽留流产患者绒毛组织中HGF、TGF-β1的表达变化及意义[J].山东医药,2013,53(31):62-65.
[9]姜在来,张玮,张辉,等.TNF-a,TGF-β1和IL-10基因多态性与乙型肝炎后肝硬化的关系[J].世界华人消化杂志,2009,17(31):3263-3268.
[10]粟华,吴洪磊,吕卉,等.TGFβ1和AT1R基因多态性与乙肝肝硬化遗传易感性及临床表型的关联研究[J].中华医学遗传学杂志,2007,24(3):298-301.
[11]Wang H,Zhao YP,Gao CF,et al.Transforminb growth factor beta 1 gene variants increase transcription and are associated with liver cirrhosis in Chinese[J].Cytokine,2008,43(1):20-25.
[12]罗斌,王俊利,黄重敏,等.转化生长因子-βl基因单核苷酸多态性与乙型肝炎后肝硬化的相关性研究[J].中华医院感染学杂志,2010,20(10):1389-1392.
[13]石伟珍,过建春,陈群伟,等.TGF-β1基因多态性与乙型肝炎肝硬化的相关性研究[J].医学研究杂志,2011,40(1):93-96.
[14]Babhy K,Iozzo RV,Kovalszky I.Decorin-TGF beta axis in hepatic fibrosis and cirrhosis[J].J Histochem Cytochem,2012,60(4):262-268.
[15]Bi WR,Yanb CQ,Shi Q.Transforminb growth factor-β1 induced epithelial-mesenchymal transition in hepatic fihrosis[J].Hepatogastroenterology,2012,59(118):1960-1963.
[16]Dunning AM,Ellis PD,McBride S,et al.A transforming growth factorβl signal peptide variant increases secretion in vitro and is associated withincreasedincidenceofinvasivebreastcancer[J].CancerRes,2003,63(10):2610-2615.
[17]张志强,吴鸣宇,蔡兵.中国人群转化生长因子-β1基因多态性与乙型肝炎后肝硬化关系的 Meta分析[[J].中国医药导报,2011,8(16):29-30.
[18]Kin Jh,Lee HS,Im JP,et al.Association of transtforming growth factor betal gene polymorphisms with a hepatoce llular carcinoma risk in patients with chronic hepatitis B virus infection[J].Exp Mo1 Med,2003,35(3):196-202.
[19]Holla LI,Fassman A,Benes P,et al.5 polymorphisms in the transforming growth factor betal gene(TGFβ1)in adult periodontitis[J].J Clin Periodontol,2002,29(4):336-341.
[20]杨再兴,王皓,高春芳,等.转化生长因子β1基因多态性对乙型肝炎肝硬化的影响[J].中华医学杂志,2005,15(15):1021-1026.
[21]田小霞,张慧英,王黎敏,等.复合致病因素诱导肝硬化大鼠TGF-α 和 TGF-β1 的动态变化[J].中国应用生理学杂志,2016,32(1):65-68.
Correlation of TGF-β1 polymorphisms with cirrhosis after Hepatitis B infec-tion in China:a meta-analysis
Zhang Lin,Li Shiping,Zhao Dianpeng,Wang Meng,Geng Chao(Department of Hepatopancreatobiliary Surgery ,Affiliated Hospital of Weifang Medical University,Weifang 261000,P.R.China)
Li Shiping.E-mail:13406674038@163.com
ObjectiveTo meta-analyze the literature on possible correlation of TGF-β1 polymorphism with cirrhosis after Hepatitis B infection in China.MethodsRelevant case-control studies were identified in PubMed,Cochrane Library,EMbase,CNKI,CBM,and WanFang databases,and data were meta-analyzed using RevMan 5.3.ResultsA total of five studies involving 586 cases were identified.Metaanalysis suggests that presence of cirrhosis after Hepatitis B infection is not significantly associated with the-509 genotype(OR=1.04,95%CI:0.79-1.36),the T allele at-509(OR=1.09,95%CI:0.92-1.28),the T allele at-869(OR=1.02,95%CI:0.82-1.27),or the-869 genotype (OR=1.61,95%CI:1.17-2.21).No significant publication bias was found.ConclusionGenotypes or alleles at the TGF-β1 polymorphisms-509 and-869 are not significantly associated with occurrence of cirrhosis after Hepatitis B infection in China.
TGF-β1;Polymorphism;Hepatitis B;Cirrhosis;Meta-analysis
R575.2
A
1674-5671(2017)05-04
10.3969/j.issn.1674-5671.2017.05.12
李世平。E-mail:13406674038@163.com
[2017-05-04收稿][2017-07-03修回][编辑 罗惠予]

