FGFR2、THBS1和THBS4在胃癌组织中的表达及临床意义
周潇 黄婷婷 邱红
FGFR2、THBS1和THBS4在胃癌组织中的表达及临床意义
周潇 黄婷婷 邱红
作者单位:430030 武汉 华中科技大学同济医学院附属同济医院肿瘤科
目的探讨成纤维细胞生长因子2型受体(fibroblast growth factor receptor 2,FGFR2)、凝血酶敏感蛋白家族(thrombospondins,THBS)成员THBS1和THBS4在胃癌组织中的表达及临床意义,并分析FGFR2与THBS1、THBS4的相关性。方法采用免疫组化SABC法检测胃癌组织中FGFR2、THBS1和THBS4的表达,并分析其与临床病理特征的关系。结果FGFR2、THBS1和THBS4在胃癌组织中的高表达率分别为68.67%、57.83%和62.65%,三者在胃癌组织中的表达均高于癌旁正常组织(P<0.001)。FGFR2表达与肿瘤浸润深度(P=0.003)和临床分期(P=0.009)密切相关,而与患者年龄、性别、肿块大小、分化程度及淋巴结转移无相关性(P>0.05);THBS1表达与患者的临床病理特征均无相关性(P>0.05);THBS4表达与患者肿瘤分化程度相关,高或中分化肿瘤组织THBS4的表达明显高于低分化肿瘤组织(P=0.001)。相关性分析显示FGFR2与THBS1表达呈正相关(r=0.229,P=0.037),与THBS4表达呈负相关(r=-0.213,P=0.045)。结论FGFR2、THBS1与THBS4在胃癌组织中高表达,FGFR2可能正向调控THBS1表达,而负向调控THBS4表达,其作用可能是FGFR2信号通路参与胃癌侵袭转移的分子机制之一。
胃肿瘤;成纤维细胞生长因子2型受体;THBS1;THBS4
胃癌是最常见的消化系统恶性肿瘤,近年来发病率明显降低,但患者预后并无明显改善[1]。晚期患者5年生存率不超过5%,中位生存期不足1年[2]。研究发现成纤维细胞生长因子2型受体(fibroblast growth factor receptor 2,FGFR2)在多种肿瘤组织中高表达,被认为是新的肿瘤分子靶向治疗靶点[3-4]。凝血酶敏感蛋白家族(thrombospondins,THBS)共有5个成员,可介导癌细胞与间质细胞及正常组织细胞间的相互作用,参与肿瘤的发生发展[5]。胃癌及癌间质中THBS1及THBS4表达情况报道不一致,已有学者关注FGFR家族与THBS家族之间的关系。本研究旨在探讨FGFR2、THBS1及THBS4在胃癌组织中的表达及其临床意义,并分析FGFR2与THBS1、THBS4表达之间的相关性,以期为胃癌临床诊疗和预后评价提供参考。
1 材料与方法
1.1 组织标本
收集我院2014年1月~10月行手术切除的胃癌组织标本83例,所有患者术前均未接受放疗或化疗,术后均经病理学确诊。其中男性52例,女性31例;年龄27~81岁,中位年龄 53岁;肿块>4 cm 39例,≤4 cm 44例;低分化腺癌46例,高或中分化腺癌37例;胃癌分期依据国际抗癌联盟发布的第八版AJCC胃癌病理分期标准:Ⅰ~Ⅱ期35例,Ⅲ~Ⅳ期48例。以距肿瘤组织5 cm以外的正常胃组织为对照组。
1.2 试剂
兔抗人FGFR2单克隆抗体购于美国Cell Signaling Technology公司,兔抗人THBS1多克隆抗体购于美国Origene公司,兔抗人THBS4多克隆抗体购于美国Abgent公司。SABC检测试剂盒及DAB显色液均购于武汉博士德生物工程有限公司。
1.3 方法
所有石蜡组织切片均经烘干、脱蜡、水化、灭活内源性酶和抗原修复后,用5%BSA室温封闭30 min,加入对应一抗4℃孵育过夜,PBS冲洗后,滴加生物素化山羊抗兔IgG,PBS冲洗后滴加SABC试剂,20 min后再次PBS冲洗,DAB显色试剂盒显色,蒸馏水洗涤后苏木素轻度复染,脱水、透明、封片,显微镜下观察,以PBS代替一抗作为阴性对照。
1.4 免疫组化评分判定
每张切片随机选取5个视野,根据阳性细胞比例及染色强度判读每个视野的评分。阳性细胞比例:lt;10%为0分,10%~30%为1分,30%~50%为2分,gt;50%为3分。染色强度:未着色为0分;轻度着色为1分;中度着色为2分;强着色为3分。每个视野评分=阳性细胞比例得分×染色强度得分。5个视野评分的平均值为该切片的最终评分。本研究以≥4分定义为高表达,lt;4分为低表达。
1.5 统计学方法
采用IBM SPSS Statistics 19.0软件进行数据分析。FGFR2、THBS1和THBS4与各项临床病理特征之间的关系采用 χ2检验或 Fisher确切概率法;FGFR2与THBS1、THBS4之间的相关性分析采用Spearman等级相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 FGFR2、THBS1和THBS4在胃癌组织中的表达
FGFR2表达于细胞质(图1A),FGFR2高表达率为68.67%(57/83);THBS1和THBS4在细胞质与细胞间质中均有表达(图1B-C),高表达率分别为57.83%(48/83)和 62.65%(52/83)。三者在胃癌组织中的表达均高于癌旁正常组织(P<0.001),见图2。
2.2 FGFR2、THBS1和THBS4的表达与临床病理特征的关系
肿瘤浸润程度深的患者(T4期)肿瘤组织中FGFR2的表达明显高于肿瘤浸润程度较浅的患者(T1期/T2期/T3期)(P=0.003),Ⅲ期和Ⅳ期患者 FGFR2表达亦明显高于Ⅰ期和Ⅱ期患者(P=0.009),提示FGFR2表达与胃癌患者肿瘤浸润深度和临床分期密切相关(P<0.05),而 FGFR2表达与患者的年龄、性别、肿块大小、分化程度及淋巴结转移无相关性(P>0.05)。THBS1表达与患者年龄、性别、肿块大小、分化程度、肿瘤浸润深度、淋巴结转移情况及临床分期均无相关性(P>0.05)。THBS4表达与肿瘤分化程度相关,高或中分化肿瘤组织THBS4的表达明显高于低分化肿瘤组织(P=0.001),与患者年龄、性别、肿块大小、肿瘤浸润深度、淋巴结转移情况及临床分期无相关性(P>0.05),见表 1。
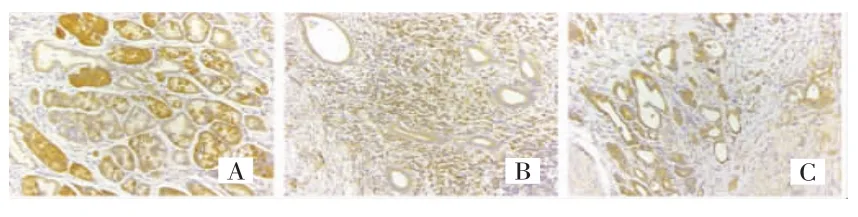
图1 FGFR2、THBS1和THBS4在胃癌组织中的表达(IHC×200)

图2 FGFR2、THBS1和THBS4在胃癌组织和癌旁正常组织中的表达
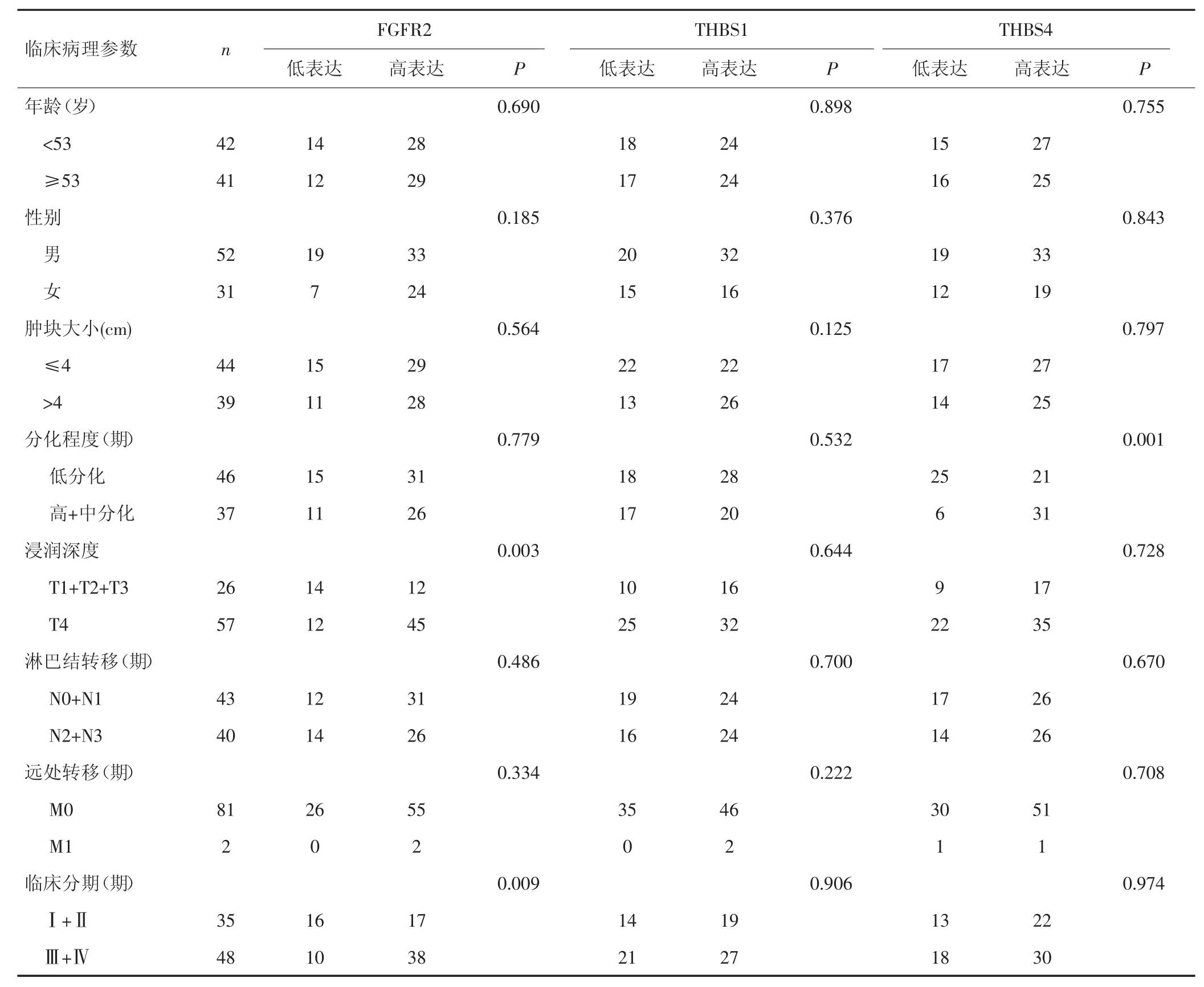
表1 FGFR2、THBS1和THBS4的表达与临床病理特征的关系(n)
2.3FGFR2表达与THBS1、THBS4表达的相关性
Spearman等级相关分析显示,FGFR2与THBS1表达呈正相关(r=0.229,P=0.037),与 THBS4表达呈负相关(r=-0.213,P=0.045)。
3 讨论
研究表明,FGFR2在肺癌、乳腺癌及胰腺癌等恶性肿瘤中过表达[3,6-7],尽管已有研究者发现 FGFR2 在胃癌组织中表达增加,但其在胃癌发生发展中的作用并不明确[8-9]。本研究检测胃癌组织中FGFR2的表达情况,发现癌组织中FGFR2的表达明显高于癌旁正常组织,且FGFR2的表达与肿瘤浸润深度及临床分期显著相关。提示FGFR2可能在胃癌侵袭转移中发挥重要作用,与以往研究认为FGFR2是一个重要的治疗靶点观点一致[4,10]。
THBS家族是一类多功能蛋白质,参与调控多种生物学过程,目前对THBS1和THBS4的相关研究尚无一致结论。THBS1可抑制肺癌和膀胱癌血管生成和肿瘤生长,而在乳腺癌和胰腺癌中的作用却相反[11]。THBS1与血管内皮细胞表面CD36结合后可抑制血管生成[12],而与 CD47 结合却促进血管生成[13]。THBS1分解成的25 KD和140 KD片段由于与不同基质金属蛋白酶及其抑制剂结合的差异,对肿瘤侵袭、转移的影响亦截然不同[14]。THBS1与淋巴管生长也有一定关系,其与单核细胞表面CD36结合后可抑制炎症诱导的淋巴管生长,并明显抑制淋巴管内皮细胞增殖和游走[15]。THBS4由于缺少TSRs序列,其抑制血管生成的作用较THBS1弱。研究表明,THBS4表达与MMP9表达密切相关,可促进肿瘤侵袭转移[16]。本研究免疫组化染色结果显示,THBS1和THBS4表达定位于细胞质及细胞间质中。以往研究发现,在甲状腺癌、乳腺癌及结直肠癌中,THBS1表达于肿瘤细胞质中[17-19],而在膀胱癌、胰腺癌和前列腺癌中,THBS1只在间质组织中表达[20-22]。Lin等[23]研究发现胃癌组织中仅肿瘤间质的成纤维细胞表达THBS1,而Nakao等[24]发现胃癌细胞质表达THBS1。提示THBS的表达具有器官和组织特异性,研究人群的异质性及使用抗体的差异均可能影响其表达分布。
本研究还发现,胃癌组织中THBS1及THBS4的表达均高于癌旁正常组织,但THBS1表达与患者的临床病理特征无显著相关性。肿瘤组织中THBS1可调控血管生成,影响肿瘤细胞的黏附、增殖、侵袭、转移及免疫反应。THBS1的多效性取决于肿瘤微环境中不同受体的存在,其与不同受体的结合可介导不同甚至相反的肿瘤生物学效应[25]。本研究得出THBS1相关结论可能是其综合效应的结果,但今后仍需深入研究其在胃癌发生发展中的作用。本研究还发现低分化胃癌组织中THBS4的表达明显低于高分化及中分化胃癌组织,表明THBS4可能具有抑制胃癌侵袭、转移的能力,但仍需进一步体内和体外实验加以证明。
已有研究者关注FGFR家族与THBS家族的相关性。THBS1可抑制FGFR2诱导的血管生成。多种细胞因子和生长因子可影响THBS1的表达,如PDGF或EGF可上调THBS1,但肿瘤坏死因子、IL-6或bFGF可下调THBS1[26-27]。在前列腺癌中,THBS1表达降低伴随着FGFR2表达升高[28]。FGFR8激活乳腺癌细胞的相关信号通路进而下调THBS1的表达[29]。THBS4在肠型胃癌及弥漫性胃癌中的表达情况完全相反,与肿瘤侵袭转移密切相关[16]。目前,FGFR2与THBS家族的相关性并不清楚。本研究通过相关性分析发现,FGFR2表达与THBS1表达呈正相关,而与THBS4表达呈负相关,推测FGFR2可能参与正向调控THBS1和负向调控THBS4,这两种调控作用可能是FGFR2信号通路参与胃癌侵袭转移过程的分子机制之一,这为探寻胃癌侵袭、转移的分子机制和胃癌的分子靶向治疗提供了新的思路。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):87-108.
[2]Thrumurthy SG,Chaudry MA,Chau I,et al.Does surgery have a role in managing incurable gastric cancer?[J].Nat Rev Clin Oncol,2015,12(11):676-682.
[3]Nomura S,Yoshitomi H,Takano S,et al.FGF10/FGFR2 signal induces cellmigrationandinvasioninpancreaticcancer[J].Br J Cancer,2008,99(2):305-313.
[4]Byron SA,Pollock PM.FGFR2 as a molecular target in endometrial cancer[J].Future Oncol,2009,5(1):27-32.
[5]Carlson CB,Lawler J,Mosher DF.Structures of thrombospondins[J].Cell Mol Life Sci,2008,65(5):672-686.
[6]Behrens C,Lin HY,Lee JJ,et al.Immunohistochemical expression of basic fibroblast growth factor and fibroblast growth factor receptors 1 and 2 in the pathogenesis of lung cancer[J].Clin Cancer Res,2008,14(19):6014-6022.
[7]Bane AL,Pinnaduwage D,Colby S,et al.Expression profiling of familial breast cancers demonstrates higher expression of FGFR2 in BRCA2-associated tumors[J].Breast Cancer Res Treat,2009,117(1):183-191.
[8]Han N,Kim MA,Lee HS,et al.Evaluation of fibroblast growth factor receptor 2 expression,heterogeneity and clinical significance in gastric cancer[J].Pathobiology,2015,82(6):269-279.
[9]Ahn S,Lee J,Hong M,et al.FGFR2 in gastric cancer:protein over-expression predicts gene amplification and high H-index predicts poor survival[J].Mod Pathol,2016,29(9):1095-1103.
[10]Byron SA,Gartside MG,Wellens CL,et al.Inhibition of activated fibroblastgrowth factor receptor 2 in endometrial cancer cells induces cell death despite PTEN abrogation [J].Cancer Res,2008,68(17):6902-6907.
[11]Horiguchi H,Yamagata S,Rong Qian Z,et al.Thrombospondin-1 is highly expressed in desmoplastic components of invasive ductal carcinoma of the breast and associated with lymph node metastasis[J].J Med Invest,2013,60(1-2):91-96.
[12]Jeanne A,Schneider C,Martiny L,et al.Original insights on thrombospondin-1-related antireceptor strategies in cancer[J].Front Pharmacol,2015,6:252.
[13]Lamy L,Foussat A,Brown EJ,et al.Interactions between CD47 and thrombospondin reduce inflammation[J].J Immunol,2007,178(9):5930-5939.
[14]Donnini S,Morbidelli L,Taraboletti G,et al.ERK1-2 and p38 MAPK regulate MMP/TIMP balance and function in response to thrombospondin-1 fragments in the microvascular endothelium[J].Life Sci,2004,74(24):2975-2985.
[15]Cursiefen C,Maruyama K,Bock F,et al.Thrombospondin 1 inhibits inflammatory lymphangiogenesis by CD36 ligation on monocytes[J].J Exp Med,2011,208(5):1083-1092.
[16]Forster S,Gretschel S,Jons T,et al.THBS4,a novel stromal molecule of diffuse-type gastric adenocarcinomas,identified by transcriptomewide expression profiling[J].Mod Pathol,2011,24(10):1390-1403.
[17]Scarpino S,Di Napoli A,Taraboletti G,et al.Hepatocyte growth factor(HGF)downregulates thrombospondin 1(TSP-1)expression in thyroid papillary carcinoma cells[J].J Pathol,2005,205(1):50-56.
[18]García-Quiroz J,Rivas-Suárez M,García-Becerra R,et al.Calcitriol reduces thrombospondin-1 and increases vascular endothelial growth factor in breast cancer cells:implications for tumor angiogenesis[J].J Steroid Biochem Mol Biol,2014,144(Pt A):215-222.
[19]Sundaram P,Hultine S,Smith LM,et al.p53-responsive miR-194 inhibits thrombospondin-1 and promotes angiogenesis in colon cancers[J].Cancer Res,2011,71(24):7490-7501.
[20]Qian X,Rothman VL,Nicosia RF,et al.Expression of thrombospondin-1 in human pancreatic adenocarcinomas:role in matrix metalloproteinase-9 production[J].Pathol Oncol Res,2001,7(4):251-259.
[21]Miyata Y,Sakai H.Thrombospondin-1 in urological cancer:pathological role,clinical significance,and therapeutic prospects[J].Int J Mol Sci,2013,14(6):12249-12272.
[22]Donmez G,Sullu Y,Baris S,et al.Vascular endothelial growth factor(VEGF),matrix metalloproteinase-9(MMP-9),and thrombospondin-1(TSP-1)expression in urothelial carcinomas [J].Pathol Res Pract,2009,205(12):854-857.
[23]Lin XD,Chen SQ,Qi YL,et al.Overexpression of thrombospondin-1 in stromal myofibroblasts is associated with tumor growth and nodal metastasis in gastric carcinoma[J].J Surg Oncol,2012,106(1):94-100.
[24]Nakao T,Kurita N,Komatsu M,et al.Expression of thrombospondin-1 and Ski are prognostic factors in advanced gastric cancer[J].Int J Clin Oncol,2011,16(2):145-152.
[25]Huang T,Wang L,Liu D,et al.FGF7/FGFR2 signal promotes invasion and migration in human gastric cancer through upregulation of thrombospondin-1[J].Int J Oncol,2017,50(5):1501-1512.
[26]Morandi V,Cherradi SE,Lambert S,et al.Proinflammatory cytokines(interleukin-1 beta and tumor necrosis factor-alpha) down regulate synthesis and secretion of thrombospondin by human endothelial cells[J].J Cell Physiol,1994,160(2):367-377.
[27]Loganadane LD,Berge N,Legrand C,et al.Endothelial cell proliferation regulated by cytokines modulates thrombospondin-1 secretion into the subendothelium[J].Cytokine,1997,9(10):740-746.
[28]Doll JA,Reiher FK,Crawford SE,et al.Thrombospondin-1,vascular endothelial growth factor and fibroblast growth factor-2 are key functional regulators of angiogenesis in the prostate[J].Prostate,2001,49(4):293-305.
[29]Tarkkonen K,Ruohola J,HrknenP.Fibroblastgrowthfactor8induced downregulation of thrombospondin 1 is mediated by the MEK/ERK and PI3K pathways in breast cancer cells[J].Growth Factors,2010,28(4):256-267.
Expression of FGFR2,THBS1 and THBS4 and correlation with gastric cancer
Zhou Xiao,Huang Tingting,Qiu Hong(Department of Oncology,Tongji Hospital Affiliated to Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430030,P.R.China)
ObjectiveTo evaluate the expression of fibroblast growth factor receptor 2(FGFR2),thrombospondins 1(THBS1)and thrombospondins 4(THBS4)in gastric cancer tissues.MethodsExpression of FGFR2,THBS1 and THBS4 was detected based on immunohistochemistry of SABC and investigate its association with pathological features.ResultsRates of high expression of FGFR2,THBS1 and THBS4 were,respectively,68.67%,57.83%,and 62.65%.Expression of all three proteins was significantly higher in gastric cancer tissue than in adjacent normal tissues.Patients with high FGFR2 expression had deeper tumor depth(P=0.003)and were in a later clinical stage(P=0.009)than patients with low FGFR2 expression.THBS1 expression showed no significant relationship with clinicopathological factors.In contrast,high THBS4 expression correlated with moderately differentiated and well-differentiated tumors(P=0.001).Correlation analysis suggests a positive correlation between FGFR2 and THBS1 expression(r=0.229,P=0.037)and negative correlation between FGFR2 and THBS4 expression(r=-0.213,P=0.045).ConclusionFGFR2,THBS1 and THBS4 expression is high in gastric cancer tissues.THBS1up-regulationandTHBS4 down-regulation by FGFR2 may be one of the molecular mechanisms of gastric cancer progression.
Qiu Hong.E-mail:tjqiuhong@163.com
Gastric neoplasms;Fibroblast growth factor receptor 2;Thrombospondins 1;Thrombospondins 4

邱红,主任医师,副教授,硕士生导师。现任华中科技大学同济医学院附属同济医院消化系统肿瘤科副主任。兼任CSCO青年委员会委员,中国抗癌协会肿瘤营养学会化疗学组委员,中国抗癌协会肿瘤标志专业委员会委员,中国研究型医院学会精准医学与肿瘤MDT专业会常务委员,世界华人肿瘤医师协会放射治疗肿瘤学协作组执行委员会常务委员,湖北省抗癌协会癌症康复及姑息治疗委员会常务委员兼秘书,湖北省临床肿瘤协会胃癌专业委员会常务委员,湖北省抗癌协会胃癌专业委员会委员等。从事肿瘤临床工作10余年,在消化系统肿瘤化疗、放疗及靶向治疗方面积累了丰富经验,承担国家级科研课题2项,吴阶平基金会课题1项,参与并获得湖北省科技进步奖三等奖1项,武汉市科技进步奖二等奖1项,发表学术论文30余篇。
R735.2
A
1674-5671(2017)05-05
10.3969/j.issn.1674-5671.2017.05.05
国家自然科学基金资助项目(81372664)
邱红。E-mail:tjqiuhong@163.com
[2017-06-30收稿][2017-07-25修回][编辑 罗惠予]

