精准医疗时代的晚期胃癌综合治疗
张娣 孙亦挺 赵泽毅 李松 刘联
精准医疗时代的晚期胃癌综合治疗
张娣 孙亦挺 赵泽毅 李松 刘联
作者单位:250012 济南 山东大学齐鲁医院肿瘤内科
胃癌是常见的恶性肿瘤,晚期胃癌发病率高,药物治疗有效率低,预后差。目前,在肿瘤治疗全面进入精准医疗时代的大形势下,化学治疗虽然进入瓶颈期,但仍是晚期胃癌综合治疗的基础。近年来,随着胃癌分子分型及发病机制研究不断深入,晚期胃癌治疗也逐渐进入靶向治疗、精准医疗与免疫治疗时代。对于晚期胃癌患者,在精准诊断的基础上合理选择上述四大治疗策略进行分层或联合治疗,有可能实现个体化治疗,获得最大生存受益。
胃肿瘤;化学治疗;靶向治疗;精准治疗;免疫治疗
胃癌是严重危害人类健康的世界第5大恶性肿瘤[1],我国胃癌发病率和死亡率均高居第2位[2]。在全球范围内,胃癌每年新增病例约952 000例,亚洲占73.5%,其中47.0%发生在中国。胃癌发病隐匿,缺乏特异性症状,我国约三分之二的胃癌患者初诊时已处于晚期,远高于日本和韩国[3]。晚期胃癌失去了手术根治的机会,而内科治疗手段有限,有效率低,因此预后较差。我国晚期胃癌5年生存率仅为10.8%[4-5]。近年来,随着精准医学理论和技术的发展,胃癌的分子病理分型研究发展较快,分子靶向治疗、免疫治疗等新兴手段不断发展,给晚期胃癌治疗带来了新的希望。本文就精准医疗时代晚期胃癌综合治疗的现状和前景进行述评。
1 化学治疗
在晚期胃癌患者中,对于局部复发或出现消化道梗阻等外科急症者,可考虑选择二次切除、放射治疗、介入治疗、造瘘引流、营养管置入等局部姑息性治疗措施,以控制局部病灶发展、减轻症状、提高生活质量。而对于已出现远处转移的晚期胃癌,全身化疗仍然是“基石”性的治疗手段。氟尿嘧啶、铂类、紫杉类、伊立替康及蒽环类药物是五大基本药物。目前,晚期胃癌一线化疗方案主要包括两药和三药方案。两药方案即氟尿嘧啶类联合铂类为主的CF方案,包括氟尿嘧啶的口服制剂卡培他滨(XP方案)或替吉奥(SP方案),铂类可以是顺铂或奥沙利铂(OX或OS方案)[6-8]。三药方案包括两大类,一类是在上述两药基础上添加紫杉类药物(DCF、DOF、DOX 方案)[7]或蒽环类药物(ECF[9]及其衍生方案 EOF、ECX、EOX[9])组成;另一类是伊立替康、亚叶酸钙及氟尿嘧啶组成的FOLFIRI方案[10]。Guimbaud 等[11]的 French Intergroup Study研究比较了ECX方案与FOLFIRI方案一线治疗晚期胃癌或食管胃交界腺癌的长期疗效,发现FOLFIRI组的中位至进展时间(mTTF)显著长于ECX组,而中位无病进展期(mPFS)和中位总生存期(mOS)两组无显著差异。基于该研究结果,NCCN指南(2015.V2版)推荐FOLFIRI作为晚期胃癌的一线治疗方案。此外,根据患者的耐受情况,还可选择有效药物的搭配,如紫杉类药物联合顺铂(DP方案)、卡铂(PC方案)、奥沙利铂(DO方案)或卡培他滨(DX方案)、替吉奥(DS方案)等,以及伊立替康与上述铂类或氟尿嘧啶口服药物联合方案。见表1。
二线及以上化疗方面,仍然是上述有效方案或药物的组合。排除一线使用药物,结合患者的身体状况和耐受能力进行选择,包括紫杉类药物、伊立替康、铂类药物、蒽环类药物、氟尿嘧啶类药物单药或组合。目前,晚期胃癌单纯化疗mPFS为4~6个月,而mOS小于 12 个月,疗效不容乐观[6-10,13]。因此,化疗虽然是晚期胃癌内科治疗最重要的手段,但其疗效已达瓶颈期,亟需探索更好的治疗方式。
2 靶向治疗
胃癌疗效不佳的主要原因是存在高度异质性,这种异质性不仅表现在不同地域与种族、不同病理类型之间,在不同患者、甚至同一胃癌不同病灶部位及不同发展阶段,均可能存在不同的分子病理学特征及遗传学改变[14-16]。传统治疗模式恰恰忽略了这种异质性,仅根据镜下病理诊断结果决定治疗方案,疗效有限,且副作用较大。近年来,靶向治疗快速发展,其特点是药物针对患者基因的某个特异性靶点发挥作用,由于选择了特殊的人群及特定的作用对象,靶向治疗较传统化疗既提高了疗效,又降低了毒副作用。目前,胃癌的潜在靶点主要包括EGFR家族相关蛋白及抗血管生成相关通路蛋白两大类,前者包括HER-2、EGFR、MET、FGFR、KRAS 等[17],后者包括 VEGF、VEGFR 等[18]。
2.1 HER-2
HER-2是目前临床意义最明确、应用最广泛的靶点。曲妥珠单抗是针对HER-2的人源化单克隆抗体,美国FDA批准用于HER-2阳性乳腺癌的治疗。ToGA研究[19]是奠定曲妥珠单抗在HER-2高表达胃癌人群治疗地位的里程碑式的研究。该研究发现,相对于XP方案(5-FU/卡培他滨+顺铂)的11.2个月,联用曲妥珠单抗后患者的OS延长到13.8个月,患者生存期首次超过了1年。尤其是IHC3+或IHC2+/FISH+亚组,化疗联合曲妥珠单抗组的mOS长达16.0个月,mPFS提高到7.6个月,客观缓解率提高到51.3%,均较单纯化疗组显著提高。曲妥珠单抗是首个在胃癌治疗中获得阳性结果的单抗,但遗憾的是,HER-2扩增在胃癌中的比例仅占10%~15%;在预后最差的弥漫性胃癌中只占2%~10%[20],临床实用价值有限。另外,针对HER-1和HER-2两个靶点的小分子酪氨酸激酶抑制剂(TKI)拉帕替尼却未能复制曲妥珠单抗的成功[21]。在一项纳入HER-2阳性的晚期胃癌一线治疗的Ⅲ期临床LOGIC研究中,XELOX方案(奥沙利铂+卡培他滨)联合拉帕替尼后mOS为12.2个月,与单纯化疗组的10.5个月比较差异无统计学意义(P>0.05)。可见,对于HER-2靶点及其靶向治疗的研究尚需进一步探索。
2.2 EGFR
EGFR是肿瘤组织中普遍高表达的一个蛋白家族,其TKI在EGFR突变的晚期非小细胞肺癌中获得较大成功。西妥昔单抗是针对EGFR的IgG1单克隆抗体,竞争性阻断EGF和其他配体结合,从而抑制细胞增殖,诱导细胞凋亡[22],在晚期结直肠癌的靶向治疗中占据重要地位。在胃癌一线治疗中,EXPAND研究[23]报道了西妥昔单抗联合XP方案(卡培他滨+顺铂)与单用XP方案的疗效,结果显示西妥昔单抗组mPFS和mOS低于XP方案组。另一个针对EGFR的帕尼单抗的REAL-3研究[24]亦得到类似结果。mTOR是EGFR下游信号通路的一个肿瘤蛋白,其TKI依维莫司在晚期乳腺癌及肾癌中疗效确切,但在晚期胃癌三线治疗患者进行的Ⅲ期GRANITE-1研究中,依维莫司并未较安慰剂显示出显著的生存获益[25]。至此,针对EGFR靶点的几个晚期胃癌临床研究均告失败。说明至少在晚期胃癌中,EGFR不是合适的靶点,其原因可能是胃癌的高度异质性干扰,导致在未经选择人群中的相应靶向治疗一再失败。
2.3VEGF/VEGFR
血管新生是肿瘤生长、转移过程中的必要环节,而VEGF/VEGFR通路在血管生成过程中发挥关键作用。VEGF家族成员主要包括VEGF-A、VEGF-B、VEGF-C及VEGF-D,各个成员还有许多异构体。VEGFR主要包括 VEGFR1、VEGFR2及 VEGFR3。其中,VEGF-A与VEGFR2是调节血管生成、内皮细胞增殖和迁移等生物学行为的关键分子。目前进入临床应用或研究阶段的VEGF(R)抑制剂主要包括靶向VEGF的贝伐珠单抗、阿柏西普(Afilibercept);靶向于VEGFR的大分子雷莫芦单抗(Ramucirumab)及胞内小分子TKI尼达尼布、舒尼替尼、索拉非尼、瑞戈非尼、阿西替尼、阿帕替尼等。其中,在晚期胃癌中生存获益的仅有雷莫芦单抗、阿帕替尼、瑞戈非尼等药物。
贝伐珠单抗是美国FDA批准的第一个抗血管生成药物,可用于治疗结直肠癌、非小细胞肺非鳞癌、膀胱癌等晚期恶性肿瘤[26]。一项对局部晚期或转移性胃癌的Ⅲ期临床试验研究AVAGAST显示,XP方案联合贝伐珠单抗将OS从单纯XP方案化疗的10.1个月提高到12.1个月,但差异无统计学意义[27]。与之相反,雷莫芦单抗在二线治疗的两个Ⅲ期研究中,无论是单药(REGARD研究[28])还是联合紫杉醇(RAINBOW 研究[29])OS均较对照组显著获益。针对 VEGFR2的TKI阿帕替尼是国产原研药物,在晚期胃癌三线化疗及以上的Ⅲ期研究[30]中获得成功,mOS为7.6个月,较对照组提高了2.6个月;mPFS也显著获益。另一项三线及以上晚期胃癌的Ⅱ期INTEGRATE研究显示,瑞格非尼能提高mPFS到2.6个月,而mOS虽然达5.8个月,但较安慰剂组差异无统计学意义[31]。
综合靶向治疗的研究结果(表2),目前获得OS阳性结果仅有HER-2高表达晚期胃癌一线治疗的曲妥珠单抗,针对肿瘤微环境血管新生的VEGFR2抗体雷莫芦单抗(二线单药或联合紫杉醇)和小分子TKI阿帕替尼(三线及以上化疗)。
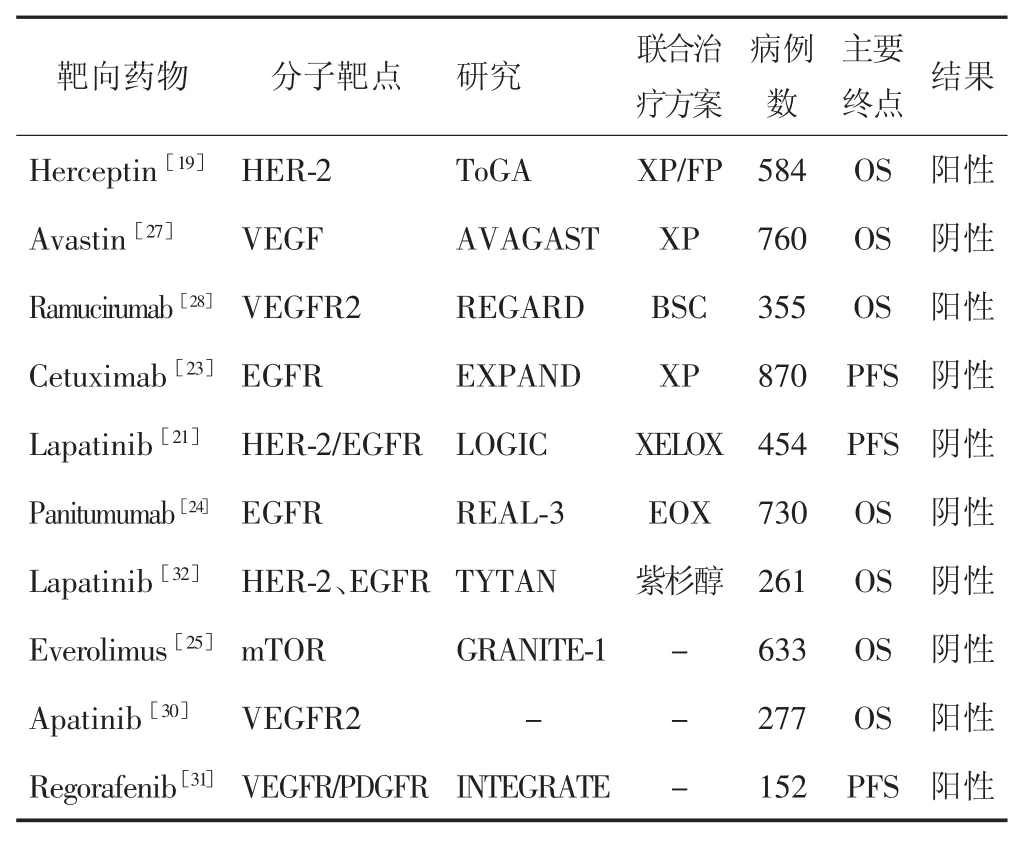
表2 胃癌靶向治疗的Ⅲ期临床研究结果
3 精准治疗
靶向治疗在胃癌治疗中的疗效有限,可能与胃癌的高度异质性有关。胃癌组织的分子特征是“同”少“异”多,需根据患者的具体分子特征进行准确诊断和个体化治疗,但对于一代测序和靶向治疗是难以完成的任务。从诊断角度来看,一代测序每次只能检测单个基因的少数几个突变,灵敏度及准确率低,只能检测已知突变,且样本需求量大,检测耗时长;从治疗角度来看,靶向治疗多针对已知的固定单个或少数几个靶点进行干预治疗,属于“以衣量人”,匹配成功概率较小。近年来,二代测序技术(nextgenerationsequencing,NGS)迅猛发展,这种高通量测序解决了一次性检测大量基因改变的难题,可同时分析点突变、碱基缺失插入突变、基因拷贝数变化和基因融合多种突变类型,而且精准度高、样本需求量少、检测周期短等。NGS技术不断进步,推动了精准医学的发展[33]。
NGS技术的发展也给胃癌的分子分型和发病机制研究带来了突破。半个世纪以来,胃癌的病理分型与发病机制研究进展缓慢。1965年的Lauren分型[34](肠型、弥漫型)因简单、实用仍在临床沿用,但其不涉及分子机制。2006年Vauhkonen等[35]发现不同的Lauren分型对化疗反应不同可能源于不同的病理分子机制,自此迈出了胃癌分子分型可贵的一步。2011年,新加坡学者基于基因芯片技术,按照基因组特征将胃癌分为基因组肠型(genomic intestinal,G-INT)和基因组弥漫型(genomic diffuse,G-DIF),G-INT 患者的预后明显优于G-DIF患者,G-INT患者对5-FU为基础的辅助化疗疗效更好,提示这种内在分型是胃癌预后的独立预测因子[36]。2013年,在此基础上又将胃癌分为间质型(mesenchymal)、增殖型(proliferative)和代谢型(metabolic),增殖型胃癌细胞存在高度的基因组不稳定性、p53突变和DNA低甲基化;代谢型对5-FU敏感,是否接受5-FU辅助治疗显著影响患者生存;而间充质型具有肿瘤干细胞的特性,高表达CD44,对PI3K/Akt/mTOR靶点抑制剂敏感[37]。这些研究拓展了胃癌分子分型及其疗效预测的研究空间,为后续研究奠定了基础。
2014年Nature在线发表的癌症基因组图谱(the cancer genome atlas,TCGA)分型[38]是 NGS 应用于胃癌分子机制研究的里程碑,引起广泛关注。研究者将胃癌患者组织和血液标本进行了6大分子平台测序分析,即成组体细胞拷贝数分析、全外显子测序、成组DNA甲基化分析、mRNA测序、miRNA测序、成组反相蛋白分析。基于对所得数据的分析整合,提出了一种全新的胃癌分子分型(EB病毒阳性型、微卫星不稳定型、基因组稳定型、染色体不稳定型)及其遗传学特征和干预对策(表3)。但TCGA研究亦未涉及各类分子分型与疗效及预后的关系,且标本取自欧美患者,对指导亚洲这一胃癌高发区的胃癌诊治价值有限。

表3 胃癌TCGA分型概览
2015年,亚洲癌症研究协作组发表了基于亚洲患者标本的ACRG分型,采用多项NGS技术将患者的遗传特征进行分类并分析了其与预后的关系[39]。研究者根据病理标本中MSI、EMT和TP53的情况将胃癌分为MSS/EMT、MSI、MSS/TP53+和MSS/TP53-4种亚型。研究发现MSI亚型预后最好,高突变(ARID1A、KRAS、PI3K-PTEN-mTOR、ALK),MLH1 缺失,DNA 甲基化,多为肠型,复发率低(22%);其次是MSS/TP53+型,其预后较好,EBV感染较多,高突变(APC、ARID1A、KRAS、PIK3CA、SMAD4);MSS/TP53-型预后较差,多合并TP53突变;MSS/EMT多为弥漫型,印戒细胞癌,CDH1表达缺失,突变率低,早期发病,复发率高(63%)。此外,MSS/EMT亚型中的腹膜种植率高于其他三种之和(64%vs 23%)。MSI型(23%)和 MSS/TP53-型(21%)的肝转移率高于MSS/EMT型(4.6%)和MSS/TP53+型(8%)。在利用NGS技术阐明胃癌发病分子机制及其与治疗和预后的关系方面,中国学者也进行了探索[40]。
目前关于胃癌的精准医疗研究多停留在基础研究阶段,但是NGS技术在短时间内挖掘的海量数据有可能突破胃癌异质性的禁锢,促进胃癌发病机制及靶点干预的研究,尤其是针对分子靶点“异病同治”理论的提出和临床研究的开展,为实现胃癌患者个体化治疗开辟了思路。
4 免疫治疗
近年来,肿瘤微环境的研究成为热点,尤其是肿瘤免疫逃逸与其周围免疫微环境的关系研究已由基础走向临床。免疫检查点程序化死亡蛋白-1及其程序化死亡配体-1/2(PD-1,PD-L1/L2)、细胞毒性 T 淋巴细胞相关蛋白4(CTLA4)与其配体的相互作用,抑制了体内细胞免疫正常发挥,导致肿瘤细胞躲避免疫监视而存活。目前上市的抗体有抗PD-1的Nivolumab、Pembrolizumab和抗 PD-L1的Atezolizumab、Avelumab等,均已获批用于恶性黑色素瘤、晚期非小细胞肺癌、膀胱癌的治疗,并在多数肿瘤中取得良好疗效。KEYNOTE-012研究[41]结果显示,Pembrolizumab在胃癌治疗中获得初步成功,多线治疗后PD-L1阳性患者仍可获得持续疗效,ORR为22%,中位缓解时间为40周,mOS为11.4个月,且安全性可控。现有的数据支持Pembrolizumab治疗晚期胃癌的研究进一步深入,如Pembrolizumab单药或联合一线化疗的Ⅱ期研究KEYNOTE-059;Pembrolizumab对比紫杉醇作为二线治疗的Ⅲ期KEYNOTE-061研究等。2017年ASCO-GI口头报告的一项Ⅲ期研究中,Nivolumab在三线及以上的单药治疗中也获得了5.3个月的OS,1年生存率为26.6%,显著高于安慰剂。抑制CTLA-4结合的Tremelimumab在晚期胃癌二线治疗中亦取得与化疗相当mPFS(4.8个月)[42]。而2016年ASCO-GI报道的CheckMate-032研究结果显示,对于化疗耐药的胃癌患者,采用Nivolumab(1 mg/kg)联合 Ipilimumab(3 mg/kg)治疗的 mOS 达6.9个月,疗效值得期待。针对免疫检查点的免疫治疗虽起步较晚,且存在较多悬而未决的问题,如疗效预测指标、疗效评价指标、免疫耐药、毒副反应等,但是在多个晚期恶性肿瘤中已展现出持久、良好和独特的疗效,因此在胃癌中的疗效值得期待。
5 结语
综上所述,化疗仍是晚期胃癌治疗的基础,基石性地位不可替代,但受到胃癌高度异质性的干扰,其疗效已进入瓶颈期。随着胃癌分子分型及发病机制研究不断进展,胃癌治疗也逐渐进入靶向治疗、精准医疗及免疫治疗的新时代。对于晚期胃癌患者,在充分利用NGS技术进行精准诊断的基础上,合理选择上述治疗策略进行分层或联合治疗,有可能实现个体化治疗的目标,获得最大的生存受益。从理论机制和目前的研究趋势来看,精准治疗(包括篮子研究和雨伞研究)和免疫治疗是晚期胃癌领域最有可能获突破的临床研究方向,有可能实现晚期胃癌患者获得长期生存的目标。
[1]Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):e359-386.
[2]Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3]Shen L,Shan YS,Hu HM,et al.Management of gastric cancer in Asia:resource-stratified guidelines[J].Lancet Oncol,2013,14(12):e535-547.
[4]Hartgrink HH,Jansen EP,van Grieken NC,et al.Gastric cancer[J].Lancet,2009,374(9688):477-490.
[5]Hundahl SA,Phillips JL,Menck HR.The National Cancer Data Base Report on poor survival of U.S.gastric carcinoma patients treated with gastrectomy:Fifth Edition American Joint Committee on Cancer staging,proximal disease,and thequot;different diseasequot;hypothesis[J].Cancer,2000,88(4):921-932.
[6]Ajani JA,Rodriguez W,Bodoky G,et al.Multicenter phase III comparison of cisplatin/S-1 with cisplatin/infusional fluorouracil in advanced gastric or gastroesophagealadenocarcinoma study:the FLAGS trial[J].J Clin Oncol,2010,28(9):1547-1553.
[7]Van Cutsem E,Moiseyenko VM,Tjulandin S,et al.Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer:a report of the V325 Study Group[J].J Clin Oncol,2006,24(31):4991-4997.
[8]Kang YK,Kang WK,Shin DB,et al.Capecitabine/cisplatin versus 5-fluorouracil/cisplatin as first-line therapy in patients with advanced gastric cancer:a randomised phase III noninferiority trial[J].Ann Oncol,2009,20(4):666-673.
[9]Cunningham D,Starling N,Rao S,et al.Capecitabine and oxaliplatin for advanced esophagogastric cancer[J].N Engl J Med,2008,358(1):36-46.
[10]Dank M,Zaluski J,Barone C,et al.Randomized phase Ⅲ study comparing irinotecan combined with 5-fluorouracil and folinic acid to cisplatin combined with 5-fluorouracil in chemotherapy naive patients with advanced adenocarcinoma of the stomach or esophagogastric junction[J].Ann Oncol,2008,19(8):1450-1457.
[11]Guimbaud R,Louvet C,Ries P,et al.Prospective,randomized,multicenter,phase Ⅲ study of fluorouracil,leucovorin,and irinotecan versus epirubicin,cisplatin,and capecitabine in advanced gastric adenocarcinoma:a French intergroup(Federation Francophone de Cancerologie Digestive,Federation Nationale des Centres de Lutte Contre le Cancer,and Groupe Cooperateur Multidisciplinaire en Oncologie)study[J].J Clin Oncol,2014,32(31):3520-3526.
[12]Koizumi W,Kim YH,Fujii M,et al.Addition of docetaxel to S-1 without platinum prolongs survival of patients with advanced gastric cancer:a randomized study(START)[J].J Cancer Res Clin Oncol,2014,140(2):319-328.
[13]Vanhoefer U,Rougier P,Wilke H,et al.Final results of a randomized phase III trial of sequential high-dose methotrexate,fluorouracil,and doxorubicin versus etoposide,leucovorin,and fluorouracil versus infusional fluorouracil and cisplatin in advanced gastric cancer:a trial of the European Organization for Research and Treatment of Cancer Gastrointestinal Tract Cancer Cooperative Group[J].J Clin Oncol,2000,18(14):2648-2657.
[14]Chau I,Ashley S,Cunningham D.Validation of the Royal Marsden hospital prognostic index in advanced esophagogastric cancer using individual patient data from the REAL 2 study[J].J Clin Oncol,2009,27(19):e3-4.
[15]Wagner AD,Grothe W,Haerting J,et al.Chemotherapy in advanced gastric cancer:a systematic review and meta-analysis based on aggregate data[J].J Clin Oncol,2006,24(18):2903-2909.
[16]Shah MA.Update on metastatic gastric and esophageal cancers[J].J Clin Oncol,2015,33(16):1760-1769.
[17]Yamada Y.Molecular therapy for gastric cancer[J].Chin Clin Oncol,2013,2(1):5.
[18]Hirashima Y,Yamada Y,Matsubara J,et al.Impact of vascular endothelial growth factor receptor 1,2,and 3 expression on the outcome of patients with gastric cancer[J].Cancer Sci,2009,100(2):310-315.
[19]Bang YJ,Van Cutsem E,Feyereislova A,et al.Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer(ToGA):a phase 3,open-label,randomised controlled trial[J].Lancet,2010,376(9742):687-697.
[20]Tanner M,Hollmén M,Junttila TT,et al.Amplification of HER-2 in gastric carcinoma:association with TopoisomeraseⅡalpha gene amplification,intestinaltype,poorprognosis and sensitivity to trastuzumab[J].Ann Oncol,2005,16(2):273-278.
[21]Hecht JR,Bang YJ,Qin SK,et al.Lapatinib in combination with capecitabine plus oxaliplatin in human epidermal growth factor receptor 2-positive advanced or metastatic gastric,esophageal,or gastroesophageal adenocarcinoma:TRIO-013/LOGiC-a randomized phaseⅢtrial[J].J Clin Oncol,2016,34(5):443-451.
[22]Imai K,Takaoka A.Comparing antibody and small-molecule therapies for cancer[J].Nat Rev Cancer,2006,6(9):714-727.
[23]Lordick F,Kang YK,Chung HC,et al.Capecitabine and cisplatin with or without cetuximab for patients with previously untreated advanced gastric cancer(EXPAND):a randomised,open-label phase 3 trial[J].Lancet Oncol,2013,14(6):490-499.
[24]Waddell T,Chau I,Cunningham D,et al.Epirubicin,oxaliplatin,and capecitabine with orwithoutpanitumumab forpatientswith previously untreated advanced oesophagogastric cancer(REAL3):a randomised,open-label phase 3 trial[J].Lancet Oncol,2013,14(6):481-489.
[25]Ohtsu A,Ajani JA,Bai YX,et al.Everolimus for previously treated advanced gastric cancer:results of the randomized,double-blind,phase III GRANITE-1 study[J].J Clin Oncol,2013,31(31):3935-3943.
[26]Hurwitz H,Fehrenbacher L,Novotny W,et al.Bevacizumab plus irinotecan,fluorouracil,and leucovorin for metastatic colorectal cancer[J].N Engl J Med,2004,350(23):2335-2342.
[27]Ohtsu A,Shah MA,Van Cutsem E,et al.Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer:a randomized,double-blind,placebo-controlled phase Ⅲstudy[J].J Clin Oncol,2011,29(30):3968-3976.
[28]Fuchs CS,Tomasek J,Yong CJ,et al.Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma(REGARD):an international,randomised,multicentre,placebo-controlled,phase 3 trial[J].Lancet,2014,383(9911):31-39.
[29]Wilke H,Muro K,Van Cutsem E,et al.Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma(RAINBOW):a double-blind,randomised phase 3 trial[J].Lancet Oncol,2014,15(11):1224-1235.
[30]Li J,Qin S,Xu J,et al.Randomized,double-blind,placebo-controlled phase III trial of apatinib in patients with chemotherapy-refractory advanced or metastatic adenocarcinoma of the stomach or gastroesophageal junction[J].J Clin Oncol,2016,34(13):1448-1454.
[31]Pavlakis N,Sjoquist KM,Martin AJ,et al.Regorafenib for the Treatment of advanced gastric cancer(INTEGRATE):a multinational placebo-controlled phaseⅡtrial[J].J Clin Oncol,2016,34(23):2728-2735.
[32]Satoh T,Xu RH,Chung HC,et al.Lapatinib plus paclitaxel versus paclitaxel alone in the second-line treatment of HER2-amplified advanced gastric cancer in Asian populations:TyTAN-a randomized,phase Ⅲ study[J].J Clin Oncol,2014,32(19):2039-2049.
[33]Jameson JL,Longo DL.Precision medicine-personalized,problematic,and promising[J].N Engl J Med,2015,372(23):2229-2234.
[34]Lauren P.The two histological main types of gastric carcinoma:diffuse and so-called intestinal-type carcinoma.an attempt at a histo-clinical classification[J].Acta Pathol Microbiol Scand,1965,64:31-49.
[35]Vauhkonen M,Vauhkonen H,Sipponen P.Pathology and molecular biology of gastric cancer[J].Best Pract Res Clin Gastroenterol,2006,20(4):651-674.
[36]Tan IB,Ivanova T,Lim KH,et al.Intrinsic subtypes of gastric cancer,based on gene expression pattern,predict survival and respond differently to chemotherapy[J].Gastroenterology,2011,141(2):476-485.
[37]Lei Z,Tan IB,Das K,et al.Identification of molecular subtypes of gastric cancer with different responses to PI3-kinase inhibitors and 5-fluorouracil[J].Gastroenterology,2013,145(3):554-565.
[38]CancerGenomeAtlasResearch N.Comprehensivemolecular characterization of gastric adenocarcinoma[J].Nature,2014,513(7517):202-209.
[39]Cristescu R,Lee J,Nebozhyn M,et al.Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes[J].Nat Med,2015,21(5):449-456.
[40]Chen K,Yang D,Li X,et al.Mutational landscape of gastric adenocarcinomainChinese:implicationsforprognosisandtherapy[J].Proc Natl Acad Sci USA,2015,112(4):1107-1112.
[41]Muro K,Chung HC,Shankaran V,et al.Pembrolizumab for patients with PD-L1-positive advanced gastric cancer(KEYNOTE-012):a multicentre,open-label,phase 1b trial[J].Lancet Oncol,2016,17(6):717-726.
[42]Ralph C,Elkord E,Burt DJ,et al.Modulation of lymphocyte regulation for cancer therapy:a phase Ⅱ trial of tremelimumab in advanced gastric and esophageal adenocarcinoma[J].Clin Cancer Res,2010,16(5):1662-1672.

刘联,教授,硕士研究生导师,山东大学血液肿瘤学博士、免疫学博士后,山东大学齐鲁医院杰出青年人才,山东大学齐鲁医院肿瘤内科主任医师。现任山东免疫学会肿瘤分子标志物及靶向治疗专业委员会主任委员,中国医师协会肿瘤分会青年委员会委员,山东医学会姑息医学分会青年委员会副主任委员,山东抗癌协会化疗分会委员、青年委员会常务委员,山东医师协会肿瘤精准医疗分会常务委员,山东老年学会靶向治疗专业委员会常务委员,山东医师协会肿瘤MDT专业委员会常务委员,国家自然科学基金通讯评委,国家食药监局新药审评中心数据核查员,山东省自然科学基金结题评审专家。长期从事肿瘤学临床、教学和科研工作,擅长消化系统肿瘤的综合治疗及胃癌腹膜转移机制的研究。主持国家自然科学基金2项,其他国家及省部级基金8项;近年发表SCI收录学术论文13篇,总影响因子超过100分,他引次数230余次。
R735.2
A
1674-5671(2017)05-07
10.3969/j.issn.1674-5671.2017.05.04
国家自然科学基金资助项目(81172487)
刘联。E-mail:lianliu@sdu.edu.cn
[2017-06-20收稿][2017-07-18修回][编辑 罗惠予]

