TOPO-1在转移性结直肠癌组织中的表达及与伊立替康化疗的相关性研究
陈绍俊 黄健 华丽 陈海辉 欧海玲 黄海欣
临床研究
TOPO-1在转移性结直肠癌组织中的表达及与伊立替康化疗的相关性研究
陈绍俊1黄健2华丽1陈海辉1欧海玲3黄海欣1
作者单位:545005 柳州 广西医科大学第四附属医院肿瘤科;530300 横县2横县人民医院肿瘤科;530023 南宁3广西中医药大学第一附属医院病理科
目的探讨拓扑异构酶1(topoisomerase1,TOPO-1)在转移性结直肠癌组织中的表达,并分析其与伊立替康(CPT-11)化疗疗效的相关性。方法经病理活检证实为转移性结直肠癌初诊者98例,均接受FOLFIRI方案一线化疗,化疗前检测肿瘤组织TOPO-1的表达水平,分析TOPO-1表达水平与近期疗效的关系,并观察远期疗效。结果TOPO-1表达水平与转移性结直肠癌的临床特征无明显相关性(P>0.05)。高表达组患者RR为52.2%(24/46),低表达组RR为28.8%(15/52),差异有统计学意义(Plt;0.05)。TOPO-1高表达组中位PFS为9.5个月(8~12个月),低表达组为8.0个月(7~9个月),差异有统计学意义(P=0.002)。结论TOPO-1高表达转移性结直肠癌患者可从伊立替康化疗中获得更高的近期疗效和更长的无疾病进展生存时间,可能对伊立替康化疗更敏感。
结直肠肿瘤;转移性结直肠癌;拓扑异构酶1;伊立替康;化疗
结直肠癌患者存在个体基因及遗传差异,因此,不同患者对相同的化疗方案敏感度也存在较大差异。伊立替康为主的方案是晚期结直肠癌主要化疗方案之一。伊立替康是喜树碱半合成衍生物,体内作用后转变为SN-38,并通过其抑制拓扑异构酶1(topoisomerase-1,TOPO-1)而影响 DNA合成,阻碍DNA单链断裂后的修复,继发性造成DNA双链不可逆性断裂,从而发挥细胞毒作用[1]。转移性结直肠癌患者伊立替康化疗的疗效存在差异,可能与关键靶酶TOPO-1的表达相关。目前国内相关研究报道不多,本研究通过检测转移性结直肠癌组织中TOPO-1的表达情况,分析其与伊立替康化疗疗效的相关性,为转移性结直肠癌患者的个体化治疗提供新思路。
1 资料与方法
1.1 研究对象
收集2014年1月至2015年12月在广西医科大学第四附属医院肿瘤科住院的转移性结直肠癌(IVA-B期,2010AJCC分期第7版)患者98例,年龄≤60岁62例,>60岁36例;男性51例,女性47例;结肠癌 49例,直肠癌49例;中高分化65例,低分化33例;肝转移60例,其他部位转移38例。纳入标准:⑴化疗前经穿刺活检,病理证实的初诊转移性结直肠癌患者;⑵以伊立替康为主的FOLFIRI方案作为一线治疗方案;⑶保存有适于进行免疫组化检测的石蜡包埋标本;⑷具有可测量病灶并能评价疗效;⑸预期生存期gt;6个月;⑹ECOG PS评分0~1分;⑺中性粒细胞≥1.5×109L-1,血小板≥100×109L-1,血肌酐lt;1.2 mg/L,总胆红素、ALT、AST及AKP≤正常参考值的2.5倍。排除标准:⑴预计生存期lt;12周;⑵患者病灶无法按RECIST标准测量评价。本研究得到广西医科大学第四附属医院伦理委员会批准,并由患者签署知情同意书。
1.2 方法
1.2.1 实验方法 免疫组化染色法采用二步法检测
TOPO-1蛋白的表达。常规脱蜡、乙醇梯度水化,TOPO-1用EDTA液(pH 7.5)修复抗原,3%H2O2去离子水孵育以抑制内源性过氧化物酶,TBS缓冲液冲洗;DAB显色、苏木素复染、脱水、透明,中性树胶封片后镜下观察。
1.2.2 免疫组化结果判定 随机选择有代表性的5个高倍镜视野(20×10)。TOPO-1免疫组化染色结果判定:根据细胞核染色程度及染色细胞百分率进行综合评分:基本不着色0分,色淡着为1分,着色适中为2分,着色深者为3分,着色细胞占计数细胞百分率≤5%为0分、6%~25%为1分、25%~50%为2分、≥51%为3分。将每张切片着色程度得分与着色细胞百分率的得分相乘为最后得分。得分≥4分记为高表达,得分<4分记为低表达。
1.2.3 化疗方案 入组患者均采用以伊立替康为主的FOLFIRI方案一线化疗,具体给药剂量及方式:伊立替康180mg/m2,静脉滴注(维持90min),第1天;甲酰四氢叶酸钙(LV)400 mg/m2,静脉滴注,第 1 天;5-FU 400 mg/m2,静脉推注,第 1 天;然后 5-FU 2 400 mg/m2,持续静脉输注46~48 h;每2周重复。至少4个周期评价疗效。
1.3 近期疗效和生存评价
完成4个周期FOLFIRI方案化疗后,进行影像学检查。按实体瘤疗效评价标准(RECIST 1.1)评价近期疗效,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD),有效率(RR)=(CR+PR)/总例数×100%。同时观察无进展生存期(PFS),PFS指从本次治疗开始到肿瘤进展的时间。通过门诊复查、住院复查及电话等途径随访,末次随访时间为2016年6月20日。
1.4 统计学方法
采用SPSS 16.0软件进行数据分析,TOPO-1表达
情况与临床特征和有效率的关系采用χ2检验;采用Kaplan-Meier法绘制生存曲线,组间比较采用logrank检验。Plt;0.05为差异有统计学意义。
2 结果
2.1 TOPO-1在转移性结直肠癌组织中的表达
TOPO-1在转移性结直肠癌组织中的表达主要集中在细胞核,见图1。98例患者中TOPO-1高表达率为 46.94%(46/98),低表达率为 53.06%(52/98)。
2.2 TOPO-1表达与转移性结直肠癌临床特征的关系
TOPO-1表达与年龄、性别、肿瘤部位、分化程度及转移部位等临床特征无关(Pgt;0.05),见表1。
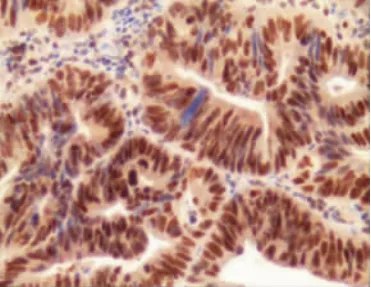
图1 TOPO-1在转移性结直肠癌组织中的表达(IHC×200)
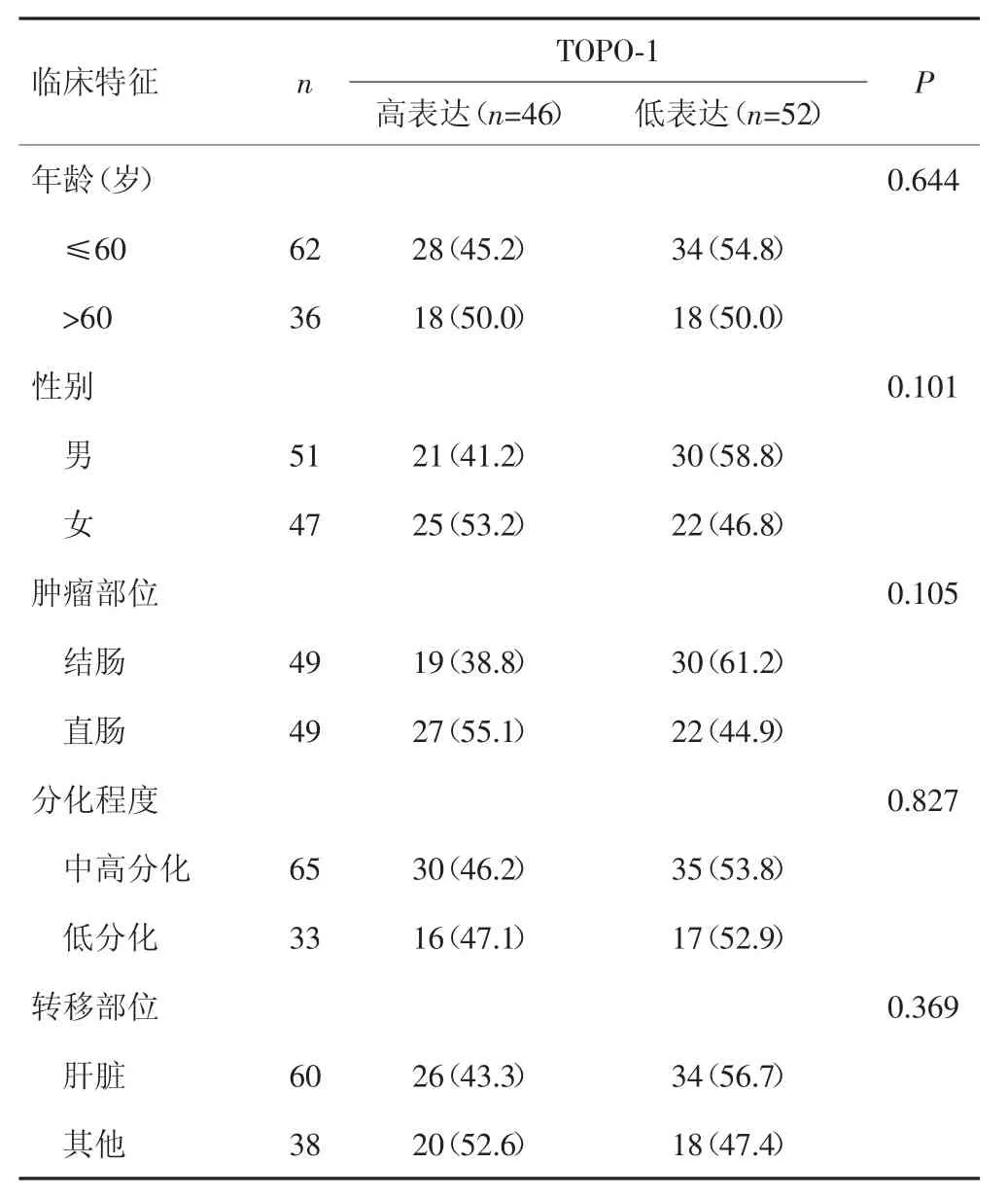
表1 TOPO-1表达与转移性结直肠癌临床特征的关系[n(%)]
2.3 TOPO-1表达与近期疗效的关系
在可评价近期疗效的98例患者中获CR4例(4.1%),PR 35例(35.7%),SD 33例(33.7%),PD 26例(26.5%),RR为39.8%。TOPO-1高表达组RR为52.2%(24/46),低表达组RR为28.8%(15/52),差异有统计学意义(P=0.019),提示TOPO-1表达与伊立替康化疗疗效相关,高表达组比低表达组有效率更高。
2.4 TOPO-1表达与无进展生存时间的相关性
98例患者中4例失访,随访率为96%,失访患者按截尾值计算处理。Kaplan-Meier法绘制生存曲线,FOLFIRI方案化疗后TOPO-1高表达组中位PFS为9.5个月(8~12个月),低表达组为8.0个月(7~9个月),两者比较差异有统计学意义(P=0.002),生存曲线见图2。
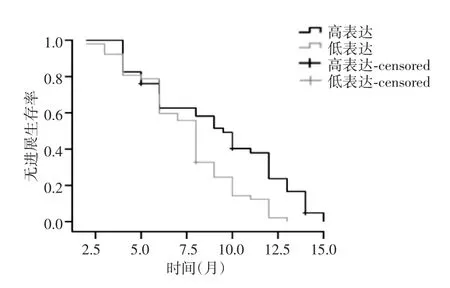
图2 TOPO-1表达与PFS的关系
3 讨论
我国结直肠癌发病率在所有消化道恶性肿瘤中高居第二位[2]。50%~60%结直肠癌确诊时已出现远处转移,其中80%~90%为不可切除的转移灶,对于这些患者,全身化疗是主要的治疗方法。尽管靶向治疗药物如贝伐珠单抗、西妥昔单抗等联合化疗已被证实可延长患者生存时间,但由于价格昂贵,目前不能为大部分患者使用。因此对晚期结直肠癌相关化疗药物的研究及探索有重要的意义[3-5]。
近年来,伊立替康等药物的加入已使结直肠癌患者中位生存期由10~12个月延长至14~16个月[6-8]。国内外多项临床研究表明采用伊立替康为基础的化疗方案可提高患者的RR、PFS和OS[9-10]。伊立替康属于喜树碱衍生物,能够特异抑制TOPO-1,而TOPO-1是一种参与调节DNA拓扑结构,并且广泛存在于真核细胞、原核细胞等生物体的酶。在DNA转录、复制时,双螺旋打开形成互不交叉的单链,通过与TOPO-1和DNA两者结合而形成稳定的复合物,特异性阻止DNA链重新组合,从而引起DNA长链断裂及再修复,使DNA产生不可逆转的永久性损伤,最终导致肿瘤细胞死亡。伊立替康在组织中经过羧酸酯酶的作用而产生有活性的代谢产物SN-38,此中间产物的抗肿瘤活性比伊立替康强,等于伊立替康抗肿瘤活性的100~1 000倍,而SN-38为DNA TOPO-1抑制剂,以其特殊的多环平面共轭结构,通过与TOPO-1-DNA复合物结合,从而阻止断裂单链再连接,阻断DNA复制叉,由此产生细胞毒性。这种细胞毒性具有时间依赖性,并特异性作用于S期,具有高特异性,不产生多耐药性[11]。在恶性肿瘤中,如结肠癌、子宫颈癌、卵巢癌、神经细胞瘤的肿瘤细胞内,TOPO-1的含量比正常细胞明显升高[12-13]。Allen等[14]研究14例卵巢癌中 TOPO-1的表达,结果阳性率为 43%(6/14)。TOPO-1抑制剂类药物对肿瘤细胞具有较高的选择性。
目前TOPO-1在转移性结直肠癌中的表达的相关研究不多,且存在争议。Qiu等[15]收集复旦大学附属华东医院转移性结直肠癌患者共90例,用免疫组化法检测TOPO-1的表达水平,试验组根据ERCCl低表达选择添加奥沙利铂或TOPO-1高表达选择伊立替康联合5氟尿嘧啶的化疗方案,结果显示TOPO-1高表达使用伊立替康的39例患者(7例死亡,11例疾病进展)与TOPO-1低表达使用伊立替康的5例患者(1例死亡,2例疾病进展)中位生存时间为311 d和202 d,差异有统计学意义(P=0.021);治疗到进展时间为235 d和8 d,差异亦有统计学意义(P=0.036)。但徐建明等[16]收集了78例结直肠癌患者,并用免疫组化进行TOPO-1检测,其中高表达32例,低表达48例,所有患者均用伊立替康联合5-FU方案化疗,用百分位数的Q75值代替Q50作为截断值,结果TOPO-1低表达患者的OS明显延长(P=0.02)。可见,TOPO-1表达与结直肠癌细胞对伊立替康的敏感性可能呈正相关这一观点尚存争议。本研究发现TOPO-1的表达水平与其临床特征无相关性,高表达组的患者均较低表达组患者可从伊立替康化疗中获得更高的近期疗效和更长的无疾病进展时间,提示检测TOPO-1表达或可作为伊立替康治疗转移性结直肠癌疗效的预测因子,但仍需长期进一步随访并进行多因素分析加以明确。此外,本研究免疫组化步骤和结果判定差异可能导致结果偏倚,且样本量较小,根据肿瘤标记的表达状况再分组样本量更小,因此,研究结果有待进一步证实。
[1]Pommier Y,Leo E,Zhang H,et al.DNA topoisomerases and their poisoning by anticancer and antibacterial drugs[J].Chem Biol,2010,17(5):421-433.
[2]Chang YS,Chang SJ,Yeh KT,et al.RAS,BRAF,and TP53 gene mutationsin Taiwanese colorectal cancer patients[J].Onkologie,2013,36(12):719-724.
[3]Jakobsen A,Andersen F,Fischer A,et al.Neoadjuvant chemotherapy in locally advanced colon cancer.a phaseⅡtrial[J].Acta Oncol,2015,54(10):1747-1753.
[4]Huo YR,Huang Y,Liauw W,et al.Prognostic value of carcinoembryonic antigen(CEA),AFP,CA19-9 and CA125 for patients with colorectal cancer with peritoneal carcinomatosis treated by cytoreductive surgery and intraperitoneal chemotherapy[J].Anticancer Res,2016,36(3):1041-1049.
[5]Arredondo J,González I,Baixauli J,et al.Tumor response assessment in locally advanced colon cancer after neoadjuvant chemotherapy[J].J Gastrointest Oncol,2014,5(2):104-111.
[6]Uchida K,Otake K,Tanaka K,et al.Clinical implications of CES2 RNA expression in neuroblastoma[J].J Pediatr Surg,2013,48(3):502-509.
[7]Ottaiano A,Nasti G,Cassata A,et al.FOLFOXIRI in metastatic colorectal cancer:A criticism from its native land[J].Cancer Lett,2017,408:71-72.
[8]Leal F,Ferreira FP,Sasse AD.FOLFOXIRI regimen for metastatic colorectal cancer:a systematic review and meta-analysis[J].Clin Colorectal Cancer,2017.
[9]Wulaningsih W,Wardhana A,Watkins J,et al.Irinotecan chemotherapy combined with fluoropyrimidines versus irinotecan alone for overall survival and progression-free survival in patients with advanced and/or metastatic colorectal cancer[J].Cochrane Database Syst Rev,2016,2:CD008593.
[10]Munakata M,Sakata Y.Chemotherapy for advanced colorectal cancer[J].Nihon Rinsho,2011,69(suppl 3):30-36.
[11]Silvestris N,Simone G,Partipilo G,et al.CES2,ABCG2,TS and Topo-I primary and synchronous metastasis expression and clinical outcome in metastatic colorectal cancer patients treated with first-line FOLFIRI regimen[J].Int J Mol Sci,2014,15(9):15767-15777.
[12]Heestand GM,Schwaederle M,Gatalica Z,et al.Topoisomerase expression and amplification in solid tumours:analysis of 24,262 patients[J].Eur J Cancer,2017,83:80-87.
[13]Shen J,Kong W,Wu Y,et al.Plasma mRNA as liquid biopsy predicts chemo-sensitivity in advanced gastric cancer patients[J].J Cancer,2017,8(3):434-442.
[14]Allen JD,Jackson SC,Schinkel AH.A mutation hot spot in the Bcrp1 (Abcg2)multidrug transporter in mouse cell lines selected for Doxorubicin resistance[J].Cancer Res,2002,62(8):2294-2299.
[15]Qiu JG,Shen DM,Huang CJ,et al.Clinical values of detecting excision repair cross complementing 1 and top-isomerase I in individualized therapies of metastatic colorectal cancer[J].Zhonghua Yi Xue Za Zhi,2013,93(48):3852-3856.
[16]徐建明,朱步东,Mangia Anita,等.胸苷酸合成酶和拓扑异构酶-1及Ki-67对伊立替康联合5-氟脲嘧啶治疗晚期大肠癌的预测价值[J].中华肿瘤杂志,2005,27(5):312-315.
Correlation of TOPO-1 expression with irinotecan therapy in patients with metastatic colorectal cancer
Chen Shaojun1,Huang Jian2,Hua Li1,Chen Haihui1,Ou Hailing3,Huang Haixin1(1Department of Medical Oncology,the Fourth Affiliated Hospital of Guangxi Medical University,Liuzhou 545005,P.R China;2Hengxian People's Hospital,Hengxian 530300,P.R China;3Department of Pathology,the First Affiliated Hospital of Guangxi Traditional Chinese Medicine University,Nanning 530023,P.R China)
Huang Haixin.E-mail:huanghaixinliuzhou@163.com
ObjectiveTo explore TOPO-1 expression in patients with metastatic colorectal cancer.MethodsTOPO-1 expression was detected by immunohistochemistry in 98 cases of metastatic colorectal cancer before receiving FOLFIRI chemotherapy,and investigate its association with short-term efficacy of chemotherapy.The long-term efficacy of chemotherapy was evaluated.ResultsTOPO-1 expression showed no obvious correlation with clinico-pathological characteristics(P>0.05).The patients showing high and low TOPO-1 expression showed significant difference between response rate(52.2%vs 28.8%,P<0.05)and median progression-free survival(9.5 months vs 8.0 months,P=0.002).ConclusionIrinotecan showed a tendency toward higher response rate and longer median survival for treating metastatic colorectal cancer patients with high expression of TOPO-1.
Colorectal neoplasms;Metastatic colorectal cancer;Topoisomerase-1;Irinotecan;Chemotherapy
R735.3
A
1674-5671(2017)05-05
10.3969/j.issn.1674-5671.2017.05.09
国家自然科学基金资助项目(81260340);广西自然科学基金资助项目(2013GXNSFAA019263)
黄海欣。E-mail:huanghaixinliuzhou@163.com
[2017-06-03收稿][2017-08-29修回][编辑 江德吉]

