生物芯片高通量检测卵巢癌转录组差异表达基因的生物标记识别
何文龙 隋杏玲
生物芯片高通量检测卵巢癌转录组差异表达基因的生物标记识别
何文龙 隋杏玲
目的探究卵巢癌中基因的表达情况并识别重要的代谢通路。方法从ArrayExpress数据库下载卵巢癌芯片数据,使用rank product方法识别差异表达基因;利用STRING900、STRING、Bossi&Lehner和PSICQUIC四个数据库对这些差异基因进行KEGG通路富集分析,并运用R语言运算取这些通路的交集,以找出在卵巢癌发生中重要的代谢通路;最后构建各通路中重叠基因的网络节点图,以识别通路中的重要基因。结果在卵巢癌中共检测到1,732个差异表达基因和176条代谢通路。其中,p53信号通路、酪氨酸代谢、鞘脂类代谢是卵巢癌中最重要的代谢通路。这些通路中基因的表达均发生了显著变化。结论所识别的重要代谢通路和这些通路中基因表达的变化可作为卵巢癌诊断的潜在生物标记。
卵巢癌;差异表达基因;通路富集分析;网络构建
作者单位:300010 天津,天津医科大学公共卫生学院(何文龙);250101 济南,济南基因云馆数字图书馆(隋杏玲)(通讯作者:隋杏玲)
卵巢癌恶性肿瘤是危害女性健康与生命的恶性肿瘤之一,仅有20%左右的卵巢癌患者可在早期被发现,晚期患者的死亡率居妇科恶性肿瘤死亡率之首[1,2]。
目前,卵巢癌的早期诊断多采用血清CA125、癌胚抗原(carcino-embryonic antigen,CEA)、人附睾蛋白4(human epididymis protein-4,HE4)等作为重要标记物。但这些标记物普遍存在敏感性和特异性差、准确率较低等问题[3],远不能满足临床实际的应用需要。代谢组学作为一种将图像识别方法和生物信息学结合起来的分析技术,在卵巢癌的早期诊断、预后和治疗评价方面得到了广泛的应用并已检测出了可作为卵巢癌诊断的候选标记物[4,5]。虽然这些研究为卵巢癌的生物学特性的异常改变及早期诊断提供了途径,但对于卵巢癌发病的分子机理及各基因间的相互作用还不能清晰阐释。已有的研究表明,卵巢癌的发生和发展是一个复杂的过程,具有复杂的生物学行为,涉及了多个基因的异常表达和相互作用。因此,寻找更加灵敏、特异、检测方便的卵巢癌肿瘤标记物,对于早期发现并提高治疗效果具有重要意义。
高通量技术和生物信息学分析手段的联合应用,为从基因组水平研究疾病的分子基础提供了途径。本文运用生物信息学方法,对从ArrayExpress数据库选取的卵巢癌的微阵列芯片基因表达数据进行挖掘,旨在通过对差异表达基因进行通路富集分析,找出卵巢癌中重要的代谢通路,并对其中包含的基因进行分析,以期为卵巢癌的诊断提供分子标记。
1 材料与方法
1.1 数据收集与预处理 实验所用数据芯片E-GEOD-10971[6]、E-GEOD-14001[7]、E-GEOD-18520[8]和E-GEOD-27651均选自ArrayExpress数据库(http://www.ebi.ac.uk/arrayexpress/)。使用Affymetrix包读取每个芯片数据,分别采用稳健多阵列平均法(RMA算法)[9]和分位数法[10]对其进行背景矫正与规范化,以消除非特异性杂交的影响;运用mas5算法[11]对探针的匹配值与误配值进行修正,对于表达式的值则采用中位数方法进行取值。使用GeneFilter包的featureFilter方法进行数据筛选,去掉四分位数间距大于0.5的基因,若有多个探针对应同一个基因,则保留其中间值。
1.2 差异表达基因的筛选 使用RankProd包中的rank product方法对4个芯片数据进行合并,然后计算各基因的FoldChange(FC)值。|log2FC|>2且P小于0.01的基因则视为差异表达基因,并区分出上调与下调的基因。
1.3 通路富集分析 利用在线分析软件EnrichNet-Network-based enrichment analysis(http://www.enrichnet.org/)中的STRING900、STRING、Bossi&Lehner和PSICQUIC分子网络数据库对所得的|log2FC|≥3的差异表达基因进行通路富集分析(Kyoto Encyclopedia of Genes and Genomes,KEGG),然后运用R语言运算取所有通路的交集,并计算每条通路的Xd值[12]的平均值,以找出在卵巢癌发生中比较重要的通路。
1.4 通路网络构建 从http://www.enrichnet.org/下载Xd值的平均值大于0.68的各通路的cytoscape-network数据,将其导入Cytoscape 3.1.0软件中构建它们的网络节点图,仅保留该通路基因集中的重叠基因,然后将四个数据库中同一通路的网络节点图进行合并,找出该通路的重要基因。
2 结果
2.1 差异表达基因的识别 通过对所得基因芯片数据进行过滤筛选,共得到1,732个差异表达基因,其中上调基因580个,下调基因1,152个。前27个上调和前29个下调的差异表达基因的具体信息见表1。
2.2 通路富集分析 将|log2FC|≥3的656个差异表达基因输入STRING900、STRING、Bossi&Lehner和PSICQUIC四个数据库进行在线KEGG生物通路注释,分别得到了193条、196条、177条和192条通路。进一步通过R语言运算取交集后,共得到176条通路。比较重要的通路有p53信号通路、酪氨酸代谢、鞘脂类代谢、甘氨酸-丝氨酸-苏氨酸代谢、细胞外基质相互作用等。前10条通路的具体信息见表2。
2.3 基因的相互作用网络分析 Cytoscape作为一个强大的分子相互作用网络分析和可视化软件,对生物信息学的研究具有重要帮助。连通度作为评价节点中心性的参数,其大小可以反映该节点在网络中的重要性。通过Cytoscape软件对卵巢癌中重要通路的差异表达基因进行网络图谱分析可以发现,细胞周期蛋白依赖性激酶抑制剂2A(CDKN2A)在p53信号通路中与细胞周期蛋白(CCND2、CCNE1)和蛋白磷酸酶(PPM1D)密切相关,暗示该基因在p53信号通路改变中具有重要作用(图1A);单胺氧化酶(MAOA、MAOB)和乙醇脱氢酶(ADH1B)在酪氨酸代谢通路中起着中心性作用(图1B);在鞘脂类代谢通路中主要包含5个基因,各基因间紧密作用,共同调控疾病的发生(图1C)。各通路中基因间的相互联系及其具体参数见图1和表3。
3 讨论
作为女性肿瘤的高发疾病,卵巢癌的发生是多种体内多种因素共同作用的结果。我们通过对卵巢癌基因表达芯片进行分析,发现共有1,732个基因的表达发生了变化;进一步利用不同数据库对部分差异表达基因进行通路富集分析表明,p53信号通路、酪氨酸代谢通路和鞘脂类代谢通路是卵巢癌发生中的重要通路,暗示这些通路的改变可能是卵巢癌发生、发展的重要原因之一。这与Fu等[13]的研究结果基本一致。
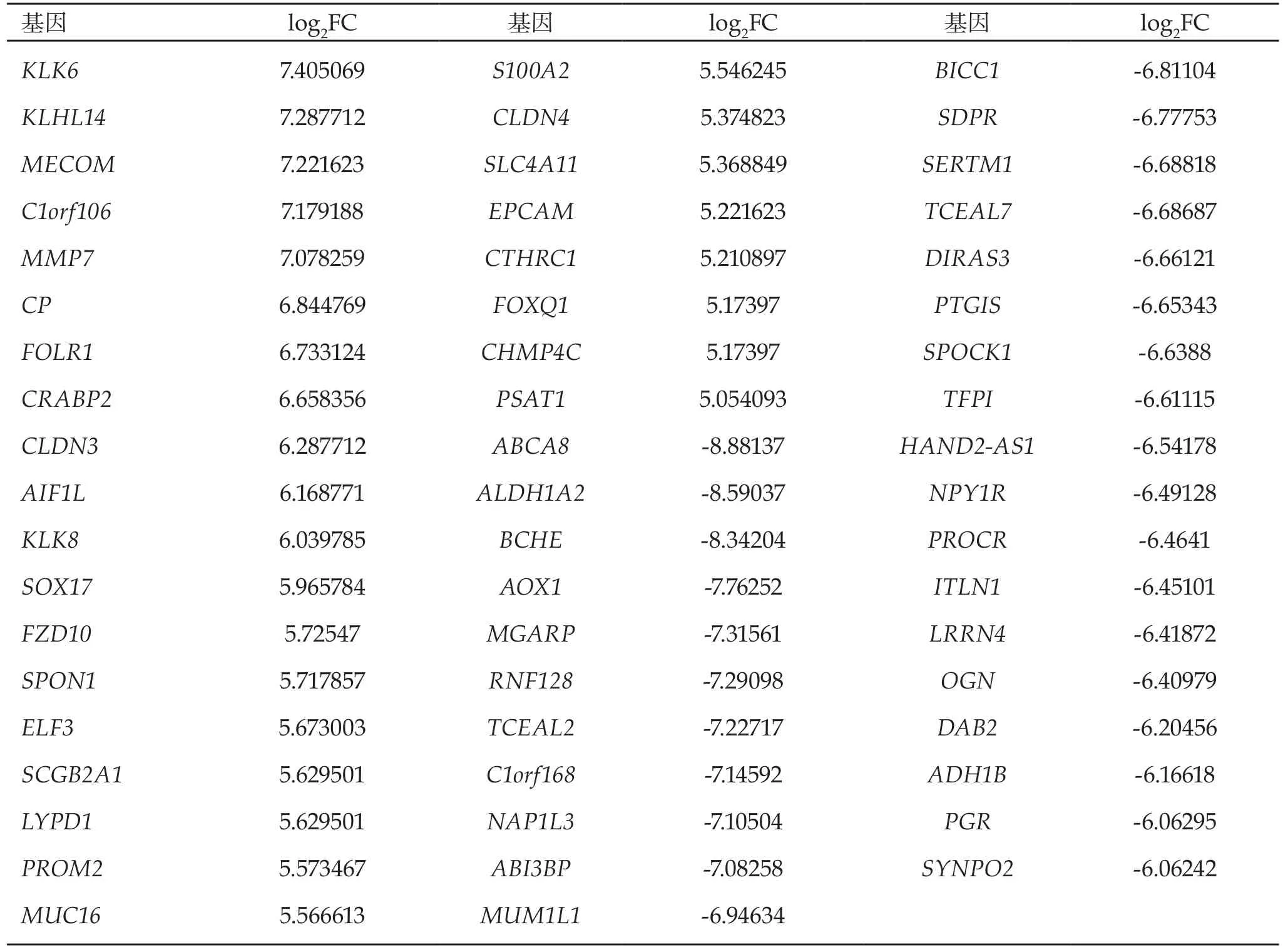
表1 卵巢癌中P值小于0.01的前27个上调和前29个下调的差异表达基因
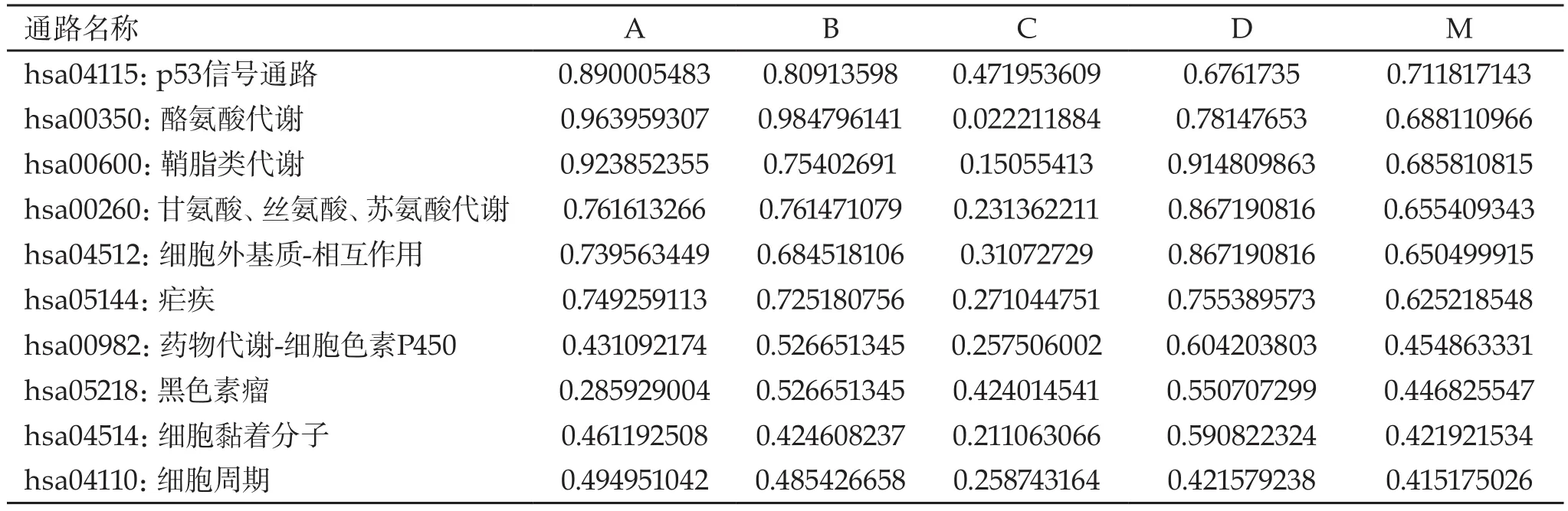
表2 基于KEGG的通路富集分析
已知p53通路的异常改变是肿瘤细胞恶变转化的主要原因之一。本研究通过对参与p53信号通路的基因的网络分析发现,CDKN2A在p53信号通路起着重要作用。作为与细胞周期相关的抑癌基因,CDKN2A/p16在人类癌症的发生中经常发生突变[14],但在早期卵巢癌和转移性卵巢癌中发生突变的频率却很低[15]。Bian等[16]利用DNA重组技术构建了人类卵巢癌细胞系UACC-1598的CDKN2A/p16-A148T突变体和CDKN2A/p16-野生型基因表达体系,发现在卵巢癌中CDKN2A/p16的第148位密码子发生了单碱基突变。Kim等[17]在早期卵巢癌和复发性上皮性卵巢癌也发现了该基因的突变。在本研究中,CDKN2A(pfp=3.671164,P=0)是差异表达基因之一,其表达量上调可能是导致p53通路改变的重要原因。
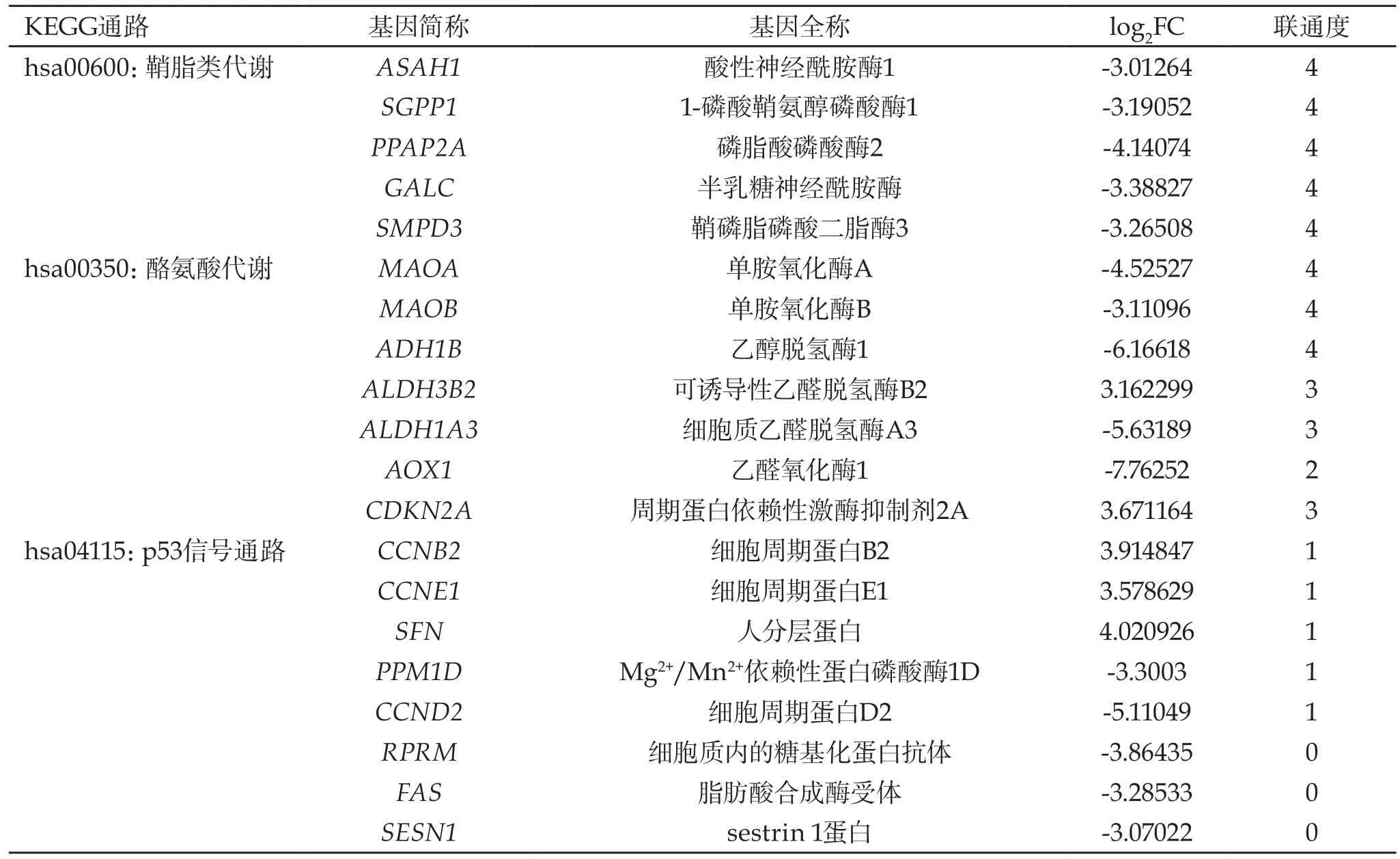
表3 各通路中差异表达基因的信息
酪氨酸作为苯丙氨酸代谢的产物之一,其代谢的异常可引起疾病的发生。Fong等[4]通过对卵巢癌患者的卵巢代谢物进行分析发现,苯丙酮酸和苯乳酸的含量明显升高;卵巢癌患者在接受治疗后,血清中酪氨酸-赖氨酸-亮氨酸-40的含量明显下降[18]。卵巢癌中酪氨酸代谢的异常可能与苯丙氨酸代谢密切相关。我们的研究结果表明,酪氨酸代谢是卵巢癌中重要的代谢通路之一,与酪氨酸下游产物代谢相关的基因发生了明显下调。研究表明,卵巢癌治疗药物药效的发挥与酪氨酸激酶受体的下调有关[19]。目前已有利用酪氨酸激酶定向治疗卵巢癌的报道,尽管它的疗效还无定论[20]。这些结果暗示,酪氨酸代谢可作为卵巢癌诊断的指标之一。
鞘脂类作为细胞膜的组成成分之一,其代谢产物神经酰胺、神经鞘氨醇和1-磷酸鞘氨醇在肿瘤的发生发展中发挥着重要作用,它们可以调节细胞的增值、存活及凋亡等。Babahosseini等[21]的研究发现,神经酰胺和1-磷酸鞘氨醇能够降低发生恶变的小鼠卵巢上皮细胞的弹性,而鞘氨醇的作用却正好相反。Guillwrmet-Guibert等[22]发现,通过加入鞘氨醇激酶-1抑制剂、神经酰胺类似物等提高细胞内神经酰胺的水平或者降低细胞内鞘氨醇激酶-1的活性来提高神经酰胺、1-磷酸鞘氨醇的比率,可有效提高胰腺癌细胞对胞苷的化学敏感性,从而杀死癌细胞。Anderson等[23]研究表明,通过添加外源性鞘氨醇能够使小鼠上皮性卵巢癌细胞中柠檬酸合成酶活性降低、促进三羧酸循环,减少胆固醇的合成和糖酵解,从而改变细胞代谢路径。以上研究表明,鞘脂类代谢与肿瘤的发生、进展密切相关,它在肿瘤的治疗中具有巨大的潜力。Choi等[24]利用小鼠动物模型研究发现α-半乳糖神经酰胺辅助肿瘤细胞疫苗治疗卵巢癌,可打破肿瘤细胞的免疫耐性,明显提高血清中γ-干扰素的水平。我们的通路富集分析结果表明,鞘脂类代谢在卵巢癌的发生发展中占有重要地位,与鞘脂类代谢相关的主要基因密切相互作用并都下调表达,这些基因的表达的异常可能是导致卵巢癌发生的重要原因。
综上所述,本研究通过生物信息学方法对卵巢癌相关基因的表达和通路富集分析发现,在卵巢癌的发生发展中,有大量基因的表达发生了明显变化(上调或下调),并引起了通路代谢的异常,p53信号通路、酪氨酸代谢通路和鞘脂类代谢通路可作为卵巢癌诊断的重要指标。
1 Teneriello MG,Park RC.Early detection of ovarian cancer.CA Cancer J Clin,1995,45(2): 71-87.
2 Jacobs IJ,Menon U.Progress and challenges in screening for early detection of ovarian cancer.Mol Cell Proteomics,2004,3(4): 355-366.
3 Williams TI,Toups KL,Saggese DA,et al.Epithelial ovarian cancer: Disease etiology,treatment,detection,and investigational gene,metabolite,and protein biomarkers.J Proteome Res,2007,6(8): 2936-2962.
4 Fong MY,McDunn J,Kakar SS.Identification of metabolites in the normal ovary and their transformation in primary and metastatic ovarian cancer.PLoS One,2011,6(5): e19963.
5 Fan L,Zhang W,Yin M,et al.Identification of metabolic biomarkers to diagnose epithelial ovarian cancer using a UPLC/QTOF/MS platform.Acta Oncol,2012,51(4):473-479.
6 Tone AA,Begley H,Sharma M,et al.Gene expression profiles of luteal phase fallopian tube epithelium fromBRCAmutation carriers resemble high-grade serous carcinoma.Clin Cancer Res,2008,14(13): 4067-4078.
7 Tung CS,Mok SC,Tsang YT,et al.PAX2 expression in low malignant potential ovarian tumors and low-grade ovarian serous carcinomas.Mod Pathol,2009,22(9):1243-1250.
8 Gamwell LF,Gambaro K,Merziotis M,et al.Small cell ovarian carcinoma: genomic stability and responsiveness to therapeutics.Orphanet J Rare Dis,2013,8: 33.
9 Ma L,Robinson LN,Towle HC.ChREBP.ChREBP*Mlx is the principal mediator of glucose-induced gene expression in the liver.J Biol Chem,2006,281(39):28721-28730.
10 Rifai N,Ridker PM.Proposed cardiovascular risk assessment algorithm using high-sensitivity C-reactive protein and lipid screening.Clin Chem,2001,47(1): 28-30.
11 Zhang L,Miles MF,Aldape KD.A model of molecular interactions on short oligonucleotide miroarrays.Nat Biotechnol,2003,21(7): 818-821.
12 Glaab E,Baudot A,Krasnogor N,et al.EnrichNet:network-based gene set enrichment analysis.Bioinformatics,2012,28(18): i451-i457.
13 Fu LJ,Wang B.investigation of the hub genes and related mechanism in ovaian cancer via bioinformatics analysis.J Ovarian Res,2013,6(1): 92.
14 Witkiewicz AK,Knudsen KE,Dicker AP,et al.The meaning of p16 (ink4a) expression in tumors:functional significance,clinical associations and future developments.Cell Cycle,2011,10(15): 2497-2503.
15 Schuyer M,van Staveren IL,Klijn JG,et al.SporadicCDKN2(MTS1/p16ink4) gene alterations in human ovarian tumours.Br J Cancer,1996,74(7): 1069-1073.
16 Bian Z,Yu Y,Yang T,et al.Effect of tumor suppressor gene cyclin-dependent kinase inhibitor 2A wild-type and A148T mutant on the cell cycle of human ovarian cancer cells.Oncol Lett,2014,7(4): 1229-1232.
17 Kim YM,Lee SW,Chun SM,et al.Analysis and comparison of somatic mutations in paired primary and recurrent epithelial ovarian cancer samples.PLoS One,2014,9(6): e99451.
18 Choudhuri S,Sharma C,Banerjee A,et al.A repertoire of biomarkers helps in detection and assessment of therapeutic response in epithelial ovarian cancer.Mol Cell Biochem,2014,386(1-2): 259-269.
19 Cho YR,Choi SW,Seo DW.Thein vitroantitumor activity of Siegesbeckia glabrescens against ovarian cancer through suppression of receptor tyrosine kinase expression and the signaling pathways.Oncol Rep,2013,30(1): 221-226.
20 Morotti M,Becker CM,Menada MV,et al.Targeting tyrosine-kinases in ovarian cancer.Expert Opin Investig Drugs,2013,22(10): 1265-1279.
21 Babahosseini H,Roberts PC,Schmelz EM,et al.Bioactive sphingolipid metabolites modulate ovarian cancer cell structural mechanics.Integr Biol (Camb),2013,5(11):1385-1392.
22 Guillermet-Guibert J,Davenne L,Pchejetski D,et al.Targeting the sphingolipid metabolism to defeat pancreatic cancer cell resistance to the chemotherapeutic gemcitabine drug.Mol Cancer Ther,2009,8(4): 809-820.
23 Anderson AS,Roberts PC,Frisard MI,et al.Metabolic changes during ovarian cancer progression as targets for sphingosine treatment.Exp Cell Res,2013,319(10):1431-1442.
24 Choi YS,Hoory T,Monie A,et al.Alpha-Galactosylceramide enhances the protective and therapeutic effects of tumor cell based vaccines for ovarian tumors.Vaccine,2008,26(46): 5855-5863.
Microarray data analysis and biomarker identification of ovarian cancer
Wenlong HE1,Xingling SUI2
1School of Public Health,Tianjin Medical University,Tianjin 300010,China;2Digital Library,Ji'nan Gene Cloud Museum,Ji’nan 250101,China
ObjectiveTo explore the gene expression pattern and identify the important metabolic pathways in ovarian cancer.MethodsThemicroarray data of ovarian cancer was downloaded from ArrayExpress database,and the differentially expressed (DE) genes in it were identified by the rank product method.The KEGG pathway enrichment analysis of these DE genes was performed by using the on line database STRING900,STRING,Bossi&Lehner and PSICQUIC.The R language was used to computing the intersection of these pathways and finding out the important pathways in ovarian cancer.Finally,the important genes and their relations in these pathways were analyzed by constructing the nodes network of the overlapped genes.ResultsA total of 1,732 DE genes and 176 metabolic pathways were involved in the occurrence.The p53 signaling pathway,tyrosine metabolism and sphingolipid metabolism were the most important pathways in ovarian cancer.The expression pattern of the genes that involved in these pathways was also greatly changed.ConclusionThe important pathways and change of the genes involved in them can be regard as the underlying biomarkers for the diagnosis of ovarian cancer.
Ovarian cancer; Differentially expressed genes; Pathway enrichment analysis; Network construction

