Wnt5a和Wnt11在肺癌中的表达及意义
唐凤娟,许三鹏,王国平,2,况 东
Wnt5a和Wnt11在肺癌中的表达及意义
唐凤娟1,许三鹏1,王国平1,2,况 东1
目的探讨Wnt5a和Wnt11在肺癌组织中的表达及与肺癌类型的关系,并评估两者表达与临床病理特征的关系。方法采用免疫组化EnVision法检测120例肺癌和20例正常肺组织中Wnt5a和Wnt11蛋白表达,并分析两者表达的相关性及与临床病理特征的关系。结果84例非小细胞肺癌中,Wnt5a阳性率为36%,Wnt11阳性率为38%。36例小细胞肺癌中Wnt5a和Wnt11阳性率均低,分别为8.3%和0。两者在非小细胞肺癌中的表达显著高于小细胞癌。腺癌中Wnt11阳性率较高,为56%,Wnt5a为9%,鳞状细胞癌中Wnt5a阳性率较高,为50%,Wnt11为25%。两者表达与患者性别、年龄、分化程度以及淋巴结转移无明显相关性(P>0.05)。结论Wnt5a和Wnt11表达与肺癌类型有关,Wnt5a和Wnt11在非小细胞肺癌中的阳性率显著高于小细胞癌,Wnt5a在鳞状细胞癌中的表达较高,而Wnt11在腺癌中的表达较高。两者表达与肺癌患者年龄、淋巴结转移、细胞分化程度无明显相关性。
肺肿瘤;非小细胞肺癌;Wnt5a;Wnt11;免疫组织化学
原发性肺癌(以下简称肺癌)在20世纪末已成为癌症死亡的首要原因,发展中国家的女性肺癌病死率达11%,与子宫颈癌并重[1]。Wnt信号的失调在胚胎发育中可导致夭折或发育缺陷,在成体中则可引起细胞异常增殖及分化而导致肿瘤的发生、发展[2-3]。非经典Wnt通路介导的Wnt/Ca2+通路和Wnt/PCP通路[4]均与肿瘤的发生、发展及预后密切相关,在肺癌中均有潜在研究价值[5]。有学者对非小细胞肺癌的基因表达模式进行分析,证实在鳞状细胞癌发展过程中存在非经典Wnt信号通路的激活[6]。2013年,Bartis等[7]证实腺癌细胞系A549中Wnt11基因表达显著增强,而鳞状细胞癌细胞系中Wnt5a基因表达显著增强。Wnt5a和Wnt11调节cadherin的表达以及增强β-catenin进入细胞核是降低细胞黏附的重要步骤。但迄今为止非经典Wnt信号通路的效应因子Wnt5a和Wnt11在肺癌组织中的表达及不同类型肺癌中的表达相关性鲜有报道。本实验采用免疫组化EnVision法检测肺癌中Wnt5a和Wnt11蛋白的表达,探讨其与肺癌发生、发展及与临床病理特征的关系及意义,并探讨各类型肺癌中Wnt5a与Wnt11表达的相关性。
1 材料与方法
1.1临床资料及标本来源选取华中科技大学同济医学院附属同济医院病理科2015年1月~2016年3月确诊为肺癌且临床病理资料完整的组织标本120例,20例正常肺组织标本作为对照组。肺癌病例中非小细胞肺癌84例(包括腺癌32例,鳞状细胞癌32例,大细胞癌20例),小细胞肺癌36例;男性96例,女性24例,年龄41~76岁,平均58岁;有淋巴结转移者64例,无淋巴结转移者56例;64例腺癌和鳞状细胞癌中细胞学分化程度:高分化5例,中分化32例,低分化27例。
1.2试剂Wnt5a抗体及Wnt11抗体购自美国Santa Cruz公司,免疫组化检测试剂盒购自上海基因科技公司,其余相关试剂均购自北京中杉金桥公司。
1.3方法采用免疫组化EnVision法检测Wnt5a和Wnt11在肺癌组织中的表达,使用GTVisionⅢ抗兔/鼠通用型免疫组化检测试剂盒,结合产品说明书和本实验室积累的经验进行操作。正常肺组织为阴性对照;采用PBS缓冲液代替一抗作为空白对照。
1.4免疫组化结果判读Wnt5a与Wnt11阳性均表现为胞质染色[8],且着色强度高于背景(间质结缔组织等)的非特性染色强度。不着色或与背景无差异者判为阴性。
1.5统计学分析采用SPSS 20.0进行统计数据分析,组间差异性分析采用χ2检验,P<0.05为差异有统计学意义;相关性分析采用Spearman等级相关检验进行分析,P<0.05为差异有统计学意义。
2 结果
2.1Wnt5a、Wnt11在肺癌中的表达120例肺癌中,Wnt5a阳性率为28.3%,Wnt11阳性率为28.3%。其中84例非小细胞肺癌中,Wnt5a阳性率为36%,Wnt11阳性率为38%,小细胞肺癌中Wnt5a和Wnt11阳性率均低,分别为8.3%和0。腺癌中Wnt11和Wnt5a的阳性率分别为56%、9%,鳞状细胞癌中Wnt5a的阳性率分别为50%、25%,大细胞肺癌中Wnt5a和Wnt11的阳性率相对接近,分别为45%和30%(表1,图1、2)。
2.2不同类型肺癌中Wnt5a、Wnt11表达与临床病理特征的关系120例肺癌组织中,Wnt5a表达与肺癌患者性别、年龄、淋巴结转移无相关性(P>0.05),而在4种类型肺癌中的表达差异有显著性(P<0.01),在非小细胞肺癌(鳞状细胞癌、腺癌、大细胞癌)中阳性率显著高于小细胞肺癌(P<0.01,表2);Wnt11表达与肺癌患者性别、年龄、淋巴结转移均无相关性(P>0.05),而在4种类型肺癌中的表达差异有显著性(P<0.01),在非小细胞肺癌(鳞状细胞癌、腺癌、大细胞癌)中阳性率显著高于小细胞肺癌(P<0.01,表2)。
在32例腺癌、32例鳞状细胞癌组织中,Wnt5a在鳞状细胞癌中的表达显著高于腺癌(P<0.01),而在患者年龄、淋巴结转移、细胞分化程度不同分组间差异均无显著性(P>0.05,表3);Wnt11在腺癌中的表达显著高于鳞状细胞癌(P<0.05),而在患者年龄、淋巴结转移、细胞分化程度不同分组间差异均无显著性(P>0.05,表3)。
3 讨论
Wnt基因介导的Wnt信号转导通路异常活动被证明是肿瘤发生的关键信号通路之一,该转导通路在人类不同肿瘤中广泛激活并调节细胞的生长、迁移和分化,在肿瘤生物学和干细胞生物学的研究中越来越显现出其潜在的价值。Wnt信号通路的异常已被证实在多系统多种肿瘤发生、发展过程中发挥作用,如黑色素瘤、乳腺癌、卵巢癌、子宫颈癌[9]、前列腺癌、肝细胞癌[10]等。最新研究证实非小细胞肺癌中的腺癌涉及经典Wnt7b和非经典Wnt11信号上调,可能存在Wnt11/Wnt7b组合模式,而鳞状细胞癌则涉及非经典Wnt5a信号上调和经典Wnt途径抑制因子DKK-1上调[11],均涉及非经典Wnt通路和经典Wnt通路共同作用。
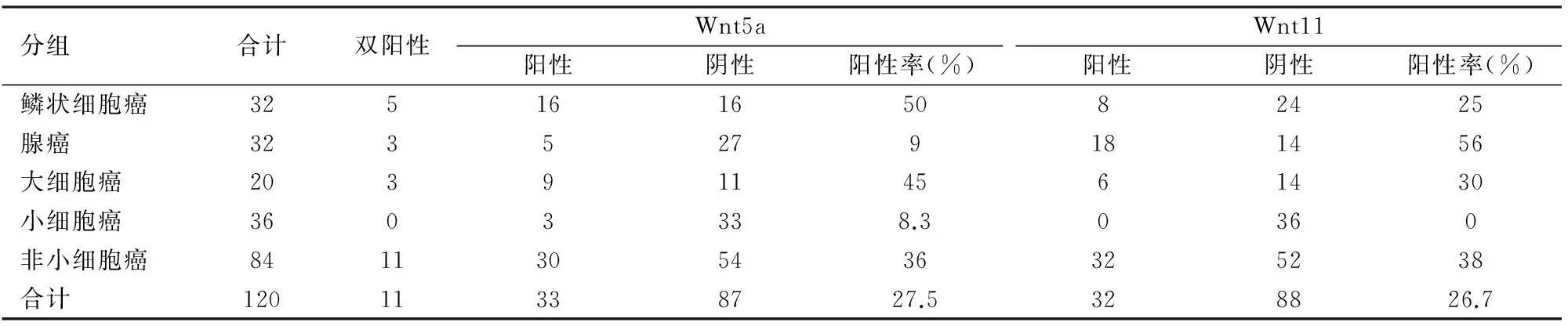
表1 Wnt5a、Wnt11在肺癌中的表达

表2 Wnt5a、Wnt11表达与肺癌临床病理特征的关系

表3 Wnt5a、Wnt11表达与肺腺癌和鳞状细胞癌临床病理特征的关系
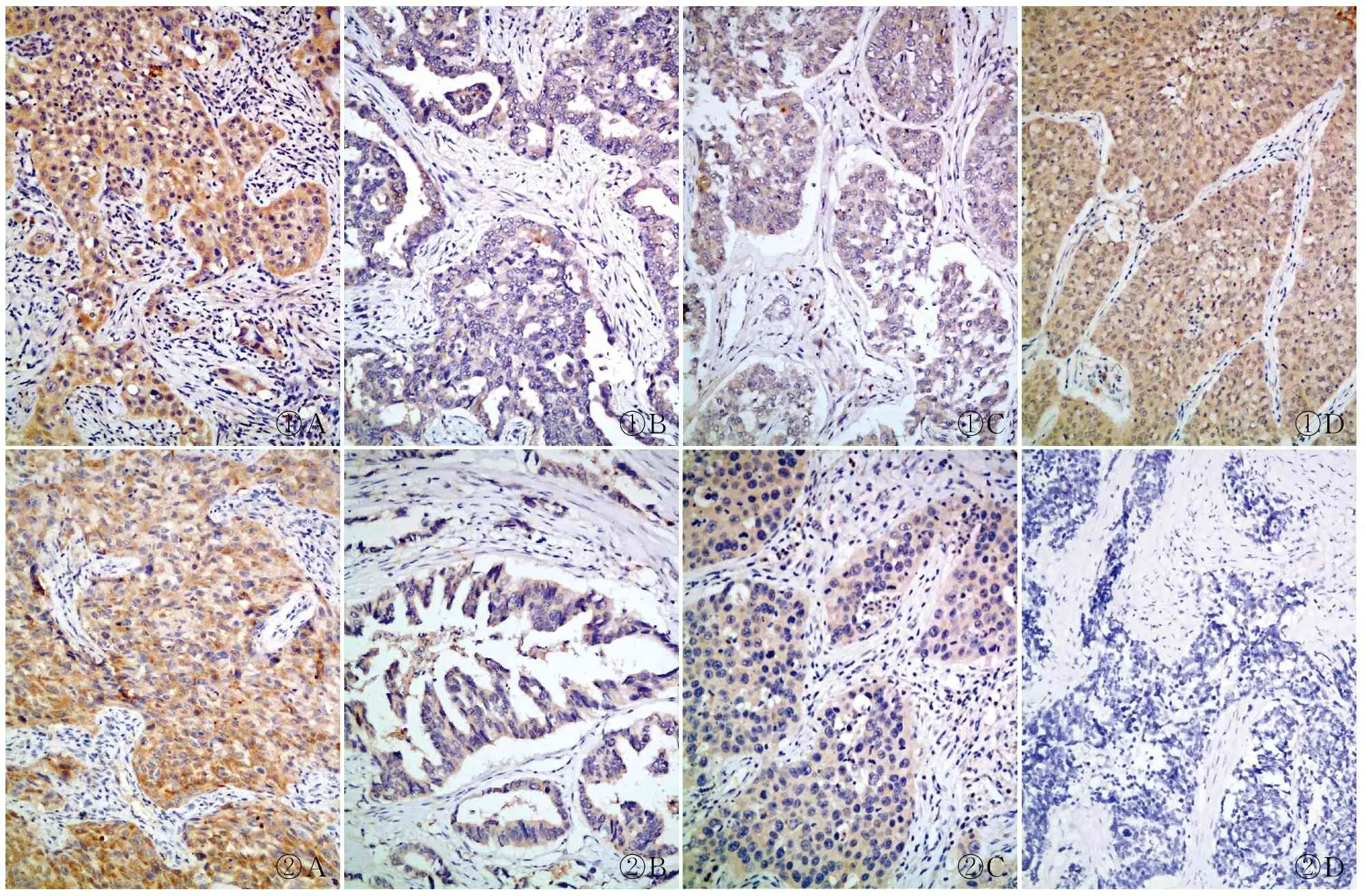
①A①B①C①D②A②B②C②D
图1Wnt5a在肺癌中的表达:A.鳞状细胞癌;B.腺癌;C.大细胞癌;D.小细胞癌,EnVision法图2Wnt11在肺癌中的表达:A.鳞状细胞癌;B.腺癌;C.大细胞癌;D.小细胞癌,EnVision法
Wnt5a是Wnt蛋白家族重要成员之一,主要介导激活非经典Wnt信号通路。目前已证实,Wnt5a参与多种肿瘤的发生、发展[12],但在不同的肿瘤中Wnt5a所扮演的角色可能截然相反[13]。Wnt5a可抑制肝癌细胞MHCC97L的增殖和迁移能力[10],而在子宫颈癌中Wnt5a可能促进子宫颈浸润性鳞状细胞癌的发生、发展。日本学者[14]发现在非小细胞肺癌尤其是鳞状细胞癌中Wnt5a表达增高,并影响肺癌的转归和预后。Wnt11与Wnt5a一样,均是非经典Wnt蛋白的一员。Wnt11在肝细胞癌中的表达明显低于正常肝细胞,而在前列腺癌、乳腺癌、胃癌、大肠腺癌和肾细胞癌中表达上调。最新研究表明在肺腺癌细胞系中Wnt11基因表达水平显著上调[15]。本组实验结果显示,Wnt5a及Wnt11在非小细胞肺癌中表达显著高于小细胞肺癌,且Wnt5a在鳞状细胞癌中表达显著高于腺癌,Wnt11在腺癌中的表达显著高于鳞状细胞癌。但两者表达与患者性别、年龄、细胞分化程度以及淋巴结转移均无显著相关性。
本组实验结果未显示,Wnt5a与Wnt11与淋巴结转移、细胞分化程度等预后相关因素的相关性,可能与不同类型肿瘤中Wnt5a和Wnt11所扮演角色不同有关,另一方面可能与样本量不足以及免疫组化实验本身缺陷导致实验结果偏差有关。鉴于Wnt5a与Wnt11在不同类型非小细胞肺癌中的表达存在差异,推测Wnt5a和Wnt11表达对判断肿瘤类型存在一定意义,且在不同类型非小细胞肺癌中可能存在不同的促肿瘤生成作用。因此,进一步分析两者的下游信号机制对于阐明肺癌的发生机制,为改善肺癌的治疗及预后提供重要线索。
综上所述,Wnt5a和Wnt11在肺癌中具有潜在的研究价值,其介导的非经典Wnt信号通路可能为不同类型肺癌靶向治疗及预后判断提供重要线索。
[1] Torre L A, Bray F, Siegel R L,etal. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Ouyang H, Zhuo Y, Zhang K. WNT signaling in stem cell differentiation and tumor formation[J]. J Clin Invest, 2013,123(4):1422-1424.
[3] Yamamoto H, Awada C, Hanaki H,etal. The apical and basolateral secretion of Wnt11 and Wnt3a in polarized epithelial cells is regulated by different mechanisms[J]. J Cell Sci, 2013,126(Pt 13):2931-2943.
[4] Angers S, Moon R T. Proximal events in Wnt signal transduction[J]. Nat Rev Mol Cell Biol, 2009,10(7): 468-477.
[5] Puvirajesinghe T M, Bertucci F, Jain A,etal. Identification of p62/SQSTM1 as a component of non-canonical Wnt VANGL2-JNK signalling in breast cancer[J]. Nat Commun, 2016,7:10318.
[6] Hu Y, Galkin A V, Wu C,etal. CAFET algorithm reveals Wnt/PCP signature in lung squamous cell carcinoma[J]. PLoS One, 2011,6(10):e25807.
[7] Bartis D, Csongei V, Weich A,etal. Down-regulation of canonical and up-regulation of non-canonical Wnt signalling in the carcinogenic process of squamous cell lung carcinoma[J]. PLoS One, 2013,8(3):e57393.
[8] Huang Y, Liu G, Zhang B,etal. Wnt-5a regulates proliferation in lung cancer cells[J]. Oncol Rep, 2010,23(1):177-481.
[9] 平 静, 田 杰, 陈 莹, 等. 子宫颈鳞状细胞癌及其癌前病变中Wnt5a的表达[J]. 临床与实验病理学杂志, 2016,32(7):796-798.
[10] 毕利泉, 刘晓红, 陈英剑, 等. Wnt5a基因对肝癌细胞增殖及迁移能力的影响[J]. 临床与实验病理学杂志, 2012,28(8):857-861.
[11] Nguyen D X, Chiang A C, Zhang X H,etal. WNT/TCF signaling through LEF1 and HOXB9 mediates lung adenocarcinoma metastasis[J]. Cell, 2009,138(1):51-62.
[12] Tang Q, Zhao H, Yang B,etal. WIF-1 gene inhibition and Wnt signal transduction pathway activation in NSCLC tumorigenesis[J]. Oncol Lett, 2017,13(3):1183-1188.
[13] Asem M S, Buechler S, Wates R B,etal. Wnt5a signaling in cancer[J]. Cancers (Basel), 2016,8(9).pii: E79. doi: 10.3390/cancers8090079.
[14] Nakashima N, Liu D, Huang C L,etal. Wnt3 gene expression promotes tumor progression in non-small cell lung cancer[J]. Lung Cancer, 2012,76(2):228-234.
[15] Bartis D, Csongei V, Weich A,etal. Down-regulation of canonical and up-regulation of non-canonical Wnt signalling in the carcinogenic process of squamous cell lung carcinoma[J]. PLoS One, 2013,8(3):e57393.
ExpressionofWnt5aandWnt11inlungcancerandtheirsignificance
TANG Feng-juan1, XU San-peng1, WANG Guo-ping1,2, KUANG Dong1
(1DepartmentofPathology,TongjiHospital,TongjiMedicalCollegeHuazhongUniversityofScienceandTechnology,Wuhan430030,China;2InstituteofPathology,TongjiMedicalCollegeHuazhongUniversityofScienceandTechnology,Wuhan430030,China)
PurposeTo detect Wnt5a and Wnt11 expres-sion in lung cancer, to explore the relationship between their ex-pression and the types of lung cancer, and to assess the relationships between their expression and clinicopathologic factors (such as gender, age, degree of cell differentiation, lymph node metastasis).MethodsThe 120 cases of lung cancer were se-lected as the experimental group. In addition, 20 cases of normal lung tissue were selected as the control group. Immunohistochemistry EnVision method was used to detect the expression of Wnt5a and Wnt11. The results were analyzed by the statistical software.ResultsThe positive expression rate of Wnt5a and Wnt11 was 36% and 38% in 84 cases of non-small cell lung carcinoma. While the expression rate of Wnt5a and Wnt11 were low (8.3% and 0, respectively)in 36 cases of small cell lung carcinoma. Both expression in non-small cell lung carcinoma was significantly higher than that of small cell carcinoma. The expression rate of Wnt11 in adenocarcinoma was higher (56%, while Wnt5a was 9%), and the expression rate of Wnt5a in squamous cell carcinoma was higher (50%, while Wnt11 was 25%). However, there was no significant difference between the two groups in the sex, age, differentiation and lymph node metastasis.ConclusionBoth Wnt5a and Wnt11 expression was associated with lung cancer types. The positive expression rate of Wnt5a and Wnt11 in non-small cell lung carcinoma is significantly higher than that of small cell lung carcinoma. The expression level of Wnt5a is higher in squamous cell carcinoma, while Wnt11 is higher in adenocarcinoma. Both of their expression show no significant correlation with the lung cancer clinicopathological indicators (including the gender, age, degree of differentiation and lymph node metastasis in patients).
lung neoplasms; non-small cell lung carcinoma; Wnt5a; Wnt11; immunohistochemistry
R 734.2
A
1001-7399(2017)10-1082-05
时间:2017-10-23 13:30 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20171023.1330.005.html
10.13315/j.cnki.cjcep.2017.10.005
接受日期:2017-07-31
国家自然科学基金(8100048)
1华中科技大学同济医学院附属同济医院病理科,武汉 430030
2华中科技大学同济医学院基础医学院病理学系,武汉 430030
唐凤娟,女,硕士,医师。E-mail: tangfengjuan0703@163.com
况 东,男,博士,主治医师,通讯作者。E-mail: tjkdpathology@hust.edu.cn

