结直肠腺癌组织中USP10的表达及生物信息学分析
曾 智,阎红琳,陈龙艳,田 山,黄亚冰,古丽娟,熊晓星,4,袁静萍
·论 著·
结直肠腺癌组织中USP10的表达及生物信息学分析
曾 智1,阎红琳1,陈龙艳2,田 山2,黄亚冰1,古丽娟3,熊晓星3,4,袁静萍1
目的探讨泛素特异性蛋白酶10(Ubiquitin-specific protease 10, USP10)及其mRNA在人结直肠腺癌组织中的表达及意义,并分析表达失调的原因。方法选取99例人结直肠腺癌及83例正常肠黏膜组织,采用组织芯片和免疫组化法检测USP10蛋白表达,并分析该蛋白表达与临床病理特征及患者预后生存的关系。采用GEO数据库分析USP10 mRNA表达水平。通过生物信息学法筛选出负性调控USP10蛋白表达的miRNA。采用免疫印迹及实时荧光定量PCR法分别检测不同肠癌细胞系中USP10蛋白和miR-149的表达。结果USP10蛋白在正常肠黏膜组织中的阳性率为71.08%(59/83),明显高于肠腺癌组织(53.54%,53/99)(P=0.015)。USP10蛋白表达与结直肠腺癌临床病理特征及患者预后生存无相关性(P>0.05)。USP10 mRNA在结直肠腺癌中的表达水平是正常肠黏膜组织的1.07~1.45倍,表明USP10蛋白表达下调发生在转录后水平。生物信息学分析显示,结直肠腺癌组织中呈高水平表达的miR-149与USP10 mRNA的3′UTR端具有高度保守的潜在结合位点,且肠癌细胞系中miR-149与USP10蛋白表达呈负相关。结论USP10蛋白低水平表达与结直肠腺癌的发生密切相关,其表达下调主要发生在转录后水平,miR-149高水平表达可能是负性调控USP10蛋白表达的因子之一。
结直肠肿瘤;结直肠腺癌;USP10;miR-149;生物信息学
结直肠腺癌是人类最常见的恶性肿瘤之一,其发病率和病死率位居全球所有肿瘤的第3位,仅次于肺癌及乳腺癌[1]。目前研究普遍认为,泛素-蛋白酶体途径与肿瘤的发生、发展密切相关[2-3]。本课题组前期研究发现泛素特异性蛋白酶10(ubiquitin-specific protease 10, USP10)与胃癌浸润、转移密切相关[4]。最新分子生物学研究发现,在结肠癌中,USP10可以通过去泛素化作用,增强抑癌基因SIRT6的蛋白稳定性,从而拮抗癌基因c-myc的转录激活,进而抑制结肠癌细胞的增殖,提示USP10在结直肠腺癌的发生过程中起重要作用[5]。本实验采用组织芯片和免疫组化法检测结直肠腺癌组织中USP10蛋白的表达,旨在通过大样本的临床病例进一步阐明USP10在人结直肠腺癌组织中的表达及其临床意义。此外,本实验还通过基因芯片数据库分析结合生物信息学的方法,试图探讨USP10在结直肠腺癌中表达下调的原因。
1 材料与方法
1.1材料人结直肠腺癌组织芯片购自武汉爱威尔生物公司,组织芯片编号为IWLT-N-70C41、IWLT-N-70C42、IWLT-N-70C43,共包含105例人结直肠腺癌组织及其配对的105例正常肠黏膜组织样本,并附带相应的临床病理资料(患者性别、年龄、肿块大小、部位、分化程度、浸润深度、淋巴结转移、远处转移及TNM分期情况),其中83例有生存随访信息。三种组织芯片中的临床样本无交叉重叠,所有结直肠腺癌样本均为原发癌,取材前未行放、化疗,未服用非类固醇类抗炎药。此外,三种组织芯片附带常规HE染色的虚拟切片,经病理学复查,均证实为结直肠腺癌。
1.2免疫组化采用免疫组化SP法染色,即用型免疫组化UltraSensitive SP超敏试剂盒(鼠/兔,KIT-9710)和DAB显色试剂盒均购自福州迈新公司。一抗为USP10兔抗人单克隆抗体(ab109219;Abcam, Cambridge, MA, USA),工作浓度为1 ∶250。石蜡组织芯片常规脱蜡、水化,其余操作按试剂盒说明书进行,其中一抗为4 ℃孵育过夜,修复方式为微波抗原热修复。用人肾上腺组织作为内对照,其中肾上腺皮质成分为阳性对照,髓质成分为阴性对照[6]。
1.3免疫组化结果判读免疫组化结果由两位病理专家独立阅片,阅片前均不知晓结果。识别组织芯片上每一芯点中的组织,意见分歧时协商以双方最后达成一致为准。USP10蛋白表达结果采用半定量积分法,即着色强度呈浅黄色为1分,黄色为2分,黄褐色为3分,无阳性着色为0分;阳性细胞比例<10%为0分,10%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。USP10表达水平采用以上两项结果乘积(Score=0~12,图1)为最终结果:≤6分为阴性组,>6分为阳性组。
1.4基因芯片数据分析从美国国立生物技术信息中心(NCBI)的肿瘤公共数据库GEO Datasets(https://www.ncbi.nlm.nih.gov/gds)中下载人结直肠腺癌样本基因表达谱数据集(GSE44076、GDS4382、GSE37364)[7-9],并通过NCBI 自带的GEO2R分析软件进行数据分析。以人USP10为靶基因,应用microRNA分析软件TargetScan(http://www.targetscan.org)和Pictar(http://pictar.mdc-berlin.de)预测,筛选获得可能与USP10结合的microRNA,将预测出的9种miRNA分别调入GEO数据库,下载microRNA表达谱数据集(GSE48267:包含62例新鲜组织,其中31例为结直肠腺癌、31例为配对的正常肠黏膜组织)[10],同上述方法进行miRNA表达含量分析,筛选出在结直肠腺癌中表达上调的miRNA。
1.5细胞培养4种不同的肠癌细胞系(LOVO细胞系、SW48细胞系、SW480细胞系、DLD1细胞系)为武汉大学人民医院中心实验室保存。细胞培养于含10%胎牛血清、100 U/mL青霉素和链霉素的DMEM培养液中,并置于37 ℃、5%CO2的培养箱中。待细胞密度达80%~90%时,通过胰酶消化更换培养基传代。
1.6实时荧光定量PCR采用Trizol法提取细胞总RNA,包括miRNA。miRNA的逆转录采用茎环法,根据miRNA成熟体序列设计特异性茎环引物(表1)。逆转录分两步完成,第一步反应体系包括:4 μL的样品总RNA,1 μL茎环引物,7 μL RNase Free ddH2O;反应程序:65 ℃ 5 min,然后冰上5 min;第二步在上述体系中继续加入4 μL 5×RT buffer,2 μL dNTP(10 mmol/L),1 μL RT-Ace逆转录酶和1 μL 40 U/μL的RNase Inhibitor;反应程序:30 ℃ 10 min,42 ℃ 20 min,95 ℃ 5 min,然后4 ℃保存。实时荧光定量PCR采用双链DNA染料Power SYBR Green试剂盒(ABI)和ABI 7500 fast系统。反应体系:5 μL PCR Master Mix(2×),0.2 μL上游引物(10 μmol/L),0.2 μL下游引物(10 μmol/L),1 μL cDNA,3.6 μL ddH2O。所有反应在96孔板(MicroAmp optical 96-well)中进行,用Optical adhesive covers(Applied Biosystems)进行封口,扩增反应采用三复孔,并计算标准差来衡量实验误差。通过计算miR-149与内参U6的Ct值之差(ΔCt),来反映在等量RNA起始反应的情况下目的miRNA表达的差异。

表1 引物序列

图1 USP10蛋白在结直肠腺癌及正常肠黏膜组织中不同表达评分的代表图,SP法
1.7Westernblot用RIPA裂解液裂解肠癌细胞后,采用BCA法测定蛋白浓度。定量后取各样本40 μg进行SDS-PAGE电泳,电压保持在40~60 V,待样品跑齐至浓缩胶与分离胶的界限时,再恒压100 V电泳1.5 h。然后应用PVDF膜转膜1 h,5%脱脂牛奶封闭1 h。USP10兔抗人单克隆抗体(ab109219;Abcam,Cambridge,MA,USA,工作浓度1 ∶1 000)和GAPDH鼠抗人单克隆抗体(60004-1-Ig,Proteintech,Wuhan,China,工作浓度1 ∶2 000)4 ℃孵育过夜,洗膜后分别加入辣根酶标记的羊抗兔和羊抗鼠二抗孵育1 h,洗涤后与ECL发光试剂反应,曝光洗片,扫描图像。条带灰度值采用Image J软件测算,以GAPDH作为内参进行标准对照。每组实验重复3次。
1.8统计学分析采用SPSS 15.0软件进行统计学分析,对计数资料用率表示,采取χ2检验、Fisher精确检验;绘制Kaplan-Merier生存曲线,采用Log-rank检验生存率的比较;以单样本K-S检验方法验证基因表达谱数据是否符合正态分布,对符合正态分布的数据采用t检验,对不符合正态分布者行两独立样本非参数检验(Mann-Whitney Test)。P<0.05为差异有统计学意义。
2 结果
2.1USP10蛋白在结直肠腺癌及正常肠黏膜组织中的表达3张组织芯片共包含105例肠腺癌组织及配对的105例正常肠黏膜组织,经过免疫组化染色及形态学阅片后,有99例肠腺癌组织具有完整的肿瘤成分,有83例正常肠黏膜组织具有完整的黏膜上皮。其余芯片位点存在掉点或结果无法判读的情况。
USP10蛋白阳性信号主要定位于细胞质及部分细胞膜。其中在结直肠腺癌组织,USP10蛋白主要表达于肿瘤细胞;在正常肠黏膜组织,该蛋白主要表达于正常腺体的上皮细胞;此外,在间质中的部分淋巴细胞、浆细胞及神经纤维也可见USP10的散在阳性信号(图1)。本实验主要分析USP10蛋白在实质上皮成分中的表达,发现USP10蛋白在正常肠黏膜组织的阳性率为71.08%(59/83),明显高于肠腺癌组织(53.54%,53/99),差异具有统计学意义(χ2=5.875,P=0.015,图2)。
2.2USP10蛋白与结直肠腺癌临床病理特征的关系99例结直肠腺癌患者平均年龄为60岁,肿块平均直径为4.8 cm。结果发现USP10蛋白表达与患者年龄、性别、肿块大小、肿瘤部位、细胞分化程度、浸润深度、淋巴结转移、远处转移及TNM分期均无明显相关性,差异无统计学意义(P>0.05,表2)。

图2 USP10蛋白在结直肠腺癌及正常肠黏膜组织中的表达

表2 USP10蛋白表达与结直肠腺癌临床病理特征的关系[n(%)]
2.3USP10蛋白表达与结直肠腺癌患者的生存率的关系在随访成功的83例患者中,死亡19例,存活64例,随访时间23~45个月。USP10阴性组:死亡7例,存活30例,中位生存时间34.82个月;USP10阳性组:死亡12例,存活34例,中位生存时间32.31个月;Log-rank检验显示,USP10蛋白表达与患者预后生存时间之间无相关性,差异无统计学意义(χ2=1.699,P=0.192,图3)。

图3 USP10蛋白表达与结直肠腺癌患者预后的生存曲线
2.4结直肠腺癌及正常肠黏膜组织中USP10mRNA的表达GEO Datasets表达谱数据显示,USP10 mRNA在结直肠腺癌组织中的表达水平略高于正常肠黏膜组织,差异有统计学意义(P<0.05),但差异倍数仅为1.07~1.45倍(图4)。
2.5结直肠腺癌及正常肠黏膜组织中与USP10有结合位点的miRNA的表达TargetScan预测出与USP10有结合位点的8种miRNA分别为miR-129-5p、miR-132-3p、miR-212-3p、miR-138-5p、miR-24-3p、miR-142-5p、miR-103-3p及miR-107,其中与USP10 3’UTR具有高度保守结合位点的为miR-138-5p及miR-142-5p。PicTar预测出miR-138及miR-149。将这9种miRNA调入GEO数据库(GSE48267)进行miRNA表达含量分析,筛选出在结直肠腺癌中表达上调的3种miRNA。其中miR-149上调最为显著,结直肠腺癌组织中的表达含量是正常肠黏膜组织的7.67倍,差异有统计学意义(P<0.05,图5)。miR-129-5p及miR-212-3p仅上调1.08倍及1.15倍,差异无统计学意义(P>0.05,表3)。
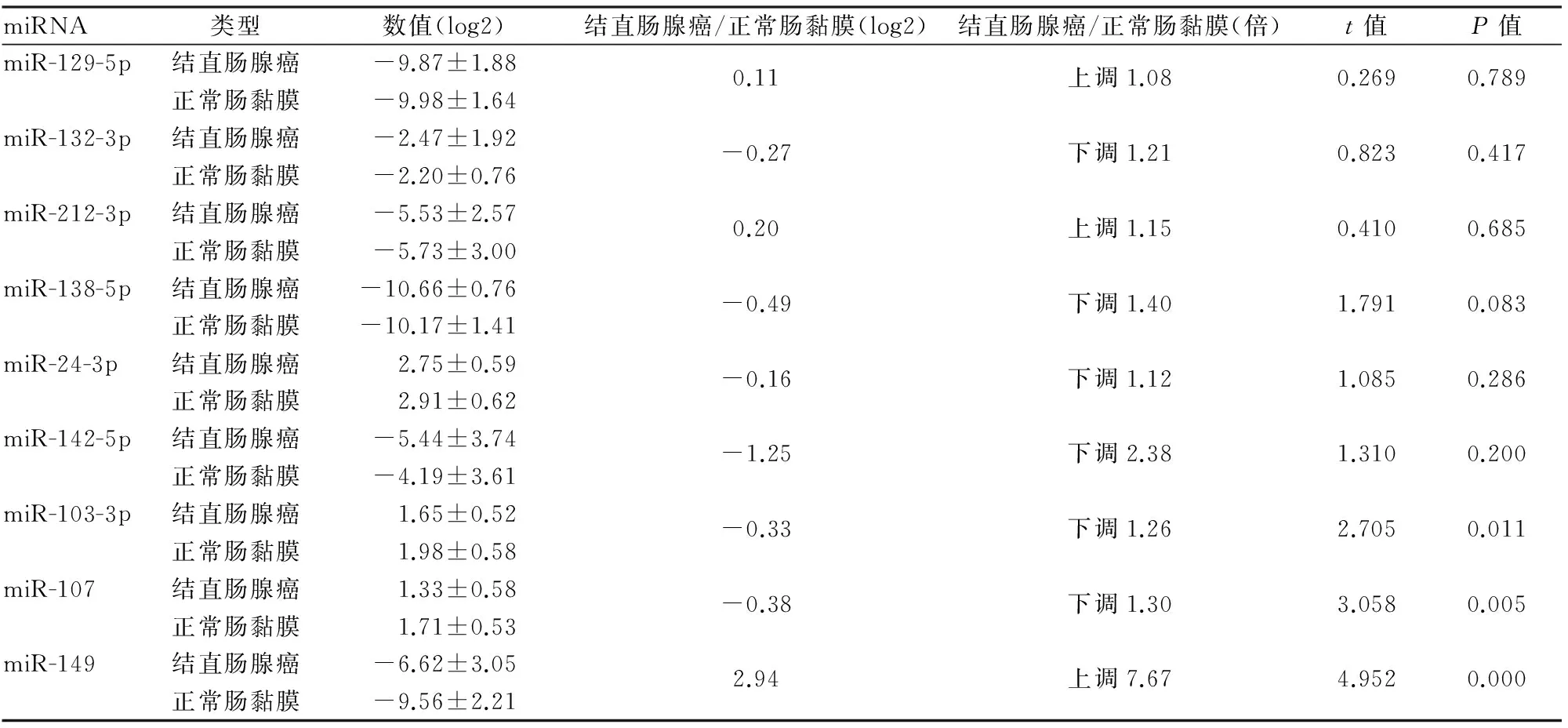
表3 miRNA基因芯片数据

图4 USP10 mRNA表达水平的散点图
A.在基因芯片GSE44076中,USP10 mRNA在98例结直肠腺癌中的表达水平是98例正常肠黏膜的1.07倍;B.在GDS4382中,17例结直肠腺癌的表达水平是17例正常肠黏膜的1.16倍;C.在GSE37364中,27例结直肠腺癌的表达水平是38例正常肠黏膜的1.45倍

图5 GSE48267数据分析
miR-149在结直肠腺癌及正常肠黏膜组织中的表达水平散点图
2.6肠癌细胞系中miR-149与USP10蛋白表达的相关性鉴于GEO数据库芯片结果显示,miR-149在结直肠腺癌组织中的表达上调,而本实验中USP10蛋白在结直肠腺癌组织中表达下调,为探讨两者之间的相关性,本组实验进一步在4种不同肠癌细胞系(LOVO细胞系、SW48细胞系、SW480细胞系、DLD1细胞系)中检测miR-149和USP10蛋白表达水平。结果显示,在LOVO细胞系中,miR-149的表达相较于其他三种细胞系下降(P<0.05,图6A),而USP10蛋白表达上升(图6B);同样,在SW48细胞系、SW480细胞系和DLD1细胞系中,miR-149与USP10蛋白表达也呈相反变化趋势,提示肠癌细胞系中miR-149与USP10蛋白的表达呈负相关。

图6 肠癌细胞系中miR-149与USP10蛋白表达的相关性
A.miR-149在肠癌细胞系中的相对表达,*P<0.05;B.USP10蛋白在肠癌细胞系中的表达
3 讨论
泛素-蛋白酶体途径是细胞内重要的蛋白质降解调节系统。通过对底物蛋白的多聚泛素化并经蛋白酶体降解,影响或调节多种细胞活动。USP10,又名UBPO,位于16号染色体长臂24.1上。该基因编码的蛋白由798个氨基酸构成,能特异性地将泛素分子从泛素结合的蛋白底物中切割出来,主要参与泛素依赖的蛋白分解代谢、泛素周期等生命过程[4,11]。早期研究发现在内涵体中USP10能够促进囊性纤维化跨膜传导调节因子(cystic fibrosis transmembrane conductance regulator, CFTR)去泛素化,进而增强CFTR的内吞回收功能[12]。
近年来,USP10与肿瘤相关的分子机制研究有了较大进展,相继发现USP10与p53、T-bet、PCNA、Beclin1、SIRT6及NEMO等蛋白的去泛素化密切相关,进而参与细胞增殖、分化及自噬等生物学过程[5,13-16]。其中最具代表性的研究成果是:USP10通过去泛素化作用调节p53蛋白的稳定性,从而逆转泛素连接酶Mdm2诱导的p53转运和泛素化降解过程[11]。进一步研究发现USP10不仅可以稳定野生型p53蛋白,而且还可以稳定突变型p53蛋白,并在肾癌的发生过程中起重要作用[11]。本组前期实验报道USP10蛋白作为一种抑癌基因参与胃癌的发生、发展过程,是胃癌患者预后的独立预测指标[4]。本组最新实验还报道USP10与S100A12、E-cadherin等蛋白表达呈正相关,后者在胃癌发生、发展过程中也起重要作用[17]。此外,USP10蛋白还可以作为一种分子标志物,在肾上腺皮质肿瘤及髓质肿瘤的鉴别诊断中起重要作用,在本实验应用这一表达特点作为免疫组化实验中USP10蛋白表达的内对照[6]。
Lin等[5]通过细胞学实验发现USP10可以通过去泛素化作用稳定SIRT6蛋白,从而拮抗c-myc的转录激活,最终抑制结直肠腺癌的发生。在该研究中,Lin等[5]还检测了10例结直肠腺癌及其正常肠黏膜组织中USP10蛋白的表达情况,发现USP10在一部分结直肠腺癌组织中呈现低水平表达,然而该结论仍需要大样本研究证实。在本研究中,本实验收集了99例结直肠腺癌组织样本,发现USP10蛋白在的肠黏膜上皮细胞中高表达,在结直肠腺癌中表达下调,提示USP10蛋白低水平与结直肠腺癌的发生密切相关,这一结果支持Lin等的研究。进一步的临床病理参数分析发现,USP10蛋白低表达与患者年龄、性别、肿块大小、肿瘤部位、细胞分化程度、浸润深度、淋巴结转移、远处转移及TNM分期之间无明显相关性,提示USP10蛋白表达与结直肠腺癌的发展过程关系不大。此外,生存随访分析也显示USP10蛋白表达水平的高低并不能作为结直肠腺癌患者预后生存时间长短的预测指标。
在基因芯片表达谱数据库中,作者选取3份有代表性的人结直肠腺癌及正常肠黏膜组织的基因芯片数据集,分析结果发现USP10 mRNA在结直肠腺癌组织中的表达水平略高于正常肠黏膜组织,但差异倍数并未超过1.5倍。这一结果与蛋白水平的表达调控方向并不一致,提示USP10蛋白在结直肠腺癌中的低水平表达并非是由该基因的mRNA合成下调所致,即该分子事件并非发生在转录水平,可能是发生在转录后水平。microRNA (miRNA)由DNA转录产生,不翻译成蛋白质,通过碱基互补配对方式可以与靶基因的3′UTR区域部分或完全互补,从而剪切靶基因的转录产物或者抑制转录产物的翻译,进而起到转录后调控靶基因表达的作用。近年来研究发现多种miRNA在结直肠腺癌的发生过程中起重要作用[18]。本实验采用生物信息学方法,通过多种预测软件筛选出9种可能与USP10 3′UTR区域具有结合位点的miRNA,并将这些miRNA调入miRNA表达谱数据库后,发现miR-149是唯一一个在结直肠腺癌组织中表达明显上调且具有USP10 3′UTR区域结合位点的miRNA,同时,本实验发现肠癌细胞系中miR-149与USP10蛋白的表达呈负相关,提示在人结直肠腺癌发生过程中,miR-149可能可以与USP10 3′UTR区域结合,进而负性调控USP10 mRNA的转录,从而抑制USP10蛋白的表达。当然这一结论还有待进一步的双荧光素酶报告基因等分子生物学实验证实。
综上所述,USP10蛋白低水平表达主要与结直肠腺癌的发生有关,而与该肿瘤的发展过程关系不大,其在预测患者预后生存方面的作用有限。同时,USP10蛋白在结直肠腺癌与正常肠黏膜组织中的差异性表达主要发生在转录后调控水平,miR-149在这个过程中可能起负性调控作用。
[1] Torre L A, Bray F, Siegel R L,etal. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015,65(2):87-108.
[2] Ding F, Xiao H, Wang M,etal. The role of the ubiquitin-proteasome pathway in cancer development and treatment[J]. Front Biosci (Landmark Ed), 2014,19:886-895.
[3] Bhattacharya S, Ghosh M K. Cell death and deubiquitinases: perspectives in cancer[J]. Biomed Res Int, 2014,2014:435197.
[4] Zeng Z, Wu H X, Zhan N,etal. Prognostic significance of USP10 as a tumor-associated marker in gastric carcinoma[J]. Tumour Biol, 2014,35(4):3845-3853.
[5] Lin Z, Yang H, Tan C,etal. USP10 antagonizes c-Myc transcriptional activation through SIRT6 stabilization to suppress tumor formation[J]. Cell Rep, 2013,5(6):1639-1649.
[6] Zeng Z, Zhou Z, Zhan N,etal. USP10 expression in normal adrenal gland and various adrenal tumors[J]. Endocr Pathol, 2015,26(4):302-308.
[7] Sanz-Pamplona R, Berenguer A, Cordero D,etal. Aberrant gene expression in mucosa adjacent to tumor reveals a molecular crosstalk in colon cancer[J]. Mol Cancer, 2014,13:46.
[8] Khamas A, Ishikawa T, Shimokawa K,etal. Screening for epigenetically masked genes in colorectal cancer using 5-Aza-2′-deoxycytidine, microarray and gene expression profile[J]. Cancer Genomics Proteomics, 2012,9(2):67-75.
[9] Valcz G, Patai A V, Kalmar A,etal. Myofibroblast-derived SFRP1 as potential inhibitor of colorectal carcinoma field effect[J]. PLoS One, 2014,9(11):e106143.
[10] Li E, Ji P, Ouyang N,etal. Differential expression of miRNAs in colon cancer between African and Caucasian Americans: implications for cancer racial health disparities[J]. Int J Oncol, 2014,45(2):587-594.
[11] Yuan J, Luo K, Zhang L,etal. USP10 regulates p53 localization and stability by deubiquitinating p53[J]. Cell, 2010,140(3):384-396.
[12] Bomberger J M, Barnaby R L, Stanton B A. The deubiquitinating enzyme USP10 regulates the post-endocytic sorting of cystic fibrosis transmembrane conductance regulator in airway epithelial cells[J]. J Biol Chem, 2009,284(28):18778-18789.
[13] Pan L, Chen Z, Wang L,etal. Deubiquitination and stabilization of T-bet by USP10[J]. Biochem Biophys Res Commun, 2014,449(3):289-294.
[14] Yang Q, Ou C, Liu M,etal. NRAGE promotes cell proliferation by stabilizing PCNA in a ubiquitin-proteasome pathway in esophageal carcinomas[J]. Carcinogenesis, 2014,35(7):1643-1651.
[15] Liu J, Xia H, Kim M,etal. Beclin1 controls the levels of p53 by regulating the deubiquitination activity of USP10 and USP13[J]. Cell, 2011,147(1):223-234.
[16] Niu J, Shi Y, Xue J,etal. USP10 inhibits genotoxic NF-kappaB activation by MCPIP1-facilitated deubiquitination of NEMO[J]. EMBO J, 2013,32(24):3206-3219.
[17] Li D, Zeng Z, Yu T,etal. Expression and clinical implication of S100A12 in gastric carcinoma[J]. Tumour Biol, 2016,37(5):6551-6559.
[18] Zhu L, Fang J. The structure and clinical roles of microRNA in colorectal cancer[J]. Gastroenterol Res Pract, 2016,2016:1360348.doi:10.1155//2016/1360348.Epub 2016 Dec 28.
ExpressionofUSP10incolorectaladenocarcinomaandanalysisofbioinformatics
ZENG Zhi1, YAN Hong-lin1, CHEN Long-yan2, TIAN Shan2, HUANG Ya-bing1, GU Li-juan3, XIONG Xiao-xing3,4, YUAN Jing-ping1
(1DepartmentofPathology,2DepartmentofGastroenterology,3CentralLaboratory,4DepartmentofNeurosurgery,RenminHospitalofWuhanUniversity,Wuhan430060,China)
PurposeTo investigate the expression and significance of USP10 protein and mRNA in normal colorectal mucosa and colorectal adenocarcinoma, and to analyze the cause of the disorder.Methods99 cases of colorectal adenocarcinoma and 83 cases of normal intestinal mucosa tissue were selected. Using tissue microarray and immunohistochemistry the expression of USP10 protein was detected, and the relationship was analyzed between USP10 protein and clinical pathological parameters or prognosis survival time. The expression of USP10 mRNA was analyzed by GEO datesets. Some miRNAs that down-regulate the expression of USP10 protein were screened by bioinformatics methods. The expression of USP10 protein and miR-149 in colorectal cancer cell lines were detected by Western blot and real-time quantitative PCR.ResultsThe positive rate of USP10 protein in normal intestinal mucosa tissues was 71.08% (59/83), which was significantly higher than that in colorectal adenocarcinoma tissues (53.54%, 53/99,P=0.015). No correlation were proved between USP10 protein expression and clinical pathological parameters or survival time (P>0.05). The expression level of USP10 mRNA in colorectal adenocarcinoma was 1.07~1.45 times that were higher than that of normal intestinal mucosa, which showed that the down-regulation of USP10 protein was at the post-transcriptional level. The program predicted a putative highly-conserved binding site in the USP10 mRNA 3′UTR for miR-149 which was up regulated in colorectal adenocarcinoma tissues. In addition, the expression of miR-149 was negatively correlated with the expression of USP10 protein in colorectal cancer cell lines.ConclusionThe down-regulation of USP10 protein which occurs at the post-transcriptional level is closely related to the pathogenesis of colorectal adenocarcinoma. The high expression of miR-149 may be one of the factors that negatively regulate the expression of USP10 protein.
colorectal neoplasms; colorectal adenocarcinoma; USP10; miR-149; bioinformatics
R 735.3
A
1001-7399(2017)10-1063-07
时间:2017-10-23 13:30 网络出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20171023.1330.001.html
10.13315/j.cnki.cjcep.2017.10.001
接受日期:2017-08-30
国家自然科学基金(81602535)、湖北省自然科学基金面上项目(2016CFB249)
武汉大学人民医院1病理科、2消化内科、3中心实验室、4神经外科,武汉 430060
曾 智,男,主治医师。E-mail: zhizeng@whu.edu.cn
袁静萍,女,主任医师,通讯作者。E-mail: yuanjingping2003@aliyun.com

