CYP3A4基因18B位点多态性与晚期EGFR基因突变NSCLC患者疗效及不良反应的关系
程艳芳,费晶,王艳娜,王慧,孟玲利,巩平
(石河子大学医学院第一附属医院,新疆石河子832000)
·论著·
CYP3A4基因18B位点多态性与晚期EGFR基因突变NSCLC患者疗效及不良反应的关系
程艳芳,费晶,王艳娜,王慧,孟玲利,巩平
(石河子大学医学院第一附属医院,新疆石河子832000)
目的探讨细胞色素3A4(CYP3A4)基因18B位点(CYP3A4*18B)多态性与表皮生长因子受体(EGFR)基因突变晚期非小细胞肺癌(NSCLC)患者疗效及不良反应的关系。方法选择EGFR基因突变晚期初治NSCLC患者44例,口服EGFR酪氨酸激酶抑制剂(EGFR-TKI)吉非替尼片250 mg,1次/d;或厄洛替尼片150 mg,1次/d。直至患者病情进展或无法耐受不良反应而停药。治疗前采用PCR及直接测序法检测CYP3A4*18B的基因突变状态,比较突变型和野生型患者疗效(客观缓解率、疾病控制率)及不良反应的差异。结果CYP3A4*18B基因突变频率为36.4%(16/44),野生型纯合子占63.6%(28/44),突变型杂合子占34.1%(15/44),突变型纯合子占2.3%(1/44)。野生型与突变型患者疗效比较差异无统计学意义(P均>0.05),野生型患者皮疹发生率高于突变型患者(P<0.05)。结论CYP3A4*18B的多态性与晚期EGFR基因突变NSCLC患者的EGFR-TKI疗效无关,与药物不良反应有关。
非小细胞肺癌;细胞色素3A4;表皮生长因子;基因多态性;酪氨酸激酶抑制剂;治疗结果;不良反应
非小细胞肺癌(NSCLC)占所有组织类型肺癌的85%[1]。随着对肿瘤发生机制研究的不断深入,对不同组织类型的肺癌可行进一步的分子分型。表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)是治疗NSCLC的一线药物,患者总生存时间2~24个月[2],个体差异显著。目前对EGFR-TKI疗效的判断主要依赖于EGFR突变状态、性别、腺癌、吸烟等临床病理特征,但这并不能完全解释其药物作用的敏感性差异。第一代EGFR-TKI代表药物吉非替尼,约60%由肝脏代谢。研究表明,代谢酶和各种转运蛋白的个体表达会影响吉非替尼的生物利用度[3,4]。在体内,吉非替尼主要的肝内代谢酶细胞色素3A4(CYP3A4)的表达变化可解释吉非替尼血浆药物暴露量的个体差异[5]。厄洛替尼与吉非替尼类似,其大部分由CYP3A4介导代谢,也表现出广泛的个体间药代动力学差异[6]。研究表明,吉非替尼和厄洛替尼主要不良反应为皮疹、腹泻[7]。部分患者可发生间质性肺炎等严重不良反应,其致死率可达35%[8]。有研究结果显示,化疗药物伊立替康、甲氨蝶呤所致迟发性腹泻、中性粒细胞减少及肝肾功能损害与其各自代谢酶基因多态性有关[9,10]。因此,本研究探讨CYP3A4基因18B位点(CYP3A4*18B)多态性与EGFR基因突变晚期NSCLC疗效及不良反应的关系,为预测TKI药物敏感性差异、疗效、不良反应提供参考。
1 资料与方法
1.1 临床资料 收集2013年1月~2016年3月在本院接受EGFR-TKI药物治疗的晚期初治NSCLC患者44例。纳入标准:年龄18~80岁;经细胞病理学或组织病理学检查确诊为Ⅳ期NSCLC;治疗前行EGFR基因检测且突变阳性,自愿接受EGFR-TKI治疗;至少有1个可测量或可评估的病灶;能够依从研究和随访;签署知情同意书。排除标准:既往或同时合并其他恶性肿瘤患者;严重感染或其他严重内科疾病患者。本研究获得本院医学伦理委员会批准。
1.2 CYP3A4*18B突变检测 采用PCR及直接测序法。治疗前留取患者外周静脉血2 mL,置于EDTA抗凝管中。采用血液基因组DNA提取试剂盒(北京天根生化公司)从血标本中提取DNA,置于-80 ℃低温冰箱中贮存备用。依据引物设计原则及相关文献[11]制备引物(上海生工生物公司)。上游引物为5′-AAATGTCTTTCCTCTCCTTTCAGC-3′,下游引物为5′-AGCCTTCCTACATAGAGTCAGTG-3′,扩增产物293 bp。PCR反应条件:94 ℃预变性10 min,94 ℃变性40 s,55 ℃退火45 s,72 ℃延伸35 s,循环35次,72 ℃再延伸10 min,4 ℃取出,-20 ℃冰箱保存。2%琼脂糖(西班牙Biowest Agarose)凝胶电泳后采用紫外凝胶成像系统(美国Bio-Rad)对所得PCR产物进行拍照。采用直接测序法(北京六合华大基因科技公司)检测所得PCR产物的基因序列。
1.3 治疗方案、疗效及不良反应评价 患者均口服吉非替尼片(阿斯利康制药有限公司)250 mg,1次/d,或厄洛替尼片(上海罗氏制药有限公司)150 mg,1次/d,直至病情进展或患者无法耐受不良反应而停药。采用实体瘤疗效评价标准进行疗效评定,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD);客观缓解率(ORR)=(CR+PR)/(CR+PR+SD+PD)×100%,疾病控制率(DCR)=(CR+PR+SD)/(CR+PR+SD+PD)×100%。采用2009年美国国家癌症研究所制定的常见不良反应事件评价标准4.0对不良反应进行评价。
1.4 统计学方法 采用SPSS17.0统计软件。CYP3A4*18B的基因型分布采用Hardy-Weinberg平衡检验。计数资料采用χ2检验及Fisher′s确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 CYP3A4*18B基因型分布及基因频率 CYP3A4*18B基因野生型碱基为G的单峰,突变型碱基由G突变为A,纯合子碱基为A的单峰,突变型杂合子为杂合双峰。基因突变频率为36.4%(16/44),野生型纯合子(GG)占63.6%(28/44),突变型杂合子(GA)占34.1%(15/44),突变型纯合子(AA)占2.3%(1/44)。各基因型频率分布符合Hardy-Weinberg平衡定律(P>0.05)。
2.2 CYP3A4*18B基因型与患者临床病理特征的关系 CYP3A4*18B基因型与患者性别、年龄、吸烟史、美国东部肿瘤协作组(ECOG)评分、药物、EGFR基因突变类型无关(P均>0.05)。见表1。
2.3 CYP3A4*18B基因型与化疗疗效的关系 CYP3A4*18B基因野生型(GG)28例,CR 0例、PR 9例、SD 10例、PD 9例,ORR为32.1%,DCR为67.9%;CYP3A4*18B基因突变型(GA+AA)16例,CR 0例、PR 3例、SD 9例、PD 4例,ORR为18.8%,DCR为75.0%。野生型与突变型患者ORR、DCR比较差异无统计学意义(P均>0.05)。
2.4 CYP3A4*18B基因型与药物不良反应的关系 CYP3A4*18B基因野生型患者发生Ⅰ~Ⅳ级皮疹20例(71.4%)、腹泻12例(42.9%)、间质性肺炎1例(3.6%)、肝功能损害1例(3.6%);突变型患者发生Ⅰ~Ⅳ级皮疹5例(31.3%)、腹泻5例(31.3%)、间质性肺炎0例、肝功能损害2例(12.5%)。二者皮疹发生率比较差异有统计学意义(P<0.05),其余不良反应发生率比较差异无统计学意义(P均>0.05)。
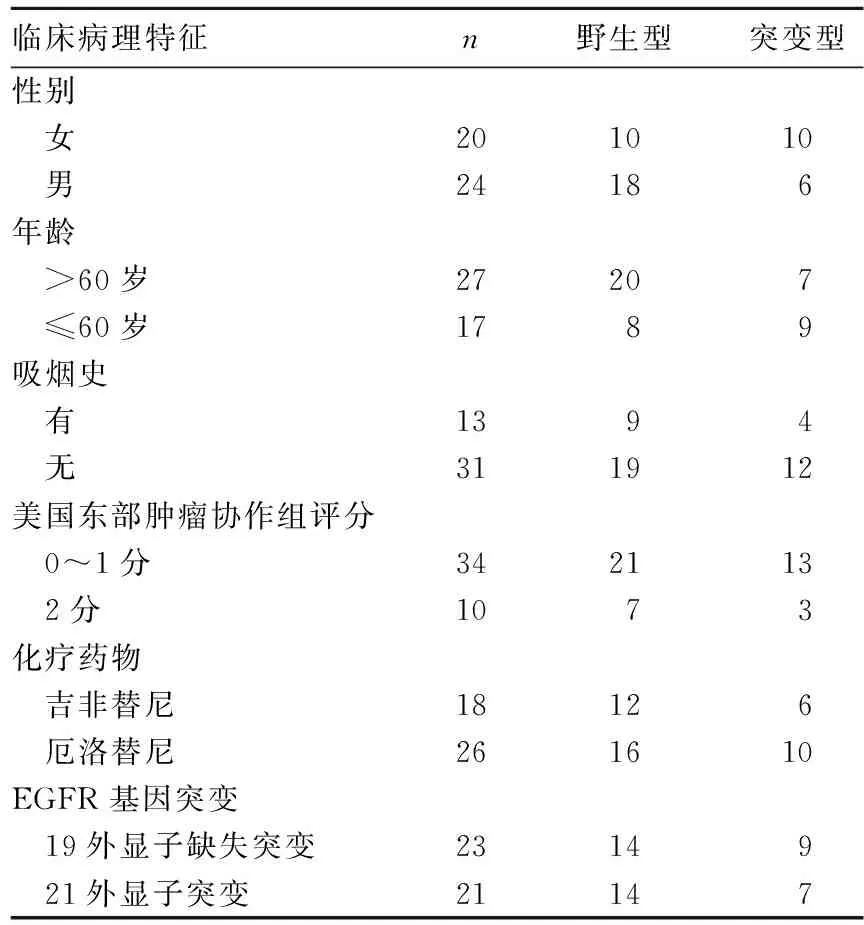
表1 CYP3A4*18B基因型与患者临床病理特征的关系(例)
3 讨论
TKI药物的主要作用机制为选择性和可逆性地与NSCLC患者EGFR的细胞内ATP位点相结合[12],通过抑制磷酸激酶的活化,阻断下游信号的转导,抑制肿瘤细胞生长、侵袭、转移及新生血管形成,从而发挥抗肿瘤作用。一项以铂类为基础的联合化疗对比TKI药物的研究显示:吉非替尼组中位无进展生存期达10.8个月,显著优于化疗组的5.4个月;中位总生存期达30.5个月,化疗组仅为23.6个月[13]。EGFR突变患者对TKI的有效率超过了70%,因此TKI成为EGFR突变患者的一线治疗药物。但临床工作中发现,不同个体间TKI药物敏感性存在差异。药物基因组学的研究发现,单核苷酸多态性目前被公认为是导致药动学、药效学及不良反应复杂性与多样性的重要原因[14],与大约80%的遗传变异相关。因此本研究通过检测CYP3A4基因型探讨多态性对TKI药物敏感性的影响,为临床个体化应用TKI药物提供参考。
第一代TKI代表性药物吉非替尼和厄洛替尼,主要通过细胞色素P450(CYP450)家族的亚族CYP3A4酶代谢,这一代谢酶参与了约50%临床用药的代谢过程。其中CYP3A4*18B是目前已发现的突变率最高的位点,在首次发现该突变位点的日本人群中突变率达24.9%[15],在中国福建汉族高脂血症患者中突变率为23.48%[16],本研究中NSCLC患者突变率达36.4%,考虑可能因为CYP家族存在肺癌易感性、CYP3A4与NSCLC发生风险有关,CYP基因多态性增加了肺癌的发生风险[17]。既往研究[18]认为CYP3A4基因多态性可预测药物所致的不良反应,对临床个体化用药具有指导意义。CYP3A4*18基因多态性提高了CYP3A4对药物的代谢水平[19]。对CYP3A4*18B基因多态性与其代谢药物疗效及不良反应的研究中发现,CYP3A4*18B基因多态性与其代谢药物洛匹那韦疗效无相关性[20],与其所代谢药物阿托伐他汀血药浓度及疗效也无相关性[16];CYP3A4*18B基因多态性对肾移植患者他克莫司不良反应和排斥反应无影响[21];也未发现CYP3A4*18B位点的基因多态性与卡马西平所致皮肤不良反应的相关性[22]。但有研究[23]结果表明,CYP3A4*18B基因多态性与抗结核药物所致肝损伤的发生有关。既往研究证实,吉非替尼药代动力学、血药浓度的改变可导致吉非替尼临床应用的个体化[24]。本研究结果显示,CYP3A4*18B基因多态性与吉非替尼和厄洛替尼的疗效无相关性,但突变型较野生型患者皮疹发生率降低。研究表明,CYP3A4*18B基因多态性导致酶活性增高,使药物的代谢加快,从而降低了药物在体内的暴露剂量[25]。考虑本研究结果的原因与其一致。日本一项关于吉非替尼疗效与代谢酶基因多态性关联性的研究也表明,吉非替尼疗效与代谢酶CYP3A4 基因多态性无相关性[26];但其对药物不良反应的研究发现,吉非替尼主要不良反应皮疹的发生与代谢酶基因多态性无关,与药物的血药浓度存在相关性。药代动力学的研究发现,药物的吸收、转运、代谢、排泄等多个过程中多基因的变异可能是导致其血药浓度个体间差异的原因[27]。因此进一步研究药物在体内多个过程基因多态性的联合作用可能为阐明多态性导致药物疗效及不良反应个体化的原因提供更充分的依据。
本研究采用直接测序法对44例NSCLC患者CYP3A4*18B基因型进行检测,进而探讨TKI疗效及不良反应个体差异的原因。结果显示,CYP3A4*18B基因多态性与TKI疗效无相关性;但基因突变型患者,主要不良反应皮疹的发生率低于野生型患者,提示检测患者代谢酶的基因型对预测其药物的不良反应有重要意义。
本研究样本量较小,对于TKI疗效及不良反应个体差异的原因进行了初步探讨。进一步研究可加大样本量并深入探讨其药物代谢酶基因多态性与药代动力学、药效学之间的联系,为NSCLC患者TKI药物的安全、合理、个体化应用提供更充分的分子学依据。多基因的联合作用也是未来研究的方向。
[1] Lara MS, Brunson A, Wun T, et al. Predictors of survival for younger patients less than 50 years of age with non-small cell lung cancer (NSCLC): a California cancer registry analysis[J]. Lung Cancer, 2014,85(2):264-269.
[2] Rosell R, Moran T, Queralt C, et al. Screening for epidermal growth factor receptor mutation in lung cancer[J]. New Engl J Med, 2009,361(10):958-967.
[3] Ranson M, Wardell S. Gefitinib, a novel, orally administered agent for the treatment of cancer[J]. J Clin Pharm Ther, 2004,29(2):95-103.
[4] Li J, Zhao M, He P, et al. Differential metabolism of gefitinib and erlotinib by human cytochrome P450 enzymes[J]. Clin Cancer Res, 2007,13(12):3731-3137.
[5] Swaisland HC, Cantarini MV, Fuhr R, et al. Exploring the relationship between expression of cytochrome P450 enzymes and gefitinib pharmacokinetics[J]. Clin Pharmacokinet, 2006,45(6):633-644.
[6] Rudin CM, Liu W, Desai A, et al. Pharmacogenomic and pharmacokinetic determinants of erlotinib toxicity[J]. J Clin Oncol, 2008,26(7):1119-1127.
[7] Lynch TJ Jr, Kim ES, Eaby B, et al. Epidermal growth factor receptor inhibitor-associated cutaneous toxicities: an evolving paradigm in clinical management[J]. Oncologist, 2007,12(5):610-621.
[8] 程军,叶根深.吉非替尼致间质性肺病49例文献分析[J].中国新药与临床杂志,2016,35(2):145-148.
[9] 杨孟丹,张颖,王晓鹏,等.UGT1A1基因多态性与伊立替康临床用药安全性及疗效的关系[J].现代肿瘤医学,2017,25(2):252-256.
[10] 李菲,尹郸丹,周小兰,等.急性淋巴细胞白血病患儿GSTP1及MTHFR基因多态性对大剂量甲氨蝶呤不良反应的影响[J].中国实验血液学杂志,2017,25(3):723-728.
[11] 杨建伟,陈增,苏颖,等.胃癌细胞色素氧化酶CYP3A4基因多态性与含紫杉醇方案化疗敏感性的研究[J].临床肿瘤学杂志,2014,19(1):23-28.
[12] Siegel-Lakhai WS, Beijnen JH, Schellens JH. SchellensaCurrent knowledge and future directions of the selective epidermal growth factor receptor inhibitors erlotinib (Tarceva) and gefitinib (Iressa)[J]. Oncologist, 2005,10(8):579-589.
[13] Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med, 2010,362(25):2380-2388.
[14] Liao B, Li X, Cai L, et al. A hierarchical clustering method of selecting kernel SNP to unify Informative SNP and tag SNP[J]. IEEE /ACM TCBB, 2015,12(1):113-122.
[15] Fukushima-Uesaka H, Saito Y, Watanabe H, et al. Haplotypes of CYP3A4 and their close linkage with CYP3A5 haplotypes in a Japanese population[J]. Hum Mutat, 2004,23(1):100-107.
[16] 刘亦伟,林翠鸿,王长连,等.CYP3A4*18A、CYP3A4*18B和MDR1 C3435T基因多态性对阿托伐他汀血药浓度及疗效的影响[J].中国药学杂志,2016,51(19):1682-1689.
[17] Zienolddiny S, Campa D, Lind H, et al. A comprehensive analysis of phase Ⅰ and phase Ⅱ metabolism gene polymorphisms and risk of non-small cell lung cancer in smokers[J]. Carcinogenesis, 2008,29(6):1164-1169.
[18] 林高通,王晨明,莫菊彩.CYP3A4基因多态性对药物代谢及其个体化给药的影响[J].海峡药学,2013,25(4):1-3.
[19] 吴秀君,郭涛,张凤芹,等.CYP3A4*18基因型对唑吡坦在健康回族志愿者体内的药代动力学的影响[J].中国药学(英文版),2016,25(2):122-127.
[20] Berno G, Zaccarelli M, Gori C, et al. Analysis of single-nucleotide polymorphisms(SNPs)in human CYP3A4 and CYP3A5 genes: potential implications for the metabolism of HIV drugs[J]. BMC Med Genet, 2014,15(1):1-7.
[21] 朱琳,宋洪涛,王庆华,等.CYP3A4*18B和CYP3A5*3基因多态性对肾移植患者他克莫司剂量及浓度的影响[J].药学学报,2012,47(7):878-883.
[22] 刘晓,胡琨,弓莉,等.细胞色素P4503A4和3A5基因多态性与卡马西平浓度及皮肤药物不良反应的相关性研究[J].中国临床药理学杂志,2016,32(19):1749-1752.
[23] 郭桐君,李玉红,朱凌妍,等.CYP3A5*3和CYP3A4*18B基因多态性与抗结核药物性肝损伤的关系[J].中华疾病控制杂志,2016,20(9):897-900,909.
[24] Zhao YY, Li S, Zhang Y, et al. The relationship between drug exposure and clinical outcomes of non-small cell lung cancer patients treated with gefitinib[J]. Med Oncol, 2011,28(3):697-702.
[25] 何晓静,汝继玲,肇丽梅.CYP3A4*18B基因多态性与卡马西平的疗效和不良反应的相关性[J].中国临床药理学杂志,2013,29(159):12-14.
[26] Kobayashi H, Sato K, Niioka T, et al. Relationship among gefitinib exposure polymorphisms of its metabolizing enzymes and transporters and side effects in Japanese patients with none small-cell lung cancer[J]. Clin Lung Cancer, 2014,16(4):274-281.
[27] 周权,余露山,曾苏.基于药物代谢酶和转运体基因组学的药物精准治疗[J].药学学报,2017,52(1):1-7.
RelationshipsofCYP3A4gene18BpolymorphismswithefficacyandadversereactionsinadvancedNSCLCpatientswithEGFRgenemutation
CHENGYanfang,FEIJing,WANGYanna,WANGHui,MENGLingli,GONGPing
(TheFirstAffiliatedHospitalofShiheziUniversityMedicalCollege,Shihezi832000,China)
ObjectiveTo explore the relationships of cytochrome 3A4 (CYP3A4) gene 18B polymorphisms (CYP3A4*18B) on the efficacy and adverse reactions in advanced non-small-cell lung cancer (NSCLC) patients with EGFR gene mutation.MethodsForty-four patients with newly diagnosed advanced NSCLC were chosen and treated with epidermal growth factor receptor tyrosine kinase inhibitor (EGFR-TKI) gefitinib 250 mg, once a day, or erlotinib 150 mg, once a day; when the patients could not tolerate the adverse reactions, we stop the medication. PCR and the direct sequencing were carried out to determine the mutations of CYP3A4*18B before treatment, and then we compared the efficacy (objective response rate, disease control rate) and adverse reactions between mutant type and wild type patients.ResultsThe mutation frequency of CYP3A4*18B gene was 36.4% (16/44), among which wild type homozygote accounted for 63.6% (28/44), mutant heterozygote accounted for 34.1% (15/44), and mutant homozygote accounted for 2.3% (1/44). There was no significant difference in efficacy of EGFR-TKI between wild type and mutant type patients (allP>0.05). Patients with CYP3A4*18B gene wild type had a higher incidence of rash than that of the mutant type (P<0.05).ConclusionThe polymorphism of CYP3A4 gene 18B is not related to the efficacy of EGFR-TKI for advanced NSCLC patients with EGFR gene mutation, but is related to the adverse reactions of drugs.
non-small-cell lung cancer; cytochrome 3A4; epidermal growth factor; gene polymorphism; tyrosine kinase inhibitor; therapeutic outcome; adverse reactions
10.3969/j.issn.1002-266X.2017.37.001
R734.2
A
1002-266X(2017)37-0001-04
国家自然科学基金资助项目(81560381);吴阶平研究课题资助项目(320.6750.14269)。
程艳芳(1991-),女,硕士,主要研究方向为肿瘤化疗与生物免疫治疗。E-mail: chengyanfang01@163.com
2017-05-31)

