细胞周期调控基因及Bcl-2、c-Jun基因在人肝细胞脂肪变性过程中的表达变化
包成,毕玉晶,杨瑞馥,智发朝
(1南方医科大学南方医院·广东省南方消化病研究所,广州510515;2北京军事医学科学院微生物流行病研究所)
细胞周期调控基因及Bcl-2、c-Jun基因在人肝细胞脂肪变性过程中的表达变化
包成1,2,毕玉晶2,杨瑞馥2,智发朝1
(1南方医科大学南方医院·广东省南方消化病研究所,广州510515;2北京军事医学科学院微生物流行病研究所)
目的观察细胞周期调控基因及Bcl-2、c-Jun基因在人肝细胞L02脂肪变性过程中的表达变化。方法以油酸和软脂酸(2∶1)混合液处理L02细胞0、5、10、20 h,建立人肝细胞脂肪变性模型。用油红O染色检测L02细胞内脂质含量;用荧光定量PCR技术检测L02细胞脂肪变性过程中CDK2、CDK4、CyclinD1、Bcl-2、c-Jun mRNA表达。结果随造模时间延长,L02细胞内橘红色脂滴聚集越来越多,至造模20 h,肝细胞染成橘红色。L02细胞内CDK2 mRNA相对表达量逐渐升高,造模5 h达最高(P均<0.05),随后逐渐下降;CDK4 mRNA相对表达量逐渐升高,造模10 h达最高(P均>0.05),随后逐渐下降,造模20 h最低(P均>0.05);不同时间点Cyclin D1 mRNA相对表达量比较差异无统计学意义(P均>0.05);Bcl-2 mRNA相对表达量随造模时间延长而升高,造模10 h达最高(P<0.05),随后降低;造模5、10、20 h的c-Jun mRNA相对表达量均较造模0 h高(P均<0.05),但无变化规律。结论人肝细胞L02脂肪变性过程中癌症相关基因CDK2、CDK4、Bcl-2、c-Jun表达先升高后降低,Cyclin D1表达变化不明显。
肝细胞脂肪变性;细胞周期;细胞周期蛋白;细胞周期蛋白依赖性激酶;细胞周期蛋白依赖性激酶抑制因子;B细胞白血病-淋巴瘤基因2;c-Jun基因
脂肪肝是最常见的与代谢紊乱相关的慢性肝病,在全世界发病率高,约为11%~46%,并有潜在的严重后遗症[1]。脂肪肝疾病谱包括单纯性脂肪肝、脂肪性肝炎、肝纤维化、肝硬化和肝细胞癌。细胞周期分为G1、S、G2、M期。细胞周期转换主要受细胞周期蛋白(Cyclin)、细胞周期蛋白依赖性激酶(CDK)和CDK抑制因子(CKI)调控。细胞周期调控异常与癌症发生发展有关。细胞周期紊乱可导致癌症的发生。B细胞白血病-淋巴瘤基因2(Bcl-2)是抗凋亡基因,可通过抑制细胞凋亡从而介导肿瘤的产生[2]。c-Jun家族癌基因在多种恶性肿瘤发展过程中起重要作用[3]。脂肪肝可以逐步发展为肝癌。研究在肝细胞脂肪变性过程中癌症相关调控基因的表达变化,对探讨脂肪肝发展为肝癌的过程具有重要意义。2016年8月~2017年1月,本研究旨在探究癌症相关基因(CDK2、CDK4、CyclinD1、Bcl-2、c-Jun基因)在人肝细胞脂肪变性的体外模型中不同造模时相的表达变化。
1 材料与方法
1.1 细胞、试剂及仪器来源 人肝细胞株L02由北京军事医学科学院赠送;DMEM培养液购自Neuronbc公司,胰蛋白酶购自GE Healthcare Life Sciences公司,软脂酸、油酸、油红O试剂、苏木精试剂购自Sigma公司;倒置显微镜购自Zeiss公司,荧光定量PCR仪器购自Roche公司,SYBR premix ExTaq购自Takara公司。
1.2 细胞培养及模型建立 将L02细胞接种于培养瓶,用含10%胎牛血清的DMEM培养液于37 ℃、5% CO2细胞培养箱内培养,2 d换液1次。待细胞生长至80%~90%时用胰蛋白酶消化,按1∶5比例传代。取对数生长期细胞接种于六孔培养板进行实验。加入0.5 mmol/L油酸和软脂酸(2∶1)混合液处理人L02肝细胞株,建立肝细胞脂肪变性模型。
1.3 L02细胞内脂质含量检测 采用油红染色法。分别于油酸和软脂酸混合液处理(造模)0、5、10、20 h收集相应的脂肪变性L02细胞,加4%多聚甲醛孵育1 h,弃甲醛再加60%异丙醇并孵育5 min,弃60%异丙醇,均匀加油红O工作液,摇匀并室温避光孵育20 min,弃油红O工作液,水洗2~5次,加苏木精孵育1 min。弃苏木精,水洗2~5次。用蒸馏水覆盖细胞,在显微镜下观察并对细胞进行拍照。脂质形成的标准为经油红染色后L02细胞胞质内形成橘红色脂滴。
1.4 L02细胞内CDK2、CDK4、CyclinD1、Bcl-2、c-Jun mRNA表达检测 采用荧光定量PCR技术。分别于造模0、5、10、20 h收集L02细胞提取RNA。配消化DNA体系50 μL(10×DNase Ⅰ buffer 5 μL,rDNase Ⅰ 2 μL,RNA 4~7 μg,剩余以水填充)。于PCR仪中消化,37 ℃、30 min;加入DNA酶失活剂10 μL混匀灭活DNase,离心后取上清液用于逆转录。变性:配体系(N6随机引物1 μL,消化离心后的RNA 23 μL),于PCR仪中进行变性,70 ℃ 10 min,变性后立即放置于-20 ℃冰箱8 min防止复性。逆转录:配体系(5×First-Strand buffer 8 μL,0.1 mol/L DTT 4 μL,10 mmol/L dNTP 2 μL,RNase抑制剂1 μL),每管加入15 μL,再加入SuperscriptⅢ逆转录酶1 μL。逆转录程序:25 ℃、10 min,50 ℃、60 min,70 ℃、15 min,4 ℃恒温。配体系:SYBR premix 10 μL,上下引物各0.6 μL,H2O 6.8 μL,模板2 μL。引物序列:CDK2正向引物:5′-CATGAGGTGGTGACCCTGTGG-3′,反向引物:5′-GTCGTAGTGCAGCATTTGCG-3′;CDK4正向引物:5′- CATTCTGGTGACAAGTGGTGG-3′,反向引物:5′-CGGCTTCAGAGTTTCCACAGA-3′;Cyclin D1正向引物:5′-TTGTTGAAGTTGCAAAGTCCTGG-3′,反向引物:5′- CGGATGGTTTCCACTTCGC-3′;Bcl-2正向引物:5′- CATGTGTGTGGAGAGCGTCAA-3′,反向引物:5′-GCCGGTTCAGGTACTCAGTCA-3′;c-Jun正向引物:5′- GCCAGGTCGGCAGTATAGTC-3′, 反向引物:5′- GGACTCTGCCACTTGTCTCC-3′。采用荧光定量PCR技术进行检测。用LCS480 1.50.SP4软件(Roche)计算CDK2、CDK4、CyclinD1、Bcl-2、c-Jun mRNA相对表达量。

2 结果
油红O染色结果:随造模时间延长,L02细胞里的橘红色脂滴越来越多;造模20 h,L02细胞被染成橘红色,说明L02细胞发生脂肪变性。随造模时间延长,CDK2 mRNA相对表达量逐渐升高,造模5 h达最高(P均<0.05),随后逐渐下降;CDK4 mRNA相对表达量逐渐升高,造模10 h达最高(P均>0.05),随后逐渐下降,造模20 h最低(P均>0.05);不同时间点Cyclin D1 mRNA相对表达量比较差异无统计学意义(P均>0.05);Bcl-2 mRNA相对表达量随造模时间的延长而升高,造模10 h达最高(P<0.05),随后降低;造模5、10、20 h的c-Jun mRNA相对表达量均较造模0 h高(P均<0.05)。见表1。
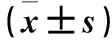
表1 L02细胞不同时间点癌变相关基因表达比较
3 讨论
细胞周期转换主要受Cyclin、CDK和CKI的调控。Cyclins与CDK结合可促进细胞周期的转换[4]。CDK2的活性对细胞周期的运行至关重要[5]。本研究发现,CDK2、CDK4 mRNA在肝细胞脂肪变性过程中呈一过性表达升高,提示肝脂肪变可能会激活肝细胞CDK2和CDK4的活性,潜在影响细胞周期调控;而CyclinD1 mRNA在肝脂肪变过程中其表达并未出现明显变化。Rb蛋白磷酸化不足时会出现CyclinD1过表达[6],推测油酸和软脂酸混合液可能会使Rb蛋白磷酸化。
细胞周期通过正负调节因子作用来维持正常运行,当调节因子失衡时,异常细胞逃离正常细胞周期的监测,从而为细胞癌变的发生提供基础[7]。癌症中细胞周期调控基因会发生异常,如CDK2在癌症组织中可长期呈高表达[8]。因此CDK调节功能和细胞周期检查位点功能的缺失可与癌症的分子病理机制有关。研究发现,高脂饮食可促进注射了CT26结肠癌细胞的BALB/c小鼠主动脉微血管生成、实体瘤生长以及肿瘤肺转移,免疫组化法检测显示,小鼠肿瘤组织中cyclin A、Cyclin D1和CDK2的表达明显增加[9],表明高脂饮食可以破坏正常细胞的周期调控机制,导致细胞进行无限增殖分化。细胞周期调控无论是在肝细胞脂肪变性还是肝细胞癌变的过程中都起到重要作用。本研究表明细胞周期调控对脂肪肝以后发展为肝细胞癌具有重要意义。
Bcl-2是一种抗凋亡基因,在生长因子受体介导的信号传导途径中发挥作用,它通过抑制细胞凋亡从而介导肿瘤的发生发展[2]。Bcl-2家族蛋白调节线粒体膜的通透性,使细胞色素C从线粒体泄漏,从而调控细胞凋亡。本研究结果显示,肝细胞脂肪变性模型可以诱导活化Bcl-2,表明Bcl-2对脂肪肝将来发展为肝细胞癌具有一定的影响。
c-Jun家族癌基因在恶性肿瘤的进展中也起到重要作用。在癌旁异型增生肝组织以及肝癌细胞内出现c-Jun异常表达[3]。JNK信号转导通路是胰岛素抵抗和脂肪酸诱导的肝毒性的关键介质。肝细胞在脂毒性的状态通过上调JNK和Bcl-2相互作用介质而最终发生凋亡。有关肠癌动物模型的研究表明,c-Jun的致瘤功能依赖于JNK对其的磷酸化作用,因此JNK/c-Jun通路有致瘤作用[10,11]。本研究结果显示,肝细胞脂肪变性可使c-Jun mRNA的表达升高,表明癌症相关基因c-Jun在脂肪肝时期就有了转录水平的升高。
综上所述,肝细胞脂肪变性模型实验显示,细胞周期调控基因、Bcl-2、c-Jun等癌症相关基因的转录水平随着肝细胞脂肪变性过程的推进,出现了不同程度的改变,而以上调控基因表达异常与癌症的发生发展密切相关。提示本研究中癌症相关基因可能参与了脂肪肝发展为肝癌的过程。这为研究脂肪肝的病理生理机制及治疗方法提供了新思路。
[1] Berlanga A, Guiu-Jurado E, Porras JA, et al. Molecular pathways in non-alcoholic fatty liver disease[J]. Clin Exp Gastroenterol, 2014,7:221-239.
[2] 苑建磊,兰涛,周国庆,等.VEGF、Bag-1及Bcl-2在肝癌中的表达及意义[J].临床和实验医学杂志,2014,13(4):268-271.
[3] 张颖超,韩喜春,贾明库,等.癌基因c-fOS和c-jun在肝细胞型肝癌中的表达及临床意义[J].吉林大学学报,2002,28(1):46-48.
[4] Gopinathan L, Tan SL, Padmakumar VC, et al. Loss of Cdk2 and cyclin A2 impairs cell proliferation and tumorigenesis[J]. Cancer Res, 2014,74(14):3870-3879.
[5] Mueller S, Huard J, Waldow K, et al. T160-phosphorylated CDK2 defines threshold for HGF-dependent proliferation in primary hepatocytes[J]. Mol Syst Biol, 2015,11(3):795.
[6] Rao SS, Chu C, Khotz DS. Ectopic expression of cyclin D1 prevents activation of gene transcription by myogenic basic-helix-loop-helix regulators[J]. Mol Cell Biol, 1994,14(8):5259-5267.
[7] 卢斌,戴益民.肝癌发生中细胞周期调控的异常[J].世界华人消化杂志,2001,9(2):205-208.
[8] Kawana H, Tamaru J, Tanaka T, et al. Role of p27Kip1 and cyclin-dependent kinase 2 in the proliferation of non-small cell lung cancer[J]. Am J Pathol, 1998,153(2):505-513.
[9] Park H, Kim M, Kwon G T, et al. A high-fat diet increases angiogenesis, solid tumor growth, and lung metastasis of CT26 colon cancer cells in obesity-resistant BALB/c mice[J]. Mol Carcinog, 2012,51(11):869-880.
[10] 包翠芳,魏嘉,梁佳,等.前列地尔对局灶性脑缺血大鼠p-JNK及p-c-Jun表达的影响[J].山东医药,2011,51(25):15-16.
[11] 倪桂莲,崔融,陈干明,等.加巴喷丁对糖尿病神经痛大鼠痛敏和脊髓Glu及下丘脑JNK的影响[J].中华全科医学,2015,13(11):1757-1759,1907.
Expressionchangesofcellcycleregulatorygenes,Bcl-2,andc-Junintheprocessofhumanhepaticsteatosis
BAOCheng1,BIYujing,YANGRuifu,ZHIFachao
(1NanfangHospital,SouthernMedicalUniversity,Guangzhou510515,China)
ObjectiveTo investigate the expression changes of cell cycle regulatory genes [Cyclin-dependent kinase2 (CDK2), Cyclin-dependent kinase4 (CDK4), and CyclinD1], B-cell lymphoma/leukemia-2 (Bcl-2), and c-Jun in the process of human hepatic steatosis.MethodsL02 liver cell line was incubated with mixture of oleic acid and palmitic acid by the ratio of 2:1 (OP21) for 0, 5, 10, and 20 h to build the models of human hepatocyte steatosis. Oil Red O staining was performed to evaluate the fat content of the L02 liver cells. The mRNA expression levels of CDK2, CDK4, CyclinD1, Bcl-2, and c-Jun in the L02 cells at different time points were detected by real-time PCR.ResultsMore and more orange droplets were accumulated in the L02 cells with the time goes on, and the liver cells were dyed orange at 20 h. The mRNA expression level of CDK2 increased gradually, reached the peak at 5 h (P<0.05), and then decreased gradually; the mRNA expression level of CDK4 increased gradually, reached the peak at 10 h (P>0.05), then decreased gradually, and reached the lowest point at 20 h (P>0.05); no statistically significant difference was found in the expression levels of Cyclin D1 at different time points during the process (allP>0.05); the mRNA expression level of Bcl-2 increased over time, reached the peak at 10 h (P<0.05), and then decreased; the mRNA expression level of c-Jun was higher at 5, 10, and 20 h than that at 0 h (allP<0.05), but there were no regular changes.ConclusionDuring the process of hepatic steatosis, the relative mRNA levels of the cancer-related genes (CDK2, CDK4, Bcl-2, and c-Jun) first increase and then decrease, while the expression of Cyclin D1 does not change significantly.
hepatic steatosis; cell cycle; Cyclin; Cyclin-dependent kinase; Cyclin-dependent kinase inhibitor; B-cell lymphoma/leukemia-2; c-Jun gene
10.3969/j.issn.1002-266X.2017.37.004
R575
A
1002-266X(2017)37-0012-03
国家高技术研究发展计划(863计划)(2015AA020702)。
包成(1990-),男,在读硕士,主要研究方向为脂肪肝。E-mail:908729477@qq.com
智发朝(1962-),男,博士,主任医师,主要研究方向为胆胰疾病和小肠疾病的微创治疗。E-mail:zhifc41532@163.com
2017-06-13)

