腹膜透析导致的蛋白质丢失及其影响因素分析
唐杏明 胡洁萍 邓惠钊 林健 郑伟平 邹朝晖
·论著·
腹膜透析导致的蛋白质丢失及其影响因素分析
唐杏明 胡洁萍 邓惠钊 林健 郑伟平 邹朝晖
目的分析中山大学附属东华医院腹膜透析患者经腹透液丢失的蛋白质的总量及各种主要蛋白的浓度、成分,并进一步分析造成蛋白质丢失过多的危险因素。方法选择2015年3月至2016年2月于中山大学附属东华医院行腹膜透析的尿毒症患者122例(男79例,女43例),用免疫比浊法测定腹透液蛋白质总量,用电泳法分析各种蛋白的成分;根据24 h腹透液蛋白的中位数将患者分为高蛋白丢失组及低蛋白丢失组,比较2组患者一般资料、腹膜转运类型、营养指标及其他临床特征的差别,使用多因素Logistic回归分析造成腹透液蛋白丢失过多的因素。结果24 h腹透液蛋白中位数为4.18 g,以白蛋白为主(透出液浓度均数:0.36 g/L),其他主要包括转铁蛋白、IgG及IgA;高蛋白丢失组腹透液各种蛋白成分均较低蛋白丢失组高,高蛋白丢失组血清白蛋白水平更低[(37.33±3.85) g/Lvs(39.05±3.88) g/L,P<0.001];且高蛋白丢失组患者高平均转运及高转运患者比例更高(59.0%vs34.4%,P<0.05),多因素Logistic回归分析发现腹膜高转运状态(包括高转运及高平均转运)是腹透患者腹透液过多丢失蛋白独立危险因素(OR 3.08,95% CI 1.41~6.75)。结论经腹膜透析丢失的蛋白质以白蛋白为主,腹膜高转运状态是腹透患者经腹透液丢失过多蛋白的独立危险因素。对于腹膜高转运的腹膜透析患者,应加强营养支持。
尿毒症;腹膜透析;蛋白质丢失
腹膜透析(peritoneal dialysis,PD)是终末期肾病患者主要的肾脏替代治疗手段之一。PD具有简单、安全、有效的特点,且有较高的早期存活率、良好的残存肾功能保护作用、更低的交叉感染危险性等优点,近30年来在全世界广泛应用[1]。研究表明,49.6%的长期PD的尿毒症患者存在营养不良,其中重度营养不良为8%。我们前期的研究也发现,中山大学附属东华医院腹膜透析中心的尿毒症患者营养不良的发生率为77.5%[2]。经研究证实,腹膜透析过程中,患者体内的蛋白质会随肌酐等代谢废物一起向腹透液中转运并排出体外,造成这些营养物质经腹透液丢失,并进一步加重尿毒症患者的营养不良的状况。本研究以PD患者为观察对象,通过检测排出的腹透液,了解经PD丢失的蛋白质成分及总量,分析患者自身腹膜转运特性、自身营养状况等因素对蛋白质丢失的影响,以指导临床治疗,提高PD患者的远期生存质量。
资料与方法
一、研究对象
选取2015年3月至2016年2月维持PD治疗的尿毒症患者122例,其中女性43例,男性79例,年龄19~83岁,平均年龄(44.1±12.1)岁,透析时间3~120个月,平均透析时间(29.0±11.5)个月。24 h腹透液蛋白中位数为4.18 g,据之将大于等于4.18 g患者归为高蛋白丢失组(n=61),将低于4.18 g患者归为低蛋白丢失组(n=61),见表1。纳入标准:①年龄在18岁以上;②PD 3个月以上;③治疗方式为持续性非卧床腹膜透析。排除标准:①入院前4周内有明确部位的感染病史(如腹膜炎);②入院前4周内有输注白蛋白等血制品史或进食蛋白粉等营养品;③入院前4周内有各种原因导致的进食困难史;④既往有恶性肿瘤、终末期肝病、长期慢性腹泻病史。入选患者均签署知情同意书,且研究经医院伦理委员会批准。
二、方法
所有患者在返院复诊当天,留取全天24 h的腹膜透析透出液(每天4袋,每袋约2 000 ml)摇匀,每袋用无菌注射器留取20 ml(离体30 min内),分2管送检,同时登记患者一般情况等资料。对其中1管用免疫比浊法,分析经PD途径丢失的蛋白质总量;对另外1管用电泳法,分析透出液主要的蛋白成分。
所有患者行改良的快速腹膜平衡实验,判断患者自身腹膜转运类型[低转运(D/Pcr,0.34~0.49)、低平均转运(D/Pcr,0.50~0.64)、高平均转运(D/Pcr,0.65~0.80)、高转运(D/Pcr,0.81~1.03)];将“高转运”及“高平均转运”共同归为“高转运状态组”,将“低转运”、“低平均转运”归为“低转运状态组”进行对比分析。
在返院复诊当天,留取空腹时血清标本,测血清白蛋白、前白蛋白、总胆固醇,作为客观营养指标;同时采用问卷调查的方式行主观综合性营养评估(SGA)法,评估主观营养状况。
以24h腹透液蛋白的中位数为界,将患者分为高蛋白丢失组及低蛋白丢失组,比较两组患者一般资料、腹膜转运类型、营养指标及其他临床特征的差别,使用多因素Logistic回归分析造成腹透液蛋白丢失过多的因素。
三、统计学处理
采用SPSS 22.0统计软件包,连续性变量若服从正态分布则用均数±标准差表示,若不服从正态分布则用中位数(上四分位数,下四分位数)表示,分类变量用频数表示,构成比用百分比表示。不同转运类型的组间差异比较采用单因素方差分析,2组连续性变量组间比较使用t检验(符合正态分布)或非参数检验(不符合正态分布),两组间分类变量比较使用卡方检验。危险因素分析使用多因素Logistic回归。P<0.05表示差异有统计学意义。
结 果
一、蛋白质丢失情况
2组患者的腹透液蛋白成分见表2,可见2组患者腹透液蛋白均以白蛋白为主,其他主要包括转铁蛋白、IgG、IgA,上述成分在高蛋白丢失组均较高。高蛋白丢失组患者腹膜高转运状态比例较高,且腹膜转运功能越高,丢失各蛋白成分越多。(表3)
二、2组患者SGA评分与血清白蛋白、前白蛋白、总胆固醇差别
高蛋白丢失组患者血清白蛋白为(37.33±3.85) g/L,较低蛋白丢失组(39.05±3.88) 低(P<0.001),其余指标无明显差别。(表4)
三、腹透液丢失蛋白危险因素分析
校正性别、年龄、透析龄、糖尿病、SGA评分后发现,腹膜高转运状态是腹透液丢失蛋白的独立危险因素(OR=3.08,95%CI 1.41~6.75,P=0.005)。(表5)

表1 2组患者临床资料及腹膜转运类型特点

表2 2组患者24 h腹透液蛋白类型及蛋白量差别
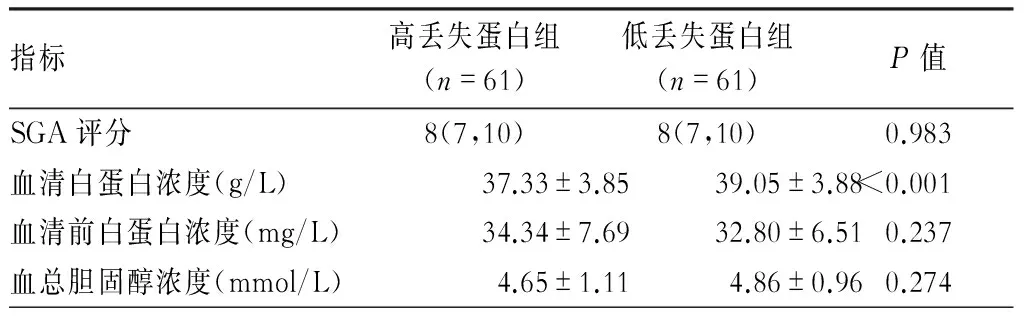
表4 2组患者SGA及血清营养学指标比较

表3 不同腹膜转运类型丢失蛋白比较
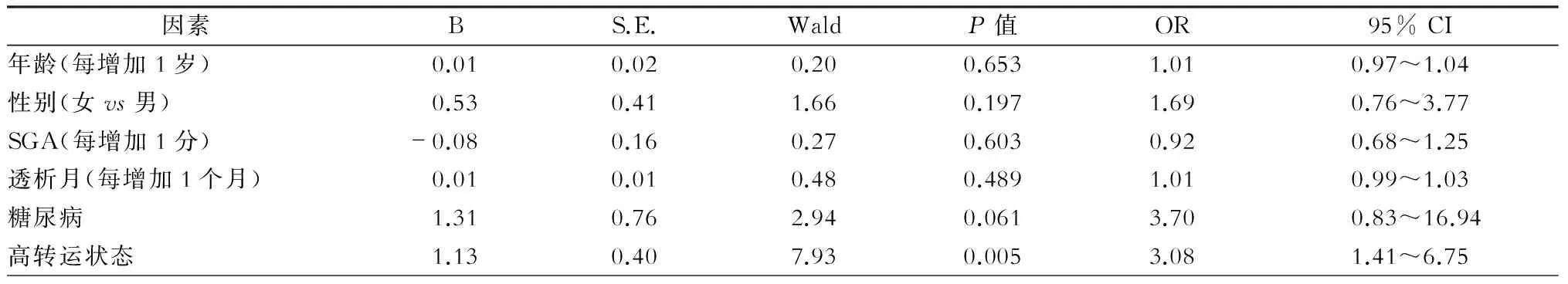
表5 多因素Logistic回归分析腹透液高丢失蛋白危险因素
讨 论
大量的蛋白经腹膜丢失,会导致营养不良的进一步加重以及免疫功能下降、内分泌系统紊乱、凝血功能异常,是PD患者预后不良的主要因素。而蛋白质的丢失,主要取决于腹膜自身的转运特性。本研究发现,每日腹透液蛋白丢失中位数为4.18 g,这与孙方云[3]的研究相符,其对国内72例腹透患者研究发现,每日腹透液蛋白丢失中位数为5 g/L。本研究发现腹透液丢失蛋白成分以白蛋白为主,包括转铁蛋白、IgG及IgA,且腹膜高转运状态是腹透液过多丢失蛋白的独立危险因素,该研究结论与Cueto-Manzano等[4]的研究相符。传统的观点认为,PET主要判断腹膜对小分子物质(如肌酐、尿素)的清除能力。本研究发现,对于白蛋白、转铁蛋白、IgG、IgA等中大分子,PET值与其透出的浓度也呈正相关;换言之,PET也能判断腹膜对中大分子物质的清除能力。
PD患者营养不良更容易发生心血管疾病、感染、心衰等严重合并症[5],本研究发现经腹膜途径丢失蛋白过多组,其血白蛋白水平也较低,且高转运状态是腹水过多丢失蛋白的独立危险因素,这与Cueto-Manzano等[6]的研究结论相符,而Margetts[7]的研究也发现,对无蛋白尿患者,营养状况对等的情况下,PET越高,则白蛋白越低,这也证实了本研究结果。而Heaf等[8]直接观察到腹膜上大孔流量高可增加经腹膜的蛋白质丢失,继而出现的血白蛋白水平下降,这可以解释高转运状态腹透患者更高的蛋白丢失水平及更低的血清白蛋白水平。虽然腹膜高转运状态患者对肌酐及尿素氮等小分子毒素的清除效果更佳,但其技术失败发生率和死亡相关风险明显增加[9],以白蛋白为代表的中大分子的过度清除可能是主要的原因。大多数研究发现,腹膜高转运患者远期预后更差[10-11],但也有研究观察到不同结果[12-14],从本研究结论来看,高转运患者血清白蛋白水平更低,提示可能远期预后更差。
有研究发现,随着透析时间增加,腹透患者经腹透液丢失蛋白越多[3],推测可能与长期腹透导致腹膜增厚、同时出现高转运及超滤衰竭有关[15]。当然,随着透析龄的增长,可能出现反复的感染、腹膜上皮细胞和毛细血管网的结构、功能改变也是可能原因之一。该研究在低蛋白丢失组的中位透析时间为12个月,高蛋白丢失组中位透析时间为20个月,本研究在低蛋白丢失组为18个月,而高蛋白丢失组为19个月,无明显差别。因而,未发现透析龄增加是患者腹透液丢失蛋白增加的危险因素,推测与两个研究入选患者临床特点差异相关。
有意思的是,尽管本研究证实腹透液高蛋白丢失组血清白蛋白水平更低,但在患者主观综合性营养评估上,高蛋白丢失组与低蛋白丢失组并无明显差别,而在其他客观的营养指标如血清前白蛋白、血清总胆固醇方面,2组间也无明显差别。这可能与腹透患者的营养状态除了与腹透液丢失蛋白有关外,与每日蛋白摄入水平、残肾水平、透析充分性等因素也密切相关,而本研究的局限也在于未考虑上述因素对患者整体营养水平的影响,因而研究结论尚需进一步设定研究条件、收集相关数据进一步证实[16]。
高转运状态是腹透患者经腹透液丢失蛋白过多的独立危险因素,这提示对高转运腹透患者增加蛋白摄入可能有助于改善其营养状态,进而改善其远期预后。
[1] 余学清.中国腹膜透析的现状及我们的应对之策[J]. 中华肾脏病杂志, 2004, 20(6): 389-390.
[2] 方慧苹, 刘琼玲, 邹朝晖. 腹膜透析患者血清白蛋白与每日蛋白质摄入量的相关性[J]. 中华肾脏病杂志, 2012, 28(7): 543.
[3] 孙方云. 腹膜透析患者腹透液蛋白质丢失及其影响因素分析[J]. 温州医科大学学报, 2015, 1: 18-21.
[4] Cueto-Manzano AM, Gamba G , Correa-Rotter R. Quantification and characterization of protein loss in continuous ambulatory peritoneal dialysis[J]. Rev Invest Clin, 2000, 52(6): 611-617.
[5] Dong J, Wang T ,Wang HY, et al. The impact of new comorbidities on nutritional status in continuous ambulatory peritoneal dialysis patients[J]. Blood Purif, 2006, 24(5-6): 517-523.
[6] Cueto-Manzano AM, Gamba G, Correa-Rotter R. Peritoneal protein loss in patients with high peritoneal permeability: comparison between continuous ambulatory peritoneal dialysis and daytime intermittent peritoneal dialysis[J]. Arch Med Res, 2001, 32(3): 197-201.
[7] Margetts PJ. Peritoneal membrane transport and hypoalbuminemia: cause or effect?[J]. Perit Dial Int, 2000, 20(1): 14-18.
[8] Heaf JG, Sarac S, Afzal S. A high peritoneal large pore fluid flux causes hypoalbuminaemia and is a risk factor for death in peritoneal dialysis patients[J]. Nephrol Dial Transplant, 2005, 20(10): 2194-2201.
[9] Bakkaloglu SA, Saygili A, Sever L, et al. Impact of peritoneal transport characteristics on cardiac function in paediatric peritoneal dialysis patients: a Turkish Pediatric Peritoneal Dialysis Study Group (TUPEPD) report[J]. Nephrol Dial Transplant, 2010, 25(7): 2296-2303.
[10] Chang TI, Kang EW, Lee YK, et al. Higher peritoneal protein clearance as a risk factor for cardiovascular disease in peritoneal dialysis patient[J]. PLoS One, 2013, 8(2): e562232.
[11] Hamasaki Y, Doi K, Tanaka M, et al. Increased peritoneal permeability at peritoneal dialysis initiation is a potential cardiovascular risk in patients using biocompatible peritoneal dialysis solution[J]. BMC Nephrol, 2014, 15: 173.
[12] Chang TI, Park JT, Lee DH, et al. High peritoneal transport status is not an independent risk factor for high mortality in patients treated with automated peritoneal dialysis[J]. J Korean Med Sci, 2010, 25(9): 1313-1317.
[13] Huang N, Chen J, Fan L, et al. High peritoneal transport status was not associated with mortality in peritoneal dialysis patients with diabetes[J]. PLoS One, 2014, 9(10): e11044510.
[14] Balafa O, Halbesma N, Struijk DG,et al. Peritoneal albumin and protein losses do not predict outcome in peritoneal dialysis patients[J]. Clin J Am Soc Nephrol, 2011, 6(3): 561-566.
[15] Bargman JM. Advances in peritoneal dialysis: a review[J]. Semin Dial, 2012, 25(5): 545-549.
[16] Cheung AK, Yan G, Greene T, et al. Seasonal variations in clinical and laboratory variables among chronic hemodialysis patients[J]. J Am Soc Nephrol, 2002, 13(9): 2345-2352.
Proteinlossescausedbyperitonealdialysisandinfluencingfactors
TANGXing-ming,HUJie-ping,DENGHui-zhao,LINJian,ZHENGWei-ping,ZOUZhao-hui.
DepartmentofDialysis,theAffiliatedDonghuaHospitalofSunYat-SenUniversity,Dongguan523110,China
TANGXing-ming,Email:txingm@mail3.sysu.edu.cn
ObjectiveTo investigate the components of protein in peritoneal dialysate and explore the risk factors causing the protein losses in the peritoneal dialysis patients in Donghua hospital.Methods122 uremic patients (79 males and 43 females) undergoing continuous ambulatory peritoneal dialysis (CAPD) were enrolled and assigned into high protein losses group (HP) and low protein losses group (LP) according the median losses of protein in dialysate from March 1, 2015 to Feb. 28, 2016. The amount and component of the protein in dialysate were accessed by the immunoturbidimetry and electrophoresis, and the demographic data and clinical data were collected to analyze the difference between the two groups. The logistic regression was applied to disclose the risk factors of the protein losses via dialysate.ResultsThe median of protein losses in CAPD dialysis patients was 4.18 g/24 h, the major component was albumin (0.36 g/L), the other components were transferrin, IgG and IgA, and all of them were more eliminated in the dialysate of patients in HP group (P<0.001). Furthermore, the patients in HP group showed lower serum albumin (37.33±3.85vs. 39.05±3.88 g/L,P<0.001) and higher rate with high transport status (59.0%vs. 34.4%,P=0.006), and high peritoneal transport was risk factors of high protein losses by dialysate (OR 3.08, 95% CI 1.41-6.75).ConclusionsCAPD patients may lose substantial amount of protein by dialysis solution, the major components was albumin, and high peritoneal transport was risk factors of high protein losses by dialysate.
Uremia; Peritoneal dialysis; Protein losses by dialysate
10.3969/j.issn.1671-2390.2017.10.004
东莞市科技局立项项目(No.201410515000269)
523110 东莞,中山大学附属东华医院透析科
2017-07-25
2017-09-22)

