小凹蛋白-1介导阿托伐他汀对自发性高血压大鼠肾叶间动脉收缩反应的抑制作用
谢小萍 张海军 郭艺彬 张茜 常耀明 暴军香
·实验研究·
小凹蛋白-1介导阿托伐他汀对自发性高血压大鼠肾叶间动脉收缩反应的抑制作用
谢小萍 张海军 郭艺彬 张茜 常耀明 暴军香
目的肾叶间动脉收缩反应增强是高血压肾脏损伤的早期表现,是重要的预防和治疗靶点。平滑肌细胞小凹蛋白-1(caveolin-1)上调是其发生机制之一,阿托伐他汀(atorvastatin,ATVS)可通过降低胆固醇(cholesterol,CHO)调控caveolin-1表达,本研究探讨ATVS是否通过caveolin-1抑制自发性高血压大鼠(spontaneously hypertensive rat,SHR)肾叶间动脉对血管紧张素II(angiotensin,Ang II)的收缩反应。方法12只SHR大鼠随机分为2组:SHR对照组及ATVS(50 mg·kg-1·d-1)处理组,每组6只,6只Wistar Kyoto (WKY)大鼠作为正常对照组。采用尾套法测量大鼠尾动脉收缩压(systolic blood pressure,SBP),血管环张力描记技术检测肾叶间动脉收缩反应,蛋白免疫印迹(Western blot)法检测caveolin-1和血管紧张素Ⅱ 1型受体(angiotensin II type 1 receptor,AT1)蛋白表达,免疫沉淀和Western blot检测caveoin-1与AT1的结合。结果与WKY大鼠相比,SHR组SBP 显著增高(P<0.05),肾叶间动脉对Ang Ⅱ的收缩反应强度及敏感性均显著增强(P<0.05);4周ATVS处理显著降低SHR组SBP(P<0.05)及肾叶间动脉对Ang Ⅱ的收缩反应强度及敏感性(P<0.05)。SHR组动脉AT1及caveolin-1的蛋白表达显著高于WKY大鼠(P<0.05),AngⅡ孵育所致caveolin-1与AT1的结合亦较WKY组显著增多(P<0.05)。ATVS处理可降低SHR组caveolin-1和AT1的蛋白表达(P<0.05),并抑制caveolin-1与AT1的结合(P<0.05),CHO孵育则可增高ATVS组caveolin-1蛋白含量并促进其与AT1的相互作用(P<0.05),同时可显著增加肾叶间动脉对AngⅡ收缩反应的强度及敏感性(P<0.05)。结论ATVS可抑制SHR大鼠肾叶间动脉对Ang Ⅱ的收缩反应,其机制与caveolin-1的蛋白表达降低及caveolin-1与AT1的结合减少有关。
阿托伐他汀;高血压;血管紧张素Ⅱ;小凹蛋白-1
肾脏血管丰富,是高血压的重要损害靶器官之一。大量研究表明,肾动脉的高收缩反应性是高血压肾脏损伤的始动和促进因素之一,亦是重要的预防和治疗靶点[1-2]。高血压时,系统和局部肾素-血管紧张素系统(renin-angiotensin system,RAS)处于过度激活状态[3],Ang Ⅱ所致收缩反应在容量血管和阻力血管均显著上调[4],我们的前期结果提示高血压大鼠(spontaneously hypertensive rat,SHR)肾脏肌性血管,特别是肾叶间动脉对Ang Ⅱ的收缩反应强度和敏感性增高[5],其机制与平滑肌细胞膜穴样凹陷(caveolae)改变有关,表现为数量增多,小凹蛋白-1(caveolin-1)蛋白含量及其与血管紧张素Ⅱ 1型受体(angiotensin Ⅱ type 1 receptor,AT1)的结合增加等[5-6]。胆固醇(cholesterol, CHO)是调控caveolae的重要因素,耗竭CHO可减少caveolae、降低caveolin-1水平,抑制Ang Ⅱ激活AT1后的信号转导过程[7-9]。他汀类药物是羟甲基戊二酰辅酶A(hydroxy methylglutaryl coenzyme A reductase,HMG-CoA)还原酶抑制剂,可通过竞争性抑制内源性胆固醇合成限速酶阻断细胞内羟甲戊酸代谢途径,使CHO合成减少,反馈性刺激细胞膜表面(主要为肝细胞)低密度脂蛋白受体数量,使血清CHO清除增加、水平降低[10]。除此之外,他汀还具有辅助降压和减轻炎性反应的作用[11-12]。在高血压肾病、糖尿病肾病、肾病综合征等多种动物模型中,他汀可通过抗炎、抗氧化、抑制水解酶等作用保护肾功能[13-14]。 鉴于他汀可抑制CHO合成,CHO与caveolae结构、caveolin-1表达及Ang Ⅱ致平滑肌收缩等过程密切相关。我们提出假说:他汀可通过减少caveolin-1表达及caveolin-1与AT1结合而抑制SHR肾叶间动脉对Ang Ⅱ的收缩反应。本研究观察阿托伐他汀(atorvastatin,ATVS)对SHR肾叶间动脉小凹蛋白-1的影响,并探讨其在动脉收缩功能改变中的作用。
材料与方法
一、实验材料与分组
1.实验材料 SHR大鼠和正常血压Wistar Kyoto(WKY)大鼠由第四军医大学实验动物中心提供,约12周龄,雌雄不拘,体质量为200~240 g,实验均遵照第四军医大学实验动物饲养和使用规定进行。主要试剂和仪器(除标注外均为国产分析纯): MgSO4、NaHCO3、KCl、NaCl、无水葡萄糖、 KH2PO4、CaCl2·2H2O、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA,Sigma公司,美国)、血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ,Sigma公司,美国)、CHO(Sigma公司,美国);磷酸缓冲盐溶液(phosphate buffer saline,PBS,Solarbio公司,美国);BCA蛋白定量试剂盒(Thermo公司,美国)、抗caveolin-1一抗(anti-caveolin-1)、抗AT1一抗(anti-AT1,Abcam公司,美国);Pierce Classic IP Kit(Pierce公司,美国);半湿转系统、聚丙酰胺凝胶电泳系统(Invitrogen公司,美国);微血管张力记录仪(DMT公司,丹麦);Tanon紫外线凝胶成像系统(天能科技有限公司,上海)。
2. 分组 12只SHR大鼠随机分为2组:SHR对照组及ATVS(50 mg·kg-1·d-1)处理组,每组6只;6只WKY大鼠作为正常对照组。ATVS组给予阿托伐他汀钙片(立普妥,辉瑞制药有限公司)灌胃,剂量为50 mg·kg-1·d-1,容量为10 ml/kg,SHR对照和WKY 大鼠给予等量生理盐水灌胃,每天一次,持续4周。
二、实验方法
1.尾动脉收缩压(systolic blood pressure,SBP)测定 采用Softron动物无创血压计BP-98A进行测量。选择合适的鼠网和鼠袋,将大鼠置于38 ℃保温桶中预热15 min,然后将加压感应器放置于大鼠尾根部,在清醒和安静状态下测定血压,每只大鼠测定6次,取平均值。分别于给药前和给药后2、4 周测量3组大鼠SBP。
2.血管张力测定 采用CO2将大鼠窒息至麻醉,心脏放血法处死大鼠。迅速将大鼠肾脏取出并置于4 ℃氧合的Krebs 缓冲液中(mmol/L):NaCl 118.3,KCl 4.7, NaHCO325,KH2PO41.2,MgSO41.2,CaCl22.5,葡萄糖11.1,EDTA 0.026,pH 7.40);在解剖显微镜下仔细分离并找到肾叶间动脉,剪成长度约为2 mm的血管环。先用头发丝轻穿过管腔几次以破环肾叶间动脉血管内皮,再将直径为40 μm的两根钢丝穿过血管环,分别固定于血管张力记录仪上下两端。将血管环置于充满Kreb’s缓冲液的恒温(37 ℃)浴槽中,并通入95% O2和5% CO2,待血管张力平衡且达到最适静息张力后,分别加入累积浓度的Ang Ⅱ(10-9~10-6mol/L),同时观察血管收缩反应的变化,并记录所得数据制备浓度-效应曲线,由此计算出血管的最大收缩张力(Emax)和半最大效应浓度(EC50),即反应达50%最大效应时血管激动剂的浓度。
3.免疫共沉淀 将血管组织在裂解液中匀浆,4 ℃、13 000 r/min离心10 min后取上清,用BCA法进行蛋白定量。取至少300 μg蛋白与10 μg 抗-caveolin-1混匀,4 ℃旋转孵育过夜。将Protein A/G Agarose震荡混匀后吸取20 μl至离心柱,离心并洗涤后,弃去洗脱液,加入蛋白与抗体混合物,4 ℃旋转孵育1 h,离心并洗涤后收集洗脱液,进行免疫印记分析。
4.蛋白免疫印迹 取血管组织匀浆或免疫共沉淀洗脱液,按照每泳道30 μg蛋白上样,用Invitrogen 40%~120% SDS-PAGE预制胶进行电泳。之后采用半湿转法进行转膜,50 g/L脱脂奶粉室温条件封闭1 h,一抗anti-caveolin(1∶500)或anti-AT1(1∶1 000)4 ℃孵育过夜,洗膜后加入HRP goat anti-rabbit(1∶10 000)室温孵育1 h,使用增强化学发光(enhanced chemiluminescence,ECL)发光液进行发光显影,凝胶成像系统扫描并分析。
三、统计学方法
对所得数据用SPSS16.0软件分析,并以均数±标准差形式表示,浓度效应曲线用重复测量方差分析进行统计处理,其余数据用组间t检验或单因素方差分析(One-way ANOVA)检验,P<0.05表示差异具有统计学意义。
结 果
一、WKY大鼠和SHR血压变化及ATVS的作用
本研究首先检测了4周ATVS处理对SHR大鼠血压的影响。给药前SHR组SBP(187.4±9.5) mmHg显著高于WKY大鼠(133.3±9.2)(P<0.05);两周后,WKY大鼠血压保持稳定,而SHR对照组血压升至(190.4±11.1) mmHg, ATVS处理组血压则降低至(183.5±10.2) mmHg;4周后,WKY大鼠血压无明显改变,SHR组大鼠血压升至(199.5±9.3) mmHg,而ATVS处理组血压则保持在(183.2±8.2) mmHg,显著低于SHR组(P<0.05)。(图1)
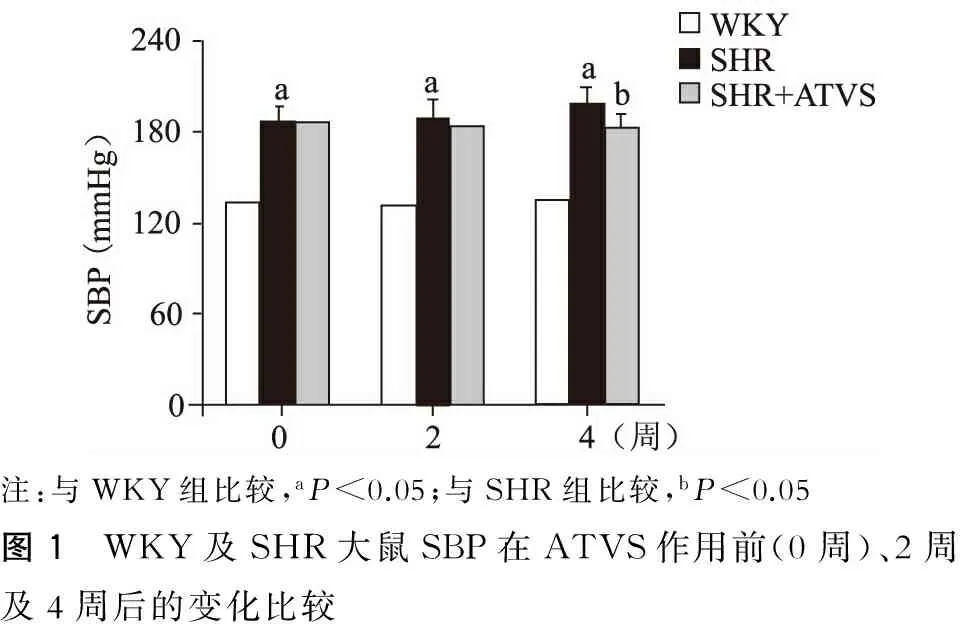
注:与WKY组比较,aP<0.05;与SHR组比较,bP<0.05图1 WKY及SHR大鼠SBP在ATVS作用前(0周)、2周及4周后的变化比较
二、ATVS抑制SHR肾叶间动脉对Ang Ⅱ的收缩反应
本研究接着观察ATVS对SHR肾叶间动脉对Ang Ⅱ收缩反应的影响。如图2A所示,在3组大鼠肾叶间动脉,随着剂量增加,Ang Ⅱ所致收缩反应先升高后降低,呈抛物线样改变。对其上升阶段进行分析可见,与WKY组相比,SHR肾叶间动脉对Ang Ⅱ收缩反应的Emax显著增加56.1%(图2B,P<0.05),EC50显著降低,提示收缩敏感性显著增高(图2B,P<0.05);ATVS作用4 周后,SHR肾叶间动脉对Ang Ⅱ的收缩反应强度仍强于WKY组,但增加程度为20.4%,较SHR组显著减小(图2B,P<0.05);ATVS处理组动脉对Ang Ⅱ收缩敏感性显著低于SHR组(图2C,P<0.05),与WKY组无明显差别。
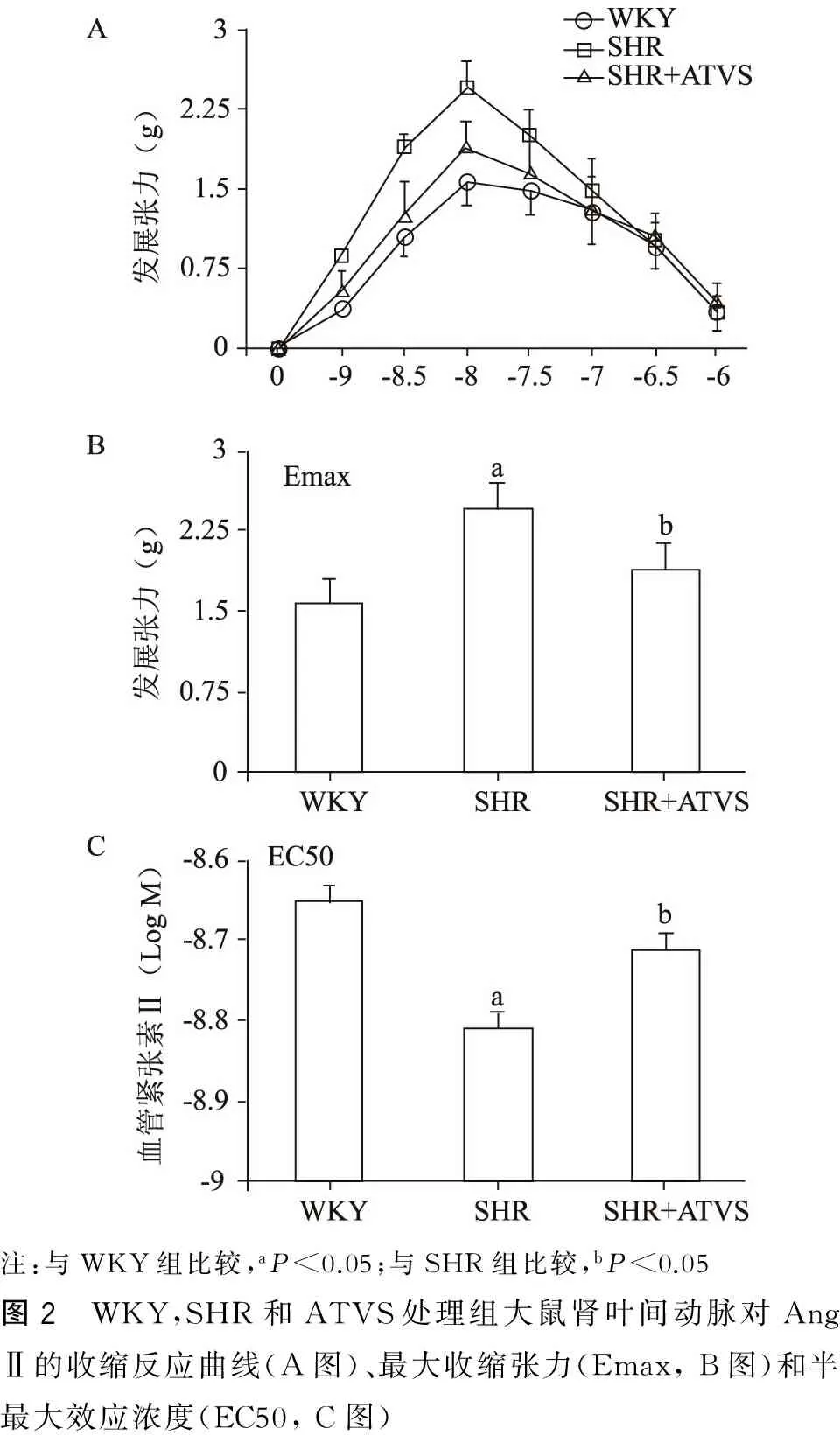
注:与WKY组比较,aP<0.05;与SHR组比较,bP<0.05图2 WKY,SHR和ATVS处理组大鼠肾叶间动脉对AngⅡ的收缩反应曲线(A图)、最大收缩张力(Emax,B图)和半最大效应浓度(EC50,C图)
三、ATVS降低SHR肾叶间动脉caveolin-1蛋白表达并抑制caveolin-1 与AT1结合
如图3A和3B所示,western blot可检测出45 000和23 000条带,与AT1和caveolin-1相对分子质量一致。与WKY大鼠相比,SHR肾叶间动脉caveolin-1和AT1蛋白表达均显著增加(P<0.05),而4 周 ATVS处理可使caveolin-1和AT1蛋白表达显著降低(P<0.05),其中caveolin-1与WKY组无显著差别,但AT1仍高于WKY组(P<0.05)。图3C和3D表示两种蛋白的相互结合,通过计算AT1与caveolin-1条带灰度的比值(AT1/caveolin-1)表示每个caveolin-1分子结合的AT1量。3组动脉中,AngⅡ刺激(10-6mol/L,1 h)均可显著增加AT1/caveolin-1(P<0.05),但与WKY组相比,SHR组大鼠肾叶间动脉Ang Ⅱ所致AT1/caveolin-1增加程度显著增高(P<0.05)。ATVS作用4周后,与SHR对照组相比,肾叶间动脉Ang Ⅱ刺激所致AT1/caveolin-1增高程度显著降低(P<0.05)。
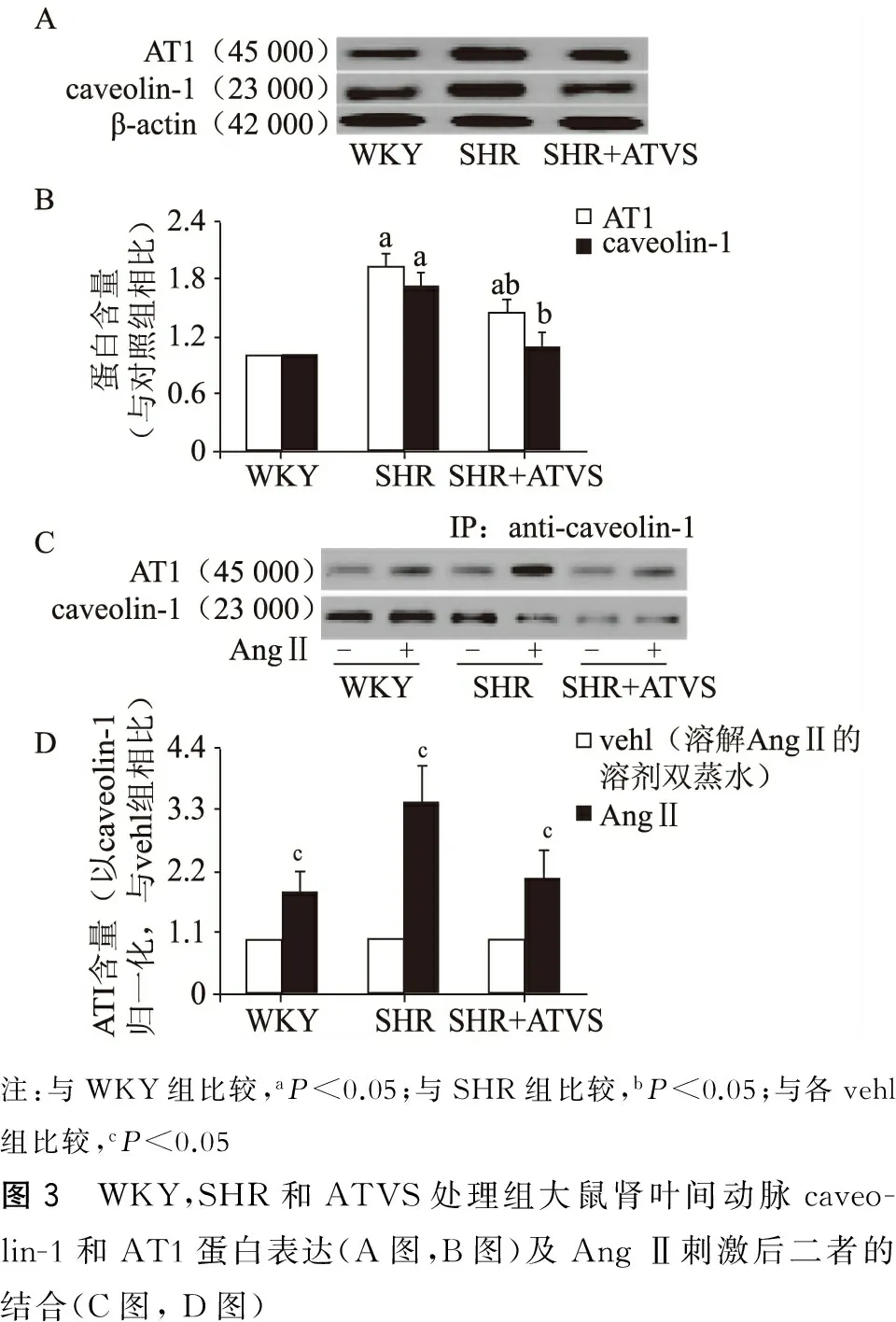
注:与WKY组比较,aP<0.05;与SHR组比较,bP<0.05;与各vehl组比较,cP<0.05图3 WKY,SHR和ATVS处理组大鼠肾叶间动脉caveo-lin-1和AT1蛋白表达(A图,B图)及AngⅡ刺激后二者的结合(C图,D图)
四、caveolin-1及其与AT1的结合在ATVS抑制 SHR肾叶间动脉收缩反应中的作用
为阐明ATVS所致caveolin-1 和AT1蛋白含量及二者的结合的降低是否介导其对SHR肾叶间动脉收缩反应的抑制作用,我们在离体动脉进行了CHO孵育(1 mmol/L,37 ℃,12 h)发现其对SHR对照组肾叶间动脉caveolin-1和AT1蛋白表达无明显影响,但可显著增加ATVS组大鼠肾叶间动脉caveolin-1蛋白表达(P<0.05,图4 A,B),AT1蛋白含量有增加趋势,但未达到显著水平。免疫共沉淀结果表明,CHO孵育对SHR组caveolin-1 和AT1结合无明显影响,但可显著增加ATVS处理大鼠肾叶间动脉二种蛋白之间的结合(P<0.05,图4C,D)。血管收缩功能检测结果显示(图5),在SHR对照组,CHO孵育对Ang Ⅱ所致肾叶间动脉收缩反应的强度(Emax)和敏感性(EC50)无明显影响,但可显著增高ATVS组大鼠动脉Emax(P<0.05),降低其EC50(P<0.05),表明其收缩强度增高,收缩敏感性增加。

注:与SHR组比较,aP<0.05;与ATVS组比较,bP<0.05;与各ve-hl组比较,cP<0.05图4 CHO孵育对SHR及ATVS处理组大鼠肾叶间动脉caveolin-1和AT1蛋白表达(A图,B图)及二者结合(C图,D图)的影响

注:与SHR组比较,aP<0.05;与vehl组比较,bP<0.05图5 CHO孵育对SHR及ATVS处理组大鼠肾叶间动脉对AngⅡ收缩反应曲线(A图)、最大收缩张力(Emax,B图)和半最大效应浓度(EC50,C图)的影响
讨 论
本研究结果表明,SHR的血压和肾叶间动脉收缩反应均显著高于WKY大鼠,ATVS可部分降低SHR血压,抑制肾叶间动脉对AngⅡ的收缩反应,同时降低SHR组 caveolin-1蛋白表达并抑制caveolin-1与AT1的结合;离体孵育CHO可增加ATVS组大鼠肾叶间动脉caveolin-1蛋白含量,促进其与AT1的结合,同时增强动脉对AngⅡ收缩反应的强度和敏感性。
肾脏是原发性高血压损伤最重要的靶器官之一,约18%的原发性高血压患者最终会出现肾功能不全,持续发展可至尿毒症期,甚至危及生命[1,15]。大量证据提示,肾动脉对血管活性物质的收缩反应增强是高血压性肾脏病变的早期促进因素。如超声多普勒肾血流检测显示原发性高血压合并肾脏早期损伤的患者肾叶间动脉阻力指数明显增高[16]。动物实验表明,SHR肾叶间动脉对KCl和PE的收缩反应明显增强,肾小球前小动脉的收缩作用比正常大鼠增加40%[17]。RAS是高血压动脉损伤的重要介导分子,高血压时动脉壁的AT1含量增加,使得动脉对AngⅡ收缩反应增强[18]。本实验室前期工作显示,与WKY大鼠相比,SHR肾叶间动脉AT1表达增加,对AngⅡ的收缩反应强度增加了32.7%,收缩敏感性也显著增强,提示在高血压形成期(SHR12周),肾肌性血管出现过度收缩,可能引发肾缺血改变[5]。鉴于肾动脉的收缩反应亢进在高血压发生、发展中的重要作用,针对其的预防和对抗措施研究一直受到重视[19]。
他汀类药物不仅具有调脂作用,临床观察发现在伴有高血压的高胆固醇血症患者中,他汀可使血压一定程度降低[11],动物实验则表明ATVS可改善血管内皮功能[20]。与其他他汀类药物相比,ATVS的肾脏保护作用最为突出,在高血压早期肾损伤患者中的研究显示,ATVS可显著降低24 h尿微量白蛋白和肾叶间动脉阻力指数,且具有剂量依赖性和时间依赖性[13,21],在晚期肾衰竭患者中,ATVS可降低房颤发生率[22]。本研究中,我们首先采用尾套法测定了WKY和SHR组大鼠的SBP,此为大鼠血压测定的经典方法[23],在检测过程中,大鼠情绪稳定,未出现躁动和激惹表现,SBP结果显示SHR组血压较WKY大鼠高40.6%,而4周ATVS(50 mg·kg-1·d-1)处理可使SHR血压显著降低约8.1%,与文献报道一致[7,21]。同时,SHR肾叶间动脉对AngⅡ的收缩强度和收缩敏感性显著高于WKY大鼠,4周 ATVS处理后,SHR与WKY大鼠肾叶间动脉收缩功能的差异显著缩小,提示ATVS降低血压和对肾脏的保护作用可能与其降低肾动脉收缩反应有关。
ATVS降低血压并改善肾叶间动脉收缩功能的机制并不十分清楚,可能涉及脂质调控、内皮稳定和抗氧化作用。Caveolae是脂膜上富含鞘酯和胆固醇的特殊结构,caveolin-1为其主要结构蛋白[24]。caveolae可以在细胞膜上形成相对分隔的微小区域,调节内皮细胞的一氧化氮合酶磷酸化、平滑肌细胞的增殖、迁移和动脉粥样硬化形成等重要生理和病理过程[9]。Ang Ⅱ作用于AT1后,AT1从caveolae外移动至caveolae内,与caveolin-1结合激活Gq/11蛋白和下游信号通路,从而快速而高效的完成信号传递过程[25]。此外,caveolin-1与AT1结合是受体脱敏和再循环的重要途径[26]。本实验中Ang Ⅱ致动脉收缩的张力曲线呈抛物线型也证实AT1被激活后将迅速脱敏,这一自我保护作用可避免动脉因持续收缩发生损伤,同时可保证每次收缩时有更多的AT1参与,使动脉收缩的效率增加。本实验室以往研究证实cavelae/caveolin-1参与Ang Ⅱ致肾叶间动脉的收缩反应,SHR肾叶间动脉caveolae数量增多,caveolin-1蛋白表达增加,与AT1结合增多,是上调动脉收缩反应强度和敏感性的重要机制[5]。
CHO是caveolae的重要成分,当其含量降低时,细胞膜caveolae数量亦明显减少[27]。由于caveolin-1主要存在于细胞膜caveolae中,caveolae结构减少亦伴随caveolin-1蛋白含量的降低,同时caveolin-1与原本存在于caveolae结构中的受体和信号分子之间的结合也受到影响[27]。我们和其他实验室的结果均表明采用甲基-β-环糊精耗竭CHO的方法抑制caveolae形成后,Ang Ⅱ作用于AT1后则需要更长时间激活下游信号通路,信号转导的强度和效率显著降低,而CHO孵育则可恢复caveolae结构,增加caveolin-1蛋白含量,促进AT1激活后的信号传递过程[8,25]。他汀类药物可抑制体内CHO合成过程中的限速酶HMG-CoA还原酶[10,12,14,28],还可增加胆管CHO的分泌(经胆管排泌途径),同时可刺激经肠道CHO排泄途径,从而增加粪便排出,降低CHO水平[28]。ATVS对CHO的调控、CHO与caveolin-1及肾动脉功能改变的关系提示ATVS可能通过caveolin-1影响SHR肾叶间动脉对Ang Ⅱ的收缩反应。
本研究发现4 周 ATVS处理可显著降低SHR肾叶间动脉caveolin-1的蛋白表达,同时抑制caveolin-1与AT1的结合,离体CHO孵育后,SHR肾叶间动脉caveolin-1和AT1的蛋白表达以及二者之间的结合无明显改变,而ATVS处理组caveolin-1蛋白表达部分恢复,caveolin-1与AT1的结合增加。动脉功能检测结果表明CHO孵育并不影响SHR肾叶间动脉对AngⅡ的收缩反应,而在ATVS处理组则显著增高动脉收缩的强度和敏感性,提示ATVS对肾叶间动脉收缩反应的抑制作用可能通过减少平滑肌细胞膜胆固醇含量,进而降低caveolin-1蛋白表达及减少caveolin-1与AT1二者之间的结合而介导。以往研究中多采用高浓度(10 mM)短时(1 h)CHO孵育恢复cavaolin-1含量,本实验则采用低浓度(1 mmol/L)较长时间(12 h)孵育,即提高了caveolin-1蛋白表达,也可保证动脉功能不受影响。
本实验中SHR组AT1蛋白表达较WKY组显著升高,而ATVS处理可降低SHR组动脉AT1蛋白水平,与文献报道一致[29]。但与caveolin-1不同,CHO孵育后AT1的表达仅呈增高趋势,未达到显著性差异水平,说明与AT1相比,caveolin-1对CHO更为敏感,而AT1的恢复则需要更大剂量或更长时间CHO孵育[30]。此外,即使CHO孵育后ATVS组AT1受体含量仍少于SHR组,但caveolin-1和AT1的结合却已恢复至与SHR组相当的水平,表明caveolin-1含量在肾叶间动脉Ang Ⅱ信号传递和收缩反应中可能发挥更为主要的调控作用。
综上所述,本研究证实ATVS可抑制SHR肾叶间动脉对AngⅡ收缩反应的强度和敏感性,其机制与减少caveolin-1蛋白表达及抑制caveolin-1与AT1的结合有关。
[1] Tozawa M, lseki K, Iseki C, et al. Blood pressure predicts risk of developing en-stage renal disease in men and women[J]. Hypertension, 2003, 41(6): 1341-1345.
[2] Protasiewicz M, Kadziela J, Poczatek K, et al. Renal artery stenosis in patients with resistant hypertension[J]. Am J Cardiol, 2013, 112(9): 1417-1420.
[3] Te RL, van Esch JH, Roks AJ, et al. Hypertension: renin-angiotensin-aldosterone system alterations[J]. Circ Res, 2015,116(6): 960-975.
[4] 王双, 万载阳, 唐朝克, 等. 两肾一夹型高血压大鼠重塑血管对血管紧张素Ⅱ反应变化及其机制[J]. 中国动脉硬化杂志, 2003, 11(6): 501-504.
[5] 张海军, 张茜, 谢小萍, 等. 平滑肌细胞caveolae在自发性高血压大鼠肾叶间动脉收缩功能改变中的作用研究[J]. 临床肾脏病杂志, 2016, 16(10): 625-631.
[6] 张海军, 苏玉婷, 孟星星, 等. 平滑肌细胞caveolae在大鼠肾动脉收缩反应调控中的作用研究[J]. 临床肾脏病杂志, 2016, 16(7): 432-438.
[7] Callera GE, Montezano AC, Yogi A, et al. Vascular signaling through cholesterol-rich domains: implications in hypertension[J]. Curr Opin Nephrol Hypertens, 2007, 16(2): 90-104.
[8] Wang Z, Bai Y, Yu J, et al. Caveolae regulate vasoconstriction of conduit arteries to angiotensin Ⅱ in hindlimb unweighted rats[J]. J Physiol, 2015, 593(20): 4561-4574.
[9] Razani B, Lisanti MP. Caveolins and caveolae: molecular and functional relationships[J]. Exp Cell Res, 2001, 271(1): 36-44.
[10] Krane V, Wanner C. Statins, inflammation and kidney disease[J]. Nat Rev Nephrol, 2011,7(7): 385-397.
[11] 谢晓竞, 杨解人, 王安才. 阿托伐他汀的降血压作用及其机制实验研究[J]. 中华全科医学, 2008, 6(9): 882-884, 封3.
[12] Taylor FC, Huffman M, Ebrahim S. Statin therapy for primary prevention of cardiovascular disease[J]. JAMA, 2013, 310(22): 2451-2452.
[13] 郑颖, 吕明睿. 阿托伐他汀改善高血压患者早期肾损害的研究[J]. 中外健康文摘, 2012, 40: 132-133.
[14] Sinatra ST, Teter BB, Bowden J, et al. The cholesterol and statin controversy: the new 2013 statin-cholesterol guidelines[J]. Altern Ther Health Med, 2014, 20(5): 14-17.
[15] Bidani AK, Griffin KA. Pathophysiology of hypertensive renal damage: implications for therapy[J]. Hypertension, 2004, 44(5): 595-601.
[16] 许红强, 王金萍, 常丽娜. 肾叶间动脉阻力指数与原发性高血压早期肾损害的相关性[J]. 安徽中医学院学报, 2006, 25(4): 51-52.
[17] 张雯, 马克涛, 刘卫东, 等. 缝隙连接在自发性高血压大鼠肾叶间动脉收缩增强中的作用[J]. 安徽医科大学学报, 2014, 49(11): 1570-1573.
[18] Burnier M, Brunner HR. Angiotensin Ⅱ receptor antagonists[J]. Lancet, 2000, 355 (9204): 637-645.
[19] 阮志芹, 李华. 原发性高血压和肾功能减退的相关性[J]. 中华高血压杂志, 2017, 1: 22-26.
[20] 张志杰, 胡申江, 孙坚, 等. 阿托伐他汀对自发性高血压大鼠血管内皮功能的保护作用[J]. 浙江大学学报(医学版), 2007, 36(4): 355-359.
[21] Li CL, Chou HW, Chan KA, et al. Effects of atorvastatin and rosuvastatin on renal function in patients with type 2 diabetes mellitus[J]. Am J Cardiol, 2015, 115(5): 619-624.
[22] Chang CH, Lee YC, Tsai CT, et al. Continuation of statin therapy and a decreased risk of atrial fibrillation/flutter in patients with and without chronic kidney disease[J]. Atherosclerosis, 2014, 232(1): 224-230.
[23] 焦海霞, 李凌, 余涓, 等. 尾套法和颈动脉法测定急性应激大鼠血压变化值的比较[J]. 福建医科大学学报, 2006, 40(4):404-405.
[24] 张勤勤, 孙润广, 李连启. Caveolae及其蛋白家族的生物学结构和功能的研究现状[J]. 北京生物医学工程, 2011, 30(2): 215-220.
[25] Yin X, Li B, Chen H, et al. Differential signaling pathways in angiotensin Ⅱ- and epidermal growth factor-stimulated hepatic C9 cells[J]. Mol Pharmacol, 2008, 74(5): 1223-1233.
[26] Linder AE, Thakali KM, Thompson JM, et al. Methyl-beta-cyclodextrin prevents angiotensin Ⅱ-induced tachyphylactic contractile responses in rat aorta[J]. J Pharmacol Exp Ther, 2007, 323(1): 78-84.
[27] Busija AR, Patel HH, Insel PA. Caveolins and cavins in the trafficking, maturation, and degradation of caveolae: implications for cell physiology[J]. Am J Physiol Cell Physiol, 2017, 312(4): C459-C477.
[28] Raghow R. Statins redux: a re-assessment of how statins lower plasma cholesterol[J]. World J Diabetes, 2017, 8(6): 230-234.
[29] Guasti L, Marino F, Cosentino M, et al. Prolonged statin-associated reduction in neutrophil reactive oxygen species and angiotensin Ⅱ type 1 receptor expression: 1-year follow-up[J]. Eur Heart J, 2008, 29(9): 1118-1126.
[30] Nickenig G, Baumer AT, Temur Y, et al. Statin-sensitive dysregulated AT1 receptor function and density in hypercholesterolemic men[J]. Circulation, 1999, 100(21): 2131-2134.
InhibitoryeffectsofCaveolin-1-mediatedatorvastatinonvasoconstrictionofinterlobarrenalarteryinSHRrats
XIEXiao-ping,ZHANGHai-jun,GUOYi-bin,ZHANGXi,CHANGYao-ming,BAOJun-xiang.
DepartmentofAerospaceHygiene,theFourthMilitaryMedicalUniversity,Xi'an710032,China
BAOJun-xiang,E-mail:baojunx@fmmu.edu.cn
ObjectiveExcessive vasoconstriction of interlobar renal artery (IRA) is one of preliminary manifestations of renal damage in hypertension, during which caveolin-1 plays an important role. Atorvastatin (ATVS) represses cholesterol (CHO) synthesis to down-regulate the expression of caveolin-1, so we aimed to investigate whether the ATVS inhibited vasoconstriction of IRA to angiotensin Ⅱ (Ang Ⅱ) by regulating caveolin-1 in spontaneously hypertensive rats (SHR).MethodsTwelve SHR were randomly divided into two groups: SHR control group, and SHR ATVS-treated group. Six Wistar Kyoto (WKY) rats weighing the same were employed as control group. Systolic blood pressure (SBP) was measured with the tail-cuff technique before and 2 or 4 weeks after ATVS treatment. Isometric force recording system was used to detect the vascular function. Western blotting was conducted to examine the protein abundance of caveolin-1 or angiotensin Ⅱ type 1 receptor (AT1). Immumoprecipitation was carried out to assess the binding of caveolin-1 and AT1.ResultsSBP, and intensity and sensitivity of vasoconstriction of IRA to Ang Ⅱ were significantly increased in SHR as compared to WKY rats (P<0.05). At 4th week, ATVS treatment could significantly reduce SPB(P<0.05), and the intensity and sensitivity of vasoconstriction of IRA to Ang Ⅱ (P<0.05) in SHR control group. Meanwhile, the protein expression of caveolin-1 or AT1as well as Ang Ⅱ elicited binding of caveolin-1 or AT1in IRA was higher in SHR than in WKY rats, which could also be reduced by ATVS (P<0.05). The ex vivo incubation of CHO raised the caveolin-1 protein content and promoted the binding of caveolin-1 and AT1in IRA of ATVS-treated SHR (P<0.05). At the same time, CHO enhanced the intensity and sensitivity of vasoconstriction of IRA to Ang Ⅱ (P<0.05).ConclusionsATVS mitigated the vasoconstriction of IRA to Ang Ⅱ in SHR, which was mediated by reducing caveolin-1 expression and inhibiting the binding of caveolin-1 and AT1.
Atorvastatin; Hypertension; Angiotensin Ⅱ; Caveolin-1
10.3969/j.issn.1671-2390.2017.10.012
国家自然科学基金项目资助(No.81401550;81671856)
710032 西安,第四军医大学航空航天卫生学教研室
暴军香,E-mail:baojunx@fmmu.edu.cn
2017-07-18
2017-09-26 )

