硬皮病肾危象一例临床病理分析
唐利 廖常彬
·病例报告·
硬皮病肾危象一例临床病理分析
唐利 廖常彬
病 例 资 料
患者:男,53岁,因“右拇指僵硬1年,皮肤肿胀发硬8个月,尿量减少1个月”以“肾衰竭”收治入院。1年前无明显诱因出现右拇指僵硬伴活动受限。8个月前患者出现双手背及足背皮肤肿胀发硬伴握拳受限,在当地医院诊断为“硬皮病”,血压约150~160/70~90 mmHg,未正规诊治。皮肤肿胀发硬逐渐发展至四肢近心端及躯干,伴双下肢乏力;2个月前到当地医院治疗,予以口服泼尼松片30 mg/d治疗,自觉皮肤发硬略好转,肾功能正常;1个月前出现尿量减少伴双下肢轻度凹陷性对称性水肿,伴纳差、腹胀,在第三军医大学就诊查血肌酐310.9 μmol/L,肾小球滤过率18.7 ml·min-1·(1.73 m2)-1,U1RNP/sm(抗核糖核蛋白抗体)可疑阳性,小便常规蛋白尿(+++),隐血(+++),红细胞17.39/ul,血常规三系减少,予以停用泼尼松片。11 d前在当地医院查血肌酐528.3 μmol/L,血常规三系减少,诊断为:急性肾损伤,三系减少原因待查,系统性硬化症,乙肝病毒携带等,予甲强龙40 mg、每天一次静滴,拉米夫定、泮托拉唑、右股静脉置管及血液透析等治疗,小便量200 ml/d,治疗后无明显缓解来我院就诊。查体:体温36.1℃,脉搏84次/分,呼吸20次/分,血压124/75 mmHg。面部皮肤发亮紧张,呈面具样面容,四肢及躯干皮肤肿胀变硬,有蜡样光泽,触之坚韧如皮革,提捏困难,压之凹陷。关节僵硬,屈伸活动轻度受限。24 h尿量<200 ml。血常规:血红蛋白86 g/L,血小板65×109/L,白细胞10.17×109/L。血生化:白蛋白35.6 g/L,尿素24.00 mmol/L,肌酐835.0 μmol/L,血清胱抑素C测定5.84 mg/L,尿酸613.0 μmol/L。尿常规:隐血(±),蛋白(++)。24 h尿蛋白定量:1.46 g,尿蛋白/尿肌酐0.123 g/mmol。红细胞形态学检查未见破碎红细胞。自身抗体及免疫功能试验:补体C3 0.617,抗核抗体 +1∶100颗粒型核仁型,抗Scl-70抗体阴性,血管炎抗体(antineutrophil cytoplasmic antibody,ANCA)及抗肾小球基底膜(glomerular basement membrane,GBM)抗体阴性。胸部CT:双肺散在斑片、结节及条索影。纵隔淋巴结增多、增大;双侧胸腔、心包少量积液。双肺散在感染灶。腹部超声:肝脏实质回损害,双肾实质回声增强。肾穿刺活检(图1~4):光镜观察:肾小球:总数13~15个,小球均呈缺血皱缩改变。系膜:个别小球节段细胞及基质轻度增生。基膜:缺血皱缩。毛细血管腔:病变不明显。肾小管:约5%肾小管萎缩,小管上皮细胞中度变性。肾间质:约5%间质纤维化伴淋巴细胞、单核细胞浸润。血管:小动脉壁呈洋葱皮样显著增厚,管腔闭塞。免疫荧光染色:IgG、IgM、IgA、C3、C4、C1q、κ、λ;3~5个小球均(—)。病理诊断:符合恶性高血压所致肾损害。诊断:硬皮病肾危象。治疗方案:规律血液透析稳定内环境,重组人促红细胞生成素纠正贫血,贝那普利10 mg,每天一次控制血压。随访3个月患者尿量小于100 ml/d,复查血肌酐900 μmol/L,进入维持性血液透析。
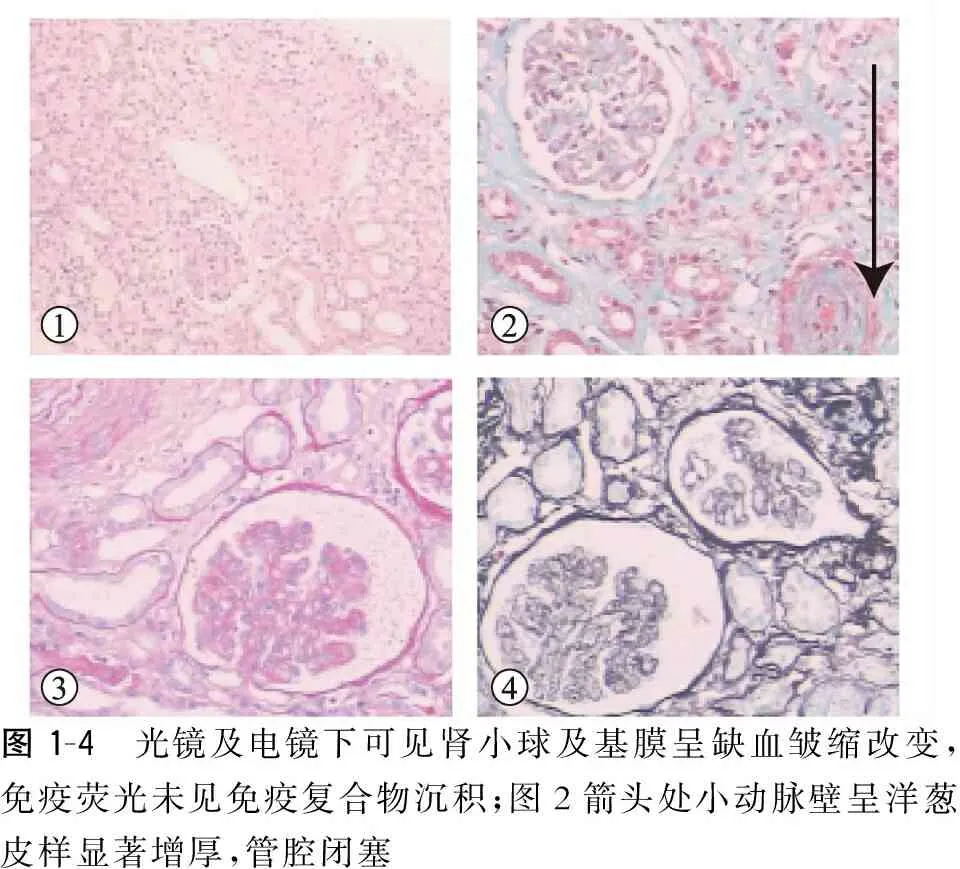
图1-4 光镜及电镜下可见肾小球及基膜呈缺血皱缩改变,免疫荧光未见免疫复合物沉积;图2箭头处小动脉壁呈洋葱皮样显著增厚,管腔闭塞
讨 论
系统性硬化症(systemic sclemsis, SSc)是一种罕见的全身结缔组织疾病,具有广泛的临床表现。本病分为弥漫性皮肤系统性硬化症(dcSSc型)、局限性皮肤系统性硬化症(lcSSc)、系统性硬化症(ssSSc)和重叠综合征。SSc患者中可存在多种自身抗体,如抗核抗体(antinuclear antibody,ANA)、抗拓扑异构酶1抗体(抗scl-70抗体)、抗着丝点抗体(anticentromere antibodies,ACA)及抗RNA聚合酶Ⅲ抗体(anti-RNA polymerase I antibody,ARA)等。根据最近一项多中心研究[1],ssSSc血清免疫学特点与 lcSSc 相似而与dcSSc不同,ACA在dcSSc患者中较高(50% ssSScvs12% in dcSSc)而抗scl-70抗体较低(16% ssSScvs22% dcSSc)。自身抗体谱与种族相关,ARA、ACA、Pm/Scl抗体在白种人阳性率较高,而非洲裔美国人中抗U3RNP抗体、抗U1RNP抗体及抗scl-70抗体阳性率更高[2-3]。本研究中此例患者抗U1RNP抗体阳性。近年研究证实自身抗体与SSC患者的某些系统受累表现相关[1],国外研究报道发生肾危象患者早期血清学自身抗体检测,三分之一患者ARA阳性,显示ARA与SSC肾脏受累密切相关[4]。对于ARA阳性SSc患者临床医师需要警惕肾危象。硬皮病肾危象(scleroderma renal crisis,SRC)是系统性硬化症引起的严重并发症之一,以恶性高血压、进行性肾衰竭为特征性临床表现[3]。目前SRC的发病机制还未完全阐明,既往认为肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosteronesystem,RAAS)激活使得肾皮质血管进一步收缩及肾血流量进一步减少导致急性肾衰竭,但越来越多证据提示补体系统的激活可能参与了发病[5-6]。国内外文献均报道SRC通常发生在SSc起病5年内[7-8],周佳鑫等[8]对SSc合并肾危象的16例患者进行回顾性分析显示从SSc起病到发展为SRC平均时间为3.2年,本例患者从SSc起病到发展为SRC不到1年时间,分析原因可能与患者皮肤硬化进展速度快及使用较大剂量激素有关。已有研究提示SRC与糖皮质激素使用有关[9],激素大于15 mg/d是SRC的危险因素。SSc合并肾危象患者可合并血栓性微血管病,本例患者发现血小板及血红蛋白低,应高度怀疑,但患者无溶血性贫血表现以及红细胞形态学检查未见破碎红细胞,且肾活检不支持。SRC诊断时约有11%的患者血压正常,本例患者血压正常,而硬皮病合并急性肾衰竭同时血压正常者不利于SRC的诊断,既往也有研究显示硬皮病合并ANCA阳性的新月体肾炎,因此硬皮病合并急性肾功能损害患者应常规排除其他可引起急性肾功能损害的原因,尤其是伴血压正常者,肾活检是必要的。此例患者发生急性肾衰竭时血压正常,我们对ANCA、抗GBM抗体、多肽抗体谱、血清蛋白电泳等继发性肾损害的常见原因进行了筛查未见明显异常,同时进行了肾活检提示肾小球呈缺血皱缩改变,小动脉壁呈洋葱皮样显著增厚,管腔闭塞,符合恶性高血压所致肾损害,为SRC典型肾脏病理改变。
大剂量血管紧张素转化酶抑制剂(angiotensin-converting enzyme inhibitor,ACEI)治疗SRC能显著改善肾危象患者的病死率,据研究报道使用ACEI后可使患者的病死率从76%下降至10%[10]。英国硬皮病研究小组制定的相关指南指出ACEI在硬皮病肾危象的治疗中应该是终生的,无论透析与否[11]。近年有研究发现内皮素-1可能参与了SRC的发病过程[12-13],因此有研究采用波生坦联合ACEI治疗SRC可获得一定疗效,但与单用ACEI治疗比较无明显优势,但此研究样本量小,因此内皮素拮抗剂的使用疗效还需更多的临床随机对照实验来明确,而最近Nagamura等[14]报告联合使用ACEI、环磷酰胺及血浆置换成功治疗硬皮病肾危象及硬皮病间质性肺炎的病例,为硬皮病肾危象的治疗提供了更多可能性。SRC可以通过经典途径补体系统激活,补体5抑制剂eculizumab可能会成为SRC的有效治疗药物[6],Thomas等[15]报道使用eculizumab治疗一例PM-Scl重叠综合征并硬皮病肾危象的患者有效。
SRC是硬皮病尤其是系统性硬化症的严重的并发症之一,也是其致残致死的重要原因,硬皮病患者应避免使用大剂量激素治疗,因其可诱发SRC的发生。作为肾科医生遇到急性肾损害患者时应想到此病的可能,增加对本病的认识及进行规范化治疗,而风湿免疫科医生遇到硬皮病合并蛋白尿,肾功能异常时应想到此病,并可与肾脏科协作积极进行肾穿刺进一步明确诊断。
[1] Nihtyanova SI, Parker JC, Black CM, et al. A longitudinal study of anti-RNA polymerase Ⅲ antibody levels in systemic sclerosis[J]. Rheumatol, 2009, 48(10): 1218-1221.
[2] Steen VD. Autoantibodies in systemic sclerosis[J]. Seminars in Arthritis and Rheumatism, 2005, 35(1): 35-42.
[3] Krzyszczak ME, Li Y, Ross SJ, et al. Gender and ethnicity differences in the prevalence of scleroderma-related autoantibodies[J]. Clinical Rheumatology, 2011, 30(10): 1333-1339.
[4] Mouthon L, Berezne A, Bussone G, et al. Scleroderma renal crisis: a rare but severe complication of systemic sclerosis[J]. Clin Rev Allerge Immunol, 2011, 40(2): 84-91.
[5] Guiducci S, Giacomelli R, Cerinie MM. Vascular complications of scleroderma[J]. Autoimmun Rev, 2007, 6(8): 520-523.
[6] Devresse A, Aydin S, Le Quintrec M, et al. Complement activation and effect of eculizumab in scleroderma renal crisis[J]. Medcine, 2016, 95(30): e4459.
[7] Scussel-Lonzetti L, Joyal F, Raynauld JP, et al. Predicting mortality in systemic sclerosis: analysis of a cobort of 309 French Canadian patients with emphasis on features at diagnosis as predictive factors for survival[J]. Medicine(Baltimore), 2002, 81(2): 154-167.
[8] 周佳鑫, 徐东, 侯勇, 等. 系统性硬化病合并肾危象16例临床分析[J]. 中华内科杂志, 2015, 54(2): 125-129.
[9] Opitz C, Klein-Weigel PF, Riemekasten G. Systemic sclerosis-a systematic overview : part 2-immunosuppression, treatment of SSc-associated vasculopathy, and treatment of pulmonary arterial hypertension[J]. Vasa, 2011, 40(1): 20-30.
[10] Bose N, Chiesa-Vottero A, Chatteriee S. Scleroderma renal crisis[J]. Semin Arthritis Rheum, 2015, 44(6): 687-694.
[11] Lynch BM, Stern EP, Ong V, et al. UK Scleroderma Study Group(UKSSG) guidelines on the diagnosis and management of scleroderma renalcrisis[J]. Clin Exp Rheumatol, 2016, 100(5): 106-109.
[12] Mouthon L, Mehrenberger M, Teixeira L, et al. Endothelin-1 expression in scleroderma renal crisis[J]. Hum Pathol, 2011, 42(1): 95-102.
[13] Penn H, Quillinan N, Khan K, et al. Targeting the endothelin axis in scleroderma renal crisis: rational and feasibility[J]. QJM, 2013, 106(9): 839-848.
[14] Nagamura N, Kin S. Scleroderma renal crisis during intravenous cyclophosphamide pulse therapy for complicated interstitial lung disease was successfully treated with angiotensin converting enzyme inhibitor and plasma exchange[J]. Nagoya J Med Sci, 2016, 78(3): 329-334.
[15] Thomas CP, Nester CM, Phan AC, et al. Eculizumab for rescue of thrombotic microangiopathy in PM-Scl antibody-positive autoimmune overlap syndrome[J]. Clin Kidney J, 2015, 8(6): 698-701.
10.3969/j.issn.1671-2390.2017.10.015
643000 四川省自贡市第三人民医院肾内科
2016-11-27
2017-09-26)

