烟草NtCBL1基因的克隆、表达载体构建及表达分析
张雪薇 刘 仑 鲁黎明 李立芹
(四川农业大学农学院,成都 611130)
烟草NtCBL1基因的克隆、表达载体构建及表达分析
张雪薇 刘 仑 鲁黎明 李立芹*
(四川农业大学农学院,成都 611130)
CBL是一类Ca2+感受蛋白,在植物适应或抵制逆境胁迫的过程中发挥重要的作用。从烟草品种K326中克隆到了一个CBL1的同源基因,该序列包含了一个642 bp的开放阅读框,编码一个由213个氨基酸残基组成的蛋白,预测分子量为24.5 kDa,等电点为5.03。同源性分析结果显示,该基因与林烟草CBL1、甜辣椒CBL1等具有较高的同源性,故命名为NtCBL1。生物信息学分析表明,NtCBL1具有CBL家族保守的EF-hand钙结合结构域。组织表达分析发现该基因在成熟期的根、茎、叶、花中均有表达,在根中的表达量最高。逆境胁迫实验表明,该基因表达受低钾、高盐、干旱、ABA和低温诱导调控,参与烟草生物与非生物逆境胁迫的响应。并成功构建了NtCBL1-pBI121过表达载体。研究结果为解析NtCBL1在响应逆境胁迫的功能奠定一定理论基础。
烟草;NtCBL1;克隆;序列分析;表达
烟草作为我国重要的经济作物之一,保障我国烟草产区的产量和质量对于我国财政收入以及烟区农业经济发展极为重要。低钾、干旱、盐碱、冷害、病害等生物与非生物胁迫严重影响烟叶的产量及品质,尤其是低钾胁迫对烟草的危害极为严重[1]。烟草对钾元素的需求量相对较大,烟叶中的含钾量更是衡量烟叶品质的重要指标之一,而在我国的大部分耕地土壤中都不同程度的缺钾[2]。如何提高烟草的抗逆性和提高钾的利用效率已成为目前研究的重要课题。
Ca2+作为细胞内重要的第二信使,几乎介导了植物生长发育的所有生理生化过程,在植物逆境应答的信号转导过程中起着重要的作用[3]。特异Ca2+感受器能感知特异刺激所产生的瞬间Ca2+信号,进而通过特异的蛋白—蛋白间的相互作用或者通过特定的磷酸化级联反应过程或者基因表达调控来传递这种特异的钙信号,从而启动一系列的生理生化反应使植物适应或抵御各种逆境胁迫[4]。类钙调神经素B亚基蛋白(Calcineurin B-Like protein,CBL)是一类小分子钙离子感受器,含有典型的钙离子结合域EF-hand。研究发现拟南芥、水稻、玉米和杨树CBL家族含有10个成员[5],CBL在植物响应生物与非生物胁迫过程中发挥着一定作用。拟南芥中AtCBL1能与AtCIPK23(CBL-interacting protein kinase)互作调控钾离子通道蛋白AKT1所介导的低钾信号转导途径[6];AtCBL1在响应盐和干旱胁迫的过程中起正向调控作用,在低温胁迫应答中起负调控作用[7]。过表达的紫花针茅SpCBL6转入拟南芥后,能降低拟南芥耐旱性,增强低温耐受性[8];水稻中OsCBL6基因的表达受盐,干旱,寒冷和ABA诱导[9]。大量研究结果表明:CBL在其他植物响应低钾、盐碱、干旱、ABA和低温等逆境胁迫应答中也具有重要功能[10~13]。
本研究从烟草K326中克隆到一个NtCBL1基因,利用生物信息学对NtCBL1编码的蛋白进行相关分析,同时,运用荧光定量PCR分析了其在根、茎、叶、花及低钾、高盐、干旱、ABA和低温胁迫下基因的表达水平,并成功构建NtCBL1-pBI121过表达载体,旨在为今后NtCBL1的功能研究奠定基础。
1 试验材料和方法
1.1 试验材料及试剂
本试验使用的植物材料为烟草K326。首先挑选籽粒饱满、大小一致的烟草种子用75%的乙醇消毒1 min,然后20%的次氯酸钠溶液消毒20 min,用无菌水反复清洗5~6次,播种于MS培养基上,每个培养基上播种40粒左右,放置在16 h光/8 h暗,25℃的光照培养箱中培养15 d后,挑取长势一致的幼苗进行低钾、高盐、干旱、ABA和低温处理,每个处理设有3盘重复,处理相应时间(3、6、12和24 h)后进行整株取样。低钾处理时将待处理材料转移到低钾培养基上,低钾培养基是将MS培养基中的KNO3去掉,并且将KH2PO4替换为NH4H2PO4,其余成分相同。高盐、干旱、ABA处理培养基是在MS培养基的分别加入NaCl(200 mmol·L-1)、PEG6000(5%)、ABA(1 μmol·L-1)。低温处理时将待处理材料放置4℃的光照培养箱中。
大肠杆菌感受态DH5α购自Vazyme Biotech公司,DNA凝胶纯化回收试剂盒购自天根公司,Trizol试剂、载体PMD19-T、高保真Pfu酶,cDNA合成试剂盒,SYBR Green Master mix、限制性内切酶、DNA Ligation Kit 2.0等试剂购自TaKaRa,引物合成与测序由上海生工生物工程有限公司完成。
1.2 试验方法
1.2.1 烟草NtCBL1基因的克隆
参考GenBank收录的林烟草NsCBL1序列(LOC104239170),采用同源克隆的方法,Primer5.0软件设计引物NtCBL1-F和NtCBL1-R(表1)。扩增反应程序为:94℃预变性5 min;94℃变性30 s;57℃退火30 s;72℃延伸1 min;34个循环。目的片段纯化后与pMD19-T载体16℃连接过夜,连接产物转化大肠杆菌DH5α感受态,随后在涂有氨苄青霉素的LB平板上进行筛选,菌落PCR检测筛选阳性克隆,送至上海生工生物工程有限公司进行测序。
1.2.2 烟草NtCBL1基因生物信息学分析
利用ExPASy ProtParam tool分析NtCBL1编码蛋白的理化性质;采用DNAMAN软件分析其编码蛋白的疏水性;运用IBCP的在线工具SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)预测NtCBL1的二级结构;SWISS-MODEL(https://swissmodel.expasy.org/)在线预测NtCBL1的三级结构,预测结果用RasTop软件打开;利用SMART(http://smart.embl-heidelberg.de/smart/set_mode.cgi?NORMAL=1)在线分析NtCBL1编码蛋白氨基酸的结构域;采用在线工具PSORT(http://psort.hgc.jp/form.html)预测NtCBL1的亚细胞定位;利用Signal-P在线预测蛋白质信号肽;运用MEGA5软件,以邻近法构建系统进化树。
1.2.3 烟草NtCBL1基因的表达分析
根据基因序列,采用Primer Premier 5.0设计Real Time PCR引物NtCBL1-qF和NtCBL1-qR(表1),采用烟草的18SrRNA为内参进行表达差异研究。所有的样品都设置3个重复,反应结束后,基因相对表达水平用2-△△Ct方法进行计算。

表1 引物序列
注:GGATCC为BamHⅠ;CCCGGG为SmaⅠ
Note:GGATCC isBamHⅠ;CCCGGG isSmaⅠ
1.2.4 构建NtCBL1-pBI121过表达载体
PCR引物NtCBL1-pBI121-F和NtCBL1-pBI121-R(表1),扩增反应程序为:94℃预变性5 min;94℃变性30 s;57℃退火30 s;72℃延伸1 min;34个循环。扩增产物纯化后,酶切回收目的片段和pBI121载体,酶切体系10 μL:10×T Buffer,0.5 μL;BSA,1 μL;BamHⅠ,1 μL;SmaⅠ,1 μL;PCR产物/pBI121载体,4 μL;ddH2O,2.5 μL。
目的片段纯化后与pBI121载体16℃连接过夜,连接产物转化大肠杆菌DH5α感受态,随后在涂有卡那霉素的LB平板上进行筛选,菌落PCR检测筛选阳性克隆,摇菌提取质粒,并送至上海生工生物工程有限公司进行测序。
2 结果与分析
2.1 基因克隆
以烟草叶片总RNA反转录合成的cDNA为模板进行PCR扩增,电泳结果显示在500~700 bp的位置上有清晰的条带(图1)。将该条带回收纯化后与pMD19-T载体进行连接,转化大肠杆菌。运用菌落PCR方法鉴定阳性克隆,随机挑选3个阳性克隆送至上海生工生物工程有限公司进行测序,测序结果显示:目的片段大小为642 bp。
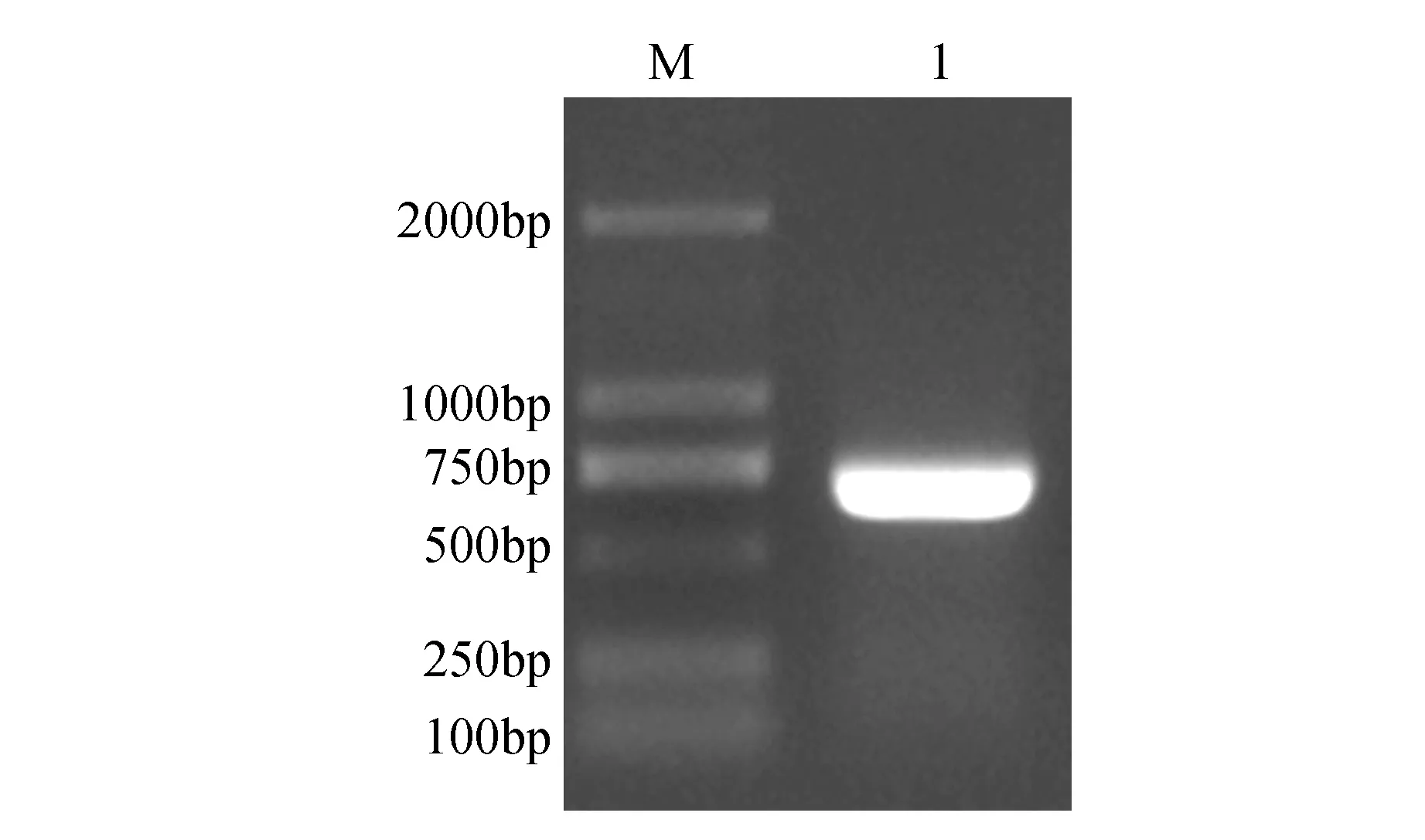
图1 NtCBL1的克隆 M.Marker 2 000 bp; 1.NtCBL1基因Fig.1 Cloning of NtCBL1 M.Marker 2 000 bp; 1.NtCBL1 gene PCR product
2.2 构建NtCBL1-pBI121过表达载体
将PCR扩增产物和pBI121载体分别进行双酶切,连接转化大肠杆菌后,挑选8个菌落进行菌落PCR,结果显示:在500~700 bp的位置上有清晰的条带(图2),挑取构建成功的阳性克隆,摇菌提取质粒,并送至上海生工生物工程有限公司进行测序,测序结果显示:目的片段大小为642 bp,表明NtCBL1-pBI121过表达载体构建成功。
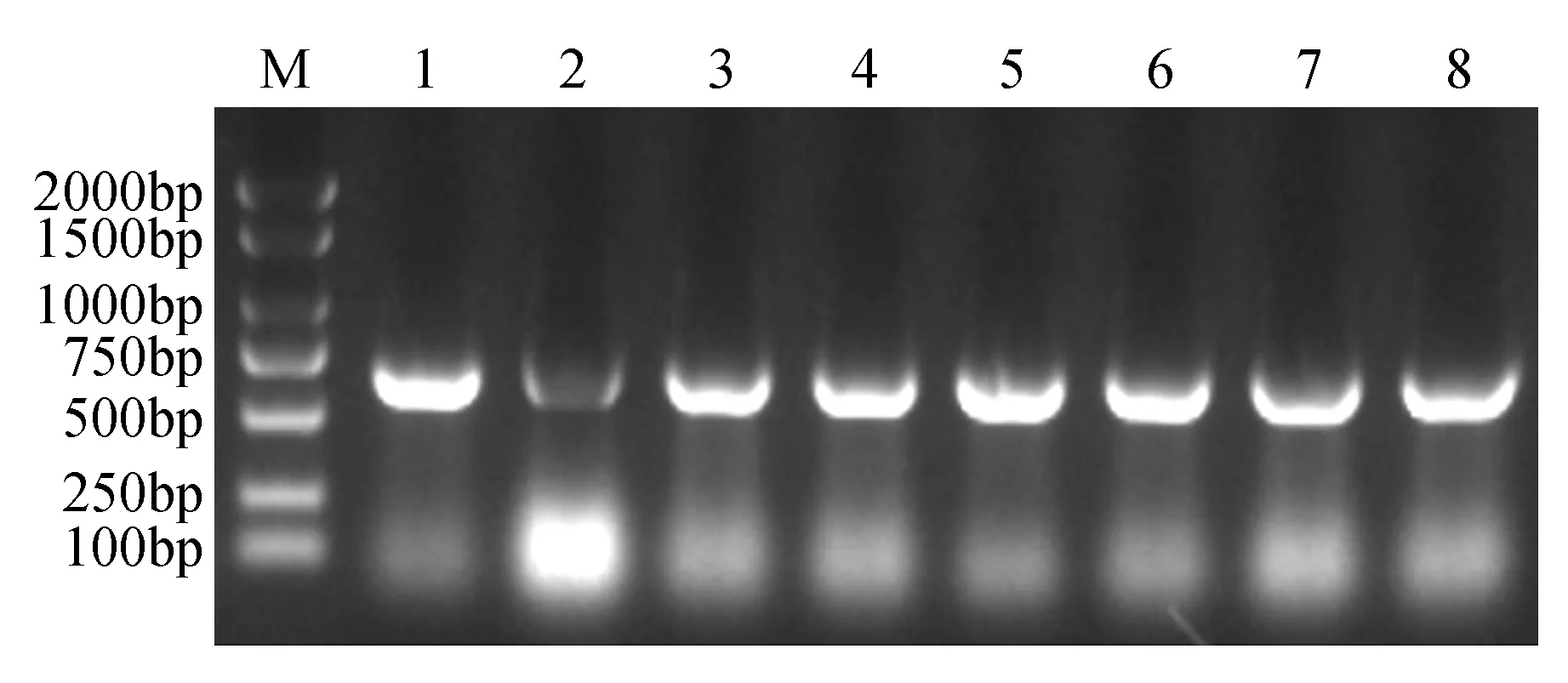
图2 NtCBL1-pBI121过表达载体的构建 M. Marker 2 000 bp; 1~8.NtCBL1基因Fig.2 Construction of NtCBL1-pBI121 overexpression vector M.Marker 2 000 bp; 1-8. NtCBL1 gene PCR product
2.3 NtCBL1基因和蛋白序列分析
2.3.1 NtCBL1的理化性质及疏水性分析
NtCBL1编码蛋白的理化性质分析结果表明:亮氨酸Leu(22,10.3%),苯丙氨酸Phe(20,9.4%),谷氨酸Glu(19,8.9%),赖氨酸Lys(18,8.5%),天冬氨酸Asp(16,7.5%),而酪氨酸Tyr(2,0.9%)和色氨酸Trp(1,0.5%)含量较低。该蛋白预测的分子量为24.5 kDa,理论等电点PI为5.03,不稳定系数(instability index)是35.75,该蛋白可能是一个稳定的酸性蛋白。该蛋白总的亲水性平均指数为-0.184,DNAMAN软件进行的疏水性分析结果显示(图3),预测该蛋白属于亲水性蛋白。
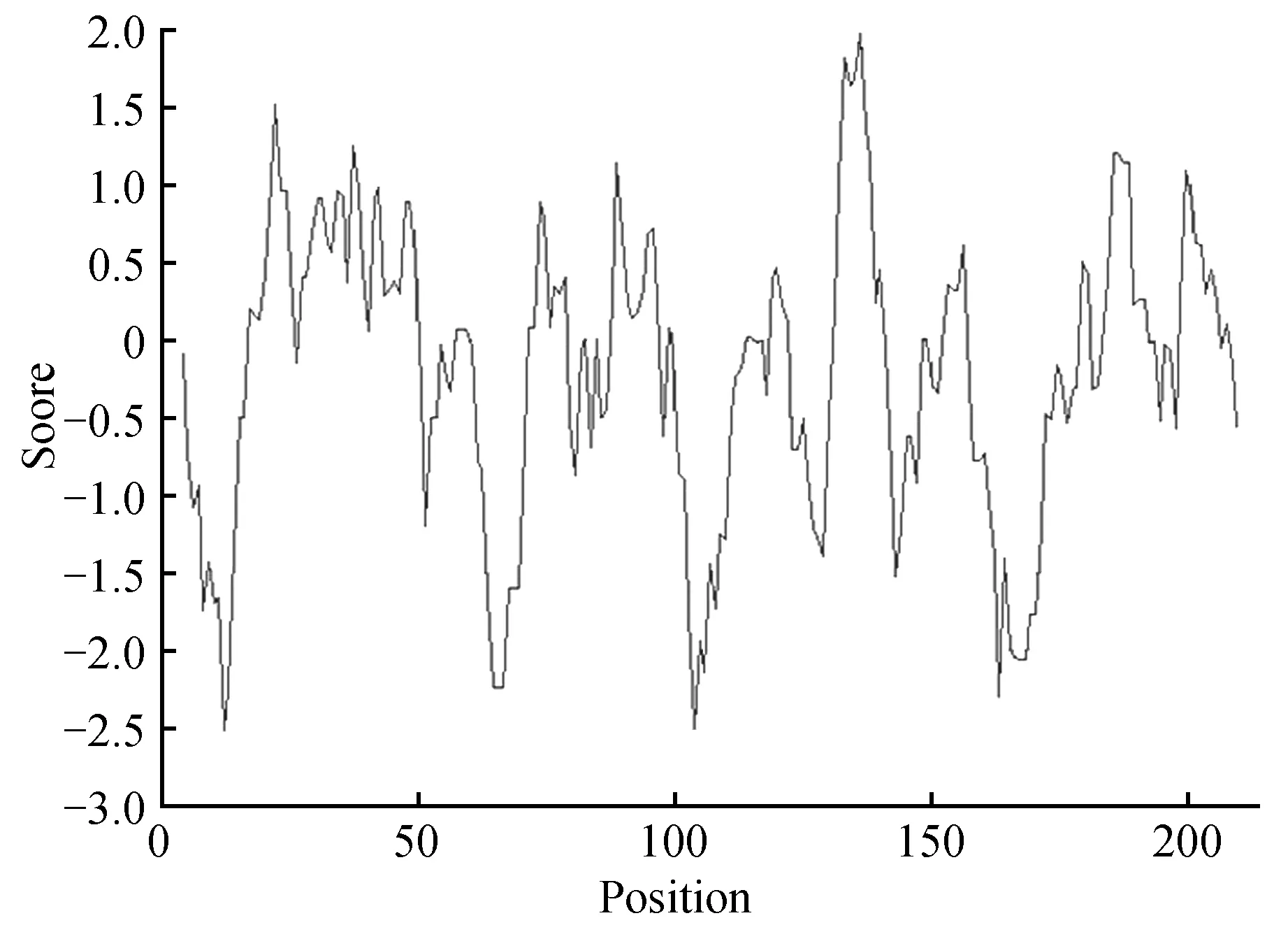
图3 NtCBL1疏水区预测Fig.3 Hydrophobic region prediction of NtCBL1
2.3.2 NtCBL1的二级、三级结构预测
利用IBCP的在线工具SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html),对NtCBL1的二级结构进行预测发现,该蛋白中45.54%氨基酸参与α-螺旋(Alpha helix),26.29%的氨基酸参与无规则卷曲(Random coil),17.37%的氨基酸参与延伸链(Extended strand),仅有10.80%的氨基酸参与β-转角(Beta turn),由此可见,该蛋白二级结构的最大元件为α-螺旋(图4)。运用SWISS-MODEL(https://swissmodel.expasy.org/)对NtCBL1的三级结构进行了预测,RasTop软件进行显示(图5),并将结果与二级结构预测进行比照,结果较为统一。
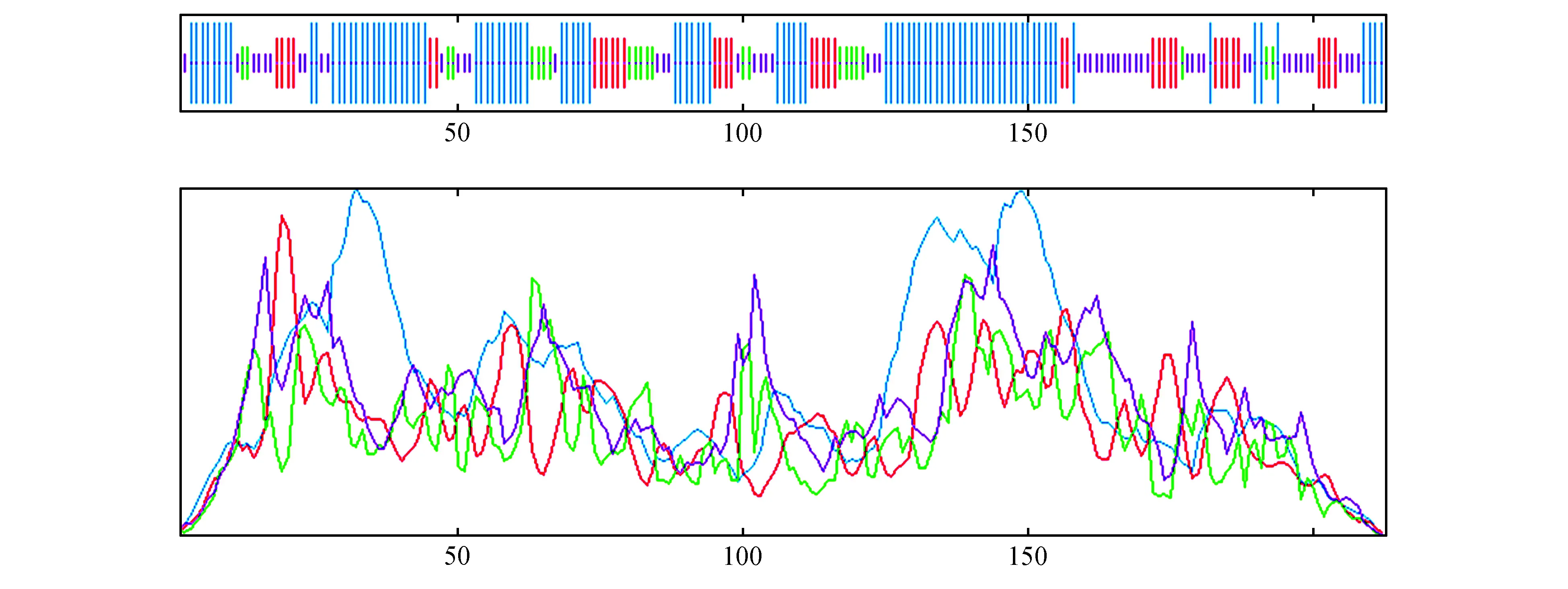
图4 NtCBL1的二级结构Fig.4 The secondary structure prediction of NtCBL1
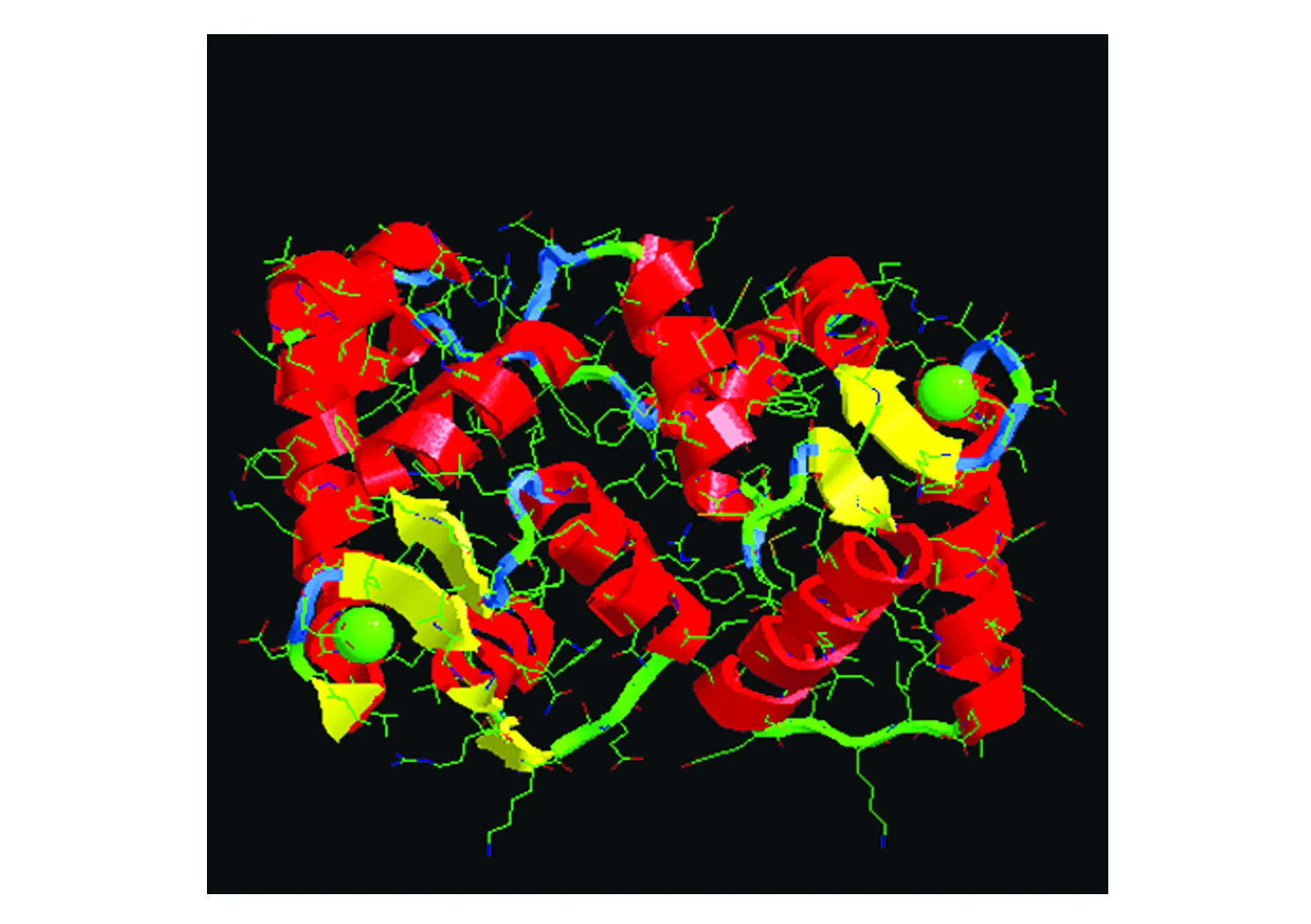
图5 NtCBL1的三级结构Fig.5 The tertiary structure prediction of NtCBL1
2.3.3 NtCBL1蛋白信号肽预测
对蛋白质信号肽的分析有助于蛋白质功能域的区分及蛋白质的细胞定位(图6)。利用Signal-P4.1,它根据信号肽序列特征,采用神经网络方法或隐马氏模型方法,对信号肽位置及切割位点进行预测。信号肽切割位点预测用Y-score maximum来判断,是否是分泌蛋白用mean S-score来判断,预测结果显示:mean S-score为0.097,小于0.5,则预测该蛋白不是分泌蛋白,不存在信号肽。
2.3.4编码NtCBL1蛋白的结构域及亚细胞定位分析
利用NCBI数据库的SMART软件对NtCBL1编码蛋白氨基酸的结构域进行分析,结果表明(图7),该蛋白含有3个保守的EF-hand钙结合结构域,作为钙结合蛋白的基本结构特征,分别位于第71~99位、第108~136位、第152~180位氨基酸。另外,NtCBL1蛋白在N端含有豆蔻酰化位点MGXXXS/T,该位点在蛋白互作和蛋白与膜的附着方面起一定作用。在细胞内的特异定位是细胞内信号响应过程的重要环节。特异性Ca2+信号传递给哪条信号通路的哪种类型的Ca2+受体及其家族中的哪个成员,这在很大程度上取决于这些信号通路成员的组织和亚细胞定位。利用PSORT(http://psort.hgc.jp/form.html)在线预测NtCBL1的亚细胞定位,结果显示,在微体上占0.612,在细胞质中占0.450,在线粒体基质中占0.1,在质膜上占0.1,预测NtCBL1可能定位在微体中。

图6 NtCBL1的信号肽预测Fig.6 Signal peptide prediction of NtCBL1
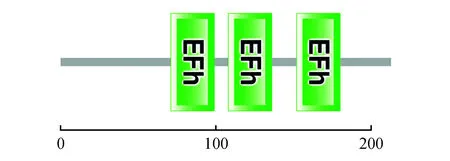
图7 NtCBL1的结构域分析Fig.7 Structure domain analysis of NtCBL1
2.3.5 NtCBL1同源性分析
把NtCBL1编码的氨基酸序列在NCBI数据库中进行BLAST比对,按照相似性程度高低选择20个基因编码的氨基酸序列(包括NtCBL1)构建系统进化树,结果表明(图8),NtCBL1与林烟草CBL1、甜辣椒CBL1、番茄CBL1等具有较高的氨基酸序列同源性,分别为100%,95%,94%,与拟南芥CBL1的同源性最低,为83%。
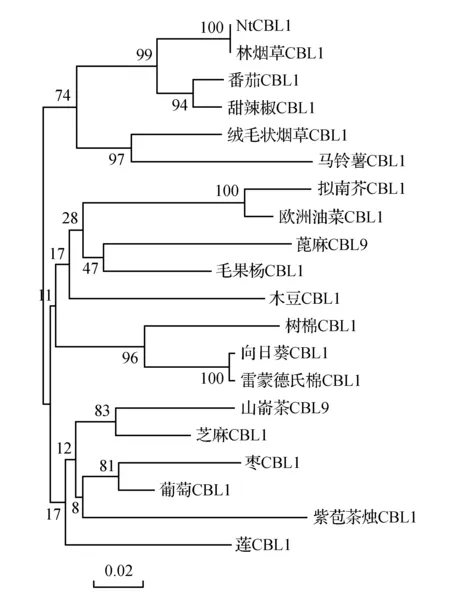
图8 NtCBL1的系统进化分析Fig.8 Phylogenetic analysis of NtCBL1
2.4 NtCBL1的组织表达分析
以成熟期的烟草品种K326根、茎、叶、花cDNA为模板进行Real Time PCR反应,分析NtCBL1在各个组织的表达量,由图9可知,NtCBL1的表达量由高到低依次为根>花>茎>叶,这说明NtCBL1基因主要在烟草K326植株的根中表达,并且其表达存在组织特异性。
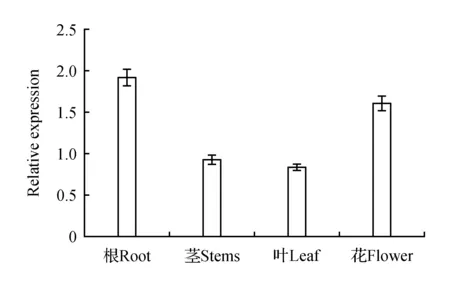
图9 NtCBL1在不同组织中的相对表达量分析Fig.9 Analysis of relative expression of NtCBL1 in different tissues
2.5 逆境胁迫下NtCBL1的表达分析
2.5.1 低钾和高盐处理下NtCBL1的表达分析
采用Real Time PCR对NtCBL1在低钾以及NaCl(200 mmol·L-1)处理下的表达量进行了分析。由图10可知,该基因在低钾处理1~12 h内表达量上调,12 h时达到最大,为对照(0 h)的2.31倍;随后表达量下降。因此低钾处理后,NtCBL1的表达量是先上调后降低。表明NtCBL1的表达受低钾诱导。NtCBL1在高盐诱导下,3 h表达量降至仅为对照(0 h)的6.9%,6 h表达量上升至最大,为对照的2.87倍;随后表达量下降。因此高盐处理后,NtCBL1的表达量是先下降再上调最后降低。
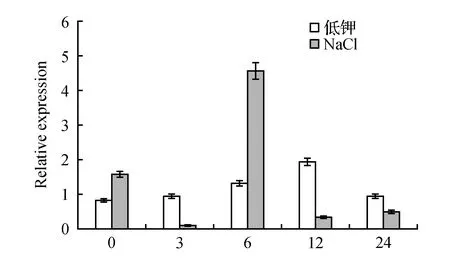
图10 NtCBL1在低钾和高盐处理下的相对表达量Fig.10 Relative expression of NtCBL1 under low-K+ and high-salt treatment
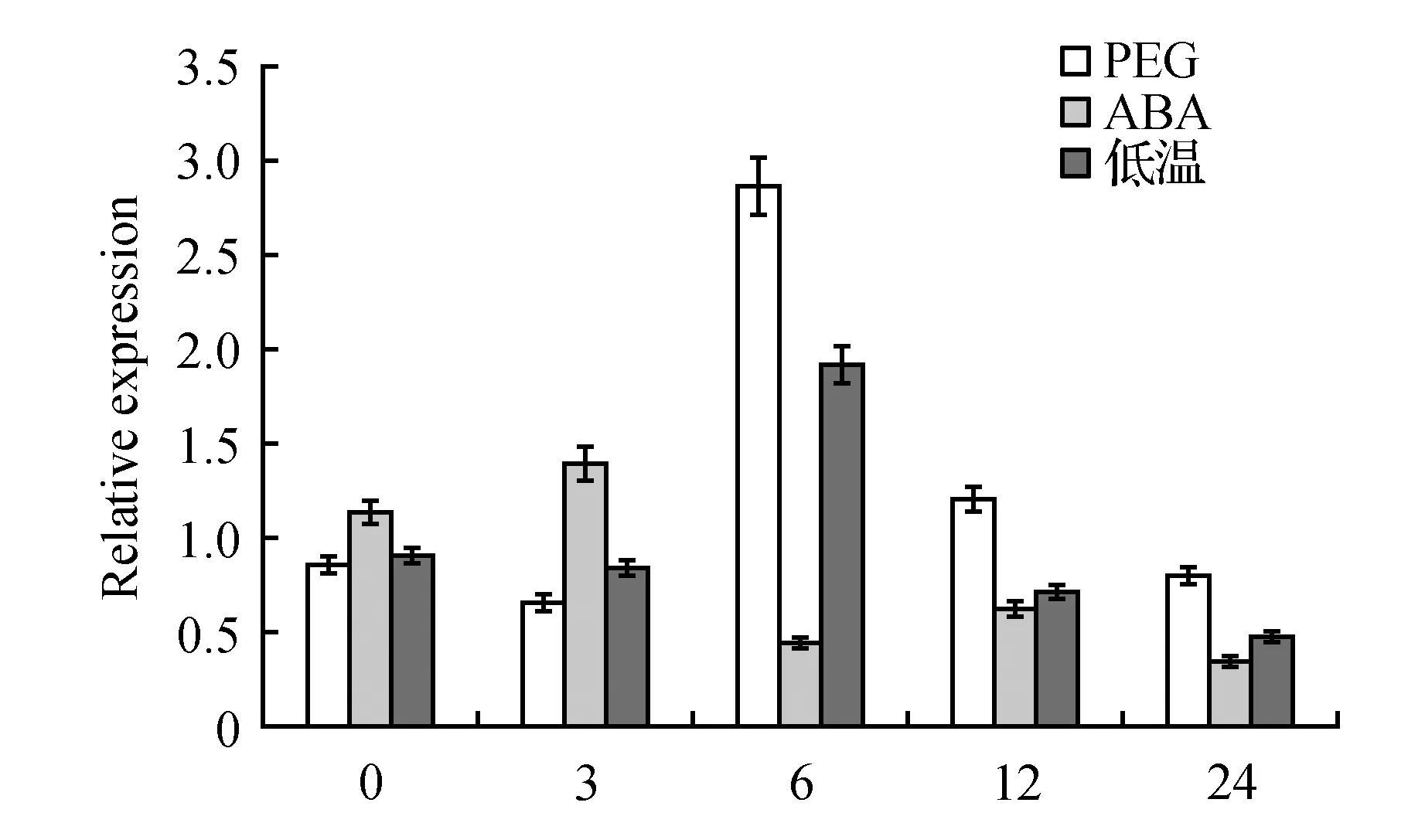
图11 NtCBL1在干旱、ABA和低温处理下的相对表达量Fig.11 Relative expression of NtCBL1 under dry,ABA and low-temperature treatmen
2.5.2干旱、ABA和低温处理下NtCBL1的表达分析
5% PEG6000模拟干旱环境,采用Real Time PCR对NtCBL1在干旱处理下的表达量进行分析。由图11可知,该基因在干旱诱导6 h表达量上升至最大,为对照(0 h)的3.34倍;随后表达量下降。表明NtCBL1基因的表达受干旱诱导。1 μmol·L-1ABA处理后,NtCBL1的表达量3 h上升至最大,为对照(0 h)的1.23倍;随后表达量下降,6 h表达量低于对照;而12 h表达量再次出现上升;24 h表达量下降至对照的31%,因此ABA处理后,NtCBL1的表达量是先上调后降低。低温4℃处理后,对NtCBL1表达量进行定量RT-PCR分析发现:该基因表达受低温诱导,在处理6 h后表达量上升至最大,为对照(0 h)的2.13倍;随后表达量下降,NtCBL1的表达量总体趋势是先上调后降低。
3 讨论
在植物中,生物和非生物胁迫都会引起细胞质内钙离子浓度呈现时空特异性的变化,这种特异钙信号通过各种钙离子结合蛋白传递给下游,从而产生引起植物生理变化的反应。植物CBL家族是研究比较深入的钙离子结合蛋白。目前的文献报道中,对普通烟草CBL基因的研究相对较少,本研究从普通烟草K326中克隆到一个CBL家族成员NtCBL1的cDNA序列,功能保守域分析发现该蛋白含有钙离子结构域EF-hand,这是CBL家族的共同特征之一[14]。氨基酸序列比对及进化树分析发现,NtCBL1与林烟草CBL1、甜辣椒CBL1、番茄CBL1的同源性较高,此外在这些蛋白N端存在一个豆蔻酰化位点MGXXXS/T,该结构的存在可能对其与下游蛋白激酶的结合或定位有关[15]。这对于下一步基因功能研究具有重要指导意义。
亚细胞定位预测结果表明NtCBL1可能定位在微体上,Batistic等的研究表明,AtCBL1亚细胞定位于质膜上[16],吴广宇等发现,野大麦HbCBL1主要定位于质膜和细胞核中[17];Zhang等发现胡杨PeCBL1亚细胞定位在质膜上[18]。不同植物中的CBL基因在亚细胞定位、CIPK相互作用的偏好性以及下游靶蛋白的选择性等特性上都可能存在差异,说明CBL家族功能的复杂性及丰富性。要明确NtCBL1的亚细胞定位和与下游靶蛋白NtCIPK的互作定位,还需要构建GFP融合表达蛋白及双分子荧光互补试验(BiFC)进行验证。
本研究利用Real Time PCR分析NtCBL1在烟草K326不同组织中的表达水平,结果显示,NtCBL1在烟草根中的表达量显著高于叶、茎和花中的表达量,推测NtCBL1可能与根部离子的吸收有关。本研究发现,在低钾和高盐处理下,NtCBL1的表达量明显上升,分别在6和12 h达到最大值,与Li等研究结果一致,茄子SmCBL1在200 mmol·L-1NaCl和100 μmol·L-1低钾处理下,表达量也在6和12 h达到最大值[19]。表明NtCBL1的表达受到低钾和高盐诱导。CBL1响应低钾胁迫的信号转导途径在拟南芥和水稻有所报道:CBL1-CIPK23复合物能调控K+离子通道AKTI所介导的K+吸收途径,维持钾离子平衡[6,20]。NtCBL1基因是否参与这一信号转导途径,可利用电生理实验研究NtCBL1-NtCIPK复合体调控的通道电流,进一步明确NtCBL1在烟草钾营养方面的功能。本研究发现NtCBL1在响应盐胁迫的应答较为敏感,处理6 h后表达量达到峰值。Xu等研究发现甘蓝BoCBL10A在耐盐型和盐敏感两个品种中表达量明显不同,耐盐型BoCBL10A-6较盐敏感型BoCBL10A-3表达量明显更高,对盐胁迫的应答更为迅速[21]。在低钾和高盐胁迫下,胡杨PeCBL1能增强K+的内流,负调控Na+的外排[18],所以我们猜测NtCBL1与烟草耐盐性相关。
本研究还发现烟草NtCBL1在ABA、干旱和低温胁迫下,表达量明显上升,与Chen等研究结果相似,欧洲油菜BnCBL1在ABA、渗透胁迫处理后,表达量也显著上升[22];拟南芥AtCBL1的表达受冷胁迫诱导,并且AtCBL1在调节对冷胁迫应激反应中具有重要作用[23];胡杨PeCBL1的表达也与干旱、冷胁迫相关,其表达量在逆境条件下上升,PeCBL1在逆境胁迫的信号转导中起着重要作用[24]。本研究结果表明CBL1在逆境下的表达特性具有保守性,猜测NtCBL1与模式植物拟南芥AtCBL1类似,在响应逆境胁迫中发挥着作用,要明确NtCBL1参与的信号转导途径还需要进一步的试验验证。已成功构建NtCBL1基因的过量表达载体,后续工作可构建NtCBL1基因的RNAi载体并进行转基因相关研究。
1.司丛丛,刘好宝,曲平治.烟草钾离子通道及转基因烟草抗逆性的研究进展[J].中国农学通报,2010,26(2):45-49.
Si C C,Liu H B,Qu P Z.Research advances in potassium ion channel of tobacco and stress resistance of transgenic tobacco[J].Chinese Agricultural Science Bulletin,2010,26(2):45-49.
2.杨铁钊,鲁黎明,王瑞华.生物技术在我国烟草研究领域的应用[J].中国烟草学报,2006,12(3):39-45.
Yang T Z,Lu L M,Wang R H.Application of biotechnology in tobacco research in China[J].Acta Tabacaria Sinica,2006,12(3):39-45.
3.Hepler P K.Calcium:a central regulator of plant growth and development[J].The Plant Cell,2005,17(8):2142-2155.
4.Luan S,Kudla J,Rodriguez-concepcion M,et al.Calmodulins and calcineurin B-like proteins:calcium sensorsfor specific signal response coupling in plants[J].The Plant Cell,2002,14(S1):S389-S400.
5.Kolukisaoglu U,Weinl S,Blazevic D,et al.Calcium sensors and their interacting protein kinases:genomics of theArabidopsisand rice CBL-CIPK signaling networks[J].Plant Physiology,2004,134(1):43-58.
6.Xu J,Li H D,Chen L Q,et al.A protein kinase,interacting with two calcineurin B-like proteins,regulates K+transporter AKT1 inArabidopsis[J].Cell,2006,125(7):1347-1360.
7.Cheong Y H,Kim K N,Pandey G K,et al.CBL:a calciumsensor that differentially regulates salt,drought,and cold responses inArabidopsis[J].Plant Cell,2003,15(8):1833-1845.
8.Zhou Y L,Cheng Y,Yang Y Q,et al.Overexpression ofSpCBL6,a calcineurin B-like protein ofStipapurpurea,enhanced cold tolerance and reduced drought tolerancein transgenicArabidopsis[J].Molecular Biology Reports,2016,43(9):957-966.
9.Kanwar P,Sanyal S K,Tokas I,et al.Comprehensive structural,interaction and expression analysis of CBL and CIPK complement during abiotic stresses and development in rice[J].Cell Calcium,2014,56(2):81-95.
10.Wang M Y,Gu D,Liut S,et al.Overexpression of a putative maize calcineurin B-like protein inArabidopsisconfers salttolerance[J].Plant Molecular Biology,2007,65(6):733-746.
11.Tang R J,Yang Y,Yang L Y,et al.Poplar calcineurin B-like proteins PtCBL10A and PtCBL10B regulate shoot salt tolerance through interaction with PtSOS2in the vacuolar membrane[J].Plant,Cell & Environment,2014,37(3):573-588.
12.Zhang H F,Yang B,Liu W Z,et al.Identification and characterization of CBL and CIPK gene families incanola(BrassicanapusL.)[J].BMC Plant Biology,2014,14(1):8.
13.Huertas R,Olías R,Eljakaoui Z,et al.Overexpression ofSlSOS2(SlCIPK24) confers salt tolerance to transgenic tomato[J].Plant,Cell &Environment,2012,35(8):1467-1482.
14.Lewit-bentley A,Réty S.EF-hand calcium-binding proteins[J].Current Opinion in Structural Biology,2000,10(6):637-643.
15.Towler D A,Adams S P,Eubanks S R,et al.Myristoyl CoA:protein N-myristoyltransferase activities from ratliver and yeast possess overlapping yet distinct peptide substrate specificities[J].Journal of BiologicalChemistry,1988,263(4):1784-1790.
17.吴广宇,李国婧,王瑞刚,等.野大麦HbCBL1和HbCBL2结构与亚细胞定位分析[J].华北农学报,2011,26(4):1-7.
Wu G Y,Li G J,Wang R G,et al.Analyses for protein structure and subcellular localization of HbCBL1and HbCBL2 fromHordeumbrevisubulatum[J].Acta Agriculturae Boreali-Sinica,2011,26(4):1-7.
18.Zhang H C,Lü F L,Han X,et al.The calcium sensor PeCBL1,interacting with PeCIPK24/25 and PeCIPK26,regulates Na+/K+homeostasisinPopuluseuphratica[J].Plant Cell Reports,2013,32(5):611-621.
19.Li J,Jiang M M,Ren L,et al.Identification and characterization ofCBLandCIPKgene families in eggplant(SolanummelongenaL.)[J].Molecular Genetics and Genomics,2016,291(4):1769-1781.
20.Li J,Long Y,Qi G N,et al.The Os-AKT1 channel is critical for K+uptake in Rice roots and is modulated by the Rice CBL1-CIPK23 complex[J].The Plant Cell,2014,26(8):3387-3402.
21.Xu L,Zhang D Y,Xu Z L,et al.Comparative expression analysis of Calcineurin B-like family geneCBL10Abetween salt-tolerant and salt-sensitive cultivars inB.oleracea[J].Science of the Total Environment,2016,571:1-10.
22.Chen L,Ren F,Zhou L,et al.TheBrassicanapusCalcineurin B-Like1/CBL-interactingproteinkinase6(CBL1/CIPK6)componentis involved in theplant response to abiotic stress and ABA signalling[J].Journal of Experimental Botany,2012,63(17):6211-6222.
23.Huang C L,Ding S,Zhang H,et al.CIPK7 is involved in cold response by interacting with CBL1 inArabidopsisthaliana[J].Plant Science,2011,181(1):57-64.
24.张和臣.逆境条件下胡杨CBL-CIPK信号途径转导的分子机制研究[D].北京:北京林业大学,2010:47-49.
Zhang H C.The molecular mechanism of CBL-CIPK signal transduction pathway under abiotic stess inPopuluseuphratica[D].Beijing:Beijing Forestry University,2010:47-49.
The Foundation of State Key Laboratory of Plant Physiology and Biochemistry,China(SKLPPBKF1505,SKLPPBKF1506)
introduction:ZHANG Xue-Wei(1993—),female,master,mainly engaged in the study of molecular biology of tobacco.
date:2016-12-08
Cloning,ConstructionofExpressionVectorandExpressionAnalysisofNtCBL1inNicotianatabacum
ZHANG Xue-Wei LIU Lun LU Li-Ming LI Li-Qin*
(College of Agronomy,Sichuan Agricultural University,Chengdu 611130)
CBL is a kind of Ca2+sensor, which plays a pivotal role in adaptation or resistance to stress in plants. ACBL1 homologous gene was cloned from the tobacco cultivar K326, which contained a 642 bp ORF encoding 213 amino acid. The predictedmolecular weight was 24.5 kDa and the isoelectric point(pI) was 5.03. By the homology analysis, the gene had high homology with calcineurin B-like protein 1 of theNicotianasylvestris(NsCBL1) andArabidopsisthaliana(AtCBL1), so named asNtCBL1. By bioinformatics analysis, NtCBL1 had the conserved EF-hand calcium binding domain of the CBL family. Expression patterns showed that the gene was expressed in roots, stems, leaves and flowers in mature stage, and the highest expression level in roots.Expression patterns under adversity stress indicated that the gene expression was induced by low-potassium, high-salt,anddrought, ABA and low-temperature, and participated in the response to biological and abiotic stress inNicotianatabacum. The research constructedNtCBL1-pBI121 overexpression vector.The results will provide some basis for the function analysis of NtCBL1 in response to stress.
tobacco;NtCBL1;cloning;sequence analysis;expression
植物生理学与生物化学国家重点实验室开放课题(SKLPPBKF1505,SKLPPBKF1506)
张雪薇(1993—),女,硕士研究生,主要从事烟草分子生物学研究。
* 通信作者:E-mail:liliqin88@163.com
2016-12-08
* Corresponding author:E-mail:liliqin88@163.com
S572
A
10.7525/j.issn.1673-5102.2017.03.009

