鲍鱼来源褐藻胶裂解酶菌株的筛选及发酵条件优化
李云涛,汪立平、2,张孟,张宇
(1.上海海洋大学 食品学院 上海水产品加工及贮藏工程技术研究中心,上海 201306;2.上海海洋大学 食品学院 食品热加工工程技术研究中心,上海 201306)
鲍鱼来源褐藻胶裂解酶菌株的筛选及发酵条件优化
李云涛1,汪立平1、2,张孟1,张宇1
(1.上海海洋大学 食品学院 上海水产品加工及贮藏工程技术研究中心,上海 201306;2.上海海洋大学 食品学院 食品热加工工程技术研究中心,上海 201306)
为筛选得到高效产褐藻胶裂解酶(Alginate lyase)微生物菌株,实现其商业化应用,采用平板透明圈法从皱纹盘鲍Haliotisdiscushannai肠道中筛选得到1株高效产胞外褐藻胶裂解酶的菌株SS-1,在扫描电子显微镜下观察菌株形态和平板菌落特征,并根据其16S rRNA基因序列分析结果,鉴定该菌株为弧菌Vibriosp.SS-1。对SS-1菌株的发酵条件进行优化,结果显示,该菌株最适发酵温度为30 ℃,初始pH值为7.2,培养28 h后酶活力可达38.6 U/mL;通过响应面法优化最佳发酵培养基配方,结果为麦芽糖11.86 g/L、酵母粉16.72 g/L、K2HPO41.36 g/L、MgSO4·7H2O 1.5 g/L、FeSO4·7H2O 0.1 g/L、NaCl 6.75 g/L;在最佳培养条件下,酶活力可达191.8 U/mL,较优化前提高了4.97倍。研究表明:该菌株具有生长快速、酶活较高的特点,可为褐藻寡糖的制备提供技术积累。
褐藻胶裂解酶;褐藻寡糖;海洋弧菌;筛选与鉴定;响应面法
褐藻胶(Alginate)作为一种高分子多糖,广泛存在于海带、海藻、羊栖菜等海洋藻体的细胞壁中,并以褐藻酸盐的形式存在,其分子结构是由α-L-古罗糖醛酸(PolyG)与β-D-甘露糖醛酸(PolyM)通过α/β-1,4糖苷键链接而成的线性多聚合体化合物。褐藻胶裂解酶(Alginate lyase)是以海洋褐藻类中所含褐藻胶为底物制备的具有多功能活性低聚褐藻寡糖的关键酶,对水产养殖业及海藻资源的开发利用具有较高的经济价值。作为一种新型多功能生物酶,褐藻胶裂解酶能通过β-1,4糖苷键的方式进行消除反应,催化褐藻胶等大分子的非还原末端C4,5间不饱和双键,并有效降解褐藻胶,生产制备低聚褐藻寡糖(Alginate-derived oligosaccharide,ADO)。低聚不饱和褐藻寡糖因具有多重功能活性,广泛应用于食品保健[1-2]、医疗医药[3-4]、农业化工[5-8]、生物原料[9]和饲料添加剂[10]等行业中。江晓路等[11]研究表明,以添加褐藻寡糖的饲料喂食海参可提高海参机体免疫力,显示了其在水产养殖业中的巨大潜力。因此,褐藻胶裂解酶在海洋资源的开发利用及水产养殖研究中具有重要价值,已成为当前研究的新热点。
1984年,Hansen等[12]首次从土壤和海水中分离得到一株产褐藻胶裂解酶的芽孢杆菌JBH2,此后,不同来源的菌株开始不断被关注,寻找新的产褐藻胶裂解酶菌株及不同类型的褐藻胶裂解酶成为该领域的研究方向。近年来,诸多研究者从海洋藻类及土壤中发现了产褐藻胶裂解酶菌株,并从马尾藻、巨藻、海带等大型海藻资源中得到了假交替单孢菌PseudoalteromonasQZ-4[13]、嗜盐白蚁菌属IsoptericolaWX[14]、Cobetiasp.WG-007[15]、黄杆菌Flavobacteriumsp.LXA[16]、Flavobacteriumsp.S20和假单胞菌Pseudomonassp.E03[17]、芽孢杆菌BacillusweihaiensisAlg07[18]、产微球茎菌Microbulbifersp.6532A[19]等,但大部分菌株产褐藻胶裂解酶的活力低、发酵周期长,从而无法使产褐藻胶裂解酶菌株应用到实际发酵生产中;此外,在海洋软体动物如皱纹盘鲍Haliotisdiscushannai[20]、欧洲大鲍螺Haliotistuberculata[21]、黑斑海兔Aplysiakurodai[22]、短滨螺Littorinabrevicula[23]等肝胰腺组织消化液中也发现有褐藻胶裂解酶蛋白。与来源于微生物的褐藻胶裂解酶相比,海洋软体动物受其生存环境及自身条件的影响,其分泌得到的褐藻胶裂解酶存在活性低、含量少、专一性差且不稳定等缺陷,不适用于工业生产[13]。因此,在实际研究中筛选得到高产褐藻胶裂解酶的微生物菌株具有更高使用价值。
皱纹盘鲍Haliotisdiscushannai作为植食性海洋软体动物以海藻等藻类植物为主要食物,其肠道中极有可能存在与消化酶共同参与褐藻胶消化及吸收的微生物菌群,而从皱纹盘鲍的肠道中筛选得到高效产褐藻胶裂解酶的菌株尚未见详细报道。本试验中,以皱纹盘鲍肠道内容物作为研究对象,从中筛选高效产褐藻胶裂解酶的菌株,并通过观察菌株菌落形态及采用16S rRNA分子技术对所得菌种进行鉴定,然后用单因素试验优化菌株产酶发酵条件,通过响应面法确定最佳的产酶发酵培养基成分,以期为开发高效产褐藻胶裂解酶菌株提供技术支撑,丰富海洋微生物酶资源,促进海洋资源的开发及商业化应用。
1 材料与方法
1.1材料
1.1.1 样品及药品 皱纹盘鲍及内脏样品采集于上海市浦东新区芦潮港镇水产交易市场;细菌基因组提取试剂盒购自生工生物工程(上海)股份有限公司;海藻酸钠、蛋白胨、酵母粉、麦芽糖等(分析纯)购于上海国药集团。
1.1.2 仪器与设备 试验用仪器主要有GHP-9080型隔水式恒温培养箱(上海一恒科技有限公司);pHS-3C型pH计(上海精密仪器有限公司);A300型梯度PCR仪[杭州朗基科学仪器有限公司(LongGene)];H2050型冷冻离心机(湖南湘仪实验室仪器开发有限公司);UV-2000型紫外分光光度计(美国UNICO公司);S-3400N型扫描电子显微镜[天美(中国)科学仪器有限公司]。
1.1.3 培养基
(1)富集培养基(g/L):海藻酸钠 5.0 g、蛋白胨 2.0 g、葡萄糖 1.0 g,加入过滤后海水 1.0 L,调节培养基初始pH值至7.2。
(2)筛选培养基(g/L):海藻酸钠 5.0 g、(NH4)2SO45.0 g、CaCl20.1 g、琼脂粉12.0 g,加入过滤后海水1.0 L,调节培养基初始pH值至7.2。
(3) 液体发酵培养基(g/L):海藻酸钠 5.0 g、K2HPO42.0 g、(NH4)2SO45.0 g、FeSO4·7H2O 0.1 g、MgSO4·7H2O 2.0 g,NaCl 10.0 g,加入蒸馏水1.0 L,调节培养基初始pH值至7.2。种子培养基与液体发酵培养基为同一培养基。
1.2方法
1.2.1 产褐藻胶裂解酶菌株的筛选 取5.0 g鲜活皱纹盘鲍肠道内容物作为试验样品,加入装有100 mL富集培养基的三角烧瓶中,于30 ℃条件下富集培养48 h,将富集后的样品进行无菌均质5 min (频率为10次/s),梯度稀释至10-6,取各梯度下样品100 μL涂布于以海藻酸钠为唯一碳源的选择性固体培养基平板上,30 ℃ 下恒温培养48 h,待平板长出菌落后,依据单菌落周围形成透明圈的大小,判断菌株降解褐藻胶能力大小。此过程可初步分离得到产褐藻胶裂解酶的疑似菌株。将所得菌株进一步于平板划线分离纯化3次,得到的产褐藻胶裂解酶典型单菌落,分别接种于种子液培养基中振荡培养12 h后,以1.5%的接种量接入装有100 mL发酵培养基的250 mL三角烧瓶中,30 ℃下以120 r/min恒温振荡培养36 h,将菌体发酵液在4 ℃条件下,以12 000 r/min离心20 min,然后取其上清液,用无菌0.22 μm滤膜过滤,得到无细胞发酵上清液,检测产酶活力大小,选择比酶活力(U/mg)最高的菌株作为后续试验菌株。
1.2.2 蛋白质含量的测定 以牛血清白蛋白配制蛋白标准溶液,采用改良Lowry法进行蛋白质含量测定[24]。
1.2.3 酶活力的测定 褐藻胶裂解酶能作用于褐藻胶产生不饱和低聚糖醛酸,在波长为235 nm条件下有强烈吸收峰,可依据吸光值大小来确定酶活力[25]。取0.1 mL发酵上清液与2.9 mL质量浓度为2 g/L的海藻酸钠溶液(0.05 mol/L Tris-HCl缓冲液,pH 7.2)混合均匀,30 ℃下水浴反应20 min后,以灭活的酶液添加相同体积的反应底物作为空白对照,设3组平行试验,用紫外分光光度计于235 nm波长条件下测定其吸光值。
酶活力单位定义为:1 mL酶液在30 ℃恒温条件下,每分钟裂解海藻酸钠反应底物,使其吸光度值增加0.01为一个酶活力单位(U)。
1.2.4 菌种的鉴定
(1)菌株菌落形态观察。以筛选的固体培养基在30 ℃下培养48 h后,观察平板上菌落形态,利用扫描电镜观察菌株形态特征及鞭毛着生情况,参照《常见细菌系统鉴定手册》进行初步鉴定。
(2)16S rRNA分子鉴定[26]。以提取菌株的总DNA为模板进行PCR反应扩增,反应条件为:94 ℃下预变性5 min;94 ℃下变性30 s,55 ℃下退火30 s,72 ℃下延伸1 min,共进行30个循环;最后在72 ℃下再延伸10 min,-20 ℃下保存,送样测序。
将得到的测序结果与从GenBank数据库中的序列进行BLAST对比,并在EzBioCloud网站上找出与之同源性接近的不同菌株序列,应用CLUSTAL、MEGA 5.0等软件进行聚类与同源性分析[27]。遵循邻接法(Neighbor-Joining method)和最大相似法(Maximum Likelihood method)原则,并通过自举分析(boostrap)进行置信度检测,自举数据集为1000次,构建分支系统发育树。
1.2.5 菌株产酶条件的优化 以初始发酵培养基作为菌株SS-1的发酵基础培养基,优化结果用于后续试验。在单因素试验中,通过单一控制变量原则,选择以不同的培养温度(25、30、35、40、45 ℃)、初始pH(5.2、5.7、6.2、6.7、7.2、7.7、8.2、8.7)、接种量(0.5%、1.0%、1.5%、2.0%、2.5%)和摇床转速(120、140、160、180、200、220 r/min)进行考察,以检测不同培养条件下菌株的生物量及产酶活力大小,确定该菌株的最佳产酶条件。所有试验均设3组平行。
1.2.6 菌株生长曲线及产酶曲线的绘制 在发酵培养基中接种3次传代后的菌株SS-1,在优化培养温度、培养基初始pH、接种量和摇床转速等单因素基础上,选择最佳的培养条件进行培养,在菌株生长过程中以每间隔4 h取样一次,测定发酵液的OD600 nm及酶活力值大小,绘制出菌株的生长及产酶曲线。
1.2.7 采用响应面法优化培养基组成
(1)Plackett-Burman(PB)试验设计。在原始发酵培养基的基础上,进行单一控制变量来考察不同碳源、氮源和无机盐对菌株SS-1产酶活力的影响,将其中具有显著性影响的因素作为后续PB试验设计的因素变量。
依据菌株SS-1的生长产酶特点,对影响菌株SS-1产酶活力培养基成分进行优化,主要对碳源、氮源和无机盐3种营养因子进行考察,采用PB法设计11因素2水平试验,以测定出的酶活力值作为试验的响应值,筛选出影响菌株产酶活力的主效因素,试验设计中的高水平(+1)和低水平(-1)的浓度选择是依据单因素试验结果中的最优值进行选择,设计试验因素及编码见表1,按照“1.2.3”
节的试验方法进行产酶活力的测定。
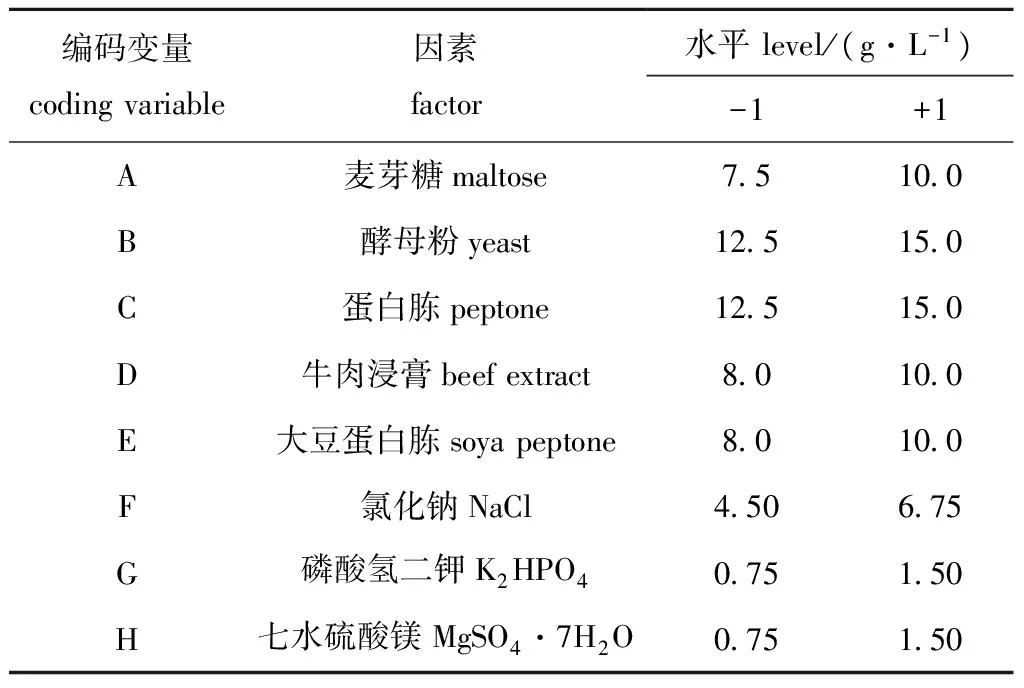
表1 PB试验设计及因素水平Tab.1 Factors and levels of Plackett-Burman design
(2)最陡爬坡试验。由PB试验设计结果分析得到了影响菌株SS-1产酶活力(U/mL)的显著性因素,由各因素的P值大小来判断模型及各个因素的显著性水平,以P<0.05表示模型或因素有显著性影响,P<0.01表示模型或因素有极显著性影响,通过P值大小筛选出影响菌株SS-1产酶活力的显著因素,依据其显著性因素的正负效应及酶活力变化来确定爬坡试验的方向,以各因素的效应值大小来确定变化步长,可更快速、经济地逼近试验最佳区域。
(3)Box-Behnken试验设计。采用二次回归的中心组合试验设计原理,由PB试验确定的显著因素作为设计因素,在最陡爬坡试验结果基础上确定最优水平作为中心水平,依据Box-Behnken试验设计(BBD)方法,通过菌株SS-1的产酶活力最佳值作为响应值,利用Desigen Expert 8.05软件选择N=17的中心组合方案,设计3因素3水平的试验进行优化,试验设计见表2,将所得结果利用分析软件进行响应面回归分析,获得二次回归方程模型进行可行性和方差分析,确定最佳培养基配方,并进行验证性试验。
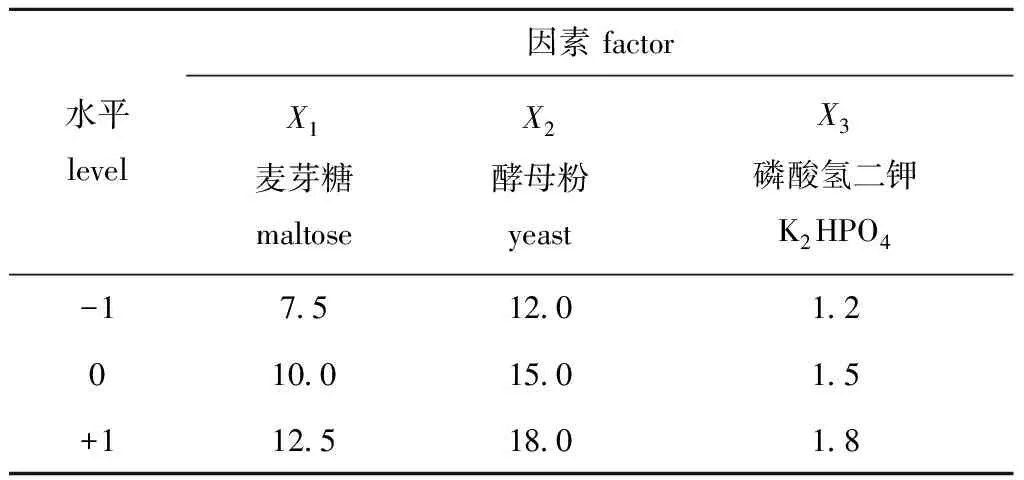
表2 Box-Behnken试验设计及因素水平Tab.2 Factors and levels of Box-Behnken design g/L
2 结果与分析
2.1产褐藻胶裂解酶菌株的筛选
通过初筛条件将海藻酸钠作为唯一碳源的选择性培养基,从鲍鱼肠道内容物中筛选出了8株产胞外褐藻胶裂解酶菌株(分别编号为A、B、C、K、L、M、SS-1、Y),通过振荡摇床发酵培养,测定不同菌株发酵上清液的酶活力大小及蛋白质含量,结果如表3所示。其中,SS-1编号菌株的比酶活力最高,且经过多次传代培养后,其遗传稳定性及产酶活力稳定,将此菌株作为目标菌株,进行后续试验鉴定及产酶条件优化研究。
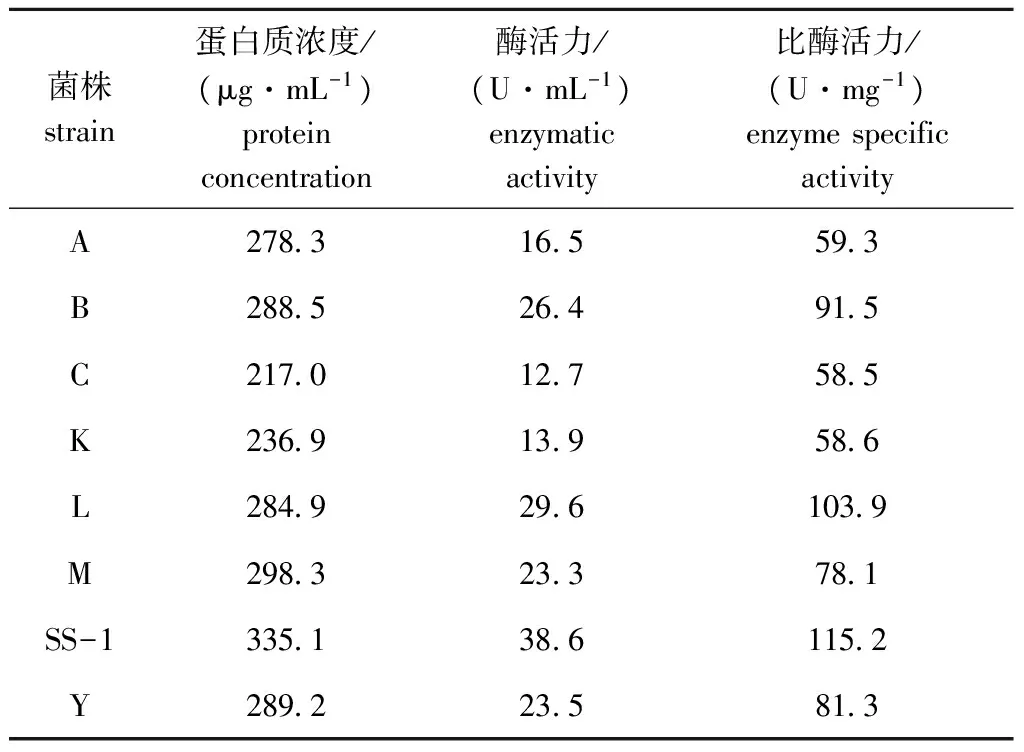
表3 不同菌株产褐藻胶裂解酶活力、蛋白质浓度和比酶活力大小比较Tab.3 The alginate lyase activity, protein concentration and enzyme specific activity in different strains
2.2菌种的鉴定
菌株SS-1在初筛平板上培养48 h后,菌体周围产生明显水解透明圈,单菌落呈不透明圆形,颜色微白泛淡黄色,直径约2 mm,边缘整齐、表面光滑、湿润,稍有隆起,革兰氏染色显示为阴性菌。在扫描电子显微镜放大倍数为15 000倍下观察,结果如图1所示,该菌株呈长弯杆状,无鞭毛,无孢子形成,具有典型弧菌形态特征,根据《常见细菌系统鉴定手册》初步鉴定为弧菌。
通过分子生物学手段,测得菌株SS-1的16S rRNA基因序列为1456 bp(GenBank 登录号:KX266239),经过序列对比,发现其16S rRNA与弧菌属菌株的相似性最高,为99%,依据16S rRNA序列构建系统发育树聚类分析,与Vibriosp.SA2在同一分支上(图2),结合菌株的形态学特征观察,故将其鉴定为Vibriosp.属,并命名为Vibriosp.SS-1。

图1 菌株SS-1扫描电镜照片Fig.1 Scanning electron micrographs of strain SS-1

图2 菌株SS-1的16S rRNA序列系统发育树Fig.2 Phylogenetic tree based on 16S rRNA sequence of bacterial strain SS-1
2.3菌株产酶条件的优化
2.3.1 温度对产酶的影响 从图3可见,温度直接影响菌体的生长及产酶,菌株SS-1产酶在温度为30 ℃时其产酶活力和菌体生物量均达到最大值,因此,菌株SS-1产酶的最适温度为30 ℃。与Fu等[27]报道的海洋环境中产褐藻胶裂解酶菌株的最适生长温度范围为25~30 ℃的结论相吻合。

图3 温度对菌株SS-1生长及酶活力的影响Fig 3 Effect of temperature on growth and enzyme activity of strain SS-1
2.3.2 初始pH对产酶的影响 从图4可见:随着pH值的增加,菌株SS-1的生长及产酶均呈先增高后降低的趋势;当pH值达到7.0~7.5时,菌株产酶活力较高,当pH值为7.2时产酶达到最大值,而过高或过低的pH值直接影响到细胞膜的电位变化,并控制菌株的代谢过程,均不利于菌株SS-1的生长及产酶。因此,该菌株最佳产酶条件的初始pH值为7.2。

图4 pH对菌株SS-1生长及酶活力的影响Fig.4 Effect of pH on growth and enzyme activity of strain SS-1
2.3.3 接种量对产酶的影响 从图5可见:随着接种量的增加,菌株SS-1的生长呈现出一定的正相关性;接种量为1.5%时,菌株生物量达最大值,当接种量继续增加时,菌株生物量反而有所降低且对酶活力影响不明显。故综合考虑,该菌株产酶的最佳接种量为1.5%。

图5 接种量对菌株SS-1生长及酶活力的影响Fig.5 Effect of inoculum concentration on growth and enzyme activity of strain SS-1
2.3.4 摇床转速对产酶的影响 从图6可见:随着摇床转速的不断增加,菌株的生物量也呈现逐渐增加的趋势;当摇床转速达到220 r/min时,菌株的生长逐渐趋于稳定,同时可以看出,摇床转速的改变对其产酶活力并无较大影响。分析其原因,可能在于摇床转速的增加有助于培养基中溶氧量的提高,从而使得菌株生长快速,但转速的改变对其产酶活力并无较大影响。魏丹等[14]在探究IsoptericolahalotoleransWX的产酶条件时也呈现出了类似规律。结合实际情况,后续试验选择摇床转速为180 r/min作为发酵条件。

图6 摇床转速对菌株SS-1生长及酶活力的影响Fig.6 Effect of rotate speed on growth and enzyme activity of strain SS-1
2.3.5 菌株SS-1的生长曲线及产酶曲线 从图7可见:菌体的生长随着时间的延长,在28 h后开始进入稳定生长期,菌株生物量接近最大值,此时酶活力达到最高值,为38.6 U/mL,与已报道的弧菌Vibriosp.YKW-34[28]、Vibriosp.QY107[29]等菌株相比较,菌株SS-1的发酵产酶周期更短,生产速度较快,在工业化生产中,极大缩短了发酵时间,从而降低了杂菌污染的风险,节约了经济成本,具有较大的优势。
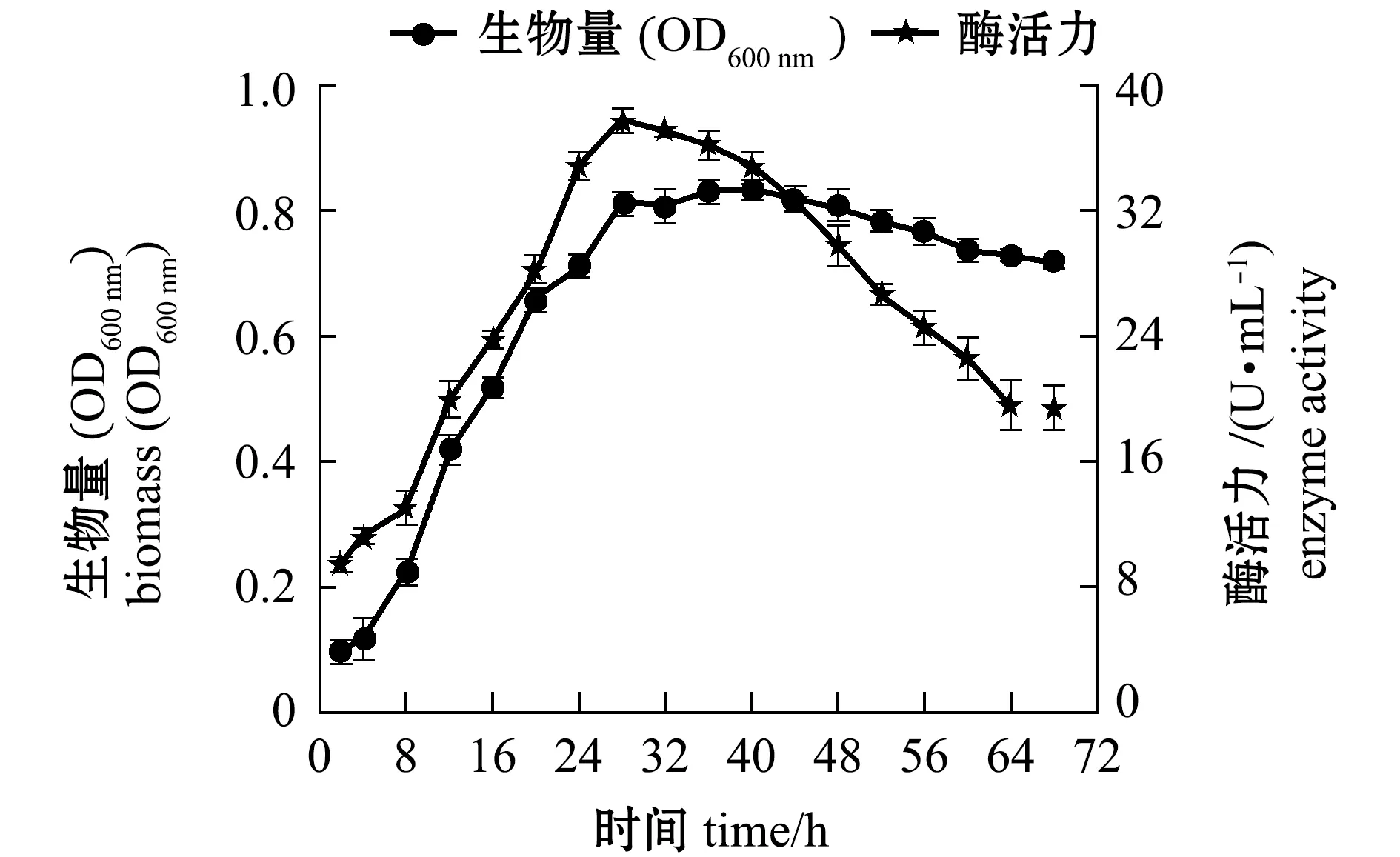
图7 菌株SS-1的生长曲线及发酵酶活力曲线Fig.7 Growth curve and enzyme activity of of strain SS-1
2.4响应面法优化培养基的结果


表4 PB试验设计及响应值Tab.4 The design and response values in Plackett-Bueman experiment
注:表中α1、α2、 α3为试验设计中的3个虚拟因子
Note:the α1, α2and α3are three virtual factors in designs of the test
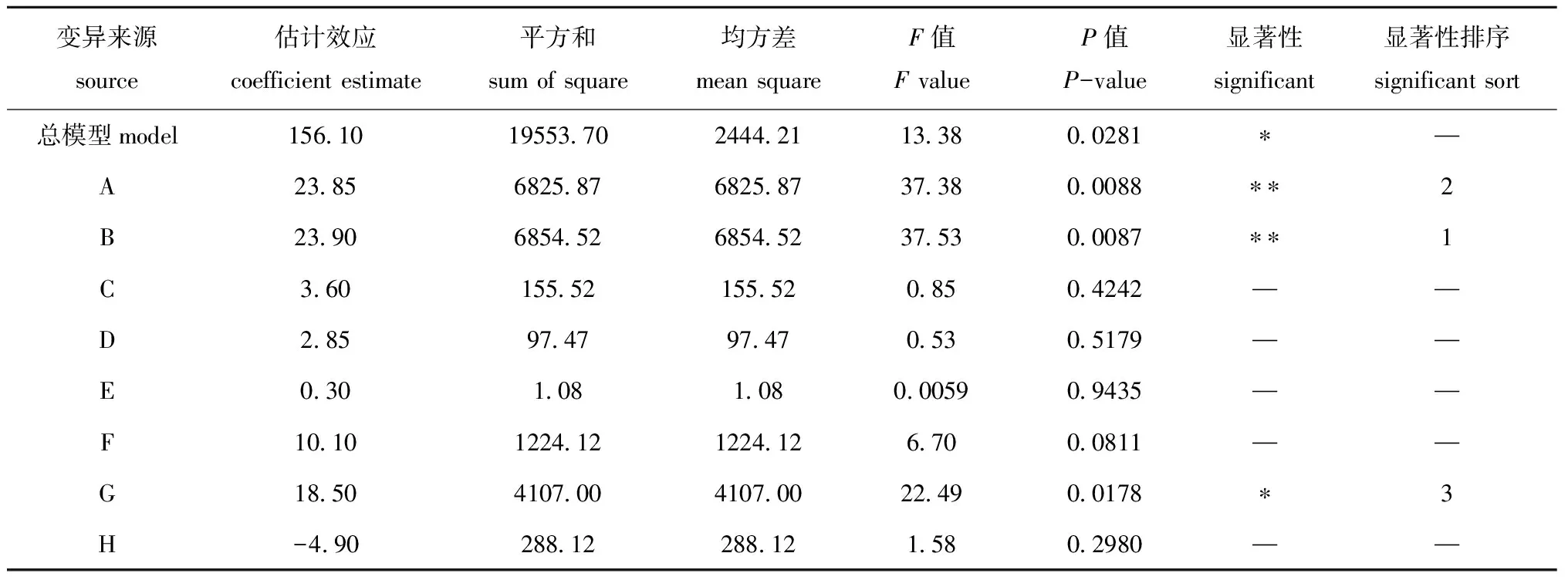
表5 各因素对响应值的显著性检验结果Tab.5 Significance testing results of all factors
注:**表示对试验结果有极显著影响(P<0.01),*表示对试验结果有显著性影响(P<0.05),下同
Note:**means very significant influence on the results of the experiment (P<0.01), * means significant influence on the results of the experiment (P<0.05), et sequentia
2.4.2 最陡爬坡试验结果 由PB试验拟合的一阶回归方程可知,麦芽糖、酵母粉和磷酸氢二钾的系数均为正值,说明这3个因素对菌株SS-1的产酶影响具有正效应,因此,依据步长以PB试验中的零水平开始沿着这3因素增大的方向移动,设计最陡爬坡试验。由表6可见:当麦芽糖为10.0 g/L、酵母粉为15.0 g/L、磷酸氢二钾为1.50 g/L时,菌株SS-1的产酶活力达到最高(200.1 U/mL),因此,将第5组水平作为中心复合设计试验(BBD)的中心点进行进一步优化。


表6 最陡爬坡试验设计及结果Tab.6 Design and results of steepest ascent experiment

表7 Box-Behnken试验设计编码表及响应值Tab.7 Design code table and response values of Box-Behnken experiment
利用Design-Expert 8.05软件对回归方程中的X1X2、X1X3、X2X3绘制响应面分析图,得到3因素交互作用的曲面图(图8~图10)。可以看出,3因素交互作用的曲面图均为开口向下的凸型曲面,有极大值点,说明试验存在最大酶活力点。比较图8和图9可以看出,图8响应面陡峭程度最高,这说明麦芽糖和酵母粉的交互作用对菌株SS-1的产酶活力影响最为显著。图10直观显示出了酵母粉与磷酸氢二钾两者对菌株SS-1的产酶活力也有较大影响。分析可能的原因是麦芽糖及酵母粉作为菌株生长中不可或缺的碳源及氮源,两者的比例直接影响着菌株Vibriosp.SS-1的代谢过程,其代谢产物的积累与酶活力存在显著相关,磷酸氢二钾作为无机盐成分,主要是为其生长环境提供一定的缓冲,维持菌株生长pH的平衡。
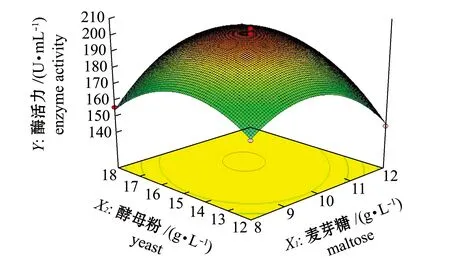
图8 麦芽糖与酵母粉交互作用的响应面曲面图Fig.8 Response surface plots showing the interactivity of both maltose and yeast extract

图9 麦芽糖与磷酸氢二钾交互作用的响应面曲面图Fig.9 Response surface plots showing the interactivity of both maltose and K2HPO4

图10 酵母粉与磷酸氢二钾交互作用的响应面曲面图Fig.10 Response surface plots showing the interactivity of both yeast extract and K2HPO4

表8 回归方程的方差分析及参数估计Tab.8 Variance analysis and parameter estimation for the regression equation
2.5最佳发酵条件的验证
通过响应面试验数据分析,对所得回归方程进行求解,利用Design-Expert 8.05软件预测得到菌株SS-1的最佳产酶条件为麦芽糖11.86 g/L、酵母粉16.72 g/L、磷酸氢二钾1.36 g/L,其他条件为MgSO4·7H2O 1.5 g/L、FeSO4·7H2O 0.1 g/L、NaCl 6.75 g/L。设计验证试验并设置5组平行,测得菌株SS-1的实际产酶活力值为191.8 U/mL,与理论预测值193.04 U/mL的误差较小,说明优化后的回归方程对预测菌株SS-1的产酶活力具有可靠性。
3 讨论
3.1产酶菌株SS-1的筛选及发酵条件的优化
褐藻胶是海洋大型褐藻类植物细胞壁的主要成分,通过生物降解可得到具有多种功能活性的褐藻寡糖,包括半乳糖、木糖、糖醛酸、甘露糖等,褐藻胶具有多种功能活性[30],应用价值极高。褐藻胶裂解酶作为降解褐藻胶的关键酶,对实现海洋藻类资源的高值化利用具有重要意义。当前能得到的褐藻胶裂解酶菌株种类多、来源广,但受到菌株发酵产酶周期长、产酶活力低等诸多不利因素的影响[14,18],褐藻胶裂解酶菌株的工业化应用受到了极大地限制。
本研究中从皱纹鲍鱼肠道中筛选得到高效产褐藻胶裂解酶菌株SS-1,经16S rRNA鉴定为海洋弧菌Vibriosp.SS-1,该菌最佳产酶周期为28 h,酶活力可达38.6 U/mL。与Fu等[28]和郭恩文等[29]筛选得到的产酶菌株相比较,本试验中得到的菌株SS-1具有生长速度快、发酵时间短等明显优势(图7),可为实现工业化发酵褐藻胶制备功能性低聚寡糖提供技术支撑,并能降低发酵过程的生产成本。同时作者通过对菌株厌氧培养发酵表明,该菌在无氧环境中也能生长并分泌褐藻胶裂解酶(该数据本文未列出),与魏丹等[14]和刘旭梅等[15]得到的好氧性产酶菌相比,菌株SS-1还具有一定的极端低氧环境适应性能力,这可能与该菌株来自于鲍鱼肠道低氧环境有关,但是具体的调控机制还需后续试验进行深入分析。
此外,本试验中将菌株SS-1置于以海藻酸钠作为唯一碳源的液体培养基中进行培养发酵,收集发酵液离心后,在上清液中检测到大量酶蛋白(表3),验证了SS-1是产胞外褐藻胶裂解酶菌株,可以实现褐藻胶的胞外降解。鲍鱼等植食性海洋动物主要以马尾藻、海带、大叶藻等大型海藻及沉积物为食[31],其体内极有可能存在降解褐藻胶的微生物菌群,可以分泌胞外褐藻胶裂解酶,降解褐藻胶为小分子,促进肠道吸收,并可因其酶解产物得到的褐藻寡糖提高水产动物机体免疫力[11]。因此,菌株SS-1可作为微生态制剂的潜在菌株[32]应用于水产养殖中。
3.2响应面法优化菌株SS-1的最佳发酵培养基
响应面分析法作为微生物发酵培养基优化的经典方法,比传统的正交试验与单因素试验具有更大的优势。本试验中,采用响应面法确定了菌株SS-1的最佳发酵培养基,使优化后菌株的酶活力达191.8 U/mL,酶活力比优化前提高4.97倍,与李恒等[33]、王霁宁等[34]、严芬等[35]、吴海哥等[36]和刘旭梅等[15]的研究结果相比,菌株SS-1的酶活力更高。此外,从试验中还发现,将菌株SS-1的培养基配方中最佳碳源替换为麦芽糖时,产酶活力提高(表7),与刘旭酶等[15]分离的Cobetiasp.WG-007,陈朋等[18]分离的BacillusweihaiensisAlg07,侯士昌等[37]筛选的Alteromonassp.H4为诱导酶产生菌相比,菌株SS-1可不受诱导底物限制,从而更具产褐藻胶裂解酶优势。但本试验中仅以摇瓶培养作为发酵条件,未经过大批量放大培养验证,后续会选择发酵罐模拟工业发酵条件进一步确定菌株SS-1的工业参数,为工业应用奠定基础。此外,关于酶学性质及酶底物专一性还需深入研究,以便更好地实现褐藻胶裂解酶的商业化应用。
综上所述,菌株SS-1可以作为一株具有潜在应用价值的高效产褐藻胶裂解酶的新菌株培养,为实现褐藻寡糖的工业化生产提供新酶源微生物资源,使其成为以藻类为食的海洋动物养殖用饲料的潜在微生态添加剂,为促进海洋资源的深加工利用发挥作用。
[1] 吴国锋,秦燕霞,王伟,等.褐藻胶寡糖制备及其对啤酒污染菌抑制的研究[J].中国食品添加剂,2015(6):130-133.
[2] 马路凯,张宾,王晓玲,等.海藻糖、海藻胶及寡糖对蒸煮南美白对虾的抗冻保水作用[J].食品科学,2015,36(16):266-271.
[3] Otterlei M,Ostgaard K,Skjåk-Braek G,et al.Induction of cytokine production from human monocytes stimulated with alginate[J].Journal of Immunotherapy,1991,10(4):286-291.
[4] Tusi S K,Khalaj L,Ashabi G,et al.Alginate oligosaccharide protects against endoplasmic reticulum-and mitochondrial-mediated apoptotic cell death and oxidative stress[J].Biomaterials,2011,32(23):5438-5458.
[5] Iwasaki K,Matsubara Y.Purification of alginate oligosaccharides with root growth-promoting activity toward lettuce[J].Bioscience,Biotechnology,and Biochemistry,2014,64(5):1067-1070.
[6] Xu Xu,Iwamoto Y,Kitamura Y,et al.Root growth-promoting activity of unsaturated oligomeric uronates from alginate on carrot and rice plants[J].Bioscience,Biotechnology,and Biochemistry,2003,67(9):2022-2025.
[7] Luan L Q,Nagasawa N,Ha V T T,et al.Enhancement of plant growth stimulation activity of irradiated alginate by fractionation[J].Radiation Physics and Chemistry,2009,78(9):796-799.
[8] 刘航.褐藻胶寡糖提高小麦抗旱能力的初步研究[J].天然产物研究与开发,2015,27(9):1520-1525.
[9] Wargacki A J,Leonard E,Win M N,et al.An engineered microbial platform for direct biofuel production from brown macroalgae[J].Science,2012,335(6066):308-313.
[10] 潘金露.饲料中壳寡糖和褐藻酸寡糖对大菱鲆(Scophthalmusmaximus)消化及肠道菌群的影响[D].大连:大连海洋大学,2016.
[11] 江晓路,杜以帅,王鹏,等.褐藻寡糖对刺参体腔液和体壁免疫相关酶活性变化的影响[J].中国海洋大学学报,2009,39(6):1188-1192.
[12] Hansen J B,Doubet R S,Ram J.Alginase enzyme production by Bacillus circulans[J].Applied and Environment Microbiology,1984,47(4):704-709.
[13] 汤海青,欧昌荣,郑晓冬.1株产褐藻胶裂解酶海洋细菌的分离鉴定及其酶学性质[J].浙江大学学报:农业与生命科学版,2013,39(4):387-395.
[14] 魏丹,窦文芳,李恒,等.高效降解褐藻胶新菌种的筛选、鉴定及产酶条件优化[J].食品与发酵工业,2012,38(7):26-31.
[15] 刘旭梅,李恒,蒋敏,等.产褐藻胶裂解酶菌株Cobetiasp.WG-007的筛选及发酵优化[J].食品与生物技术学报,2014,33(9):903-909.
[16] An Q D,Zhang G L,Wu H T,et al.Alginate-deriving oligosaccharide production by alginase from newly isolatedFlavobacteriumsp.LXA and its potential application in protection against pathogens[J].Journal of Applied Microbiology,2009,106(1):161-170.
[17] 黄李淑馨,刘钢,岳敏,等.产褐藻胶裂解酶菌株的分离与鉴定[J].食品工业科技,2013,34(23):147-151.
[18] 陈朋,朱玥明,韩文佳,等.产褐藻胶裂解酶菌种的筛选、鉴定及发酵条件优化[J].食品科学,2015,36(15):105-111.
[19] Swift S M,Hudgens J W,Heselpoth R D,et al.Characterization of AlgMsp,an alginate lyase fromMicrobulbifersp.6532A[J].PLoS One,2014,9(11):e112939.
[20] Suzuki H,Suzuki K I,Inoue A,et al.A novel oligoalginate lyase from abalone,Haliotisdiscushannai,that releases disaccharide from alginate polymer in an exolytic manner[J].Carbohydrate Research,2006,341(11):1809-1819.
[21] Heyraud A,Colin-Morel P,Girond S,et al.HPLC analysis of saturated or unsaturated oligoguluronates and oligomannuronates.Application to the determination of the action pattern ofHaliotistuberculataalginate lyase[J].Carbohydrate Research,1996,291:115-126.
[22] Rahman M M,Inoue A,Tanaka H,et al.cDNA cloning of an alginate lyase from a marine gastropodAplysiakurodaiand assessment of catalytically important residues of this enzyme[J].Biochimie,2011,93(10):1720-1730.
[23] Rahman M M,Wang Ling,Inoue A,et al.cDNA cloning and bacterial expression of a PL-14 alginate lyase from a herbivorous marine snailLittorinabrevicula[J].Carbohydrate Research,2012,360:69-77.
[24] 闫萍,杨琦,王惠珍,等.改良Lowry法和Bradford法测定蚯蚓提取物中蛋白质含量的比较[J].山西医科大学学报,2006,37(1):9-11.
[25] 吴志宏.海洋弧菌(Vibriosp.H)褐藻胶裂解酶的特性及对褐藻胶酶解产物的研究[D].青岛:中国海洋大学,2009.
[26] 马悦欣,纪涛,李慧琼,等.假交替单胞菌LJ1菌株产褐藻胶裂解酶的培养条件优化及酶学性质[J].微生物学报,2009,49(8):1086-1094.
[27] Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[28] Fu Xiaoting,Lin Hong,Moo K S.Optimization of culturing condition and medium composition for the production of alginate lyase by a marineVibriosp.YKW-34[J].Journal of Ocean University of China,2008,7(1):97-102.
[29] 郭恩文,王亚,于文功,等.产双功能褐藻胶裂解酶菌株的筛选与初步研究[J].现代生物医学进展,2013,13(29):5606-5609.
[30] 张海霞,汪秋宽,何云海,等.马尾藻褐藻多糖硫酸酯的分离纯化及结构研究[J].大连海洋大学学报,2016,31(5):559-562.
[31] 殷旭旺,李文香,白海锋,等.不同海藻饲料对刺参幼参生长的影响[J].大连海洋大学学报,2015,30(3):276-280.
[32] 刘朝阳,孙晓庆,范士亮.有益微生物在刺参养殖中的综合应用[J].中国水产,2006(7):58-59.
[33] 李恒,朱思婷,刘旭梅,等.褐藻胶裂解酶产生菌的分离鉴定及产酶发酵优化[J].中国生物工程杂志,2014,34(9):94-101.
[34] 王霁宁,严孝强,杜宗军.一株高效褐藻胶降解菌的筛选及其发酵条件的优化[J].中国酿造,2012,31(5):7-10.
[35] 严芬,连燕萍,杨光,等.高产褐藻胶裂解酶菌株的筛选及发酵条件优化[J].食品工业科技,2015,36(22):287-292.
[36] 吴海歌,张玉娟,罗福文,等.海藻酸钠降解菌的筛选及其发酵条件的优化[J].食品科技,2014,39(8):31-36.
[37] 侯士昌,温少红,唐志红,等.一株高效褐藻酸降解菌的筛选、鉴定及其发酵条件的优化[J].海洋科学,2014,38(7):20-26.
Screeningofalginatelyase-producingmicroorganismsandoptimizationoffermentationconditionsindiscabalone
LI Yun-tao1, WANG Li-ping1,2, ZHANG Meng1, ZHANG Yu1
(1. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China; 2. Engineering Research Center of Food Thermal-processing Technology, College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China)
A bacterial strain producing alginate lyase named SS-1 was isolated from intestine of disc abaloneHaliotisdiscushannaiusing sodium alginate as the sole carbon source on agar medium by transparent circle method, and initially identified asVibriosp. by morphological observation and 16S rRNA gene sequence analysis in order to screen biodegradable alginate lyase microbial strain. The best fermentation of SS-1 producng the aximal activity of alginate enzyme was observed under conditions of 30 ℃, initial pH 7.2 with activity of about 38.6 U/mL in 28 h. The optimization by a response surface methodology revealed that the optimal fermentation medium of SS-1 was comprised of maltose 11.86 g/L, yeast extract 16.72 g/L, K2HPO41.36 g/L, MgSO4·7H2O 1.5 g/L, FeSO4·7H2O 0.1 g/L, and NaCl 6.75 g/L. The supernatant of strain SS-1 had activity of 191.8 U/mL in optimized medium, 4.97 times higher compared with the basic medium, indicating that strain SS-1 is of a potential strain for alginate-derived oligosaccharide (ADO) industrial fermentation.
alginate lyase; alginate-derived oligosaccharide; marineVibrio; screening and identification; response surface methodology
10.16535/j.cnki.dlhyxb.2017.05.012
2095-1388(2017)05-0574-10
Q815
A
2017-02-23
上海市科学技术委员会工程中心建设项目(11DZ2280300)
李云涛(1991—),男,硕士研究生。 E-mail:1176452076@qq.com
汪立平(1968—),女,博士,副教授。 E-mail:lpwang@shou.edu.cn

