免疫防御酶类:海洋动物L-氨基酸氧化酶的研究进展
侯玉林,高延奇,金士博,李安兴,黎睿君
(1.大连海洋大学 农业部北方海水增养殖重点实验室,大连市海珍品疾病防控重点实验室,辽宁 大连 116023;2.中山大学 有害生物控制与资源利用国家重点实验室, 水产品安全教育部重点实验室, 广东 广州 510275)
免疫防御酶类:海洋动物L-氨基酸氧化酶的研究进展
侯玉林1,高延奇1,金士博1,李安兴2,黎睿君1
(1.大连海洋大学 农业部北方海水增养殖重点实验室,大连市海珍品疾病防控重点实验室,辽宁 大连 116023;2.中山大学 有害生物控制与资源利用国家重点实验室, 水产品安全教育部重点实验室, 广东 广州 510275)
L-氨基酸氧化酶(L-amino acid oxidase,LAAO)是一类以黄素腺嘌呤二核苷酸(FAD)或黄素单核苷酸(FMN)为辅酶的黄素蛋白酶, 该酶具有明显的抑菌、抗病毒、杀灭寄生虫、诱导细胞凋亡和细胞毒性等生物学功能。LAAO在自然界分布广泛,以有关蛇毒源LAAO研究最为深入,但有关海洋动物LAAO的报道与研究尚处于起步阶段。本研究中对海洋动物LAAO的结构特征、相对分子质量、等电点、氧化催化特异性、热稳定性、组织分布、生物学功能和异源表达等方面进行综述,旨在为后续海洋动物LAAO的进一步研究提供参考。
L-氨基酸氧化酶(LAAO);海洋动物;理化特性;生物学功能;组织分布;异源表达
L-氨基酸氧化酶(L-amino acid oxidase,LAAO)是一类以黄素腺嘌呤二核苷酸(FAD)或黄素单核苷酸(FMN)为辅酶的黄素蛋白酶,该酶能够立体特异性催化L-氨基酸氧化脱氨生成α-酮酸、氨和H2O2[1-2]。研究表明,LAAO具有抗病毒、抗细菌、抗真菌、杀寄生虫和抗肿瘤等生物学功能[3-8]。在自然界中LAAO分布广泛,细菌、真菌、藻类、蛇类、鱼类和哺乳动物类中均已有报道[5,9-12],其中,对蛇毒源LAAO的研究最为深入。目前,已发现海洋动物LAAO具有抑制细菌的生长、杀灭病原寄生虫和诱导肿瘤细胞凋亡的生物学功能(表1)。Nagashima等[13]报道,从许氏平鮋Sebastesschlegeli黏液中分离纯化出的LAAO,对杀鲑气单胞菌Aeromonassalraonicida、美人鱼发光杆菌Photobacteriumdamselae和腐败希瓦氏菌Shewanellaputrefaciens等革兰氏阴性细菌具有显著的抑制作用;Wang等[14]研究表明,从黄斑蓝子鱼Siganusoramin血清中分离的LAAO对刺激隐核虫Cryptocaryonirritans、多子小瓜虫Ichthyophthiriusmultifiliis、布氏锥虫Trypanosomabrucei具有强烈的杀灭作用;Iijima等[15]报道,从截尾海兔Dolabellaauricularia蛋白腺分泌物中纯化到的LAAO可诱使小鼠淋巴瘤细胞EL-4凋亡,推测其具有抗肿瘤作用。本研究中,综述了目前有关海洋动物LAAO的研究进展,并对存在问题及后续研究进行了展望,旨在为海洋动物源LAAO的深入研究提供参考。
1 海洋动物LAAO的基本特征
1.1结构特征、分子质量和等电点
LAAO多由两个非共价结合的亚基组成,亚基相对分子质量范围为52 000~85 000,如许氏平鮋黏液LAAO为同源二聚体结构,亚基相对分子质量为53 000[16]。对三聚体和四聚体结构的海洋动物LAAO也有报道,如黑斑海兔Aplysiakurodai卵的匀浆液上清中分离出由3个不同亚基组成的LAAO,相对分子质量为250 000[17];用蛋白质谱分析黄斑蓝子鱼LAAO的单体相对分子质量约为61 700,非变性凝胶电泳的结果显示其为同源四聚体结构[14]。研究表明,海洋动物LAAO具有3个结构域:FAD结合域、底物结合域和螺旋域[2,11-12],从斑点海兔Aplysiapunctata墨汁、大西洋鳕鱼Gadusmorhua黏液中分离的LAAO证实了其单体结构中具有辅酶FAD及FAD结合域[18-19]。海洋动物LAAO的相对分子质量范围在93 000~150 000[12],关于其晶体结构的报道匮乏。目前的研究中海洋动物LAAO等电点在4.0~6.2之间[13-14,18-20],偏酸性。
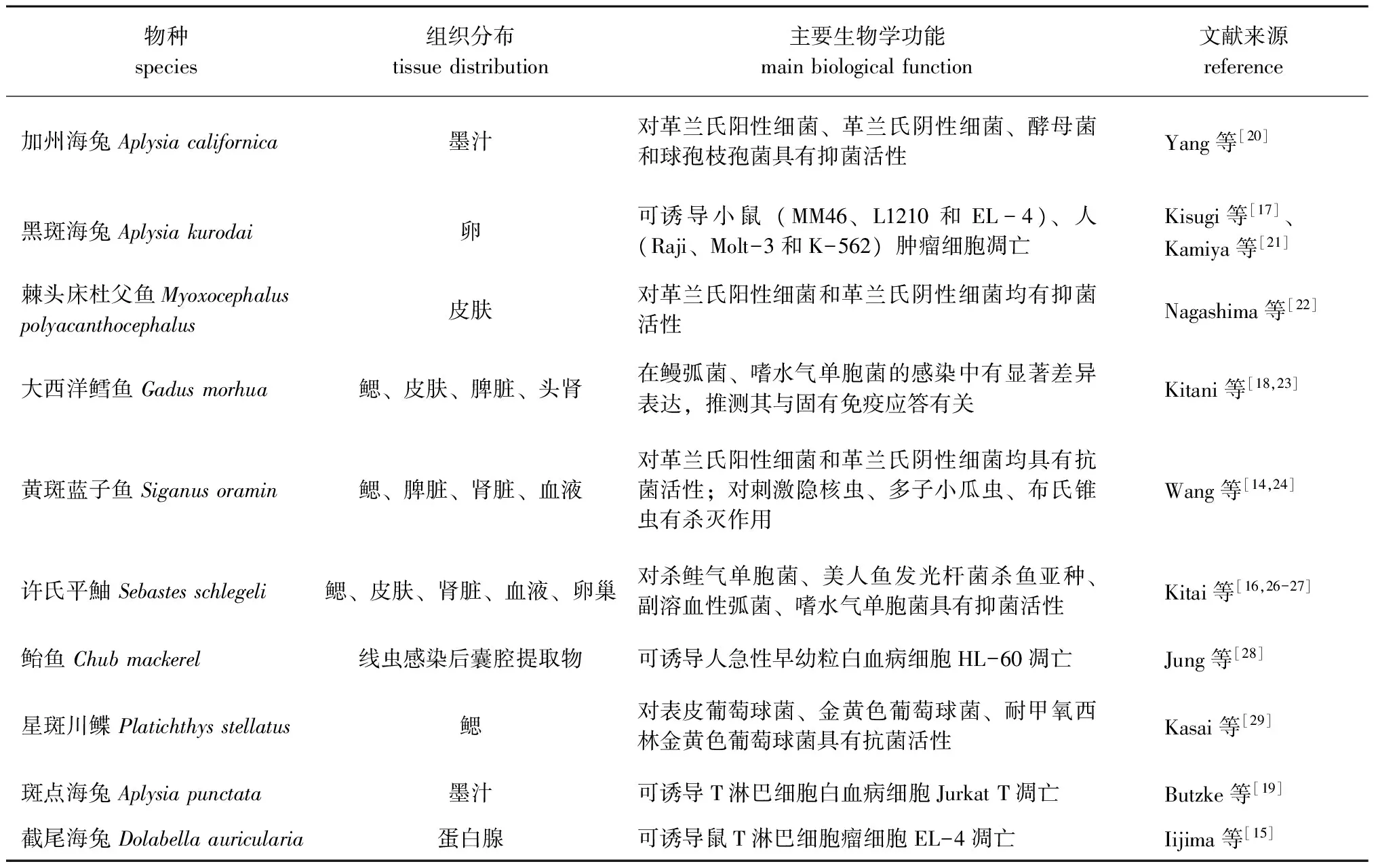
表1 海洋动物LAAO的组织分布及主要生物学功能Tab.1 Tissue distribution and principal biological functions of L-amino acid oxidase isolated from marine animals
1.2氧化催化特异性
L-氨基酸氧化酶在自然界分布较为广泛,不同物种来源的LAAO催化底物范围具有差异,关于海洋动物LAAO的氧化催化活性机制有待进一步验证和深入研究。已有调查表明,海洋动物LAAO对氨基酸的氧化催化活性谱较窄,如从许氏平鮋黏液[13]和加州海兔Aplysiacalifornica墨汁[20]中分离出的LAAO只检测到对L-赖氨酸具有氧化催化活性;从斑点海兔墨汁中分离出的LAAO[19]只对L-赖氨酸和L-精氨酸具有氧化催化特异性。
1.3热稳定性
海洋动物LAAO能够在较广的温度范围内保持活性,当环境温度超过其阈值上升时,酶的活性随之下降。研究表明,斑点海兔LAAO保持活力稳定的温度范围为0~50 ℃,当温度升至60 ℃时,酶活性减少80%,温度达到70 ℃时该酶失去活性[19]。此外,部分海洋动物LAAO在室温下亦可保持较长时间的生物学活性。Yang等[20]从加州海兔墨汁中纯化出的LAAO室温存放5个月后依然保持其抑菌能力。
2 海洋动物LAAO的组织分布
海洋动物LAAO集中分布在生物体的皮肤、鳃、脾脏和肾脏中。Kitani等[18]利用RT-PCR技术在大西洋鳕鱼的皮肤、鳃、脾脏和头肾中检测到阳性信号,而在肌肉、胃、肠道和肝脏中未检测到LAAO的表达;此外,研究人员同样采用RT-PCR技术检测到迟缓爱德华氏菌Edwardsiellatarda感染大西洋鳕鱼后,皮肤LAAO基因的表达量提高2倍;鳗弧菌Vibrioanguillarum感染鱼体后,鳃、脾脏和头肾中LAAO基因的表达量提高8倍[18,22]。
海洋动物的黏液在抵抗包括细菌在内的病原入侵过程中发挥了重要作用[22,30-31],因此,从具有大量黏液的皮肤及鳃组织中分离并最终鉴定为LAAO的报道较多。Kitani等[32]利用LAAO特异性RNA探针进行原位杂交表明,LAAO分布于许氏平鮋表皮的基膜和鳃的上皮组织中;Kasai等[28]通过免疫组织化学在星斑川鲽Platichthysstellatus的鳃组织中检测到LAAO的特异性表达。
脾脏及肾脏是硬骨鱼类的重要免疫器官[33-34],在二者中均检测到海洋动物LAAO,这表明海洋动物LAAO与固有免疫应答相关[18,23,26]。
鱼类的血清同样含有抵抗病原入侵的抗菌物质[25,35-36],也被证明存在着LAAO,Wang等[23]在黄斑蓝子鱼血清中分离到一种具有抑菌能力的天然蛋白并鉴定为LAAO。此外,在海洋生物的卵巢及其他分泌物中也鉴定到LAAO的存在。2013年,Kitani等[32]试验表明,LAAO在许氏平鮋的卵巢中也有微量表达;研究人员从海兔的墨汁、蛋白腺分泌液和卵匀浆液的上清中也可分离到具有生物学活性的LAAO[15,17,28-29]。
3 海洋动物LAAO的生物学功能
3.1抑菌作用及机理
海洋动物LAAO对多种水产病原中常见的革兰氏阴性细菌和革兰氏阳性细菌均具有抑制作用。许氏平鮋黏液中的LAAO对杀鲑气单胞菌Aeromonassalmonicida、美人鱼发光杆菌杀鱼亚种Photobacteriumdamselaesubsp. piscicida、副溶血性弧菌Vibrioparahaemolyticus、嗜水气单胞菌Aeromonashydrophila具有较强的抑菌作用,最小抑菌浓度(MIC)分别为0.078、0.16、0.63、0.31 μg/mL[16,24]。棘头床杜父鱼Myoxocephaluspolyacanthocephalus黏液中的LAAO具有较宽的抑菌谱,对杀鲑气单胞菌的最小抑菌浓度(MIC)可达到0.02 μg/mL[37-39]。
海洋动物LAAO的抑菌作用依赖于同细菌表面的结合,这可直接导致细菌表面出现褶皱及孔洞,形态发生显著变化。Kitani等[24]研究表明,许氏平鮋黏液中的LAAO可与美人鱼发光杆菌杀鱼亚种结合,而不与大肠杆菌Escherichiacoli结合,即大肠杆菌对LAAO表现出不敏感性。Wang等[23]报道,黄斑蓝子鱼血清中的LAAO可导致金黄色葡萄球菌Staphylococcusaureus表面出现褶皱,大肠杆菌表面出现明显的孔洞; Kitani等[24]研究表明,许氏平鮋黏液中的LAAO可导致杀鲑气单胞菌表面出现褶皱,副溶血性弧菌表面产生孔洞,美人鱼发光杆菌杀鱼亚种菌体显著伸长。
海洋动物源LAAO的抑菌作用与H2O2的产生有关。许氏平鮋黏液中的LAAO与H2O2展现出相同的抑菌谱[24],研究表明,过氧化氢酶可完全抑制许氏平鮋和棘头床杜父鱼黏液中LAAO的抑菌活性[1,6,21]。某些细菌可通过提高抗氧化酶的基因转录水平以抵抗H2O2造成的伤害。Kasai等[40]发现,大肠杆菌对星斑川鲽LAAO不敏感,进一步研究发现,大肠杆菌编码谷胱甘肽过氧化物酶(GPx)的基因表达量显著增高,从而减少了活性氧对细菌的伤害。然而,也有研究指出海洋动物LAAO的抑菌作用不完全依赖于H2O2。Ko等[41]研究表明,加州海兔LAAO的抑菌活性需依赖于H2O2、α-酮酸及其他催化产物,因各组分同等浓度下单独作用时没有抑菌能力。
3.2对寄生虫的杀灭作用
目前,关于海洋动物LAAO杀灭寄生虫的相关报道较少,其杀灭寄生虫的作用机制有待进一步研究,截至目前,仅报道过黄斑蓝子鱼LAAO具有杀灭寄生虫的生物学功能。研究表明,黄斑蓝子鱼血清中分离的LAAO可导致刺激隐核虫幼虫纤毛脱落、大核膨胀崩解、外膜破裂、内容物溢出[14,42-43]。此外,黄斑蓝子鱼的血清对布氏锥虫Trypanosomabrucei、多子小瓜虫Ichthyophthiriusmultifiliis也具有强烈的杀灭作用,其中,对布氏锥虫的最小杀虫血清浓度为1.5%[23]。与此相似,研究较为深入的蛇毒源LAAO同样具有杀灭寄生虫的功能,如从蝮蛇Bothropsjararaca毒液中分离到的LAAO对同属锥虫科Trypanosomatid 的利什曼原虫Leishmaniaamazonensis具有杀灭作用[8]。
3.3抗肿瘤作用及机理
海洋动物源LAAO具有潜在的抗肿瘤生物学功能,它在体外可直接杀死肿瘤细胞及参与诱导肿瘤细胞的凋亡,甚至可以延长腹水中携带大量肿瘤细胞小鼠的生命。Butzke等[19]从斑点海兔墨汁中分离到的LAAO可在6~8 h内杀死肿瘤细胞Jurkat T;从黑斑海兔卵匀浆液上清中纯化得到的LAAO可在2~114 ng/mL的浓度下裂解杀死多种鼠源、人源肿瘤细胞,研究表明,对腹水中含有1×106cells MM46肿瘤细胞的C3H/He小鼠腹腔注射LAAO后,小鼠生命得到显著延长,其中注射0.4、2单位LAAO的小鼠存活时间超过200 d[17,29]。Iijima等[15]研究显示,截尾海兔蛋白腺分泌物中的LAAO可诱导鼠T淋巴细胞瘤细胞EL-4的凋亡。研究人员发现,当异尖线虫Anisakissimplex幼虫感染鲐鱼Chubmackerel后,在感染部位形成的囊腔中纯化出的LAAO,以20 ng/mL的浓度与人早幼粒白血病细胞HL-60共孵育24 h可完全杀死肿瘤细胞,通过细胞核染色、流式细胞术等方法检测到了细胞凋亡的显著特征[27]。
海洋动物LAAO抗肿瘤的生物学活性与其催化产物H2O2有着较大的关系,高浓度的H2O2突破了肿瘤细胞抗氧化能力的极限,如斑点海兔墨汁中的LAAO通过特异性催化L-赖氨酸和L-精氨酸氧化脱氨产生H2O2,从而导致了 Jurkat T细胞的死亡[19]。进一步地研究表明,海洋动物LAAO具有不依赖于H2O2而诱导细胞凋亡的途径。当添加高剂量的H2O2酶时,截尾海兔墨汁中的LAAO对肿瘤细胞EL-4的毒性仅部分受到抑制,肿瘤细胞依然存在着凋亡的显著特征,如DNA的碎裂和Caspase 3活性的提高[15,44-45]。
4 海洋动物LAAO异源表达
LAAO具有多种生物学功能,具有广阔的应用前景,因此,针对该酶的异源表达研究一直是该领域的热点与难点。目前,已报道的海洋动物LAAO的异源表达可通过大肠杆菌和酵母表达系统实现,表达产物具有与野生型相近的生物学功能。Yang等[20]实现了加州海兔墨汁LAAO在大肠杆菌工程菌株的异源表达,重组蛋白对大肠杆菌和金黄色葡萄球菌具有抑菌作用,但其抑菌活性仅为野生型的1/3;Li等[46]选取毕赤酵母表达系统实现了黄斑蓝子鱼血清LAAO的异源表达,重组蛋白对多种革兰氏阴性细菌及革兰氏阳性细菌具有抑制作用,扫描电镜发现,细菌经重组蛋白处理后表面变得粗糙并有颗粒附着,细胞壁皱缩,细胞膜出现破裂。此外,重组蛋白的抑菌活性可受到H2O2酶的抑制,其广谱抗菌活性与过氧化氢有关;近期Kasai等[40]同样利用毕赤酵母表达系统重组表达了星斑川鲽黏液中的LAAO,重组蛋白可显著抑制葡萄球菌属Staphylococci和耶尔森氏菌属Yersinia细菌的生长,其中表皮葡萄球菌Staphylococcusepidermidis对重组蛋白最为敏感,其最小抑菌浓度(MIC)为0.078 μg/mL。此外,Li等[47]研究表明,经大肠杆菌重组表达的黄斑蓝子鱼血清中的LAAO,体外复性后可诱导刺激隐核虫幼虫裂解死亡,具有与野生型相近的杀灭寄生虫活性,但重组蛋白的活性较低。目前,关于海洋动物LAAO表达产物抗肿瘤的生物学活性还未见报道。
5 问题与展望
LAAO在自然界中分布广泛,作为蛇毒源的重要组成部分,研究多集中在蛇毒源LAAO的生物学活性尤其是抗肿瘤方面[48-50]。国内外对海洋动物LAAO的研究相对较少,为此仍需开展大量基础研究工作,比如更多的海洋动物LAAO分离及鉴定、晶体结构的掌握、更为具体的热稳定性研究,以及深入的氨基酸催化活性探究等。不同来源的海洋动物LAAO具有不同的生物学活性。研究表明,多数海洋动物黏液中的LAAO具有抑菌作用[18,28],海兔墨汁中的LAAO具有抗肿瘤作用[19,20],某些硬骨鱼类血清中的LAAO具有杀寄生虫的生物学功能[14],为此,关于海洋动物LAAO组织分布与其生物学活性的关系需深入总结和探讨,推测LAAO在海洋动物的非特异性免疫中发挥了重要作用。海洋动物源LAAO具有广泛的生物学功能,这些功能目前多数被认为同蛇毒源LAAO类似,均在较大程度上依赖于氧化催化产物H2O2[2,12],本研究中所提到的其他特殊作用机制仍有待揭示。
作为潜在的新型抗菌、杀寄生虫和抗肿瘤药物的研发对象,海洋动物LAAO的成功异源表达是其必须攻克的难关。目前,常用的表达系统主要包括原核表达系统、酵母表达系统、哺乳动物细胞表达系统和昆虫细胞杆状病毒表达系统[51],其中原核表达系统虽然表达效率高、周期短,但表达产物经常发生错误的折叠并聚集成包涵体[52-53];酵母表达系统能够进行特定的翻译后修饰但表达量较低[54];截至目前,利用哺乳动物及昆虫细胞表达系统对海洋动物LAAO体外重组表达未见报道。因此,选用合适的表达系统开展海洋动物LAAO的异源表达并对表达产物的功能进行探究,必将是未来该领域研究的热点之一。
[1] Faust A,Niefind K,Hummel W,et al.The structure of a bacterial L-amino acid oxidase fromRhodococcusopacusgives new evidence for the hydride mechanism for dehydrogenation[J].Journal of Molecular Biology,2007,367(1):234-248.
[2] 黄剑钧.蛇毒L-氨基酸氧化酶的研究进展[J].世界肿瘤杂志,2009,8(2):91-95.
[3] Lu Q M,Wei Q,Jin Y,et al.L-amino acid oxidase fromTrimeresurusjerdoniisnake venom:purification,characterization,platelet aggregation-inducing and antibacterial effects[J].Journal of Natural Toxins,2002,11(4):345-352.
[4] Samel M,Tõnismägi K,Rönnholm G,et al.L-amino acid oxidase fromNajanajaoxianavenom[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2008,149(4):572-580.
[5] El-Sayed A S,Shindia A A,Zaher Y.L-amino acid oxidase from filamentous fungi:screening and optimization[J].Annals of Microbiology,2012,62(2):773-784.
[6] Ande S R,Fussi H,Knauer H,et al.Induction of apoptosis in yeast by L-amino acid oxidase from the Malayan pit viperCalloselasmarhodostoma[J].Yeast,2008,25(5):349-357.
[7] Rodrigues R S,da Silva J F,França J B,et al.Structural and functional properties of Bp-LAAO,a new L-amino acid oxidase isolated fromBothropspauloensissnake venom[J].Biochimie,2009,91(4):490-501.
[8] Ciscotto P,Machado de Avila R A,Coelho E A F,et al.Antigenic,microbicidal and antiparasitic properties of an L-amino acid oxidase isolated fromBothropsjararacasnake venom[J].Toxicon,2009,53(3):330-341.
[9] 周鹏.寡发酵链球菌的L-氨基酸氧化酶在抗氧胁迫中的功能研究[D].北京:中国科学院研究生院,2012.
[10] Saravanakumar K,Kathiresan K.Bioprospecting potential of marine-derived trichoderma[J].Asian Pacific Journal of Tropical Biomedicine,2012,204(4):1-8.
[11] Yu Z L,Qiao H.Advances in non-snake venom L-amino acid oxidase[J].Applied Biochemistry and Biotechnology,2012,167(1):1-13.
[12] 余志良,周宁,乔华.L-氨基酸氧化酶的研究进展[J].中国生物工程杂志,2012,32(3):125-135.
[13] Nagashima Y,Kikuchi N,Shimakura K,et al.Purification and characterization of an antibacterial protein in the skin secretion of rockfishSebastesschlegeli[J].Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology,2003,136(1):63-71.
[14] Wang F H,Xie M Q,Li A X.A novel protein isolated from the serum of rabbitfish (Siganusoramin)is lethal toCryptocaryonirritans[J].Fish & Shellfish Immunology,2010,29(1):32-41.
[15] Iijima R,Kisugi J,Yamazaki M.L-amino acid oxidase activity of an antineoplastic factor of a marine mollusk and its relationship to cytotoxicity[J].Developmental & Comparative Immunology,2003,27(6-7):505-512.
[16] Kitani Y,Tsukamoto C,Zhang G H,et al.Identification of an antibacterial protein as L-amino acid oxidase in the skin mucus of rockfishSebastesschlegeli[J].The FEBS Journal,2007,274(1):125-136.
[17] Kisugi J,Kamiya H,Yamazaki M.Purification and characterization of aplysianin E,an antitumor factor from sea hare eggs[J].Cancer Research,1987,47(21):5649-5653.
[18] Kitani Y,Fernandes J M O,Kiron V.Identification of the Atlantic cod L-amino acid oxidase and its alterations following bacterial exposure[J].Developmental & Comparative Immunology,2015,50(2):116-120.
[19] Butzke D,Hurwitz R,Thiede B,et al.Cloning and biochemical characterization of APIT,a new L-amino acid oxidase fromAplysiapunctata[J].Toxicon,2005,46(5):479-489.
[20] Yang H,Johnson P M,Ko K C,et al.Cloning,characterization and expression of escapin,a broadly antimicrobial FAD-containing L-amino acid oxidase from ink of the sea hareAplysiacalifornica[J].Journal of Experimental Biology,2005,208(18):3609-3622.
[21] Kamiya H,Muramoto K,Yamazaki M.Aplysianin-A,an antibacterial and antineoplastic glycoprotein in the albumen gland of a sea hare,Aplysiakurodai[J].Experientia,1986,42(9):1065-1067.
[22] Nagashima Y,Tsukamoto C,Kitani Y,et al.Isolation and cDNA cloning of an antibacterial L-amino acid oxidase from the skin mucus of the great sculpinMyoxocephaluspolyacanthocephalus[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2009,154(1):55-61.
[23] Kitani Y,Fernandes J M,Kiron V.L-amino acid oxidase—a self defense molecule of Atlantic cod[J].Fish & Shellfish Immunology,2013,34(6):1658-1659.
[24] Wang F H,Li R J,Xie M Q,et al.The serum of rabbitfish (Siganusoramin)has antimicrobial activity to some pathogenic organisms and a novel serum L-amino acid oxidase is isolated[J].Fish & Shellfish Immunology,2011,30(4-5):1095-1108.
[25] Kitani Y,Kikuchi N,Zhang G H,et al.Antibacterial action of L-amino acid oxidase from the skin mucus of rockfishSebastesschlegeli[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2008,149(2):394-400.
[26] Kitani Y,Ishida M,Ishizaki S,et al.Discovery of serum L-amino acid oxidase in the rockfishSebastesschlegeli:isolation and biochemical characterization[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2010,157(4):351-356.
[27] Kitani Y,Mori T,Nagai H,et al.Gene expression and distribution of antibacterial L-amino acid oxidase in the rockfishSebastesschlegeli[J].Fish & Shellfish Immunology,2007,23(6):1178-1186.
[28] Jung S K,Mai A,Iwamoto M,et al.Purification and cloning of an apoptosis-inducing protein derived from fish infected withAnisakissimplex,a causative nematode of human anisakiasis[J].The Journal of Immunology,2000,165(3):1491-1497.
[29] Kasai K,Ishikawa T,Komata T,et al.Novel L-amino acid oxidase with antibacterial activity against methicillin-resistantStaphylococcusaureusisolated from epidermal mucus of the flounderPlatichthysstellatus[J].The FEBS Journal,2010,277(2):453-465.
[30] Ellis A E.Innate host defense mechanisms of fish against viruses and bacteria[J].Developmental & Comparative Immunology,2001,25(8-9):827-839.
[31] Magnadóttir B.Innate immunity of fish (overview)[J].Fish & Shellfish Immunology,2006,20(2):137-151.
[32] Kitani Y,Toyooka K,Endo M,et al.Intra-tissue localization of an antibacterial L-amino acid oxidase in the rockfishSebastesschlegeli[J].Developmental & Comparative Immunology,2013,39(4):456-459.
[33] 杨先乐.鱼类免疫学研究的进展[J].水产学报,1989,13(3):271-284.
[34] 张永安,孙宝剑,聂品.鱼类免疫组织和细胞的研究概况[J].水生生物学报,2000,24(6):648-654.
[35] Subramanian S,Ross N W,MacKinnon S L.Comparison of antimicrobial activity in the epidermal mucus extracts of fish[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2008,150(1):85-92.
[36] Subramanian S,MacKinnon S L,Ross N W.A comparative study on innate immune parameters in the epidermal mucus of various fish species[J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2007,148(3):256-263.
[37] 刘宁,时晓,杜迎春,等.患病细鳞鱼杀鲑气单胞菌的分离与鉴定[J].淡水渔业,2015,45(1):88-92.
[38] 杨嘉龙,周丽,邢婧,等.养殖刺参溃疡病杀鲑气单胞菌的分离、致病性及胞外产物特性分析[J].中国水产科学,2007,14(6):981-989.
[39] 吕俊超,张晓华,王燕,等.养殖大菱鲆病原菌——杀鲑气单胞菌无色亚种的分离鉴定和组织病理学研究[J].中国海洋大学学报,2009,39(1):91-95.
[40] Kasai K,Hashiguchi K,Takahashi H,et al.Recombinant production and evaluation of an antibacterial L-amino acid oxidase derived from flounderPlatichthysstellatus[J].Applied Microbiology and Biotechnology,2015,99(16):6693-6703.
[41] Ko K C,Wang B H,Tai P C,et al.Identification of potent bactericidal compounds produced by escapin,an L-amino acid oxidase in the ink of the sea hareAplysiacalifornica[J].Antimicrobial Agents and Chemotherapy,2008,52(12):4455-4462.
[42] 黎睿君,刘芳,王方华,等.黄斑蓝子鱼皮肤黏液对刺激隐核虫及一些病原菌的抑杀作用[J].水生生物学报,2013,37(2):243-251.
[43] 王方华.黄斑蓝子鱼血清抗寄生虫及细菌活性物质的研究[D].广州:中山大学,2010.
[44] 韩引芳.参三七抗肝纤维化的临床观察[J].实用中医内科杂志,1992,6(4):11-12.
[45] 李丽兰,黎肇炎.蛇毒L-氨基酸氧化酶抗肿瘤作用研究进展[J].蛇志,2006,18(2):127-130.
[46] Li R J,Li A X.Antibacterial efficacy of recombinantSiganusoraminL-amino acid oxidase expressed inPichiapastoris[J].Fish & Shellfish Immunology,2014,41(2):356-361.
[47] Li R J,Dan X M,Li A X.Siganusoraminrecombinant L-amino acid oxidase is lethal toCryptocaryonirritans[J].Fish & Shellfish Immunology,2013,35(6):1867-1873.
[48] 郭春梅,刘淑清,孙明忠.蛇毒L-氨基酸氧化酶的生物学作用[J].天然产物研究与开发,2012,24(S1):205-212.
[49] 陈洲,黄剑钧,薛玲,等.眼镜蛇毒L-氨基酸氧化酶分离纯化及对血管内皮细胞的抑制作用[J].中国药理学通报,2009,25(8):1024-1028.
[50] 何光志,邓树轩,田维毅,等.竹叶青蛇毒L-氨基酸氧化酶(LAAO)基因的克隆及序列分析[J].黑龙江畜牧兽医:科技版,2012(19):18-21.
[51] 毛明光,温施慧,姜志强,等.太平洋鳕神经坏死病毒衣壳蛋白(CP)的原核表达及条件优化[J].大连海洋大学学报,2016,31(2):117-123.
[52] 刘学光,郑怀东,郭欣硕,等.传染性造血器官坏死病毒糖蛋白的原核表达及多克隆抗体的制备[J].大连海洋大学学报,2013,28(3):254-258.
[53] 薛壮,李慧,孙鹤,等.刺参C型凝集素(AJL)基因的克隆及原核表达分析[J].大连海洋大学学报,2015,30(6):610-615.
[54] 娄瑞娟,罗利龙,张霞,等.巴斯德毕赤酵母表达系统的研究进展和前景展望[J].生物学杂志,2010,27(5):73-76.
L-aminoacidoxidaseasanenzymerelatedtoinnateimmunedefenseinmarineanimals:researchprogress
HOU Yu-lin1, GAO Yan-qi1, JIN Shi-bo1, LI An-xing2,LI Rui-jun1
(1.Key Laboratory of Mariculture & Stock Enhancement in North China’s Sea, Ministry of Agriculture, Key Laboratory of Valuable Sea Food Disease Prevention and Control in Dalian, Dalian Ocean University, Dalian 116023, China; 2.Key Laboratory for Aquatic Products Safety, Ministry of Education, State Key Laboratory of Biocontrol of Harmful Organisms and Resourse Utilization,Sun Yat-sen University, Guangzhou 510275, China)
L-amino acid oxidase (LAAO) as a family of flavoproteins protease containing coenzymes FAD or FMN has been reported to have significant biological functions including antiviral, antibacterial, antifungal, anti-parasitic and anti-tumor activities. So far, LAAO is widely found in nature and has been investigated intensively, especially snake venom LAAO. However, the LAAO isolated from marine animals was few reported. In this paper, structural features, molecular weight, pI value, catalytic specificity, storage stability, distribution, biological functions and heterologous expression of LAAO in marine animals are summarized to provide basic references for further study on LAAO in marine animals.
L-amino acid oxidase (LAAO); marine animal; physico-chemical property; biological function; tissue distribution; heterologous expression
10.16535/j.cnki.dlhyxb.2017.05.019
2095-1388(2017)05-0625-06
S917.4
A
2017-02-22
辽宁省教育厅一般项目(L2015077);辽宁省博士科研启动基金资助项目(201601287);大连海洋大学博士科研启动基金资助项目(HDYJ201617)
侯玉林(1994—),男,硕士研究生。E-mail:houyulin22@163.com
黎睿君(1986—),男,博士,讲师。E-mail:liruijun@dlou.edu.cn

