鲶源维氏气单胞菌的分离鉴定及药敏特性
陆梦莹,胡秀彩,吕爱军,孙敬锋,陈成勋,王晓梅,YEONG Yiksung,宋亚娇
(1.天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384;2.河南师范大学 水产学院,河南 新乡 453007)
鲶源维氏气单胞菌的分离鉴定及药敏特性
陆梦莹1,胡秀彩1,吕爱军1,孙敬锋1,陈成勋1,王晓梅1,YEONG Yiksung1,宋亚娇2
(1.天津农学院 水产学院,天津市水产生态及养殖重点实验室,天津 300384;2.河南师范大学 水产学院,河南 新乡 453007)
为探明发病怀头鲶Silurussoldatovi的病原及其生物学特征,从发病怀头鲶体内分离出1株革兰氏阴性细菌SG-1,通过细菌形态学观察、理化特性、16S rDNA测序和构建系统发育进化树分析对其进行了鉴定。结果表明:分离菌SG-1菌株葡萄糖产气、氧化酶、硝酸盐还原为阳性,鸟氨酸脱羧酶、硫化氢为阴性;进一步采用PCR方法扩增其16S rDNA序列,测序获得片段大小为1409 bp,与维氏气单胞菌Aeromonasveronii模式菌株ATCC35624序列相似性达99.86%;构建系统发育树分析显示,分离菌与维氏气单胞菌自然聚为一支,最终判定SG-1菌株为维氏气单胞菌;人工感染斑马鱼Daniorerio、鲶S.soldatovi,其死亡率均达100%,病鱼呈现体表出血、肛门红肿、腹水等症状;药敏试验结果显示,该菌对头孢克肟、头孢哌酮、头孢噻肟、诺氟沙星、左氟沙星、恩诺沙星、氟苯尼考等药物敏感,对阿莫西林、氨苄西林、磺胺异恶唑、甲氧嘧啶、复方新诺明等耐药。本研究结果为了解维氏气单胞菌感染鲶的致病机理及其该病的预防治疗提供了科学参考。
鲶;维氏气单胞菌;16S rDNA;系统发育树;药敏试验
维氏气单胞菌Aeromonasveronii是一类兼性厌氧的革兰氏阴性杆菌,隶属于气单胞菌科Aeromonadaceae、气单胞菌属Aeromonas[1]。维氏气单胞菌广泛分布于自然界土壤、水环境和水生动物体中,是一种新型的对人鱼具有感染性的条件致病菌[2],常常给水产养殖业带来巨大经济损失。研究表明,维氏气单胞菌能感染鲤Cyprinuscarpio[3]、斑点叉尾鮰Ictaluruspunctatus[4]、长吻鮠Leiocassislongirostris[5]等多种鱼类发病,临床症状表现为体表出血、腹水等,也会引起人腹泻、脑膜炎和败血症等。目前,关于鲶源维氏气单胞菌的分离鉴定研究鲜有报道[6]。2016年4—5月,天津市某养殖场鲶Silurussoldatovi发病,病鱼主要表现为反应迟钝,不摄食,体表溃烂出血,鳃丝、鳍条充血,肛门红肿突出,腹部膨大,自然感染死亡率达80%以上。本研究中,从自然发病鲶肝脏等组织中分离出1株细菌,并对其进行了理化特性分析、16S rDNA基因序列分子鉴定及其药物敏感性研究,旨在了解维氏气单胞菌的致病机理,并为该病的预防治疗提供科学参考。
1 材料与方法
1.1材料
患病鲶取自天津市宁河区某养殖场。LB琼脂、药敏纸片购自上海捷瑞生物工程,肠杆菌科细菌生化编码鉴定管GYZ-11e购自环凯微生物公司。细菌总基因组提取试剂盒(DNA)、胶回收试剂盒(离心柱型)均购自上海生工工程有限公司。2 ×Taq PCR MixPCR预混体系、DNA Marker DL2000均购自上海捷瑞生物工程有限公司。
1.2方法
1.2.1 细菌的分离纯化 参照胡秀彩等[7]的方法,通过无菌操作取病鲶肝脏等组织,接种于LB培养基上,28 ℃恒温培养箱中培养18~24 h。挑取优势单菌落于固体培养基中接种纯化,经过2~3次纯化后得到纯菌种,放置于冰箱(4 ℃)中保存备用。纯化后培养的菌液按照1∶1的比例加入40%的甘油于冰箱(-21 ℃)中冻存备用。
1.2.2 细菌形态特征及理化特性分析 将分离菌株接种于LB固体培养基上,28 ℃下培养18~24 h,进行革兰氏染色镜检菌体形态。将分离到的菌株无菌操作接种于细菌生化编码鉴定管中,按照常规方法进行硝酸盐还原、糖(醇、苷)类代谢等19种理化特性测定。
1.2.3 动物感染试验 健康鲶Silurussoldatovi体质量约40 g,购自天津某养殖场;斑马鱼Daniorerio体质量约0.5 g,购自天津某水产市场。参照田照辉等[8]的方法,将分离到的菌株用0.65% NaCl溶液配制成2.0×108cfu/mL的菌悬液。将健康鲶和斑马鱼作为试验对象,每组10尾鱼,采取腹腔注射的方法,给试验组鲶每尾注射0.15 mL菌悬液,斑马鱼每尾注射10L,对照组鲶和斑马鱼等量注射0.65%无菌生理盐水。试验鱼经过感染后连续观察7 d,统计鲶和斑马鱼的发病情况和死亡数量。
1.2.4 细菌基因组DNA提取 将分离菌株接种于LB液体培养基中,在28 ℃下以120 r/min振荡培养至对数期后期,菌液浑浊。取2 mL菌液于2 mL离心管中,以12 000 r/min离心 2 min,弃去上清液,向离心管中加入 500L无菌双蒸水,涡旋 30 s,95 ℃下水浴 5 min,以12 000 r/min离心 2 min,以上清液作为模板。
1.2.5 细菌16S rDNA基因序列的扩增及测序 细菌16S rDNA采用通用引物27F:5′-AGAGTTTGATCATGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′,引物来自上海生工。PCR扩增反应体系(共20 μL):2×Taq PCR Master Mix 10L,上下游引物各1L,DNA模板1L,无菌双蒸水7L。PCR反应条件:95 ℃下预变性5 min;95 ℃下变性40 s,55 ℃下退火复性30 s,72 ℃下延伸30 s,共进行35个循环;最后在72 ℃下再延伸10 min。采用10 g/L琼脂糖凝胶电泳检测目的基因,并将PCR扩增产物送金唯智生物科技有限公司进行基因测序。测序结果通过Blast软件进行同源性分析,采用MEGA软件构建系统发育树。
1.2.6 药敏试验 采用K-B纸片法对分离菌株进行30种常用抗生素药物的敏感性检测,采用涂布法将200 μL分离菌悬液涂布于LB固体培养基上,涂抹均匀,依次贴上待检验的药敏纸片,在28 ℃恒温培养箱中培养36 h后,测量抑菌圈直径,通过抑菌圈直径大小来判定细菌对药物的敏感性。
2 结果与分析
2.1鲶病原菌的分离及理化特性
病鲶主要表现为皮肤溃烂、出血点明显,肛门红肿外突、鳍条充血等临床症状(图1-A)。解剖发现,腹腔中有大量腹水,肠道内无内容物,肠壁充血出血,肝脏有坏死灶等病变(图1-B)。从其肝脏组织分离纯化获得1株细菌,编号为SG-1,革兰氏染色为短杆状阴性菌,两端钝圆,该菌株在LB固体培养基上形成圆形、透明、表面湿润、边缘整齐的小菌落。细菌生理生化试验结果表明,SG-1菌株葡萄糖产气、氧化酶、硝酸盐还原为阳性,鸟氨酸脱羧酶、硫化氢为阴性等,结合该菌株的菌体形态和生理生化特性,基本符合气单胞菌属细菌特征(表1)。

表1 菌株SG-1的生理生化特性Tab.1 Physiological and biochemical characteristics of strain SG-1
注:+为阳性,-为阴性,d为不确定
Note:+,positive; -,negative; d,uncertainty
2.2分离菌的16SrDNA序列及系统发育分析
以分离菌SG-1基因组DNA为模板,采用PCR方法扩增16S rDNA序列,通过琼脂糖凝胶电泳检测大小约为1500 bp的目的条带(图2),16SrDNA测序获得1409 bp片段。Blast比对表明,与维氏气单胞菌模式菌株ATCC35624[X74684.1]的16S rDNA序列相似性达99.86%。构建系统发育树分析显示,分离菌SG-1与维氏气单胞菌自然聚为一支(图3),最终判定SG-1为维氏气单胞菌。

图1 病鲶临床症状Fig.1 Clinic signs of diseased northern sheatfish Silurus soldatovi
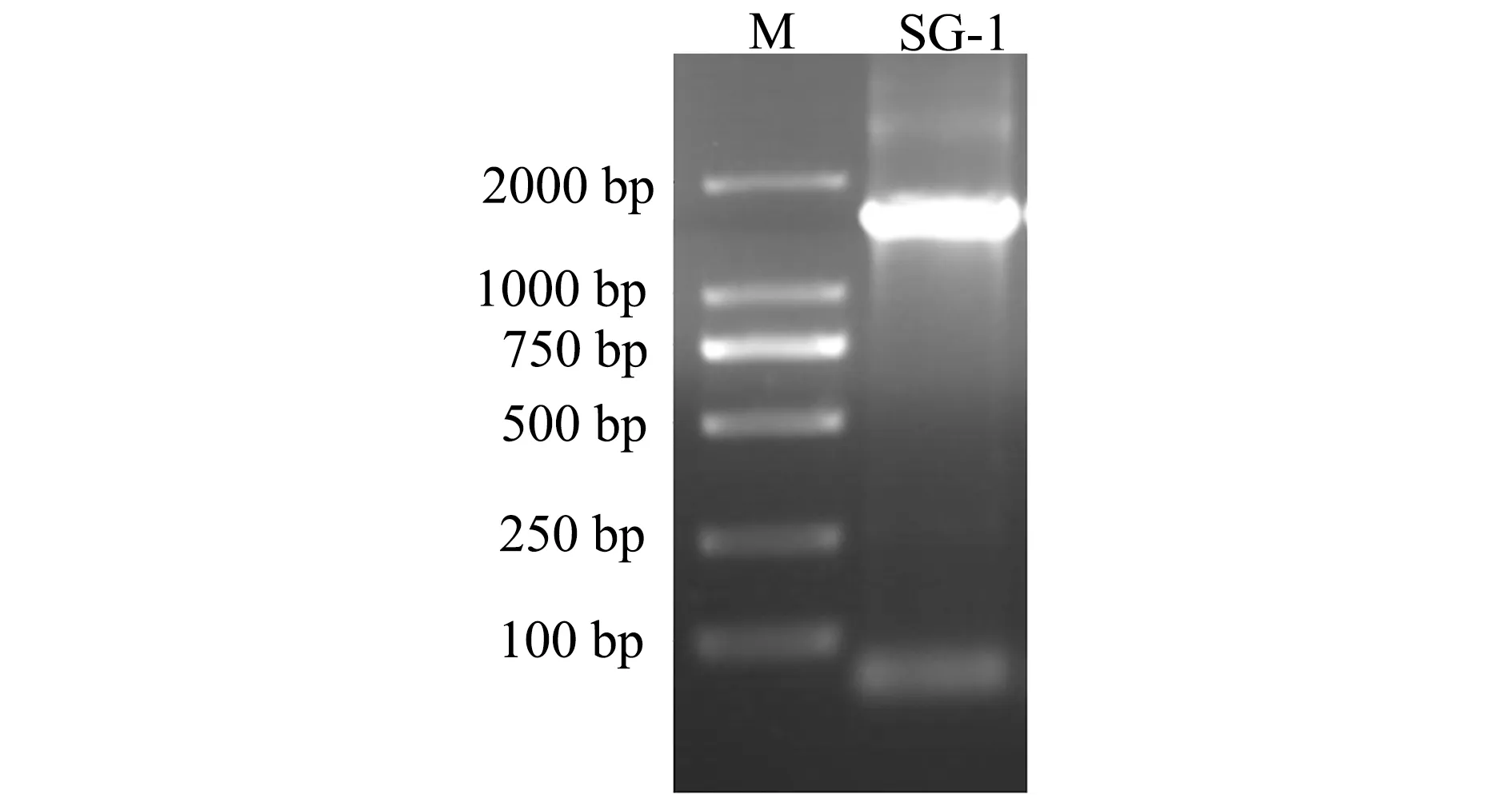
图2 SG-1菌株的16S rDNA PCR检测Fig.2 Fragment size of 16S rDNA sequence in strain SG-1 amplified by PCR

图3 菌株SG-1的16S rDNA序列系统进化树Fig.3 The 16S rDNA sequence phylogenetic tree of the strain SG-1
2.3动物感染试验结果
人工回感染鲶72 h死亡率达100%,感染病鲶出现体表出血、肛门红肿、肠壁充血、腹水等症状。人工腹腔注射斑马鱼感染4 h后出现发病死亡,48 h死亡率达100%;人工感染发病死亡鲶、斑马鱼与患病鲶自然发病症状基本相同,并且从发病鱼肝脏中再次分离到与SG-1菌株特征一致的细菌。对照组鱼则无发病死亡现象。
2.4药敏试验结果
选用30种抗生素对SG-1菌株进行药敏试验,测量抑菌圈直径,计算平均值见表2。药敏试验结果显示,该菌对头孢克肟、头孢哌酮、头孢噻肟、诺氟沙星、左氟沙星、恩诺沙星、氟苯尼考等药物敏感,对阿莫西林、氨苄西林、磺胺异恶唑、甲氧嘧啶、复方新诺明等耐药,图4为氯霉素、呋喃妥因、利福平、诺氟沙星、恩诺沙星的药敏图谱。
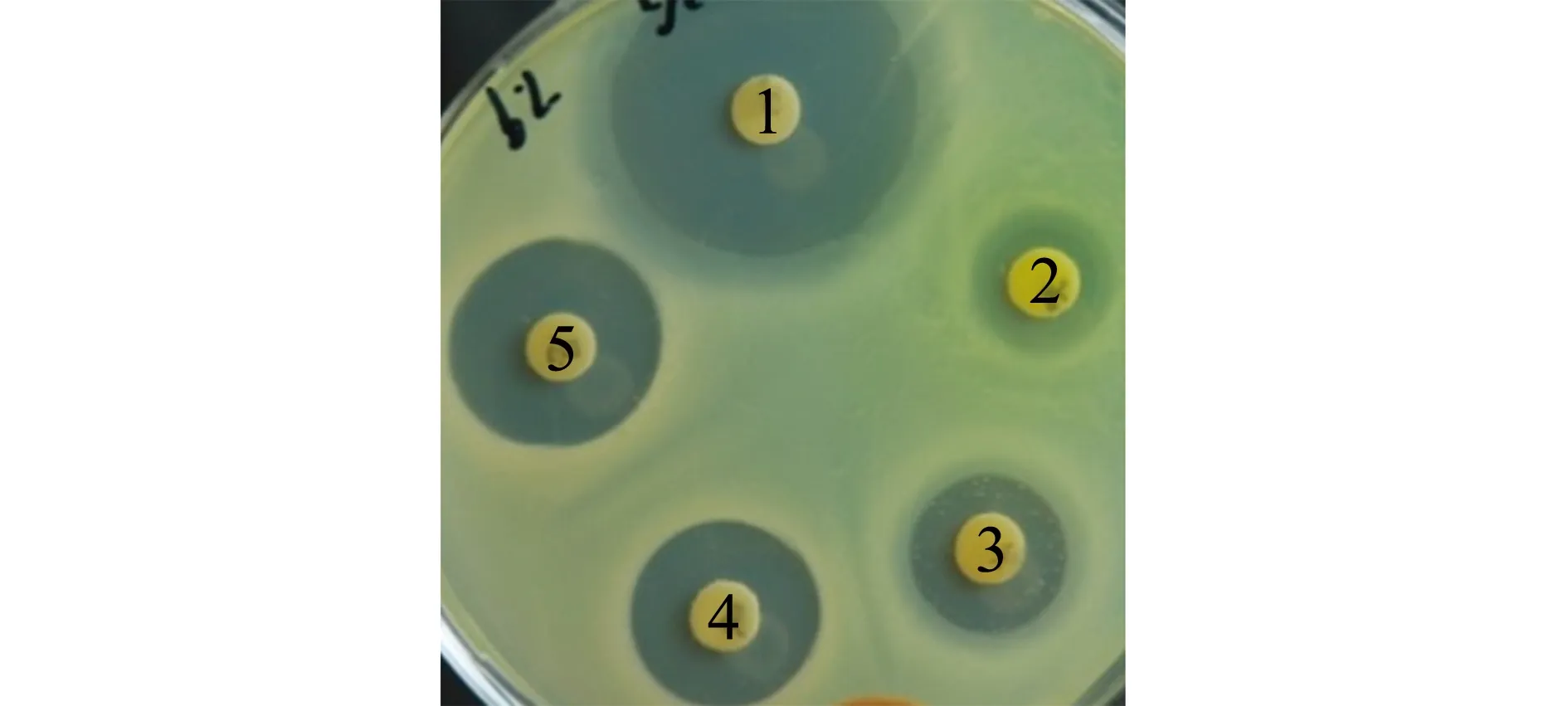
注:1为氯霉素,2为呋喃妥因,3为利福平,4为诺氟沙星,5为恩诺沙星Note:1,chloramphenicol; 2,nitrofurantoin; 3,rifampicin; 4,norfloxacin; 5,enrofloxacin图4 菌株SG-1药敏试验图Fig.4 Susceptibility pattern of strain SG-1
3 讨论
3.1维氏气单胞菌的致病性
近几年,关于水产动物维氏气单胞菌的研究报道备受关注[3-5],该菌能引发鱼类疾病发生,不仅影响了水产养殖业的健康发展,而且对人类饮食安全构成潜在威害。维氏气单胞菌广泛存在于淡水、海水、污水和土壤等环境中,主要能引起败血症、胃肠炎等疾病,对人和多种水产动物具有较强的感染致病力,被认为是一种新型人鱼共患条件致病菌[9-10]。唐毅等[11]从患烂尾病华鲮Sinilabeorendahli体内分离到2个致病性维氏气单胞菌优势菌株。房海等[12]从自然发病中华绒螯蟹Eriocheirsinensis肝胰腺中分离到维氏气单胞菌,动物试验显示,单独感染蟹发病死亡。沈文英等[13]从患病鳖Trionyxsinensis肝脏中分离得到1株高致病力细菌,经生理生化及16S rDNA鉴定为维氏气单胞菌。宋振辉等[14]从发病死亡鲫Carassiusauratus肝脏中分离出1株致病菌,并通过16S rDNA序列构建系统发育树等鉴定为维氏气单胞菌。本研究首次从国内自然发病鲶肝脏中分离到SG-1菌株,通过细菌形态学观察、生理生化特征和16S rDNA序列及系统进化树分析,最终鉴定为维氏气单胞菌。Evangelista-Barreto等[15]从水体中分离到维氏气单胞菌,认为该菌能导致肠胃炎。秦国民等[16]从发病锦鲤Cyprinuscarpio病变组织中分离到维氏气单胞菌,经人工感染试验证实可引起鳞片脱落、体表出血等症状。Yu等[3]报道维氏气单胞菌可感染以色列鲤C.carpio,病鱼表现为肠炎、腹部肿胀明显,且伴有皮肤溃烂等临床症状。马志宏等[17]报道维氏气单胞菌感染鲟Acipenserbaeri死亡率达65%以上。宋振辉等[14]通过动物感染试验表明,该菌能导致鲫C.auratus鳞片脱落、鳍条充血、肛门红肿外突等症状,死亡率高达100%。迄今,维氏气单胞菌感染鲶鱼研究报道较少[5-6]。本研究中对维氏气单胞菌SG-1菌株人工感染斑马鱼、鲶的死亡率均达100%,病鱼呈现体表出血、肛门红肿、腹水等症状,这与其他学者报道的感染症状基本一致[3,14,17]。以上研究不仅为维氏气单胞菌感染鱼类的致病机理奠定了基础,而且为该病的预防治疗提供了科学参考。值得一提的是,本研究中获得的鲶源维氏气单胞菌其生化特征鉴定出现了枸橼酸盐阳性、尿素酶阳性、苯丙氨酸酶阴性,这与标准对照株ATCC35624有所不同,可能与菌株来源、区域分布、水环境状况等因素有关。此外,鲶源维氏气单胞菌SG-1菌株与沈文英等[13]、黄文明等[18]的研究结果苯丙氨酸酶阴性一致,甚至还可能影响菌株的致病性,这有待进一步研究。
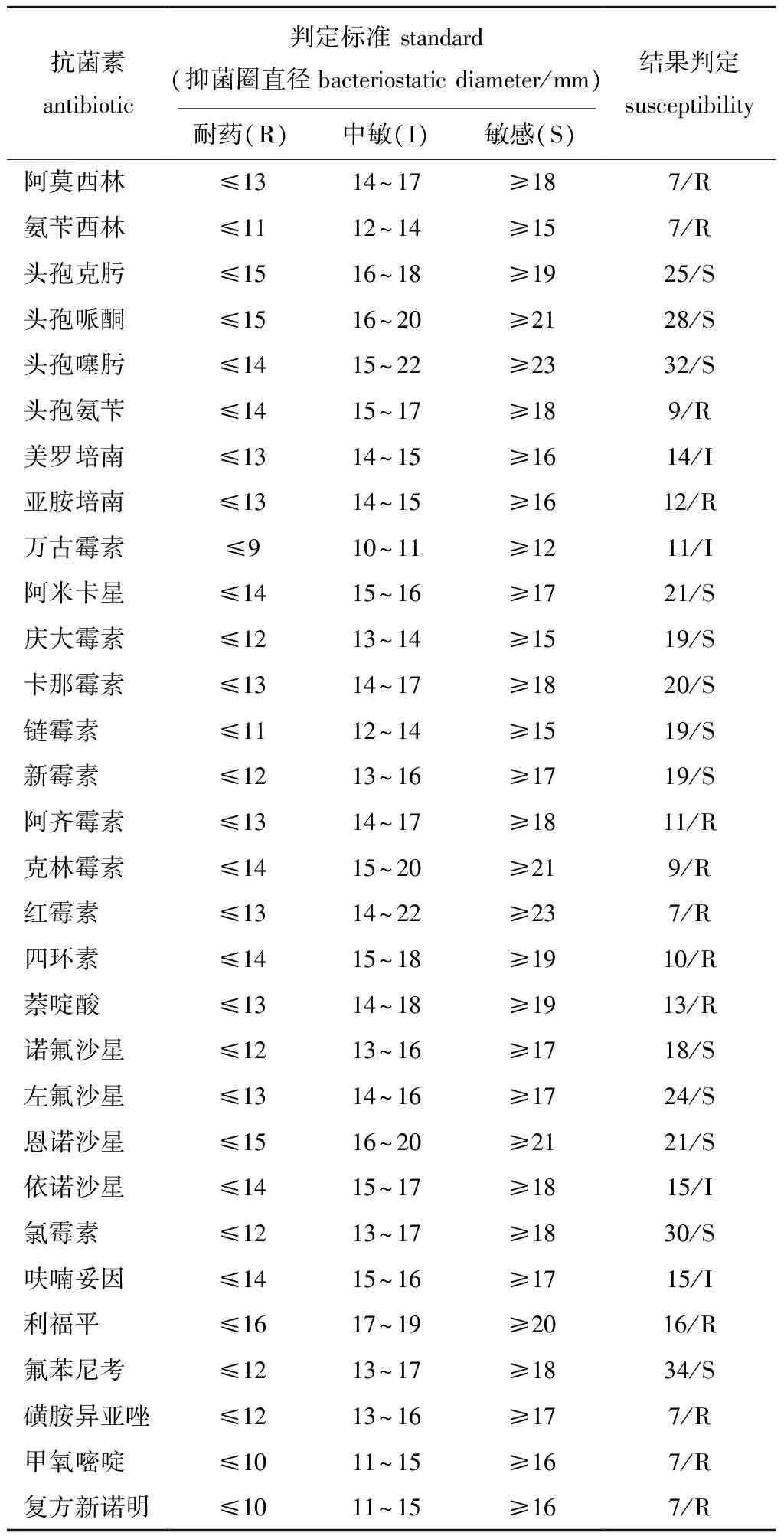
表2 菌株SG-1的药敏试验结果Tab.2 Susceptibility test results of strain SG-1
3.2维氏气单胞菌的药敏特性
随着抗生素类药物在水产养殖和疾病防治中广泛使用,细菌耐药现象日益增强,已成为疾病防治过程中面临的新难题。Nawaz等[6]从发病鲶体内分离到81株维氏气单胞菌,其中所有菌株均对四环素、氨苄青霉素和青霉素耐药,绝大多数菌株对杆菌肽耐药,7%菌株均对甲氧苄啶、磺胺异恶唑耐药。沈文英等[13]进行药敏试验结果表明,鳖病原性维氏气单胞菌对四环素、氟哌酸、庆大霉素、呋喃类药物敏感,对红霉素、青霉素等耐药。研究发现,锦鲤、鲟和虾等源维氏气单胞菌对链霉素、氧氟沙星、恩诺沙星等常用抗生素敏感[9,18]。黄文明等[19]研究显示,胭脂鱼维氏气单胞菌对四环素、恩诺沙星等药物高度敏感,对头孢曲松、复方新诺明、磺胺异恶唑等耐药。上述研究结果,除四环素外,其余抗生素的抑菌效果均与本研究结果相同[6,13],其中的耐药性差异可能由于细菌来源不同,从而造成对药物敏感性的影响也具有明显差异[6,13]。本研究中,分离的SG-1菌株对头孢克肟、头孢哌酮、头孢噻肟、诺氟沙星、左氟沙星、恩诺沙星、氟苯尼考等药物敏感,这与国内外学者的研究结果基本一致[6,8]。以上研究报道不仅为鱼类细菌性疾病防治提供了科学依据,而且为维氏气单胞菌感染鲶致病机理研究奠定了基础。
综上所述,本研究中从患病鲶体内分离到1株致病性维氏气单胞菌,首次人工感染证实对鲶、斑马鱼等有致死性。关于鲶源维氏气单胞菌致病机理有待进一步研究。
[1] Wu C J,Wu J J,Yan J J,et al.Clinical significance and distribution of putative virulence markers of 116 consecutive clinicalAeromonasisolates in southern Taiwan[J].Journal of Infection,2007,54(2):151-158.
[2] Bowman J P,Genus I.Aeromonas[M]//Brenner D J,Krieg N R,Staley J T.Bergey’s Manual of Systematic Bacteriology.Michigan,MI,USA:Springer,Michigan State University,2005:557-577.
[3] Yu J H,Han J J,Kim H J,et al.First report ofAeromonasveroniiinfection in farmed Israeli carpCyprinuscarpioin Korea[J].Journal of Fish Pathology,2010,23(2):165-176.
[4] 黄小丽,吴春燕,邓永强,等.斑点叉尾鮰维氏气单胞菌病的病理组织学观察[J].中国兽医科学,2010,40(7):738-742.
[5] Cai Shuanghu,Wu Zaohe,Jian Jichang,et al.Characterization of pathogenicAeromonasveroniiBv.veronii associated with ulcerative syndrome from Chinese longsnout catfish (Leiocassislongirostrisgunther)[J].Brazilian Journal of Microbiology,2012,43(1):382-388.
[6] Nawaz M,Sung K,Khan S A,et al.Biochemical and molecular characterization of tetracycline-resistantAeromonasveroniiisolates from catfish[J].Applied and Environmental Microbiology,2006,72(10):6461-6466.
[7] 胡秀彩,边延峰,赵腊梅,等.鱼源维氏气单胞菌的分离鉴定[J].动物医学进展,2013,34(12):232-235.
[8] 田照辉,徐绍刚,朱华,等.维氏气单胞菌感染对西伯利亚鲟血清指标和hsp70基因表达的影响[J].大连海洋大学学报,2015,30(1):6-12.
[9] 吴同垒,单晓枫,孟庆峰,等.维氏气单胞菌研究进展[J].中国兽药杂志,2011,45(7):41-44.
[10] Bomar L,Stephens W Z,Nelson M C,et al.Draft Genome Sequence ofAeromonasveroniiHm21,a symbiotic isolate from the medicinal leech digestive tract[J].Genome Announcements,2013,1(5).DOI:10.1128/genomeA.00800-13.
[11] 唐毅,郑凯迪,朱成科,等.华鲮烂尾病病原的分离鉴定及药敏分析[J].淡水渔业,2010,40(4):50-55.
[12] 房海,陈翠珍,张晓君,等.中华绒螯蟹病原维氏气单胞菌的检验[J].中国人兽共患病学报,2008,24(1):45-49.
[13] 沈文英,李卫芬,高研.中华鳖病原性维隆气单胞菌的分离及药敏试验[J].水生生物学报,2010,34(5):1060-1064.
[14] 宋振辉,乔霞,张鹦俊,等.维氏气单胞菌的分离鉴定及系统进化分析[J].中国兽医杂志,2011,47(1):23-25.
[15] Evangelista-Barreto N S,Carvalho F C T D,Vieira R H S D F,et al.Characterization ofAeromonasspecies isolated from an estuarine environment[J].Brazilian Journal of Microbiology,2010,41(2):452-460.
[16] 秦国民,张晓军,陈翠珍,等.锦鲤维氏气单胞菌感染症及其病原微生物学特性研究[J].安徽农业科学,2008,36(19):8115-8117.
[17] 马志宏,杨慧,李铁梁,等.西伯利亚鲟(Acipenserbaerii)致病性维氏气单胞菌的分离鉴定[J].微生物学报,2009,49(10):1289-1294.
[18] 黎烔,叶星,卢迈星,等.罗非鱼维氏气单胞菌的分离鉴定和药敏试验[J].水生态学杂志,2011,32(3):132-136.
[19] 黄文明,王利,冀国桢,等.胭脂鱼维氏气单胞菌和中间气单胞菌的鉴定及药物敏感性[J].水产科学,2014,32(4):210-214.
Isolation,identificationandsusceptibilityofAeromonasveroniifromdiseasednorthernsheatfishSilurussoldatovi
LU Meng-ying1, HU Xiu-cai1, LÜ Ai-jun1, SUN Jing-feng1, CHEN Cheng-xun1, WANG Xiao-mei1, YEONG Yiksung1,SONG Ya-jiao2
(1.Tianjin Key Laboraory of Aqua-Ecology and Aquaculture, College of Fisheries, Tianjin Agricultural University, Tianjin 300384, China; 2.College of Fisheries, Henan Normal University, Xinxiang 453007, China)
A bacterial strain, called as strain SG-1, isolated from liver of diseased northern sheatfishSilurussoldatoviwas shaped-rod and gram-negative bacterium by Gram-staining and identified asAeromonasveroniiby morphological, physiological and biochemical characteristics as well as the 16S rDNA gene sequencing and phylogenetic tree analysis. The isolated strain was shown to be characterized by glucose gas production, positive oxidase, nitrate reduction, negative ornithine decarboxylase and hydrogen sulfide. Further fragment size of 16S rDNA sequence amplified by PCR was 1409 bp, and had 99.86% similarity withAeromonasveroniiATCC35624 type strain. Phylogenetic tree analysis revealed that the isolate was clustered withAeromonasveronii. The northern sheatfish and zebrafishDanioreriochalenged withAeromonasveroniihad mortality rate of 100%, showing surface bleeding, anal swelling, and ascites. Susceptibility test showed that the isolate was sensitive to cefixime, cefoperazone, cefotaxime, norfloxacin, levofloxacin, enrofloxacin, and florfenicol, but resistant to amoxicillin, ampicillin, sulfisoxazole, methoxy pyrimidine, and cotrimoxazole.
Silurussoldatovi;Aeromonasveronii; 16S rDNA; phylogenetic tree; susceptibility test
10.16535/j.cnki.dlhyxb.2017.05.010
2095-1388(2017)05-0563-05
S917.1
A
2017-01-12
天津市自然科学基金重点项目(16JCZDJC33500,15JCZDJC34000,15JCZDJC33500);天津农学院大学生创新创业训练计划项目(201610061047);天津市水产产业技术体系创新团队(ITTFRS2017009);天津市高等学校“现代水产生态健康养殖”创新团队(TD12-5018);国家自然科学基金资助项目(31272692)
陆梦莹(1995—),女,本科生。E-mail:lumyac@163.com
吕爱军(1973—),男,教授。E-mail:lajand@126.com

