小麦 TaNIP4-1基因的克隆及生物信息学分析
曹荣珍,闻珊珊
(西北农林科技大学农学院,陕西杨凌 712100)
小麦 TaNIP4-1基因的克隆及生物信息学分析
曹荣珍,闻珊珊
(西北农林科技大学农学院,陕西杨凌 712100)
水通道蛋白不仅控制着水分和一些小分子溶质的跨膜运输,也是植物体应对非生物胁迫的重要组成部分。为了进一步研究小麦水通道蛋白的功能,本研究以NCBI和Ensemble Plant数据库中查找出的已报道的小麦水通道蛋白基因序列为模板,针对其保守区设计了19对引物,应用PCR的方法从5个小麦品种中克隆出19个基因片段。通过比对鉴定到一个此前未曾报道的新基因,并对其进行生物信息学分析,将其命名为 TaNIP4-1。理化特性分析表明,该基因位于3A染色体短臂,基因全长1 315 bp,CDS序列长度864 bp,含有3个外显子和2个内含子,编码含有288个氨基酸的多肽,含有保守的沙漏模型,有6个跨膜区和2个保守的NPA基序。亚细胞定位预测结果表明该基因位于质膜上。该基因启动子序列含有与逆境响应相关的顺式调控元件,而对7日龄的麦苗进行干旱和盐胁迫处理后,其qRT-PCR结果显示,干旱和盐处理5 h后, TaNIP4-1基因在小麦叶片中的表达量明显上调;盐处理7 d后, TaNIP4-1基因在小麦根部的表达量显著上调。由此可见, TaNIP4-1基因参与了小麦应对逆境的过程。
小麦;水通道蛋白; TaNIP4-1;生物信息学
近年来,气候变化影响了世界范围的小麦产量[1],提高小麦的耐旱耐盐性是应对严峻气候变化和确保我国粮食安全的重大需求。然而,人们对小麦抗逆分子机制的认知并不充足[2]。小麦通过信号识别、信号传导和代谢调节来应对逆境,最终重新建立不同器官和细胞内的水势和离子稳态。植物体对逆境的承受力最终取决于其对膜代谢活性的调节和细胞间水分运输的能力[3]。
水通道蛋白(aquaporin,AQP)是主要控制水分转移的膜通道蛋白。AQP属于主要膜内在蛋白(major membrane intrinsic protein,MIP)超家族,主要分为四个进化枝,包括占比例最大的质膜内在蛋白(plasma membrane intrinsic proteins,PIPs);存在于共生根瘤类菌体周围膜上的类Nod26膜内在蛋白(nodulin26 - like intrinsic proteins,NIPs);位于液泡膜上的液泡膜内在蛋白(tonoplast intrinsic proteins,TIPs)以及小分子碱性膜内在蛋白(small and basic intrinsic proteins,SIPs)[4]。这四种类型的AQP具有高度保守的结构,六个跨膜的α螺旋通过五个短环连接,第二和第五个环包含高度保守的天冬酰胺-脯氨酸-丙氨酸基序(NPA,Asn-Pro-Ala),分别位于细胞膜两侧,其在形成具有底物特异性膜通道的过程中起重要作用[5]。不同的水通道蛋白亚家族具有不同的底物转运特性,在某些情况下,除运输水分外,也可以进行一些小分子物质运输,如氨分子[6]和CO2分子[7]等。NIP家族成员对水分转运的能力弱于PIP和TIP,主要进行某些有机物质和矿物质的转运,如硼、硅、硒、砷、锑元素等[8-9]。
拟南芥中的AQP家族成员为35个[10],水稻和玉米中分别为33和31个[11-12]。与这些植物相比,关于小麦中水通道蛋白基因的研究相对较少,目前报道的在小麦非生物逆境胁迫中起作用的水通道蛋白基因主要有 TdPIP1;1、 TdPIP2;1、 TaAQP7、 TaNIP和 TaTIP2;2等[13-15]。有学者将来自小麦的 TaTIP2;2在拟南芥中过表达,最终降低了植株的耐旱能力,显示了 TaTIP2;2对植株的耐旱行为具有负调控作用[14]。本研究将生物信息学分析与PCR手段相结合,得到了一个我们此前经生物信息学分析未能鉴定到的水通道蛋白基因,并对其特性进行分析,为该基因的功能研究奠定了基础。
1 材料与方法
1.1 植物材料与培养
所用小麦品种为科农199、Brundge 96、西农979、晋麦47和小偃22。科农199来自于中国科学院遗传与发育生物学研究所高彩霞课题组,Brundge 96来自于美国华盛顿州立大学作物与土壤学院Diter von Wettstein课题组,西农979、晋麦47和小偃22来自于西北农林科技大学高翔课题组。五个小麦品种在冬春性、分蘖、抽穗、抗逆性等方面均有不同,扩大了对目标片段进行初步鉴定的基因组背景范围;之后再选取耐旱性较好的科农199[16]进行胁迫处理和基因表达分析。
培养条件:每天光照14 h,温度25 ℃,暗培养10 h,温度20 ℃,湿度均为60%。
将正常生长7 d的科农199幼苗参照王稼苜等的方法,采用16.1%的PEG6000进行轻度干旱处理[17],参照刘丹等的方法,采用0.35 mol·L-1NaCl做盐胁迫处理[18],然后在1 h、5 h、1 d、7 d四个时期分别取正常生长和经处理的幼苗的叶和根,提取RNA,-80 ℃保存,用于基因的表达分析。
1.2 基因组DNA与RNA提取及cDNA合成
参照CTAB法从上述5个小麦品种的叶片中提取基因组DNA(gDNA),参照Trizol法从科农199(Kenong 199)正常生长及经处理后幼苗的叶和根中提取RNA,cDNA使用StarScript II First-strand cDNA Synthesis Mix(GenStar,北京)合成,-20 ℃保存。
1.3 引物设计与PCR扩增
从NCBI数据库、Uniprot数据库和Ensembl plant数据库中查找小麦水通道蛋白序列,用Clustalx 1.83软件进行多重序列比对,剔除来自不同数据库中的相同基因序列;然后用MEGA 6.0做进化树分析,根据进化树分析结果,将获得的AQP序列大致分为PIP1、PIP2、TIP、NIP、SIP 5个组,每个组内根据序列同源情况再分为几个小组,依据分组情况及序列保守性,选择合适的位点设计引物[15],所设引物见表1。以从5个小麦品种中提取的gDNA作为模板进行PCR扩增,PCR扩增反应总体系为20 μL:250 ng的gDNA模板,Taq酶0.1 μL(大连宝生物工程有限公司),dNTPs(25 μmol·L-1)2 μL,10×Buffer缓冲液2 μL,上下游引物(5 μmol·L-1)各1 μL,最后用ddH2O补至终体积。PCR反应程序为:94 ℃预变性5 min,94 ℃变性45 s,58~60 ℃退火45 s,72 ℃延伸90 s,35个循环,然后72 ℃延伸10 min,12 ℃保温。
1.4 基因片段克隆与测序
将扩增的PCR产物通过1%琼脂糖凝胶分离后,回收目的片段,并将其连在pUCm-T载体上,挑取单克隆测序。测序由上海生物工程技术服务有限公司完成。
1.5 序列生物信息学分析
将测序结果在NCBI和Ensembl plant数据库中利用BLAST工具进行比对,从中找出未知功能的基因对其进行生物学分析。用SMART数据库和NCBI的Conserved Domains在线服务器预测这些候选基因序列的保守结构域,其理化性质由ExPASy软件分析,亚细胞定位通过TargetP 1.1预测[19],蛋白激酶特异性磷酸化位点用KinasePhos软件预测,跨膜螺旋结构域用TMHMM Sever v.2.0预测。用MEGA 6.0软件构建系统进化树,利用Gene Structure Display Server预测基因的结构[20],用PlantCARE对基因启动子序列进行分析,用PHYRE 2 软件建立其3D模型[21]。
1.6 TaNIP4-1基因的表达分析
根据 TaNIP4-1基因的cDNA序列设计的实时定量PCR(qRT-PCR)正向引物为5′-GAAC ACGGTGGGCAGCG-3′,反向引物为5′-GCACC AGCTCCCGGATG-3′。qRT-PCR反应在Roche LightCycler 480仪器上进行,以小麦Actin基因作为内参,其正向和反向引物序列分别为5′-CAC ACTGGTGTTATGGTAGG-3′和5′-AGAAGGTGTGATGCCAAAT-3′。RT-qPCR反应总体系为15 μL:SYBR Mixture 7.5 μL,cDNA模板2 μL,ddH2O 5 μL,正反向引物各0.25 μL。其反应条件为95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,反应重复40个循环,每个样品三次生物学重复,以确保结果可靠。用公式2-△△Ct计算基因表达量,此外,还要计算其标准差。

表1 水通道蛋白基因扩增所用PCR引物Table 1 Primers for amplifing the variable region of the aquaporin genes
2 结果与分析
2.1 TaNIP4-1基因的获得
以提取的5个不同品种的gDNA为模板,利用设计的19对引物(表1)进行PCR扩增,对扩增后的产物进行1%琼脂糖凝胶电泳,其产物如图1所示。同一对引物扩增的PCR产物大小一致时,只选其中一个片段回收纯化,做T克隆后测序。经测序的19个PCR产物大小为459~1 180 bp。将这些产物的测序结果分别在NCBI和Ensembl plant数据库中进行比对,发现大部分基因片段与库中的小麦水通道蛋白基因相匹配,且匹配度均在95%以上;而A18/S18的PCR产物并没有在NCBI数据库中找到与该产物匹配度很高的基因,在Ensembl plant数据库中与之相匹配的小麦基因为 TRIAE_CS42_3AS_TGACv1_211831_AA0694780.1,其功能尚未可知。
从NCBI数据库中找到已报道的拟南芥、水稻和玉米以及小麦的NIP亚族中水通道蛋白基因的氨基酸序列。利用MEGA 6.0软件结合最大似然法将它们进行系统进化分析,进化树测试参数设为1 000。根据图2进化树分析结果可知, TRIAE_CS42_3AS_TGACv1_211831_AA0694780.1基因与 OsNIP4-1最为接近,且小麦与水稻均为单子叶植物,故将该基因归为NIP4组,并参照拟南芥中水通道蛋白命名法将其命名为 TaNIP4-1。
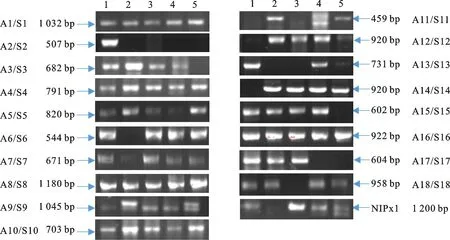
1:科农199;2:Brundge 96;3:西农979;4:晋麦47;5:小偃22
1:Kenong 199;2:Brundge 96;3:Xinong 979;4:Jinmai 47;5:Xiaoyan 22
图1小麦水通道蛋白可变区PCR扩增结果
Fig.1Amplifiedfragmentsofvariableregioninaquaporingenesofwheat
2.2 TaNIP4-1基因的生物信息学分析
2.2.1 保守结构域分析
将 TRIAE_CS42_3AS_TGACv1_211831_AA0694780.1基因的CDS序列提交到NCBI的 CDD在线服务器和SMART数据库中,分析该基因的保守结构域,分析结果显示该基因属于MIP超家族,A18/S18引物设计来源于之前数据库中已注明的小麦水通道蛋白NIP亚族的基因。
2.2.2 TaNIP4-1蛋白的理化特性分析
从Ensemble plant数据库中获得的信息可知,该基因位于3A染色体短臂,其DNA序列长度为1 315 bp,CDS序列长度为864 bp,含有3个外显子和2个内含子,编码的氨基酸数目为288,等电点为9.38,为弱碱性蛋白,相对分子质量为29.8 kDa,稳定系数为37.17,为稳定型蛋白;脂肪族指数为106.32,总平均亲水系数为0.614,即该蛋白为疏水性蛋白;含有丝氨酸和酪氨酸磷酸化位点各一个。
2.2.3 蛋白的多重序列比对分析
从NCBI数据库中找出已报道的玉米和水稻中的NIP亚族蛋白序列,并将它们与该基因蛋白序列通过Clustal-X 软件(1.81版本)进行比对,分析其保守区氨基酸序列,其结果见图3。发现该基因编码蛋白的氨基酸序列与所选的其他植物的水通道NIP亚家族的氨基酸序列具有高度同源性。该水通道蛋白基因家族NPA基序(Asn-Pro-Ala)含有2个保守NPA基序及6个保守跨膜区。
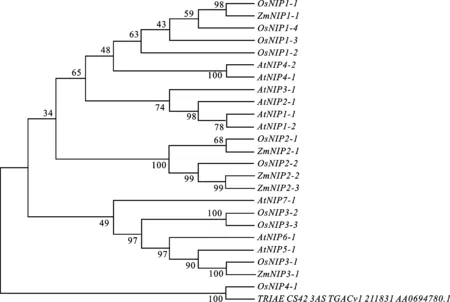
图2 TRIAE_CS42_3AS_TGACv1_211831_AA0694780.1基因系统进化树分析
2.2.4 亚细胞定位分析
水通道蛋白能否正常发挥功能,除了与它的选择性有关外,还依赖于该蛋白在亚细胞中的准确定位。实际上,除了部分蛋白能自身进行准确而及时的定位外,很多蛋白需要依靠分子间的互作才能正确进行定位,且只有正确转位后才能行使其转运功能。通过Target P 1.1 sever对TaNIP4-1进行亚细胞定位预测,发现该蛋白既没有叶绿体转运肽,也没有线粒体信号肽。使用TMHMM Sever v.2.0预测该基因的跨膜结构域,从图4中可以发现,该基因含有6个跨膜区,符合水通道蛋白的典型跨膜结构。
2.2.5 TaNIP4-1蛋白的3D模型
为了解 TaNIP4-1蛋白的结构性质,通过PHYRE 2服务器建立了该蛋白的3D模型。该模型构建时的置信度均为100%,氨基酸序列覆盖率为93%,因此,此蛋白质结构被认为是高度可靠的。从图5可以看出,该蛋白是由保守的沙漏模型及α螺旋束形成的6个长螺旋和两个额外的短螺旋组成的膜蛋白。
2.2.6 TaNIP4-1基因的启动子区序列分析
基因启动子区中的顺式作用元件可以与许多转录因子结合,进而调节其附近基因的转录,因此,这些元件在植物的胁迫反应中有重要作用。利用PlantCARE软件预测 TaNIP4-1基因起始密码子上游1 500 bp的DNA序列,发现该基因启动子区既包含Box-4、G-Box、I-Box、ACE等光响应元件,也含有激素响应元件,如ABRE为ABA响应元件,GARE-motif为赤霉素响应元件,CGTCA-motif和TGACG-motif为茉莉酸甲酯响应元件;此外,还包含有多个逆境胁迫响应元件,如MBS为干旱诱导响应元件,Box-W1为真菌诱导响应元件,而TC-rich repeats元件则参与抗性和胁迫反应。这些顺式作用元件的分析在一定程度上为了解并深入研究 TaNIP4-1的功能奠定了基础。
2.2.7 非生物胁迫下 TaNIP4-1基因表达分析
已有研究表明水通道蛋白在植物逆境胁迫中起着重要作用,为了进一步验证和鉴定 TaNIP4-1基因对非生物胁迫的响应,用qRT-PCR分析在干旱和盐胁迫处理下,小麦叶片和根组织中 TaNIP4-1基因的表达情况。从图6可以看出,干旱和盐胁迫处理下, TaNIP4-1基因基本呈一致的表达趋势。在小麦叶片中,干旱和盐分别处理1 h 后, TaNIP4-1基因表达上调,但并不显著,而在处理5 h后,该基因表达上调趋势明显,但处理1 d 后,该基因表达下调,且在处理7 d后,其表达量急剧下降。在小麦根部,经干旱处理后, TaNIP4-1基因表达基本呈先下降后上升趋势,但表达量差异并不显著;经盐胁迫处理后,该基因表达仍呈先下降后上升趋势,且在处理7 d后, TaNIP4-1基因表达显著上调。TaNIP4-1很可能是小麦根部应对盐胁迫反应过程中的次级水通道蛋白。可见,无论在叶片还是根部, TaNIP4-1基因都参与了小麦应对非生物胁迫的响应过程。

图3 TaNiP4-1基因蛋白序列与玉米和水稻中的NIp亚族蛋白的序列比对 (蓝色背景的为NPA motif,其他颜色的依次为6个跨膜区)
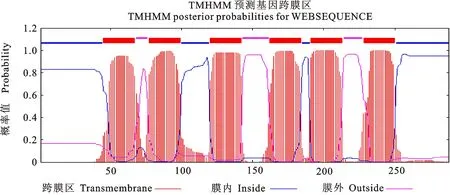
图4 TaNIP4-1基因的跨膜域分析
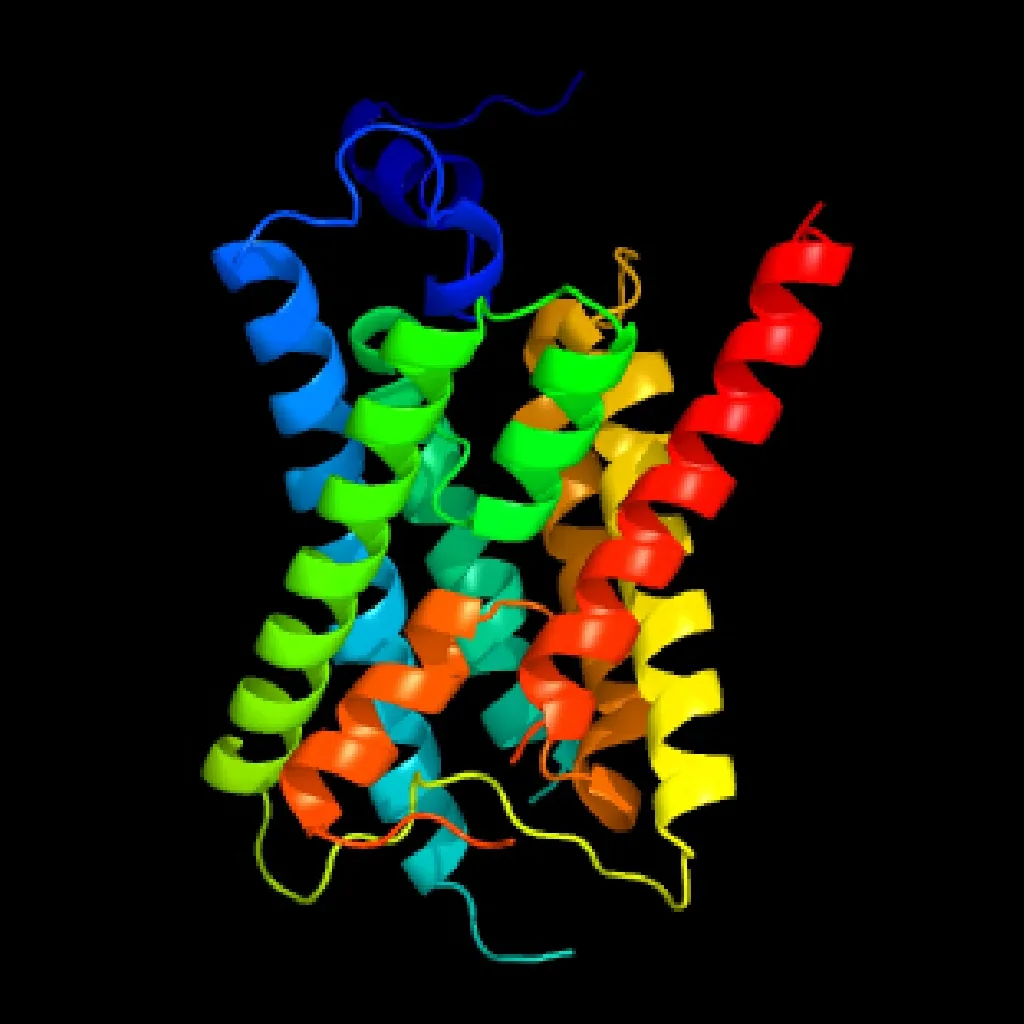
图5 TaNIP4-1蛋白的3D模型预测
3 讨 论
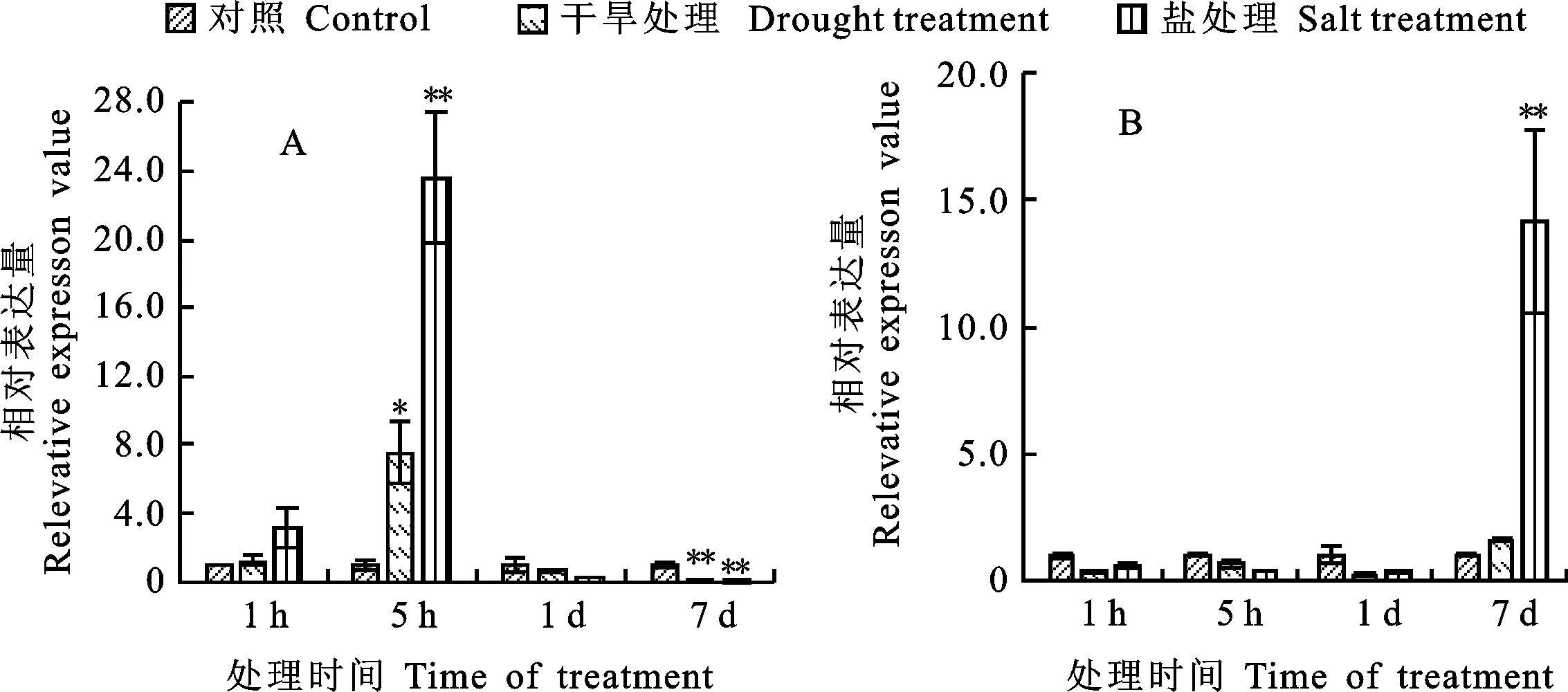
*和**分别表示干旱处理和盐处理与对照的差异在0.05和0.01水平上显著。
* and ** indicate significant difference between stress treatment and control at 0.05 and 0.01 level,respectivly.
图6干旱和盐胁迫下TaNIP4-1基因在小麦叶(A)和根(B)中的相对表达量
Fig.6RelativeexpressionlevelofTaNIP4-1geneinwheatleavesandrootsunderdroughtandsaltstresses
植物一方面通过光合作用吸收CO2作为生产有机物质的原料,另一方面通过呼吸作用提供能量、散失水蒸气维持机体的平衡。而呼吸作用的正常进行,依赖于源源不断的由植物体根部产生至体表气孔下方结束的水分运输[22]。水分由土壤进入根部及进一步运输到各个器官需要经过逐级转运。在植物体内,水转运的方式基本分三种:非质体转运、共质体转运和细胞间转运[23]。非质体转运一般是指水分子通过细胞壁和细胞间隙转运的过程;共质体转运是水分子通过连续的细胞质之间的结合处(胞间连丝)进行的转运;细胞间转运则指水分子通过细胞进行的转运,它包括水分子穿过质体膜和液泡膜的过程,但不涉及胞间连丝[24]。运水量最大的是细胞间转运,而控制细胞间转运的水通道蛋白也就成了控制植物体内水分运输的关键。然而水通道蛋白的小分子物质转运却不限于水分子,也包括环境中已经溶解的小分子,如硼酸分子[25]等。在整个植物体水分转运系统中,AQP定位于各个器官最基本的单位:细胞,乃至细胞亚单位上,以最终端的方式出现,对细胞乃至细胞器的含水量进行最基本的调控[12]。因而,AQP的功能表现对植物体应对各种环境变化来说意义非凡。
植物AQP可以发生磷酸化,甲基化,去乙酰化,氨基端乙酰化以及泛素化等修饰过程,因此其分子表现形式远大于家族成员的数量[15,20]。AQP受到上游信号如环境pH值、钙离子浓度和活性氧基团的广泛调控,作为响应,AQP及时接收信号并进行植物器官中水分以及其他物质的传递[26]。AQP在植物再生、细胞延伸、气孔开放、果实成熟和种子发芽中均起关键作用[27]。在许多植物物种中,AQP都对植物体应对非生物胁迫产生积极影响。干旱的环境会促进小麦水通道蛋白 TaAQP7提升转录水平,而过表达 TaAQP7的烟草植株表现出耐旱能力的提升[28]。同时,AQP的表达也受到环境条件影响。本研究中,应用分子生物学手段鉴定出小麦中尚未被发现的水通道蛋白基因 TaNIP4-1,并对其进行盐和干旱胁迫下的表达分析,确认该基因参与了小麦逆境胁迫应答响应过程。目前,AQP中关于PIP和TIP亚族的研究相对较多,而涉及NIP亚族的则很少,尤其是在小麦抗逆方面,因此 TaNIP4-1基因的发掘对NIP亚族基因功能的补充以及解析小麦应对逆境的响应机制有重要意义。对于 TaNIP4-1基因的功能及其具体的作用方式还有待进一步研究。
[1]ALI S,LIU Y,ISHAQ M,etal.Climate change and its impact on the yield of major food crops:Evidence from Pakistan [J].Foods,2017,6(6):e39.
[2]ALI MA,AZEEM F,ABBAS A,etal.Transgenic strategies for enhancement of nematode resistance in plants [J].TrontiersinPlantsScience,2017,8:750.
[3]HEINEN R B,YE Q,CHAUMONT F.Role of aquaporins in leaf physiology [J].JournalofExperimentalBotany,2009,60(11):2971.
[4]DANIELSON JA,JOHANSON U.Unexpected complexity of the aquaporin gene family in the mossPhyscomitrellapatens[J].BMCPlantBiology,2008,8:45
[5]ZHAO C X,SHAO H B,CHU L Y.Aquaporin structure-function relationships:water flow through plant living cells [J].ColloidsandSurfacesBBiointerfaces,2008,62(2):163.
[6]COSKUN D,BRITTO DT,LI M,etal.Rapid ammonia gas transport accounts for futile transmembrane cycling under NH3/NH4+toxicity in plant roots [J].PlantPhysiology,2013,163(4):1859.
[7]MORI IC,RHEE J,Shibasaka M.CO2transport by PIP2 aquaporins of barley [J].PlantandCellPhysiology,2014,55(2):251.
[8]BIENERT G P,SCHSSLER M D,JAHN T P .Metalloids:essential,beneficial or toxic major intrinsic proteins sort it out[J].TrendsinBiochemicalSciences,2007,33:20.
[9]ZHAO XQ,MITANI N,YAMAJI N,etal.Involvement of silicon influx transporter OsNIP2;1 in selenite uptake in rice[J].PlantPhysiology,2010,153:1871.
[10]JOHANSON U,KARLSSON M,JOHANSSON I,etal.The complete set of genes encoding major intrinsic proteins in Arabidopsis provides a framework for a new nomenclature for major intrinsic proteins in plants [J].PlantPhysiology,2001,126(4):1358.
[11]CHAUMONT F,BARRIEU F,WOJCIK E,etal.Aquaporins constitute a large and highly divergent protein family in maize [J].PlantPhysiology,2001,125(3):1206.
[12]SAKURAI J,ISHIKAWA F,YAMAGUCHI T,etal.Identification of 33 rice aquaporin genes and analysis of their expression and function [J].Plant&CellPhysiology,2005,46(9):1568.
[13]HUANG C,ZHOU S,HU W,etal.The wheat aquaporin gene TaAQP7 confers tolerance to cold stress in transgenic tobacco [J].ZeitschriftfürNaturorschungC,2014,69(3-4):142.
[14]XU C,WANG M,ZHOU L,etal.Heterologous expression of the wheat aquaporin gene TaTIP2;2 compromises the abiotic stress tolerance ofArabidopsisthaliana[J].PLoSOne,2013,8(11):e79618.
[15]PANDEY B,SHARMA P,PANDEY D M,etal.Identification of new aquaporin genes and single nucleotide polymorphism in bread wheat [J].EvolutionaryBioinformaticsOnline,2013,9(9):437.
[16] 姚艳荣,贾秀领,马瑞昆,等.冬小麦田间水分反应特性产量评价指标研究[J].中国农学通报,2009,25(17):70.
YAO Y R,JIA X L,MA R K,etal.Study on the evaluation index of water response characteristics of winter wheat [J].ChineseAgriculturalScienceBulletin,2009,25(17):70.
[17] 王稼苜,张志勇,欧行奇等,PEG胁迫对8个不同小麦品种幼苗根系的影响[J].河南科技学院学报,2015,43(3):1.
WANG J M,ZHANG Z Y,OU X Q,etal.Effects of PEG stress on seedling roots of eight different wheat cultivars [J].JournalofHenanInstituteofScienceandTechnology,2015,43(3):1.
[18] 刘 丹,王建贺,王从磊,等.不同盐浓度胁迫对小麦萌发和幼苗生长的影响[J].中国农学通报,2016,32(24):49.
LIU D,WANG J H,WANG C L,etal.Effects of different salt concentration stress on wheat germination and seedling growth [J].ChineseAgriculturalScienceBulletin,2016,32(24):49.
[19]WANG M,YUE H,FENG K,etal.Genome-wide identification,phylogeny and expressional profiles of mitogen activated protein kinase kinase kinase(MAPKKK) gene family in bread wheat(TriticumaestivumL.)[J].BMCGenomics,2016,17(1):668.
[20]MENG D,LI Y,BAI Y,etal.Genome-wide identification and characterization of WRKY transcriptional factor family in apple and analysis of their responses to waterlogging and drought stress [J].PlantPhysiology&BiochemistryPpb,2016,103:71.
[21]LI X,FENG B,ZHANG F,etal.Bioinformatic analyses of Subgroup-A members of the wheat bZIP transcription factor family and functional identification of TabZIP174 involved in drought stress response[J].FrontiersinPlantScience,2016,7:1643.
[22]XUE D,ZHANG X,LU X,etal.Molecular and evolutionary mechanisms of cuticular wax for plant drought tolerance [J].FrontiersinPlantScience,2017,8:621.
[23]STEUDLE E,PETERSON C A.How does water get through roots [J].JournalofExperimentalBotany,1998,49(322):775.
[24]UEHARA M,WANG S,KAMIYA T,etal.Identification and characterization of anArabidopsismutant with altered localization of NIP5;1,a plasma membrane boric acid channel,reveals the requirement for D-galactose in endomembrane organization [J].Plant&CellPhysiology,2014,55(4):704.
[25]MAUREL C,BOURSIAC Y,LUU DT,etal.Aquaporins in plants [J].PhysiologicalReview,2015,95(4):1321.
[26] FORREST K L,BHAVE M.The PIP and TIP aquaporins in wheat form a large and diverse family with unique gene structures and functionally important features [J].Functional&IntegrativeGenomics,2008,8(2):115.
[27] FRANGNE N,MAESHIMA M,SCHFFNER A R,etal.Expression and distribution of a vacuolar aquaporin in young and mature leaf tissues ofBrassicanapusin relation to water fluxes[J].Planta,2001,212(2):270.
[28] ZHOU S,HU W,DENG X,etal.Overexpression of the wheat aquaporin gene, TaAQP7,enhances drought tolerance in transgenic tobacco [J].PLoSOne,2012;7(12):e52439.
CloningandBioinformaticsAnalysisofTaNIP4-1inWheat
CAORongzhen,WENShanshan
(College of Agronomy, Northwest Agriculture and Forestry University, Yangling, Shaanxi 712100, China)
Aquaporins can not only transport water and some small molecules through the membrane, but also have an effect on abiotic stress. In order to study the function of aquaporins involved in drought resistance mechanism of wheat, reported wheat aquaporin gene sequences were selected from the NCBI and Ensemble Plant databases. A total of 19 pairs of primers were designed, and 19 gene fragments were cloned from five wheat cultivars’s genome using PCR. An aquaporin gene, which has not been identified in the previous bioinformatics analysis, was found via BLAST analysis and some bioinformatics analysis was further carried out. The results showed that one of the 19 genes was not yet reported and it was named as TaNIP4-1 according to the phylogenetic tree and conserved domain analysis. The physical and chemical properties analysis showed that the gene is located on the chromosome 3AS,DNA sequence length is 1315 bp,coding sequence length is 864 bp, containing three exons and two introns, encoding 288 amino acids and the protein is hydrophobic. In addition, the transmembrane domain analysis and 3D model indicated that the protein contains a conservative hourglass model with six transmembrane regions and two conserved NPA motif. Subcellular localization prediction results indicated that the gene is localized on the plasma membrane, while promoter analysis revealed this gene contained cis-acting regulatory elements which were related to drought.The qRT-PCR results showed that the expression level of TaNIP4-1 in wheat leaves was obviously increased after 5 h both under drought and salt treatments,and the expression level of TaNIP4-1 in wheat roots was significantly up-regulated after 7 days under salt treatment. Thus, these results suggested that this gene was response to the abiotic stress.
Wheat; Aquaporin; TaNIP4-1; Bioinformatics
2017-05-22
2017-08-26
西北农林科技大学引进人才科研启动项目(Z111021401);西北农林科技大学基本科研-创新一般项目(Z109021508)
E-mail:1573869152@qq.com
闻珊珊(E-mail:sswen@nwsuaf.edu.cn)
S512.1;S330
A
1009-1041(2017)10-1285-09

