青稞全蚀病和根腐病生防毛壳菌的筛选及鉴定
岳海梅,庄 华,巩文峰,张新军
(1.西藏农牧学院植物科学学院,西藏林芝 860000; 2.西北农林科技大学植物保护学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100; 3.西藏高原生态研究所,西藏林芝 860000)
青稞全蚀病和根腐病生防毛壳菌的筛选及鉴定
岳海梅1,2,庄 华2,巩文峰1,张新军3
(1.西藏农牧学院植物科学学院,西藏林芝 860000; 2.西北农林科技大学植物保护学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100; 3.西藏高原生态研究所,西藏林芝 860000)
青稞根腐病与青稞全蚀病是西藏青稞的常见根部病害,为筛选适合于防治青稞全蚀病与根腐病的毛壳菌,通过皿内拮抗试验、发酵粗提物抑菌试验和温室盆栽防效试验对4株毛壳菌的抑菌活性进行了鉴定,通过形态学和分子生物学方法对高活性菌株进行了鉴定。结果发现,在皿内拮抗试验中,毛壳菌41-4在培养第7天至第9天时,对青稞根腐病和全蚀病的抑制率分别达到60.00%和44.44%,抑菌带宽度均达到1.4 cm。培养7 d时毛壳菌41-4发酵粗提物对青稞根腐病和全蚀病的抑制率分别达到64.44%和60.00%,抑菌带宽度均达到1.5 cm。在温室盆栽防效试验中,毛壳菌41-4对青稞根腐病和全蚀病的发病严重度和病情指数均有降低作用,防效分别达到62.67%和39.45%。结合形态学特征和核糖体基因内转录间隔区(rDNA-ITS)序列构建系统发育树,将菌株41-4鉴定为球毛壳菌Chaetomiumglobosum。该生防菌株可用于开发微生物菌肥,对西藏的无公害农业生产和保护西藏的原生态具有重要意义。
青稞全蚀病;青稞根腐病;毛壳菌;筛选;鉴定
青稞(Hordeumvulgarevar.nudumHooker f.)又称裸大麦、元麦、米麦,主要分布在青藏高原的西藏和青海一带,是西藏主要的粮食作物之一,占西藏粮食作物总播种面积的 61.50%[1]。近年来,随着西藏经济的发展和人民生活水平的日益提高,农民对种植粮食的生产积极性提高,但是随之而来的农作物病害成为影响西藏农业持续、稳定和健康发展的障碍,其中,青稞根腐病和全蚀病是主要的青稞根部病害。青稞根腐病是由真菌引起的世界性病害,该病害在加拿大、南亚、南非和中国的北方地区发生频繁,严重时导致作物减产可达15%~30%,可导致青稞品质严重变劣[2-3]。青稞全蚀病在西藏青稞种植区也普遍发生,造成严重损失。
毛壳菌广泛分布于自然界各种含纤维素的基质、土壤和有机肥中,能够产生大量的纤维素酶[4],可有效降解纤维素、木质素等难降解大分子有机物,能够拮抗土壤中的某些微生物,达到抑制病原菌生长和生物防治的作用[5-6]。现己发现有些毛壳菌,如球毛壳(Chaetomiumglobosum)和角毛壳(C.cupreum) 可以用来防治稻瘟病菌、苹果黑斑病、小麦叶锈菌、种苗猝倒病和引起种子腐烂的多种病原菌[7-8]。利用毛壳菌制成的杀菌剂可以防止柑橘根、茎部的腐烂[9]。李 梅等[10]将外源的多菌灵抗性基因导入球毛壳菌,可提高球毛壳菌防治病害的能力。杨 谦等与泰国的Kasem博士合作,研制出了第一代毛壳菌生物防治制剂,在泰国已用于生产[11]。本研究拟通过对已分离的毛壳菌进行抗菌试验,筛选出对西藏常见的青稞根腐病和青稞全蚀病具有防效的毛壳菌,为西藏青稞的无公害生产和西藏农业的可持续发展提供参考。
1 材料与方法
1.1 菌株来源
青稞全蚀病菌(Gaeumannomycesgraminis)、青稞根腐病菌(Bipolarissorokiniana)、毛壳菌41-4、毛壳菌39-6-2、毛壳菌LZT0016、毛壳菌Z24-12,均来自西藏农牧学院植物病理学试验室,青稞品种为藏青320。
1.2 皿内拮抗试验
将活化的毛壳菌、青稞全蚀病菌和青稞根腐病菌分别用直径为7 mm的无菌打孔器打孔,用灭菌的镊子分别取毛壳菌和病原菌接种在 PDA平板上,毛壳菌和病原菌相距4.5 cm,同时接种,以只接种病原菌的处理作为对照,重复3次。于28 ℃恒温培养9 d,分别在培养的第3天、第5天、第7天和第9天测量病原菌的菌落半径,计算抑制率,计算公式为:
抑制率=(对照病原菌的菌落半径-对峙病原菌的菌落半径)/对照病原菌的菌落半径×100%
1.3 毛壳菌发酵粗提物的提取
1.3.1 培养基配制
一级培养基:称取马铃薯200 g,去皮切成小块,在1 000 mL的蒸馏水中煮沸20 min,用纱布滤去残渣,在滤液中加入20 g葡萄糖,3 g KH2PO4,1.5 g MgSO4·7H2O,1.5 g酵母膏,用NaOH调pH至5.8~6.0。
二级培养基:在大米中加入0.3%的蛋白胨并混合均匀,115 ℃灭菌 30 min。
1.3.2 毛壳菌的发酵
无菌条件下将生防毛壳菌接种到无菌的一级培养基中,28 ℃振荡恒温培养3 d,转速为140 r·min-1,得到一级种子。将一级种子按10%的接种量均匀接种到无菌的二级培养基中,恒温培养箱中28 ℃培养25 d。
1.3.3 毛壳菌粗提物的提取
室温下,用等体积的乙酸乙酯萃取二级培养后的毛壳菌3次,合并乙酸乙酯相,用旋转蒸发仪于45 ℃浓缩蒸干,得淡黄色浸膏,用二甲基亚砜(DMSO)溶解,得到浓度为1 g·L-1的浓缩液。
1.4 毛壳菌发酵粗提物抑菌试验
将1.3.3中的粗提物浓缩液用DMSO配置成200 μg·mL-1的稀释液[12],以DMSO为阴性对照,以30 mg·mL-1的60%的多菌灵溶液为阳性对照。在无菌条件下,将靶标菌的菌饼接种在PDA平板中央,在距靶标菌3.5 cm处分别用直径为7 mm的无菌打孔器打4个孔,孔中分别两两注入200 μg·mL-1的生防毛壳菌发酵粗提物的稀释液、阴性对照液或阳性对照液各150 μL,采用菌落生长速率法测定各处理对病原菌的抑制率。
1.5 温室盆栽防效试验
1.5.1 无菌土的制备
将试验土和砂过3 mm筛后按1∶1比例混匀,置于170 ℃干燥箱中恒温干热灭菌3次,每次灭菌3 h;花盆规格为9 cm×9 cm,每个花盆装灭菌土300 g。
1.5.2 生防菌的接种及防效测定
取直径为7 mm活化的毛壳菌菌饼置于PDB液体培养基中[13],28 ℃振荡培养5~7 d,转速160 r·min-1;取预先催芽并露白的藏青320种子在100 mL的毛壳菌培养液中浸泡12 h,晾干,用PDB培养液浸种作为阴性对照,30 mg·mL-1的60%的多菌灵溶液浸种作为阳性对照[14]。将活化的青稞全蚀病菌和根腐病菌打成直径为1 cm 的菌饼,放在装有灭菌砂土的花盆中,每个花盆中放入10片菌饼。将青稞种子的根端朝下置于菌饼上,每片菌饼上放1粒青稞种子,最后用砂土(厚度约0.5 cm)覆盖。在人工气候箱中22 ℃保湿培养10 d,记载发病率、病情指数和防效。青稞全蚀病和根腐病的分级标准同孙炳剑等[15]方法:
发病率=发病的株数/调查的总株数×100%
病情指数=∑(各级病根数×该病级值)/(调查总根数×最高级值)×100
防效=(对照病情指数-处理病情指数)/对照病情指数×100%
1.6 毛壳菌的鉴定
1.6.1 毛壳菌的形态学鉴定
对生防效果较好的毛壳菌进行鉴定,形态学鉴定以Arx 等[16]方法为主要基础和依据。将毛壳菌菌株接种到玉米粉培养基(CMA)平板上,28 ℃黑暗培养并定期观察,待子囊果成熟时,在Nikon体式解剖镜下用解剖针挑取单个子囊果,制成水玻片,通过莱卡(Leica)显微镜DM5000观察子囊果的颜色和形态、附属丝的形态、子囊的颜色和形态、子囊孢子的大小、颜色、萌发孔位置等特征并进行拍照,结合菌株在CMA培养基上的菌落特征,记录子囊果的成熟时间,结合子囊果、附属丝、子囊和子囊孢子的特征进行鉴定。每个菌株鉴定的个体数量不少于20个。
1.6.2 毛壳菌的分子鉴定
生防毛壳菌基因组DNA的提取参考甘丽萍等[17]的方法,并略有改进。用真菌核糖体基因内转录间隔区(rDNA-ITS)通用引物ITS-1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′),(上海美吉生物科技有限公司合成)对菌株的rDNA-ITS区进行PCR扩增,PCR反应体系为25 μL: 10×PCR缓冲液2.5 μL,DNA模板为15 ng,2.5 mmol·L-1dNTP 2.0 μL,10 μmol·L-1引物各1 μL,5 U·μL-1Taq酶0.2 μL,用双蒸水将反应体系补足至25 μL。反应程序:95 ℃预变性3 min;95 ℃变性30 s,53 ℃退火40 s,72 ℃延伸30 s,35个循环;72 ℃延伸10 min。
PCR产物的纯化及序列测定由上海美吉生物科技有限公司完成,在GenBank中利用Blast进行同源序列查找,选择24个相关种的rDNA-ITS核苷酸序列,使用CLUSTALX软件进行对排,用MEGA 5.10在重复1 000次下构建系统发育树(选择Farrowialongicollea为外群)。
2 结果与分析
2.1 皿内拮抗试验结果
从表1可以看出,毛壳菌41-4在青稞根腐病和青稞全蚀病菌培养第3天时表现出抑菌效果,随着培养时间的延长,抑菌效果逐渐稳定,在第7~9天时抑菌率显著提高,对青稞根腐病的抑菌率达到60.00%,对青稞全蚀病的抑菌率达到44.44%。毛壳菌LZT0016在青稞根腐病菌培养第3天时抑菌率最高(35%),对青稞全蚀病的抑菌效果随着时间的延长逐渐增强,但最高只达到24.44%。毛壳菌39-6-2和Z24-12在青稞根腐病培养第3天时没有抑菌效果,反而表现出促进病原菌生长的情况,随着培养时间的延长对青稞根腐病表现一定抑菌效果,抑菌率最高分别为22.22%和31.11%;对青稞全蚀病的抑菌率随着培养时间的延长,逐渐增大,最高抑菌率为33.33%和12.20%。同时,从图1可以看出,毛壳菌41-4与青稞根腐病菌和青稞全蚀病菌对峙培养时,均形成明显抑菌带,对两种病原菌的抑菌带宽度均达到1.4 cm。
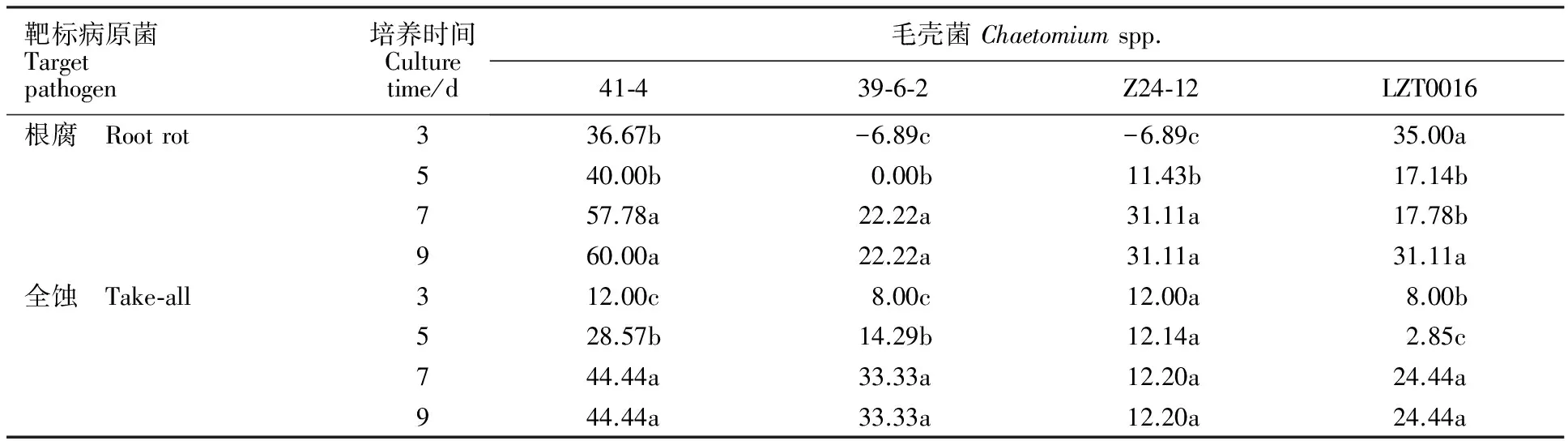
表1 4株毛壳菌对青稞根腐病菌和全蚀病菌的抑菌率Table 1 Inhibition rate of four strains of Chaetomium spp. on root rot and take-all disease in hulless barley %
同列数据后的不同字母表示0.05水平差异显著。下同。
Different letters following values indicate significant difference at 0.05 level. The same below.
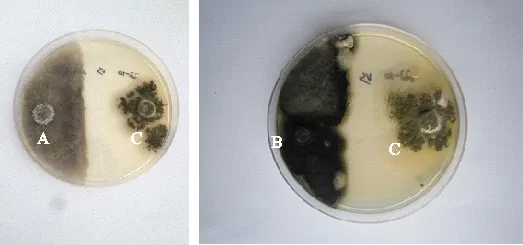
A:全蚀病菌;B:根腐病菌;C:毛壳菌41-4。
A:Take-all; B:Root rot; C:Chaetomiumspp. 41-4.
图1毛壳菌41-4对青稞根腐病和青稞全蚀病的抑菌效果
Fig.1InhibitioneffectofChaetomiumspp.41-4onrootrotdiseaseandtake-alldiseaseinhullessbarley
2.2 毛壳菌发酵粗提物的抑菌效果
从表2可知,毛壳菌41-4的发酵粗提物对青稞根腐病和青稞全蚀病有较好的抑菌效果,培养7 d时的抑菌率分别达到64.44%和60.00%,与阳性对照30 mg·mL-1的60%多菌灵抑菌效果相当。毛壳菌LZT0016对两种病原菌也有抑菌作用,但抑菌率随培养时间推移持续下降,在病原菌培养第7天时,抑菌率仅为10.00%;毛壳菌39-6-2和Z24-12对两种青稞病原菌在培养第7天时没有抑菌效果。从图2可以看出,毛壳菌41-4的发酵粗提物对两种青稞病原菌均形成明显的抑菌带,抑菌带宽度均达1.5 cm。
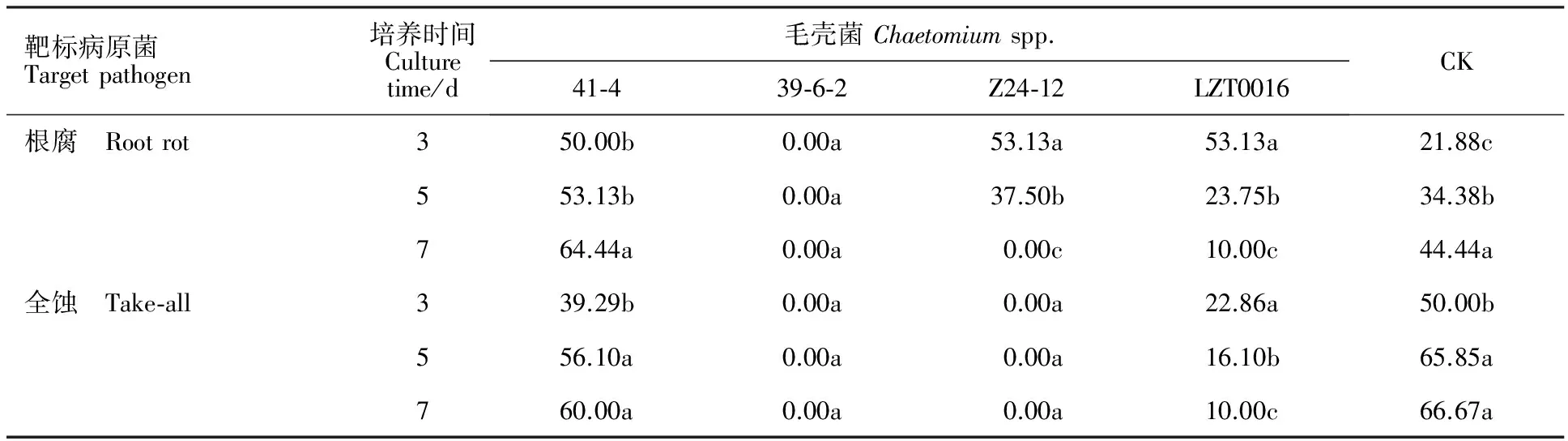
表2 4株毛壳菌发酵粗提物对青稞根腐病菌和青稞全蚀病菌的抑菌率Table 2 Inhibition rate of four strains of crude extract of Chaetomium spp. on root rot and take-all disease in hulless barley %
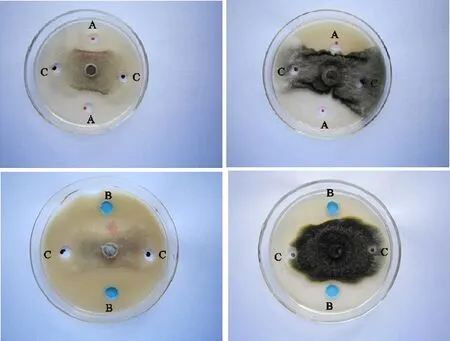
A:毛壳菌41-4发酵粗提物;B:阳性对照;C:阴性对照。左图为全蚀病菌,右图为根腐病菌。
A:Crude fermentation extract fromChaetomiumspp. 41-4; B:Positive CK; C:Negative CK;Left is take-all,and right is root rot.
图2毛壳菌41-4发酵粗提物对青稞根腐病菌和青稞全蚀病菌的抑菌效果
Fig.2 Antibacterial effect of crude fermentation extract from Chaetomium spp.41-4 on root rot and take-all disease in hulless bartey
2.3 毛壳菌的盆栽防效
从表3可以看出,毛壳菌41-4在降低青稞根腐病和青稞全蚀病的发病率上没有明显作用,但两种病害的发病严重度均降低,病情指数明显下降,表现出较好的防效,其防效仅次于30 mg·mL-1的60%多菌灵,其他3株毛壳菌在降低发病率和病性指数上也有一定作用,对两种青稞病害的防效较低。
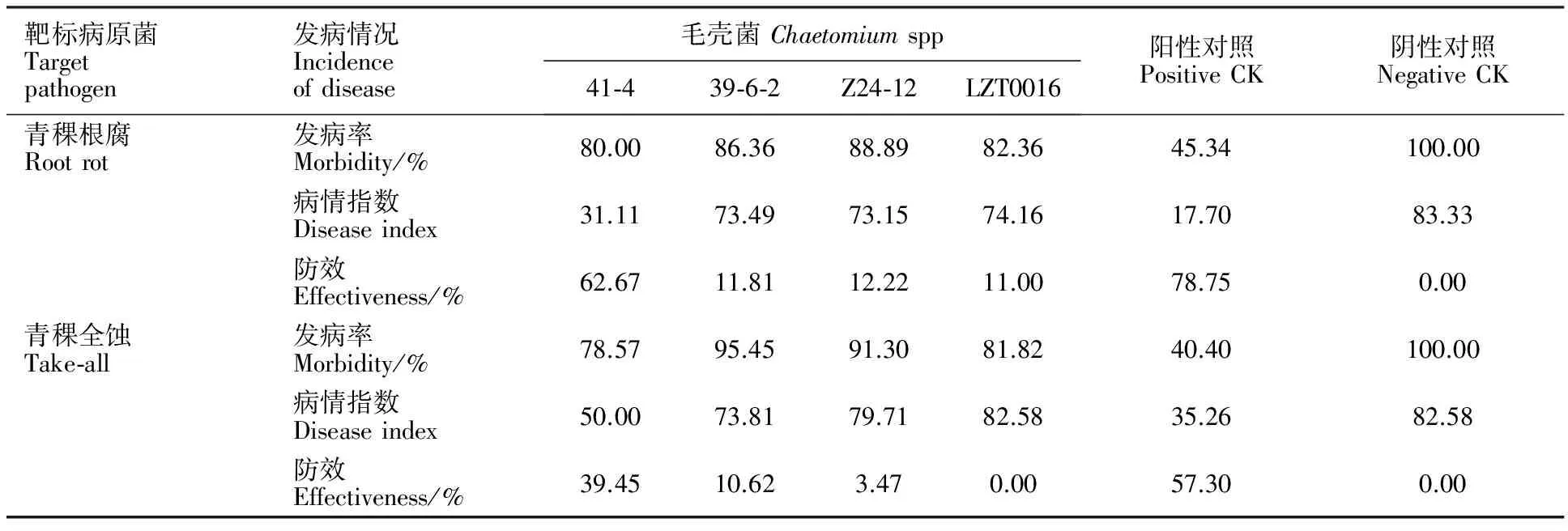
表3 4株毛壳菌对青稞根腐病和青稞全蚀病的盆栽防效Table 3 Potted control effect of four strains of Chaetomium spp. on root rot and take-all disease in hulless barley
2.4 毛壳菌的形态鉴定结果
菌株41-4具有以下特点:菌落浅色,日平均生长速率7~8 mm,气生菌丝浅色,苔藓状,致密,有浅橙色分泌物溢出;子囊果表生,球形至卵圆形,子囊果直径165~245×239~282 μm,有固定孔口,子囊果7 d开始成熟,子囊果果壁在反射光下呈橄榄褐色或灰褐色;果壁细胞多边形状或不规则形,有棱角,4~5 μm;附属丝发达,周生,直或略弯曲成波浪状,褐色,具疣,具隔,基部宽约3~4.5 μm,长度可达500 μm;子囊棍棒状,具柄,簇生,内含8个子囊孢子,容易消解,含柄部分50~80×30~40×10~15 μm;子囊孢子褐色,柠檬形,厚壁,两侧平滑,两端略突起,7.5~8.5×9.2~10.2 μm,有1个顶生萌发孔(图3)。根据形态学特征将菌株41-4鉴定为球毛壳菌Chaetomiumglobosum。该毛壳菌为土壤分离物,采集地为西藏林芝市排龙乡帕龙藏布河沟,海拔2 000 m,地理位置为N:30°01′,E:95°01′。
2.5 毛壳菌的分子鉴定结果
对毛壳菌41-4进行基因组DNA的提取,采用真菌通用引物ITS-1F和ITS4进行扩增后得到长度约为600 bp的目标片段,测序获得了567 bp核苷酸序列,将测定的序列提交GenBank(登录号:KY132166),通过选择24个相关种的rDNA-ITS序列进行同源性比对,用MEGA5.10软件构建系统发育树,从图4可以看出,毛壳菌41-4与Chaetomiumglobosum(FN868476、KJ863531)等在99%相似水平上聚为一类,从分子水平上验证了毛壳菌41-4与球毛壳菌Chaetomiumglobosum的亲缘关系最近。
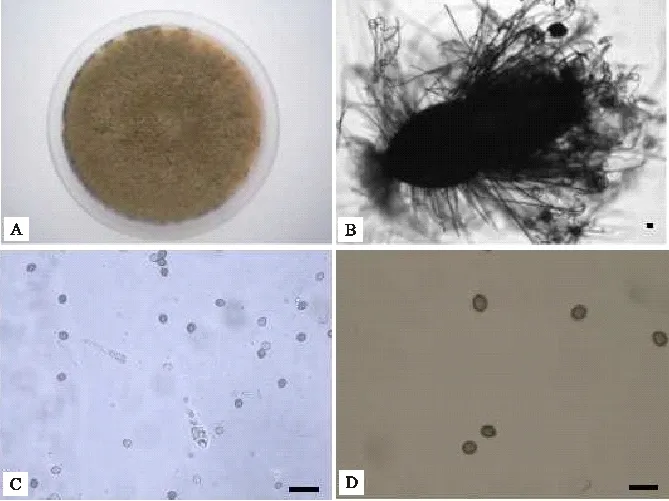
A:菌落;B:子囊果; C:子囊; D:子囊孢子 (比例尺:B=15 μm;C,D=30 μm)。
A:Colony; B:Ascomata; C:Asci; D:Ascospores(Scale bars:B = 15 μm; C,D = 30 μm).
图3毛壳菌41-4的形态特征
Fig.3MorphologicalcharacteristicsofChaetomiumspp.41-4
3 讨 论
在皿内拮抗试验中,病原菌培养3 d时,毛壳菌39-6-2和Z24-12不但没有抑菌作用反而表现出一定的促生长作用,推测这两种毛壳菌分泌物中含有促青稞全蚀病和根腐病菌生长的因子,当培养至第7天至第9天时,4株毛壳菌生长成熟,此时产生的抗菌物质的量较大,对病原菌生长表现出抑制作用,毛壳菌41-4的抑菌作用最好。
在毛壳菌发酵粗提物的抑菌试验中,39-6-2对供试病原菌无抑菌作用,毛壳菌Z24-12和LZT0016在根腐病菌生长至第3天时表现出较好的抑菌性,随着培养时间的延长,抑菌能力逐渐减弱甚至消失,可能与这两株毛壳菌活性物质的稳定性有关,毛壳菌41-4在该试验中表现出稳定而明显的抑菌效果。

括号中为相关菌株在GenBank 登记号,分支处数值表示自举值。尺标表示每个核苷酸位点上的0.1替换值。
Numbers in parentheses represent the accession numbers of the related isolates in GenBank,The numbers in each branch points denote the percentage supported by bootstrap. Scale bar represents 0.1 substitutions per nucleotide position.
图4基于rDNA-ITS序列构建的毛壳菌41-4的系统发育树
Fig.4PhylogenetictreeofChaetomiumspp.41-4constructedbasedonrDNA-ITSsequences
在盆栽防效试验中,4株毛壳菌对降低两种青稞病害发病率的作用均不明显,毛壳菌41-4对两种病害的病情指数和防效具有较好降低效果,在生产中可将该菌开发为种子包衣剂,用于病害的预防,或者开发相关生物肥料,用于青稞根部病害的预防。
国内外学者对毛壳菌的生物防治进行了系列研究,发现毛壳菌能够产生大量化学物质,不仅起到刺激植物生长的作用,而且还有助于改善土壤肥力,从而促进植物的生长并提高作物的产量。毛壳菌所产生的代谢物质,还能够诱导植物某些组织抗氧化能力的增强,从而提高植物的抗病能力[18]。施加毛壳菌菌肥能促进黄瓜生长,提高其产量,并改善其品质及农业生态环境[19]。宋富海等研究表明,球毛壳菌肥可提高土壤酶活性[20],丛国强等[21]研究表明,球毛壳菌促进小麦根系发育和植株生长并影响小麦的抗旱性。夏宣宣等[22]将球毛壳菌作为菌肥,发现其能在一定程度上提高杨树的根系生理活性,提高杨树叶片对光能的利用效率,有利于改善杨树叶片的光合机构运转状态,提高叶片的光合作用效率。印 容等[23]研究表明,球毛壳菌对油菜根肿病的防效为76.88%。本试验筛选的球毛壳菌41-4来源于西藏,对西藏主要的粮食作物青稞的两种根部病害具有较好的生防效果,该菌株可以开发成菌肥用于西藏的农业生产,可提高植物抗性,减少化学农药的使用,对西藏的无公害生产和保护西藏的原生态具有重要意义。本研究中球毛壳菌41-4的发酵粗提物具有明显的抑菌效果,具体是哪些物质成分在发挥重要作用,还需要做进一步的研究。
[1] 强小林.西藏青稞研究的现状与发展[J].西南农业学报,1991,4(1):109.
QIANG X L.Current status and prospects of research on the naked barley in Tibet [J].SouthwestChinaJournalofAgriculturalSciences,1991,4(1):109.
[2]WILDERMUTH G B.Geographic distribution of common root rot andBipolarissorokiniana in Queensland wheat soils [J].AustralianJournalofExperimentalAgriculture,1986,26(5):601.
[3]CONNER R L,DUCZEK L J,KOZUB G C,etal.Influence of crop rotation on common root rot of wheat and barley [J].CanadianJournalofPlantPathology,1996,18(3):247.
[4] 刘守安,李多川,俄世瑾,等.嗜热毛壳菌纤维素酶(CBHⅡ)cDNA 的克隆及在毕赤酵母中的表达[J].生物工程学报,2005,21(6):892.
LIU S A,LI D C,E S J,etal.Cloning and expressing of cellulase gene(CBHⅡ) from thermophilic fungiChaetomiumthermophilum CT2 [J].ChineseJournalofBiotechnology,2005,21(6):892.
[5]ZHANG H Y,YANG Q.Expressed sequence tags-based identification of genes in the biocontrol agentChaetomiumcupreum [J].ApplyMicrobiologyandBiotechnology,2007,74(3):650.
[6]LIN S B,LIN Y C,CHEN H H.Low molecular weight chitosan prepared with the aid of cellulase,lysozyme and chitinase:Characterisation and antibacterial activity [J].FoodChemistry,2009,116(1):47.
[7] 印敬明,刘晓光,万 慧,等.螺旋毛壳Chaetomiumsppirale ND35防病促生作用初探[J].莱阳农学院学报,2006,23(4):272.
YIN J M,LIU X G,WAN H,etal.A preliminary investigation on biocontrol and growth promotion by endophyticChaetomiumsppiraleND35 [J].JournalofLaiyangAgriculturalCollege,2006,23(4):272.
[8]SOYTONG K,KANOKMEDHAKU S,KUKONGVIRIYAPA V,etal.Application ofChaetomiumsppecies(Ketomitum) as a new broad spectrum biological fungicide for plant disease control:A review article [J].FungalDiversity,2001,7:1-2.
[9]DHINGRA O D,MIZUBUTI E S G,SANTANA F M.Chaetomiumglobosumfor reducing primary inoculum ofDiaporthephaseolorumsp.meridionalis in soil-surface soybean stubble in field conditions [J].BiologicalControl,2003,26(3):302.
[10] 李 梅,杨 谦,宋金柱.多菌灵抗性基因在球毛壳中的转化[J].高技术通讯,2002,12(2):45.
LI M,YANG Q,SONG J Z.Transformation of theChaetomiumglobosumwith the gene of the resistance to carbendazim [J].HighTechnologyLetters,2002,12(2):45.
[11]YANG Q,SONG J Z,LIU R Q,etal.A study on biocontrol mechanism ofChaetomiumspp.advanced study on plant pest biological control [J].BiologicalControlandBiotechnology,2000,3:110.
[12] 薛 敏.球毛壳菌中细胞松弛素类成分及其生物活性的研究[D].杨凌:西北农林科技大学,2012:28.
XUE M.Cytochalasans isolated fromChaetomiumglobosumand their bioactivity [D].Yangling:Northwest A&F University,2012:28.
[13] 张 建,王 惠,卢 亮,等.灰葡萄孢代谢产物对3种小麦病害的抑制作用[J].农药,2005,44(2):84.
ZHANG J,WANG H,LU L,etal.Inhibition of three wheat diseases by metabolites ofBotrytiscinerea[J].Pesticides,2005,44(2):84.
[14] 孙海燕,李 琦,杜文珍,等.不同杀菌剂拌种防治小麦全蚀病研究[J].植物保护,2012,38(3):156.
SUN H,LI Q,DU W Z,etal.Control of wheat take-all by seed treatments with different fungicides [J].PlantProtection,2012,38(3):156.
[15] 孙炳剑,袁虹霞,邢小萍,等.不同种子处理剂对小麦全蚀病的防治效果[J].麦类作物学报,2008,28(4):710.
SUN B J,YUAN H X,XING X P,etal.Control effect of different seed treatments to wheat take-all [J].JournalofTriticeaeCrops,2008,2008,28(4):710.
[16]ARX J A,VON G J,FIGUERAS M J.The Ascomycete genusChaetomium[M].Baarn:Gebruder Borntraeger Verlagsbuchhandlung Publisher,1986:28.
[17] 甘丽萍,王生荣.RAPD标记在植物病原真菌遗传多样性及生理分化研究中的应用[J].甘肃农业大学学报,2004,39(1):73.
GAN L P,WANG S R.Application of RAPD in the studies on genetic diversity and physiological specialization of plant pathogenic fungi [J].JournalofGansuAgriculturalUniversity,2004,39(1):73.
[18] 印敬明.内生菌螺旋毛壳(Chaetomiumsppirale)ND35防病促生作用初探[D].泰安:山东农业大学,2007:11.
YIN J M.A preliminary investigation on biocontrol and growth promotion by endophyticChaetomiumsppiraleND35 [D].Taian:Shandong Agricultural University,2007:11.
[19] 辛雅芬,米士伟,张淑玲,等.球毛壳菌在黄瓜上的侵染定殖及其对黄瓜生长和产量的影响[J].吉林农业大学学报,2013,3(4):456.
XIN Y F,MI S W,ZHANG S L,etal.Infection and colonization and its effect on growth ofChaetomiumglobosumND35 in cucumber and yield of cucumber [J].JournalofJilinAgriculturalUniversity,2013,3(4):456.
[20] 宋富海,王 森,张先富,等.球毛壳ND35菌肥对苹果连作土壤微生物和平邑甜茶幼苗生物量的影响[J].园艺学报,2015,42(2):213.
SONG FH,WANG S,ZHANG X F,etal.Effects ofChaetomiumglobosumND35 fungal fertilizer on continuous cropping soil microorganism andMalushupehensis seedling biomass [J].ActaHorticulturaeSinica,2015,42(2):213.
[21] 丛国强,尹成林,何邦令,等.水分胁迫下内生真菌球毛壳ND35对冬小麦苗期生长和抗旱性的影响[J].生态学报,2015,35(18):13.
CONG G X,YIN C L,HE B L,etal.Effect of endophytic fungusChaetomiumglobosumND35 on the growth and resistance to drought of winter wheat at the seedling stage under water stress [J].ActaEcologicaSinica,2015,35(18):13.
[22] 夏宣宣,张淑勇,张光灿,等.连作土壤中施加球毛壳ND35菌肥对杨树生理特性的影响[J].应用生态学报,2016,27(7):2255.
XIA X X,ZHANG S Y,ZHANG G C,etal.Influence ofChaetomiumglobosumND35 fungus fertilizer on physiological characteristics of poplar in replanted soil [J].ChineseJournalofAppliedEcology,2016,27(7):2255.
[23] 印 容,高慧娟,赵秀云.球毛壳菌及其产生的鞘氨醇对油菜根肿病的室内生防作用[J].华中农业大学学报,2016,35(5):62.
YIN R,GAO H J,ZHAO X Y.Biocontrol effect ofChaetomiumglobosumand sphingosine onPlasmodiaphorabrassicae [J].JournalofHuazhongAgriculturalUniversity,2016,35(5):62.
ScreeningandIdentificationofBiologicalControlChaetomiumofRootRotandTake-allDiseaseinHullessBarley
YUEHaimei1,2,ZHUANGHua2,GONGWenfeng1,ZHANGXinjun3
(1.Department of Plant Science,Tibet Agricultural and Animal Husbandry College,Linzhi,Tibet 860000,China;2.College of Plant Protection,Northwest A&F University/State Key Laboratory of Crop Stress Biology for Arid Areas,Yangling,Shaanxi 712100,China; 3.Tibet Plateau Institute of Ecology,Linzhi,Tibet 860000,China)
The root rot and take-all disease in hulless barley are common rot diseases in Tibet highland. To screen out of suitableChaetomiumspp. for controlling root rot and take-all disease in hulless barley,four strains ofChaetomiumspp. were selected,and the strains with strong antibacterial activity were screened by the antagonistic test,the crude extract of the fermentation and the pot experiment. The high activity strain was identified by morphological and molecular biology methods. In the dish antagonistic experiment,Chaetomium41-4 presented stable and obvious inhibitory effect on root rot and take-all disease in hulless barley during 7 to 9 culture days,with the inhibition rate of 60% and 44.44%,respectively,and the extent of inhibition zone reached to 1.4 cm; in fermentation extracts antibacterial experiment,the performance ofChaetomium41-4 exhibited stable antibacterial effect on root rot and take-all disease at 7th culture day,with the inhibition rate of 64.44% and 60.00%,respectively,and the extent of inhibition zone reached to 1.5 cm; in the greenhouse control effect experiment,Chaetomium41-4 play a control effect in reducing the incidence of severity and disease index for root rot and take-all disease,with the control effect rate of 62.67% and 39.45%,respectively.Chaetomium41-4 has been screened to have better biological control effect,and this strain has also been identified asC.globosumaccording to its morphological characteristics,rDNA internal transcribed spacer(rDNA-ITS) sequence and phylogenetic analysis. The biocontrol strains could be available in the development of microbial fertilizer,which is important to pollution-free agricultural production and ecological protection in Tibet.
Barley root rot; Barley take-all disease;Chaetomiumspp.; Screening; Identification
时间:2017-10-11
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20171011.1602.032.html
2017-03-14
2017-04-08
国家自然科学基金项目(31360006); 旱区作物逆境生物学国家重点实验室开放基金项目(CSBAA2016006);作物学科建设项目(2015ZWXKJS,2016ZWXKJS)
E-mail:yuehm1980@163.com
S512.3;S432.4
A
1009-1041(2017)10-1390-08

