小偃6号 TaWRKY45基因在高温抗条锈病中的功能研究
郭忠峰,陶 飞,田 玮,杨家荣,胡小平
(西北农林科技大学植物保护学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
小偃6号 TaWRKY45基因在高温抗条锈病中的功能研究
郭忠峰,陶 飞,田 玮,杨家荣,胡小平
(西北农林科技大学植物保护学院/旱区作物逆境生物学国家重点实验室,陕西杨凌 712100)
小偃6号是一个具有全生育期高温抗条锈性的小麦品种。在小麦抗病研究中发现 TaWRKY45转录因子参与了对多种病害的调控。为了研究 TaWRKY45在小偃6号高温抗条锈过程中的功能,以小偃6号为试验材料,通过实时荧光定量PCR技术(Real-time quantitative PCR,qRT-PCR)研究 TaWRKY45的表达模式,并利用病毒诱导的基因沉默(VIGS)技术,研究了 TaWRKY45沉默后对小偃6号高温抗条锈病的影响。结果表明, TaWRKY45在小麦根、茎、叶中均有表达,根中的表达量最高。当小麦受到水杨酸(SA)、条锈菌、高温(20 ℃)胁迫时, TaWRKY45表达量均上调。对小麦 TaWRKY45基因进行沉默处理后,沉默叶片(BSMV:TaWRKY45-as)的条锈菌菌落增长,坏死细胞数目减少。 TaWRKY45正向参与了小偃6号的高温抗条锈病过程。
小偃6号;高温;条锈; TaWRKY45;VIGS
小麦条锈病是由条形柄锈菌(Pucciniastriiformisf. sp.tritici,Pst)引起的世界性病害,严重威胁着小麦的生产,造成了巨大的经济损失[1]。现有的抗条锈病小麦品种常因条锈菌生理小种毒性的变异而丧失抗性。大量实践证明,选育非小种专化性的持久抗病品种是防治条锈病最有效的措施[2-3]。小麦品种的高温抗条锈性是指在相对较高环境温度下表达的一种低反应型抗病性[4-8]。Qayoum和Line[4]提出小麦高温抗条锈性具有持久性特征,并对高温抗条锈性的遗传规律进行了研究。20世纪80年代以来,我国学者针对国内小麦品种的高温抗病性进行了研究,系统鉴选出包括小偃6号在内的一系列具有高温抗条锈性的小麦品种[9-10],并且在高温抗条锈性的生化机制[11]、超微结构特征[12]、表达规律[6,13-14]等方面也进行了深入研究,但对小偃6号高温抗条锈性的分子机制方面缺乏研究。
WRKY45转录因子在抗病过程中起着重要的作用。在水稻中, OsWRKY45的过表达可以提高水稻对稻瘟病和白叶枯的抗病性[15-16]。在小麦中, TaWRKY45的过表达可以增强小麦对赤霉病、白粉病和叶锈病的抵抗力[17-19],但 TaWRKY45在小麦高温抗条锈性中的功能仍未见报道。为了深入了解 TaWRKY45在小偃6号高温抗条锈性的功能,本试验对条锈菌和高温双重胁迫后的 TaWRKY45表达水平进行测定,并对 TaWRKY45沉默处理后的植株进行组织病理研究,以明确 TaWRKY45在小偃6号高温抗条锈性的作用,为进一步解释小偃6号受高温诱导后由感病转为抗病的分子调控机制奠定基础。
1 材料与方法
1.1 试验材料
供试小麦品种:小偃6号(高温诱导的抗条锈病品种),由西北农林科技大学小麦研究所提供。
供试菌株:小麦条形柄锈菌(Pucciniastriiformisf. sp.tritici,Pst)CYR(Chinese Yellow Rust)32号生理小种夏孢子,由甘肃省农科院植物保护研究所提供。
1.2 温度处理
以小麦接种条锈菌0 h为计时点,待条锈菌侵染叶片至潜育后期(192 h,初显花斑),将接菌植株和对照植株各分为两组:一组常温(15 ℃,光照周期为16 h,光照强度为8 000~10 000 lx,相对湿度为60%~80%)培养;另一组高温(20 ℃,光照周期为16 h,光照强度为8 000~10 000 lx,相对湿度为60%~80%)处理24 h后,转到常温条件培养,于培养0、48、96、192、204、216、240、264和312 h时对不同处理的植株进行采样,液氮速冻并于-80 ℃ 保存备用。
1.3 激素处理及组织特异性检测材料的采集
选10~15粒饱满的小偃6号种子均匀播种于营养钵中,置光照培养箱(15 ℃,光照周期为16 h,光照强度为8 000~10 000 lx,相对湿度为60%~80%)中培养。待植株生长到二叶期,参照Wang等[20]的方法,对麦苗喷洒水杨酸(SA)(100 μmol·L-1),并于处理0、0.5、2、6、12和24 h时进行采样,液氮速冻并于-80 ℃保存备用。
以同样的栽培方法进行栽培,待植株生长到二叶期,采集麦苗的根、茎、叶,液氮速冻并于-80 ℃保存,作为基因表达的组织特异性检测材料。
1.4大麦条纹花叶病毒(Barleystripemosaicvirus,BSMV)介导的TaWRKY45基因沉默
依据小偃6号苗期高温诱导抗条锈病的转录组分析结果(数据尚未发表),获得 TaWRKY45 CDS序列。采用3′-Full RACE Core Set with PrimeScriptTM RTase(TaKaRa)试剂盒获得 TaWRKY45 3′端完整序列。在3′端序列设计引物(表1),并通过PCR扩增,获得140 bp的 TaWRKY45片段。参照Wang等[20]的方法,将该目的片段连接到BSMV γ载体质粒上,并在二叶期麦苗的第二叶上接种病毒,然后放置人工培养箱中培养;接种病毒后第9天,对产生花斑症状的叶片接种CYR32的新鲜夏孢子。未沉默基因的植株(BSMV:00)作为阴性对照,沉默TaPDS的植株(BSMV:TaPDS)作为阳性对照。
1.5 组织学观察
接种病毒的小麦植株接种条锈菌后,黑暗保湿(10 ℃~13 ℃,相对湿度为80%~100%)24 h,然后放置在常温下培养,并在接菌后的48 h和120 h时采样。接菌后第8天,按照1.2中的方法对植株进行不同温度处理。将植株转至20 ℃培养那一刻记为高温处理0 h,并开始对常温和高温条件下的沉默植株、未沉默植株进行采样。采样的时间点依次为高温处理0、48、72、120 h。每个时间点随机选取6~8株植株,随机采集8~10段叶片。参照Wang等[20]的方法,用Calcofluor M2R White New染色液进行染色,并在显微镜(Olympus BX-51 microscope)下观察潜育前期的菌丝长度、吸气母细胞数目、坏死细胞数目以及潜育后期的菌落线性长度、夏孢子堆线性长度、坏死细胞数目。每个处理选取30~50个侵染点进行统计。
1.6 实时定量PCR
对1.5中的沉默植株、未沉默植株在不同温度处理0、48、72、120 h进行采样。依照SV Total RNA Isolation System试剂盒和Prime Script RT reagent Kit试剂盒操作步骤进行RNA提取和反转录。扩增体系25 μL:12.5 μL Ultra SYBR Mixture,上、下游引物各1 μL,9.5 μL Nuclease-Free Water,1 μL cDNA。 Ta26s 作为内参基因。在实时检测扩增定量仪(Thermal Cycler iQ5)上进行扩增。引物用软件Primer Premier 5设计。试验所用引物如表1。

表1 本研究所用的引物Table 1 Primers used in this study
下划线序列分别为PacI、NotI的酶切位点。
The underlined sequences arePacI andNotI enzyme loci,respectively.
1.7 数据处理
数据分析采用SAS v8.01统计软件。在假设方差同质性的前提下,常温处理的空载(BSMV:00)和目的基因载体(BSMV: TaWRKY45-as)转染叶片中的坏死细胞数目、吸气母细胞数目以及菌丝长度的比较采用Student’s t-test。其他统计数据采用Duncan’s进行多重比较。
2 结果与分析
2.1 TaWRKY45序列分析
序列分析表明, TaWRKY45基因具有完整的开放阅读框(ORF),编码293个氨基酸。通过邻近法建树分析发现该蛋白与位于WRKY第三家族的水稻(Oryzasativa) OsWRKY45达到99%的相似性(图1A)。蛋白结构域分析表明,TaWRKY45在N端含有一个保守的WRKYGQK,在C端含有一个C2-HC(C-X7-C-X23-H-X1-C)型的锌指结构,具有WRKY第三家族成员的典型结构特征(图1B)。
2.2TaWRKY45基因表达的组织特异性
利用实时定量PCR对小麦根、茎、叶中的 TaWRKY45表达量进行测定。结果(图2)显示, TaWRKY45在小偃6号根、茎、叶中的表达量依次为0.038、0.024和0.022。根中的表达量显著高于茎、叶中表达量(P<0.05)。
2.3 TaWRKY45的时序表达特征
由图3可以看出,在条锈菌侵染小偃6号的早期,从48 h到192 h,常温下接菌处理的 TaWRKY45表达水平为不接菌处理的5~10倍,存在显著差异(P<0.05)。在192 h进行高温处理,从204 h到264 h,高温接菌处理的 TaWRKY45表达量显著高于高温对照(P<0.05),尤其在接种后的216 h(高温处理24 h), TaWRKY45的相对表达量为0.431,显著高于其他处理(P<0.05)(图3)。
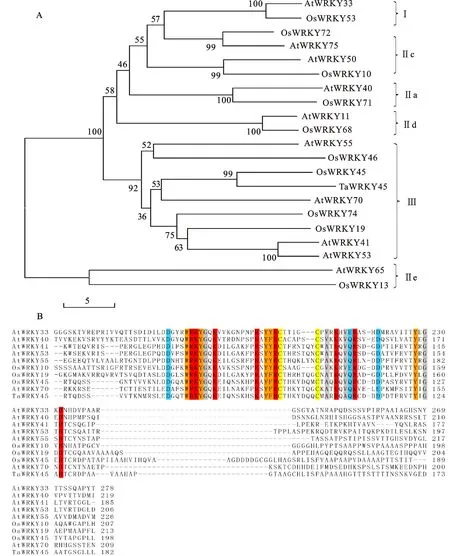
水稻和拟南芥来自于NCBI数据库。序列号分别为DAA05075(OsWRKY10)、DAA05078(OsWRKY13)、DAA05084(OsWRKY19)、DAA05110(OsWRKY45)、DAA05111(OsWRKY46)、DAA05118(OsWRKY53)、DAA05133(OsWRKY68)、DAA05136(OsWRKY71)、DAA05137(OsWRKY72)、DAA05139(OsWRKY74)、Q9SV15(AtWRKY11)、AAM34736(AtWRKY33)、Q9SAH7(AtWRKY40)、Q8H0Y8(AtWRKY41)、Q9SUP6(AtWRKY53)、Q8VWQ5(AtWRKY50)、Q9SHB5(AtWRKY55)、Q9LP56(AtWRKY65)、AAL13046(AtWRKY70)、AAL50784(AtWRKY75)。标亮部分表示保守氨基酸。
Rice andArabidopsissequences are from NCBI database. Accession No.:DAA05075(OsWRKY10),DAA05078(OsWRKY13),DAA05084(OsWRKY19),DAA05110(OsWRKY45),DAA05111(OsWRKY46),DAA05118(OsWRKY53),DAA05133(OsWRKY68),DAA05136(OsWRKY71),DAA05137(OsWRKY72),DAA05139(OsWRKY74),Q9SV15(AtWRKY11),AAM34736(AtWRKY33),Q9SAH7(AtWRKY40),Q8H0Y8(AtWRKY41),Q9SUP6(AtWRKY53),Q8VWQ5(AtWRKY50),Q9SHB5(AtWRKY55),Q9LP56(AtWRKY65),AAL13046(AtWRKY70),AAL50784(AtWRKY75). The conserved amino acids are marked by different colors.
图1TaWRKY45蛋白与不同家族WRKY蛋白的系统发育树(A)及与同源序列的比较(B)
Fig.1 Dendrogram(A) of TaWRKY45 with other WRKYs from various plant species and alignment (B) of TaWRKY45 with its homologues
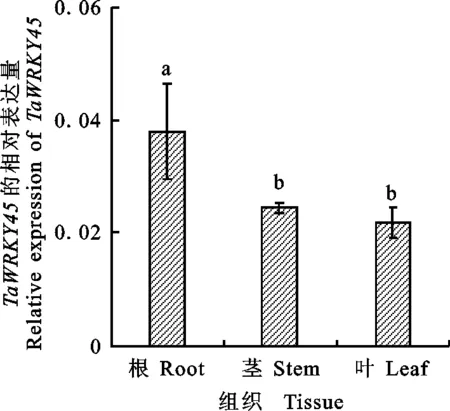
误差线上不同字母表示差异显著(P<0.05)。
Different letters above bars mean significant difference of TaWRKY45 expression among tissues(P<0.05).
图2TaWRKY45基因在不同组织的表达
Fig.2ExpressionprofilesofTaWRKY45indifferentwheattissues
2.4TaWRKY45在激素SA诱导下的表达
小麦叶片经水杨酸(SA)处理后, TaWRKY45相对表达量从0.5 h开始迅速上调,2 h达到最大值,随后恢复到初始水平。0.5 h和2 h的表达量与初始的表达量存在显著差异(P<0.05)(图4A)。对SA信号通路相关防御基因 TaGlu2在条锈菌侵染后期的转录水平测定结果显示,高温处理后 TaGlu2相对表达量递增,72 h后高温处理叶片的表达量高于常温处理叶片,在120 h高温未沉默叶片的表达量是同处理下沉默叶片的1.5倍(图4B)。
2.5TaWRKY45沉默效果及高温诱导表达
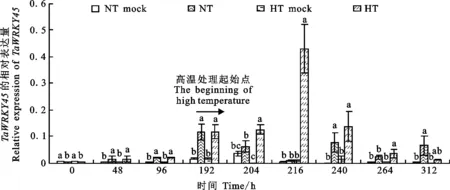
NT mock:常温不接菌;HT mock:高温不接菌。误差线上不同字母表示处理间差异显著(P<0.05)。表4、表5同。
NT mock:Normal temperature without inoculation of Pst; HT mock:High temperature without inoculation of Pst.Different letters above each error bar mean significant difference among treatments(P<0.05).The same in table 4 and table 5.
图3TaWRKY45在条锈菌侵染潜育后期高温(HT)和常温(NH)处理下的表达水平
Fig.3 Expression levels of TaWRKY45 in response to normal temperature(NT) and high temperature (HT) treatment after inoculation with Pst
小偃6号第二叶接种大麦条纹花叶病毒(BSMV)9 d后,小麦叶片出现花叶条纹症状;同时沉默八氢番茄红素脱氢酶基因(PDS)的叶片呈现光漂白症状(图5A),表明病毒诱导的基因沉默体系工作良好。 TaWRKY45的沉默结果显示,与对照(BSMV:00)相比,接菌后0、24、48、120 h, TaWRKY45在沉默叶片(BSMV:WRKY45-as)中的相对表达量下降了50%~70%,表明 TaWRKY45沉默效果较好(图5D)。高温处理条件下,相较于BSMV:00,BSMV:WRKY45-as中的孢子堆数目增多,抗病性下降,但与常温处理条件下的BSMV:WRKY45-as相比,孢子堆数量减少,抗病性增强(图5B、C)。这与沉默叶片在常温处理下 TaWRKY45表达量较低的结果一致(图5E)。
2.6TaWRKY45沉默后的病原菌侵染和寄主反应
接菌后第8天,将沉默和未沉默植株进行高温处理,此时标记为高温处理0 h。从0 h开始对病原菌的扩展和寄主坏死反应进行观察。从0 h至24 h,沉默叶片的菌落长度比未沉默叶片的长,其中,24 h未沉默叶片的菌落长度最短,为1 065.48 μm,与其他处理间存在显著差异(图6A)。高温处理后24 h至72 h,高温处理的坏死细胞数目约为常温处理的2倍;特别是72 h未沉默叶片的坏死数目显著高于沉默叶片的(图6B)。
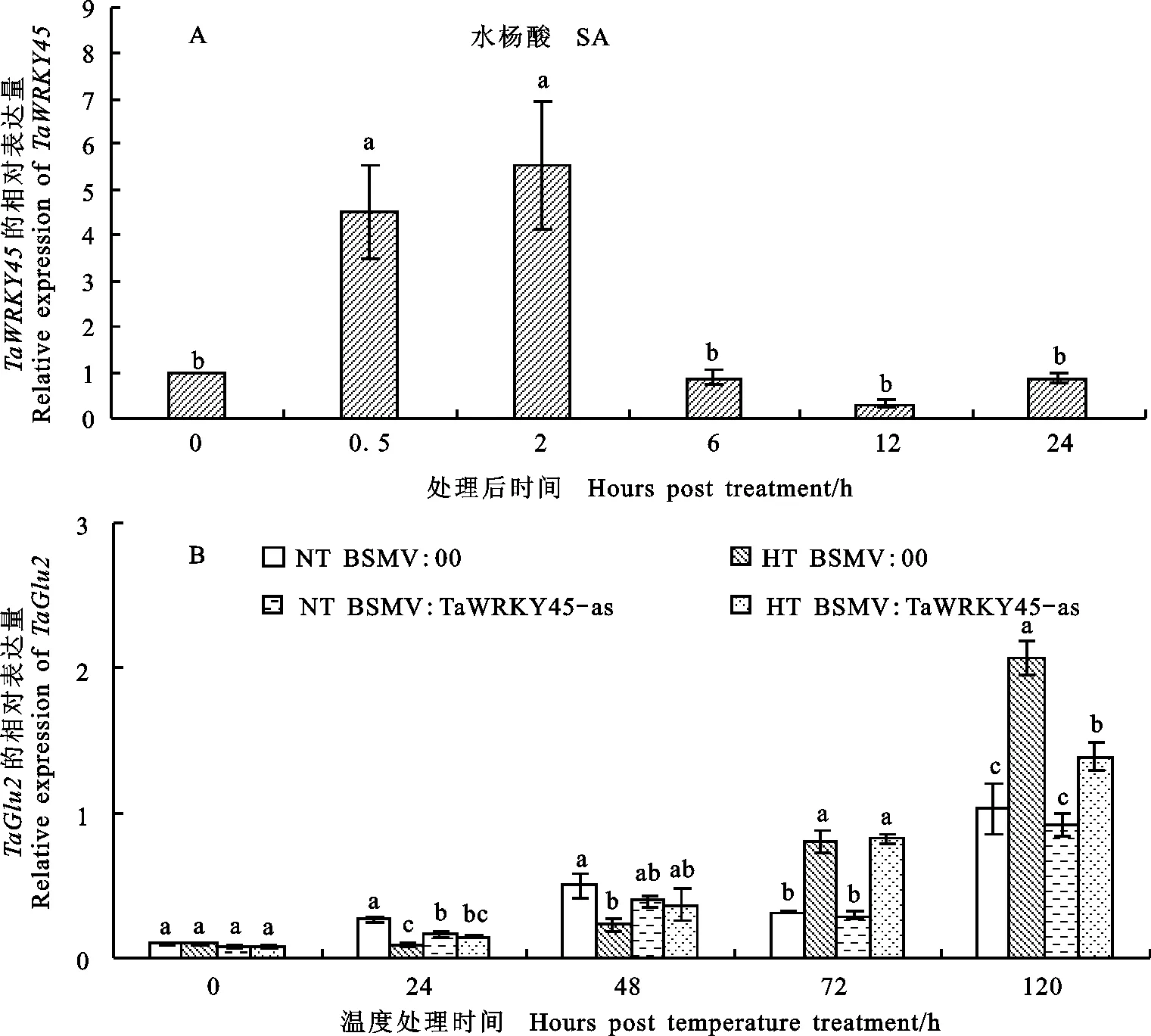
图4 TaWRKY45在水杨酸处理下(A)的表达水平和水杨酸途径相关基因 TaGlu2(B)的转录变化
Fig.4 Expression levels of TaWRKY45 in response to SA temperature(A) and the transcriptional changes in the SA pathway-related gene TaGtU2(B)
3 讨 论
WRKY转录因子不仅在植物生长发育中发挥作用[21],而且在植物抗病反应中,处于重要的地位[15-20]。研究表明,WRKY转录因子在植物抗病中发挥的作用不尽相同。正向或负向调控植物和病原菌互作的现象都存在。例如,在水稻中,OsWRKY53和OsWRKY22正向参与水稻抵抗稻瘟病[22]。而OsWRKY62是Xa21(类受体激酶)介导的抗水稻白叶枯病过程中的负调控子[23]。在小麦中,王军娟等[21]研究发现,TaWRKY70正向参与小偃6号高温抗条锈病过程,而TaWRKY49、TaWRKY62负向参与该过程。本研究中, TaWRKY45在条锈菌侵染潜育后期经高温处理后,其表达量被诱导上调,表明 TaWRKY45正向参与到高温和条锈菌双胁迫过程中。
大多数WRKY转录因子是通过SA信号通路进行防御反应[16]。在水稻中,OsWRKY45参与到水杨酸(SA)信号通路中,抵抗稻瘟病菌和白叶枯病菌的侵染[15-17]。在拟南芥中,AtWRKY70充当SA介导的信号通路的激活子,抵抗活体寄生菌白粉菌[24]。本研究中,小麦喷施SA后 TaWRKY45表达量上调(图4-A),与前人研究结果[18-19]相一致。同时发现SA通路相关基因 TaGlu2受条锈菌和高温双胁迫后表达上调,并且在高温处理的 TaWRKY45沉默叶片的表达量低于未沉默叶片的表达量。表明 TaWRKY45涉及的SA信号通路可能在小麦高温抗条锈病中起到重要作用。
A:在接毒后第9天,大麦条纹花叶病毒产生变黄的花叶症状。Mock:植株接种FES buffer;Ⅰ:BSMV:00;Ⅱ:BSMV:TaPDS;Ⅲ:BSMV:TaWRKY45-as;B、C:产生花斑的叶片接种条锈菌后经常温(NT,15 ℃)和高温(HT,20 ℃)处理。Mock1和Mock2:小麦叶片预先进行FES buffer涂抹处理,接种条锈菌后分别进行常温和高温处理;D:接种条锈菌后在常温下, TaWRKY45沉默效率的检测;**: TaWRKY45表达水平在沉默植株和未沉默植株差异显著(P<0.01);E: TaWRKY45在沉默植株和未沉默植株高温或常温后的诱导表达。
A:Mild chlorotic mosaic symptoms of BSMV at 9 days post-inoculation(dpi). Mock:Plant treated with FES buffer;Ⅰ:BSMV:00;Ⅱ:BSMV:TaPDS;Ⅲ:BSMV:TaWRKY45-as.B,C:Disease symptoms on the leaves challenged with Pst race CYR32 and then subjected to normal-temperature(NT,15 ℃,B) and high-temperature(HT,20 ℃,C) treatment.Mock1 and Mock2 represent wheat plants were pre-inoculation with FES,and then inoculated with CYR32 and subjected to NT and HT treatments,respectively;D:Efficiency of silencing of TaWRKY45 by VIGS under NT treatment after Pst inoculation;**:Significant differences in the mean TaWRKY45 expression level between the BSMV:TaWRKY45-as-inoculated plants and BSMV:00-inoculated plants with Student’st-test(P<0.01);E:Induction of TaWRKY45 in the plant pre-inoculated with BSMV:00 or BSMV:TaWRKY45-as under HT or NT treatments.
图5TaWRKY45在小麦中全生育抗条锈菌的功能分析
Fig.5 Function analyses of TaWRKY45 during all-stage plant resistance to Puccinia striiformis f.sp.tritici (Pst)using a barley stripe mosaic virus (BSMV)-induced gene silencing (VIGS) system
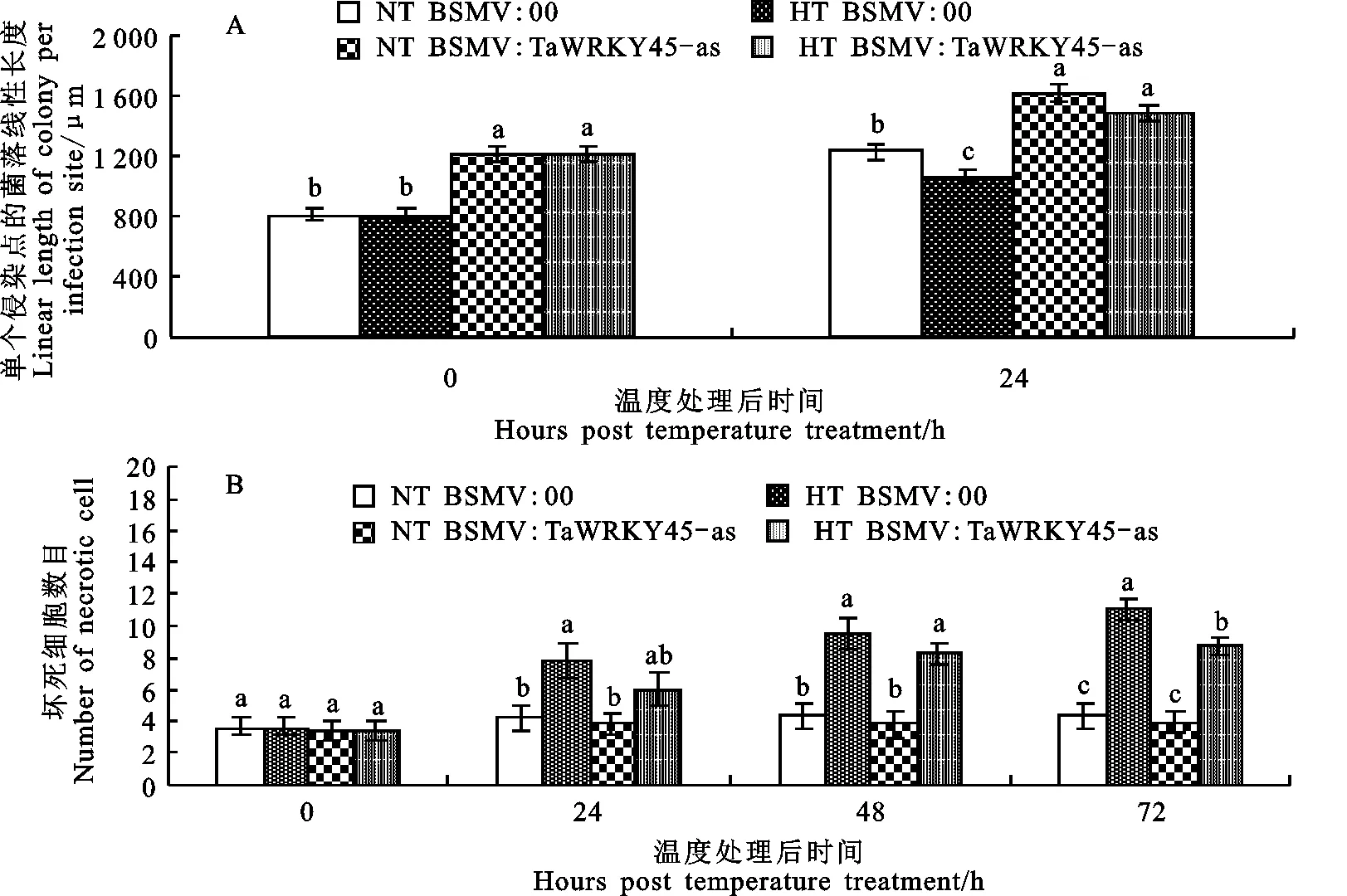
图6 温度对条锈菌菌落长度(A)和寄主坏死细胞数目(B)的影响
常温下BSMV:TaWRKY45-as的孢子堆数量比BSMV:00多;BSMV:TaWRKY45-as的菌落线性长度显著大于BSMV:00。表明沉默TaWRKY45后,植株的抗病能力减弱。由此推测 TaWRKY45在常温下也有一定的抗条锈作用。这可能是由于常温下 TaWRKY45受条锈菌诱导后表达上调(图3),从而诱导相关防御基因表达,增强植物的抗病能力,抑制菌丝的生长。而沉默 TaWRKY45基因的植株,由于 TaWRKY45的表达量减少,相关防御基因表达受抑,植株抗病能力减弱,对菌丝生长的抑制减弱。
在水稻中,SA通过激活分裂原蛋白激酶(OsMAP6)将WRKY45蛋白磷酸化从而具有活性[25]。磷酸化的WRKY45通过结合W-boxes来激活基因的转录[15]。Inoue等[26]研究发现,抗病基因 Pb1(Panicle blast 1)是通过与 WRKY45互作来提高水稻抗叶枯病的能力,敲除 WRKY45后水稻的抗病能力下降。程洪涛等[27]发现,转录因子WRKY45-2、WRKY13、WRKY42共同调控水稻对稻瘟病的抗性。本研究发现,SA可诱导 TaWRKY45上调表达(图4A),而植株经接菌和高温处理后,SA信号通路相关基因 TaGlu2表达上调(图4B), TaWRKY45正向参与小偃6号高温抗条锈过程,但对 TaWRKY45的分子调控机制还不清楚。结合前人和本研究结果,推测小偃6号受到条锈菌和高温双重胁迫后引发SA信号通路,SA通过激活某个激酶将WRKY45磷酸化,进而通过W-boxes结合到病程相关蛋白引发抗病反应。也有可能磷酸化的WRKY45与其他转录因子形成复合体共同调控小偃6号对条锈菌的抗性。
[1] 李振岐,曾士迈.中国小麦锈病[M].北京:中国农业出版社,2002:320-321.
LI Z Q,ZENG S M.Wheat Rust in China [M].Beijing:China Agricultural Press,2002:320-321.
[2] CHEN X M.Epidemiology and control of stripe rustPicciniastriiformisf.sp.triticion wheat [J].CanadianJournalofPlantPathology,2005,27(3):327.
[3] JOHSON R.The concept of durable resistance [J].Phytopathology,1979,69:198.
[4] QAYOUM A,LINE R F.High-temperature adult plant resistance to stripe rust of wheat [J].Phytopathology,1985,75:1124.
[5] LINE R F.Stripe rust of wheat and barley in North America:A retrospective historical review [J].AnnualReviewofPhytopathology,2002,40:102.
[6] 商鸿生.小麦对条锈病的高温抗病性研究[J].中国农业科学,1998,31(4):46.
SHANG H S.High temperature resistance of wheat to stripe rust [J].ScientiaAgricultureSinica,1998,31(4):46.
[7] LAGUDAH E S.Molecular genetics of race non-specific rust resistance in wheat [J].Euphytica,2011,179:81.
[8] LIN F,CHEN X M.Quantitative trait loci for non-race-specific,high temperature adult plant resistance to stripe rust in wheat cultivar express [J].TheoreticalandAppliedGenetics,2009,118:638.
[9] 王利国,商鸿生,井金学.高温抗条锈性小麦品种的筛选和鉴定[J].西北农业学报,1995,4(1):36.
WANG L G,SHANG H S,JING J X.Screening and identification of wheat varieties with high-temperature resistance to stripe rust [J].ActaAgriculturaeBoreali-OccidentalisSinica,1995,4(1):36.
[10] 马 青,商鸿生.小偃系列小麦品种对条锈病的高温抗病性研究[J].西北农业学报,2000,9(1):40.
MA Q,SHANG H S.High-temperature resistance of wheat to wheat stripe rust [J].ActaAgriculturaeBoreali-OccidentalisSinica,2000,9(1):40.
[11] 王保通,商鸿生.小麦高温抗条锈性表达与苯丙氨酸解氨酶和多酚氧化酶活性的关系[J].麦类作物学报,2001,21(3):43-44.
WANG B T,SHANG H S.The relation between the high-temperature resistance to stripe rust of wheat and phenylalanine ammonia lyase and polyphenol oxidase [J].JournalofTriticeaeCrops,2001,21(3):43-44.
[12] MA Q,SHANG H S.Ultrastructural analysis of the interaction betweenPucciniastriiformisf.sp.triticiand wheat after thermal inoculation of resistance [J].JournalofPlantPathology,2004,86(1):19.
[13] 胡小平,王雅婷,商鸿生.小偃6号高温抗条锈病的表达规律[J].西北农业学报,2012,21(2):43.
HU X P,WANG Y T,SHAGN H S.Characteristics of expression of high-temperature resistance to stripe rust in Xiaoyan 6 [J].ActaAgriculturaeBoreali-OccidentalisSinica,2012,21(2):43.
[14] 安 菲,陶 飞,田 玮,等.小偃6号高温抗条锈性表达的最佳条件[J].麦类作物学报,2015,35(9):1314.
AN F,TAO F,TIAN W,etal.Optimal conditions of expression of high-temperature resistance to stripe rust in Xiaoyan 6 [J].JournalofTriticeaeCrops,2015,35(39):1314.
[15] SHIMONO M,SUGANO S,NAKAYAMA A,etal.Rice WRKY45 plays a crucial role in benzothiadiazole-inducible blast resistance [J].PlantCell,2007,19(6):2064-2066.
[16] SHIMONO M,KOGA H,AKAGI A,etal.Rice WRKY45 plays important roles in fungal and bacterial disease resistance [J].MolecularPlantPathology,2012,13(1):83.
[17] GOTO S,SASAKURA-SHIMODA F,SUETSUGU M,etal.Development of disease-resistant rice by optimized expression of WRKY45 [J].PlantBiotechnologyJournal,2015,13(6):753.
[18] BAHRINI I,SUGISAWA M,KIKUCHI R,etal.Characterization of a wheat transcription factor, TaWRKY45,and its effect onFusariumhead blight resistance in transgenic wheat plants [J].BreedingScience,2011,61(2):121.
[19] BAHRINI I,OGAWA T,KOBAYSHI F,etal.Overexpression of the pathogen-inducible wheat TaWRKY45 gene confers disease resistance to multiple fungi in transgenic plants [J].BreedingScience,2011,61(4):319.
[20] WANG J J,TAO F,AN F,etal.Wheat transcription factor TaWRKY70 is positively involved in high-temperature seedling plant resistance toPucciniastriiformisf.sp.tritici[J].MolecularPlantPathology,2017,18(5):649.
[21] WANG H,XU Q,KONG Y H,etal.ArabidopsisWRKY45 transcription factor activates phosphate transporter1;1 expression in response to phosphate starvation [J].PlantPhysiology,2014,164(4):2020-2029.
[22] ABBRUSCATO P,NEPUSZ T,MIZZI L,etal.OsWRKY22,a monocot WRKY gene,plays a role in the resistance response to blast [J].MolecularPlantPathology,2012,13(8):829-830.
[23] PENG Y,BARTLEY L E,CHEN X,etal.OsWRKY62 is a negative regulator of basal and Xa21-mediated defense againstXanthomonasoryzaepv.oryzae in rice [J].MolecularPlant,2008,1(1):446.
[24] LI J,BRADER G,KARIOLA T,etal.WRKY70 modulates the selection of signaling pathways in plant defense [J].PlantJournal,2006,46(3):477.
[25] UENO Y,YOSHIDA R,KISHI-KABOSHI M,etal.MAP kinases phosphorylate rice WRKY45 [J].PlantSignaling&Behavior,2013,8(6):e24510.
[26] INOUE H,HAYASHI N,MATSUSHITA A,etal.Blast resistance of CC-NB-LRR protein Pb1 is mediated by WRKY45 through protein-protein interaction [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2013,110(23):9577-9578.
[27] CHENG H T,LIU H B,DENG Y,etal.The WRKY45-2,WRKY13,WRKY42 transcriptional regulatory cascade is required for rice resistance to fungal pathogen [J].PlantPhysiology,2015,167(3):1087.
FunctionsofTaWRKY45ontheHigh-TemperatureResistancetoStripeRustinXiaoyan6
GUOZhongfeng,TAOFei,TIANWei,YANGJiarong,HUXiaoping
(College of Plant Protection/State Key Laboratory of Crop Stress Biology for Arid Area,Northwest A&F University,Yangling,Shaanxi 712100,China)
Xiaoyan 6 is a wheat cultivar with all-stage high temperature resistance to stripe rust. It was reported that TaWRKY45 as a transcriptional factor confers resistance to multiple diseases in wheat. In order to explore the functions of TaWRKY45 on high temperature resistance to stripe rust in Xiaoyan 6,this study characterized its expression pattern by real-time RT-PCR and analyzed its resistance by virus-induced gene silencing(VIGS) technology. The results showed that TaWRKY45 expressed in roots,stems and leaves. And the expression of TaWRKY45 in roots was the highest among the three tissues. TaWRKY45 was upregulated in response to salicylic acid(SA),high temperature(20 ℃) and infection ofPucciniastriiformisf. sp.tritici(Pst). The length of colony in BSMV: TaWRKY45-as seedlings was longer than that in BSMV:00 seedlings,and the number of necrotic cell in BSMV: TaWRKY45-as seedlings was less than that in BSMV:00 seedlings. It can be concluded that TaWRKY45 positively involved in high temperature resistance to stripe rust in Xiaoyan 6.
Xiaoyan 6;High temperature;Stripe rust; TaWRKY45; VIGS
2017-03-24
2017-04-16
国家重点基础研究发展计划项目(2013CB127700);国家自然科学基金项目(31071640)
E-mail:1264623062@qq.com
胡小平(E-mail:xphu@nwsuaf.edu.cn);杨家荣(E-mail:yljryang@tom.com)
时间:2017-10-11
网络出版地址:http://kns.cnki.net/kcms/detail/61.1359.S.20171011.1601.014.html
S512.1;S332
A
1009-1041(2017)10-1318-09

