凋亡与自噬的相互关系在类风湿关节炎中的研究进展
李春莳++孙英焕++杜明++陶李++李光迪
【摘 要】 凋亡和自噬作为程序性细胞死亡的两种形式,二者相互联系又相互区别,凋亡和自噬的异常状态与类风湿关节炎的发生、发展密切相关。对于二者相互作用的研究不仅可以进一步揭示类风湿关节炎发生、发展的潜在机制,而且为其治疗和预防提供了新的思路。结合近年来国内外研究进展,就凋亡与自噬的相互关系在类风湿关节炎中的作用进行综述。
【关键词】 关节炎,类风湿;凋亡;自噬;p53;Beclin1;TNF-α;p62;综述
类风湿关节炎(rheumatoid arthritis,RA)是一种以持续性滑膜炎症、系统性炎症和关节不可逆损伤为特征的自身免疫性疾病。当前,RA的病因及发病机制尚不明确。但是RA的发生与遗传易感、环境和免疫系统紊乱等多重因素共同作用密切相关。现有研究表明,细胞凋亡与细胞自噬的异常状态与RA的发生密切相关[1-2]。
1 凋亡与自噬的关系
1.1 凋 亡 细胞凋亡,即Ⅰ型程序性细胞死亡(PCDⅠ),是指细胞在一定的生理或病理条件下,遵循自身的程序,自己结束其生命的过程。这一过程涉及一系列细胞形态学变化,如细胞核浓缩,片段化和质膜皱褶泡化,以及凋亡小体。同时,细胞凋亡伴随诸多生化改变,包括线粒体外膜透化(MOMP)、半胱天冬酶-3、半胱天冬酶-6、半胱天冬酶-7的激活以及分解代謝水解酶的活化。
1.2 自 噬 细胞自噬,即Ⅱ型程序性细胞死亡(PCDⅡ),是指真核细胞内降解自身细胞器和其他大分子的过程。此过程中首先形成自噬膜,自噬膜大多由细胞内线粒体或内质网膜脱落形成,有时细胞质膜和高尔基体膜也会参与自噬膜的形成;随后,自噬膜将细胞内不需要的蛋白质和细胞器包裹起来,形成自噬体;之后,自噬体和细胞内溶酶体共同形成自噬溶酶体,其中的酶可将蛋白质和细胞器水解成为小分子物质供细胞再次利用。由于细胞器与蛋白质进入溶酶体的方式不同,所以自噬可以分为3种形式:巨自噬、微自噬和分子伴侣介导的自噬。
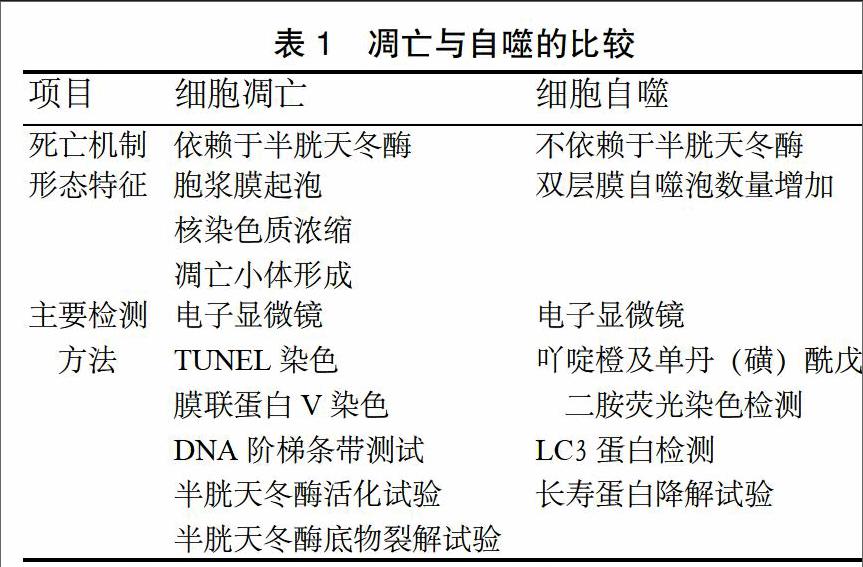
1.3 凋亡与自噬的相互关系 凋亡与自噬的比较见表1。凋亡与自噬的关系可分为3种情况:①自噬为凋亡所需[3]:自噬的发生先于凋亡且自噬可增加凋亡的活性;细胞程序性死亡可以被自噬抑制剂抑制,但不能被凋亡抑制剂所抑制[4]。②凋亡与自噬互相拮抗[5]:凋亡可以被自噬抑制,从而促进细胞存活,在抑制自噬后,细胞对凋亡信号的敏感性提高。③自噬和凋亡可相互转化,但其机制还不清楚[3]。
2 凋亡与自噬在RA中的作用
RA的病理特点为滑膜异常增生,以及之后的软骨和骨破坏。RA成纤维样滑膜细胞(RA-FLS)定位于关节滑膜内膜衬里层,能够产生多种炎性细胞因子、趋化因子和基质降解酶,参与关节炎症和骨质破坏的发生,因此RA-FLS的异常增生在RA发病机制中发挥重要作用[6];同时,RA-FLS凋亡抵抗造成了细胞死亡数目减少,异常增殖增多的情况。
目前,有证据表明细胞凋亡抵抗是由于细胞自噬起到了保护细胞的作用,且自噬通路的持续刺激、凋亡水平的下调进一步引起RA-FLS的过度活化及分化[7]。细胞自噬在RA-FLS中发挥的作用目前尚不清楚,其与细胞死亡通路之间的关系也不明确。但有研究表明,自噬可能是通过缓解RA-FLS内质网应激压力促进细胞存活[7-8]。Xu等[9]发现,RA滑膜衬里层自噬作用增强,且与RA-FLS凋亡抵抗呈正相关,这说明自噬抑制RA-FLS凋亡;同时该研究还发现,利用肿瘤坏死因子-α(TNF-α)刺激RA-FLS可诱导内质网应激增加,同时可使细胞自噬增强,从而清除胞质内未折叠或错误折叠的蛋白,抑制滑膜细胞的凋亡而促进生存。Shin等[7]研究发现,利用毒胡萝卜素刺激RA-FLS后自噬增加,凋亡减少;当用Beclin1 siRNA抑制自噬后,RA-FLS对内质网应激诱导凋亡的易感性增强。
由此可见,自噬和凋亡的平衡状态在这一系列变化中起着重要作用,因此我们要从分子机制探讨二者在RA中的关系。
2.1 p53 p53是目前研究最多的抑癌基因之一,其对细胞凋亡和自噬都有调控作用。当机体遇到缺血缺氧、DNA损伤以及原癌基因异常表达等情况时,p53会被激活,其通过上调促凋亡基因的表达,促进细胞凋亡的发生[3]。在细胞自噬中,p53发挥双重调节作用;细胞核中的p53促进自噬,胞质中的p53抑制自噬[10]。
研究发现,RA患者滑膜组织中的p53发生了基因突变[11]。Takatori等[12]研究发现,缺失p53基因小鼠的滑膜细胞增长显著增加,同时凋亡明显减少;还发现在RA患者的p53突变率较高的滑膜组织中白细胞介素-6(IL-6)的含量也增高,这说明p53可能参与调节IL-6的过表达。已知IL-6是一种促炎症细胞因子,作为一种重要介质也参与了RA滑膜炎症和关节损伤。这说明p53除了在凋亡和自噬环节中参与RA,还通过其他环节参与RA的发生、发展。另外有研究发现,RA患者淋巴细胞中的p53表达相较于正常人是偏低的[13],这与p53在滑膜组织中的表达正好相反,其机制目前还不清楚。在活动期RA患者的关节内,滑膜细胞凋亡水平降低,而提高其凋亡水平,患者症状会有所缓解。综上所述,在RA发生时p53表达降低,使凋亡水平下降,自噬水平升高,人为提高凋亡水平或抑制自噬的发生[14],都能起到缓解症状的作用。
2.2 Beclin1 Beclin1有3个重要的结构域,分别为Bcl-2结合部位(BH3)、进化保守结构域(ECD)和螺旋-螺旋结构域(CCD)[15]。自噬调控因子与不同的Beclin1结构域结合后,可实现对自噬水平的正向或负向调控[16]。抗凋亡蛋白Bcl-2、
Bcl-xL可以与Beclin1的BH3结构域结合,抑制其抗凋亡作用;同时,Bcl-2或Bcl-xL高表达还可以抑制自噬[17]。由此可见,Beclin1在调控细胞凋亡与自噬过程中都发挥着重要作用。endprint
研究显示,对比检测RA-FLS和骨关节炎成纤维滑膜细胞(OA-FLS)中的Beclin1水平是增高的[18];然而,在RA患者外周血单个核细胞中的Beclin1表达量是降低的[19],其机制不明。还有研究表明,经正规治疗的RA患者外周血单个核细胞中的Beclin1含量较治疗前显著下降[20],说明Beclin1表达水平可能与RA的病情活动有关。
2.3 TNF-α TNF-α是一种主要由激活的单核巨噬细胞和T细胞分泌的多肽,其存在形式包括二聚体、三聚体和五聚体,其中主要活性形式为三聚体。TNF-α的生物学效应受其浓度的影响,当浓度 ﹥ 10-8 mol·L-1时,机体的免疫平衡会被打破,TNF-α与其他炎症因子共同发挥作用,造成病理损伤;当浓度 ﹤10-10 mol·L-1时,TNF-α有促进组织修复,参与调节炎症反应和引起细胞凋亡等作
用[21]。TNF-α可以通过与其受体TNFE1结合,激活caspase从而诱导细胞凋亡[22-23]。研究显示,TNF-α可以激活自噬,与此同时自噬体形成可能与依赖TNF-α参与的凋亡有关[24-25]。
研究表明,TNF-α不能诱导RA-FLS凋亡,却能够引起凋亡抵抗[26]。但是,当核转录因子-κB(NF-κB)信号通路被抑制后,TNF-α就能诱导RA-FLS凋亡。还有研究证明,自噬在RA骨破坏中发挥着重要作用,TNF-α可以诱导RA自噬的激活,参与RA的关节破坏[14]。目前,TNF-α抑制剂在RA治疗中发挥重要作用,但是在临床应用中发现并不是对所有患者都有作用,其原因尚不明确[23]。有研究发现,在RA患者外周血中TNF-α水平显著高于健康对照组;同时,活动期RA患者TNF-α水平明显高于静止期RA患者,这提示监测TNF-α的表达水平可以观察RA的活动状况及病情的严重程度[27-28]。
2.4 p62 p62是SQSTM1编码的泛素结合蛋白,通过选择性募集泛素化蛋白,之后将其传递至自噬体降解这一过程参与自噬[29],且p62能够和部分凋亡相关及其存活通路中的蛋白结合发挥作用,其中有caspase-8、TRAF6(调节NF-κB通路)等[30]。其中,p62能否有效激活caspase-8非常重要,但是死亡受体被激活时,caspase-8可以清除p62,而caspase-8可能是通过p62实现经自噬降解[31-32]。以上表明,自噬可以影响凋亡,反过来凋亡能够改变p62和p62依赖的自噬性物质的降解,这表明自噬与凋亡可以相互影响,二者存在关联[33]。目前已知p62阳性多泛素化蛋白聚集体的形成可以促进RA-FLS的死亡[34],但是其在RA中是否有其他作用尚不清楚。
3 结语和展望
在正常机体中凋亡和自噬不是单独存在的,且二者处于一种平衡状态;当RA发生时,二者的平衡状态被打破。至此提出了一个问题:是由于二者关系紊乱导致了RA的发生,还是RA的发生引起了二者关系紊乱。p53、Beclin1、TNF-α、p62是已知的凋亡和自噬的交叉结点,以此为切入点有助于了解RA的病因和发病机制。在RA的发生、发展和治疗过程中,凋亡与自噬发挥着重要的作用。进一步研究二者在RA中的作用,对RA的早期诊断、治疗及判断预后将有深远的意义。但是目前对凋亡、自噬及RA三者的关系认识还不够深入,比如凋亡与自噬的交叉调控机制、凋亡与自噬在RA-FLS类肿瘤样异常增殖中的作用,在难治性RA发生、发展中的作用等诸多问题需要在今后的科研工作中进行深入且大量的研究,从而在RA诊疗方面取得一定的突破。
4 参考文献
[1] Lee HS,Woo SJ,Koh HW,et al.Regulation of apoptosis and inflammatory responses by insulin-like growth factor binding protein 3 in fibroblast-like synoviocytes and experimental animal models of rheumatoid arthritis[J].Arthritis Rheumatol,2014,66(4):863-873.
[2] Netea-Maier RT,Plantinga TS,van de Veerdonk FL,et al.
Modulation of inflammation by autophagy:Consequences for human disease[J].Autophagy,2016,12(2):245-260.
[3] 鄧正亭,李湧健,程彬彬.自噬和凋亡的相互关系在肿瘤方面的研究进展[J].现代肿瘤医学,2015,23(10):1467-1471.
[4] 赵萍,王攀,王筱冰.程序性细胞死亡与肿瘤[J].生命科学,2011,23(4):329-334.
[5] Song L,Liu H,Ma L,et al.Inhibition of autophagy by 3-MA enhances endoplasmic reticulum stress-induced apoptosis in human nasopharyngeal carcinoma cells[J].Oncol Lett,2013,6(4):1031-1038.
[6] Mcinnes IB,Schett G.The pathogenesis of rheumatoid arthritis[J].N Engl J Med,2011,365(23):2205-2219.
[7] Shin YJ,Han SH,Kim DS,et al.Autophagy induction and CHOP under-expression promotes survival of fibroblasts from rheumatoid arthritis patients under endoplasmic reticulum stress[J].Arthritis Res Ther,2010,12(1):R19.endprint
[8] Connor AM,Mahomed N,Gandhi R,et al.TNFα modulates protein degradation pathways in rheumatoid arthritis synovial fibroblasts[J].Arthritis Res Ther,2012,14(2):R62.
[9] Xu K,Xu P,Yao JF,et al.Reduced apoptosis correlates with enhanced autophagy in synovial tissues of rheumatoid arthritis[J].Inflamm Res,2013,62(2):229-237.
[10] Iacobuzio-Donahue CA,Herman JM.Autophagy,p53,and pancreatic cancer[J].N Engl J Med,2014,370(14):1352-1353.
[11] Lin J,Huo R,Xiao L,et al.A novel p53/microRNA-22/Cyr61 axis in synovial cells regulates inflammation in rheumatoid arthritis[J].Arthritis Rheumatol,2014,66(1):49-59.
[12] Takatori H,Kawashima H,Suzuki K,et al.Role of p53 in systemic autoimmune diseases[J].Crit Rev Immunol,2014,34(6):509-516.
[13] Du Y,Deng L,Li Y,et al.Decreased PERP expression on peripheral blood mononuclear cells from patient with rheumatoid arthritis negatively correlates with disease activity[J].Clin Dev Immunol,2013(1):256462.
[14] Lin NY,Beyer C,Giessl A,et al.Autophagy regulates TNFα-mediated joint destruction in experimental arthritis[J].Ann Rheum Dis,2013,72(5):761-768.
[15] Fu LL,Cheng Y,Liu B.Beclin-1:autophagic regulator and therapeutic target in cancer[J].Int J Biochem Cell Biol,2013,45(5):921-924.
[16] Sahni S,Merlot AM,Krishan S,et al.Gene of the month:
BECN1[J].J Clin Pathol,2014,67(8):656-660.
[17] Chipuk JE,Moldoveanu T,Llambi F,et al.The BCL-2 family reunion[J].Mol Cell,2010,37(3):299-310.
[18] Meng M,Liang H,Fang H,et al.The significance of PI3K/Akt/mTOR pathway and autophagy in the proliferation of synovial cells in rheumatoid arthritis[J].Medical Research & Education,2013,20(4):627-668.
[19] 洪永桃,刘静,邹倩.自噬在类风湿关节炎和系统性红斑狼疮中的作用[J].风湿病与关节炎,2014,3(6):49-52.
[20] 吴茜.Beclin1、LC3、Atg9a mRNA及氧化应激指标在类风湿关节炎中的表达及临床意义[D].兰州:兰州大学,2016.
[21] 吕志敢,郭政.肿瘤坏死因子的研究进展[J].山西医科大学学报,2006,37(3):311-314.
[22] 郑海燕,王兴芬,孙保存.自噬与凋亡相互關系的分子机制探讨[J].医学综述,2011,17(1):22-24.
[23] 黄蓓,汪庆童,刘亢亢,等.类风湿关节炎发生发展中TNF-α信号通路与CD4+T细胞的关系[J].中国药理学通报,2013,29(7):900-903.
[24] 齐亚莉,张震宇,王洪艳,等.电离辐射诱导人乳腺癌细胞自噬与凋亡的关系[J].吉林大学学报(医学版),2009,35(6):1007-1010.
[25] 于子涵,刘英.JAK-STAT1信号通路及细胞因子信号转导抑制蛋白-1在类风湿关节炎中的研究进展[J].风湿病与关节炎,2014,3(4):66-69.
[26] Li H,Wan A.Apoptosis of rheumatoid arthritis fibroblast-like synoviocytes:possible roles of nitric oxide and the thioredoxin 1[J].Mediators Inflamm,2013,2013(3):953462
[27] 梁秀云.类风湿性关节炎患者血清IL-6、TNF-α、CRP的水平变化及意义[J].海南医学,2012,23(4):85-87.
[28] 陈英,张文玲,黄涛,等.炎症因子TNF-α、IL-6、IL-17与类风湿关节炎并发动脉粥样硬化的关系[J].免疫学杂志,2017,33(3):268-272.
[29] 董越娟,石贞玉,刘诗濛,等.酒精诱导嗜铬细胞瘤细胞自噬及其与P62作用的关系[J].解剖学报,2013,44(6):772-777.
[30] Dikic I,Johansen T,Kirkin V.Selective autophagy in cancer development and therapy[J].Cancer Res,2010,70(9):3431-3434.
[31] Norman JM,Cohen GM,Bampton ET.The in vitro cleavage of the hAtg proteins by cell death proteases[J].Autophagy,2010,6(8):1042-1056.
[32] Jin Z,Li Y,Pitti R,et al.Cullin3-based polyubiquitination and p62-dependent aggregation of caspase-8 mediate extrinsic apoptosis signaling[J].Cell,2009,137(4):721-735.
[33] 韩姣,曾凡军,陈世雄,等.细胞自噬与凋亡关系的分子机制研究进展[J].海南医学,2016,27(4):604-606.
[34] 蔡永松,许鹏.类风湿关节炎滑膜成纤维细胞凋亡与自噬研究进展[J].中华风湿病学杂志,2014,18(5):341-344.
收稿日期:2017-04-17;修回日期:2017-09-01endprint

