杜香叶多糖的提取及抗氧化和抗肿瘤活性研究
李 雪, 王宏伟, 郑东然, 张鸿宇, 王英逵
(东北林业大学 生命科学学院,黑龙江 哈尔滨 150040)

LI Xue
杜香叶多糖的提取及抗氧化和抗肿瘤活性研究
李 雪, 王宏伟*, 郑东然, 张鸿宇, 王英逵
(东北林业大学 生命科学学院,黑龙江 哈尔滨 150040)
采用水提醇沉法从杜香(LedumpalustreL.)叶中提取得到多糖,通过硫酸苯酚比色法测定杜香叶多糖含量;在单因素试验的基础上进行正交试验优化提取条件,采用试剂盒法和化学实验法测定其体外总抗氧化活性以及DPPH·、·OH和H2O2清除能力;采用肝癌细胞HepG2为细胞模型,研究其对HepG2细胞的体外抗增殖活性。结果表明:杜香叶多糖提取的最佳条件为:液料比30∶1(mL∶g),提取温度80 ℃,提取时间3 h。在此条件下,多糖提取得率为7.86%±0.16%,纯度为90.06%。在质量浓度 1~5 g/L范围内,杜香叶多糖体外抗氧化活性和抗癌细胞增殖活性均呈现出量效关系趋势。5 g/L杜香叶多糖总抗氧化能力为(10.27±0.2) U/mL,达到相同质量浓度的Vc总抗氧化活性的95%以上;各浓度杜香叶多糖DPPH·、·OH清除能力均达到相同质量浓度的Vc 90%以上,杜香叶多糖对H2O2清除能力在5 g/L时达到相同质量浓度的Vc 60%以上;当质量浓度为5 g/L时,杜香叶多糖对HepG2细胞增殖抑制率达57.41%±0.02%。
杜香;多糖;抗氧化;抗肿瘤
杜香为杜鹃花科杜香属的常绿灌木[1],是大兴安岭林区的主要树种,其分布面积约占大兴安岭林地面积的70%[2]。统计资料显示[3],大兴安岭杜香干叶年产量可达53万吨以上。杜香所含化学成分丰富,含有多糖、熊果酸、挥发性精油等多种生物活性物质[4- 10]。多糖广泛存在于动物、植物和微生物中,由于其所具有的生物活性而得到广泛关注。多糖的生物活性包括抗氧化、抗肿瘤、增强免疫能力、抗辐射等等[11- 15]。随着相关研究的增多,越来越多具有生物活性的新的多糖资源不断被发现,但未见杜香叶多糖抗氧化性及抗肿瘤活性的报道。因此,本研究通过水提醇沉法提取杜香叶中的多糖,并对其体外抗氧化和抗肿瘤活性进行考察,以期为杜香资源的开发和利用提供理论依据。
1 材料与方法
1.1原料、试剂与仪器
杜香(LedumpalustreL.)叶:由内蒙古金河林业局提供,2015年8月采自大兴安岭山区;烘干后粉碎并过0.3 mm筛,放干燥器中备用。
总抗氧化能力(T-AOC)测定试剂盒,南京建成生物工程研究所;HepG2癌细胞株,中国农业科学院哈尔滨兽医研究所;1,1-二苯基-2-三硝基苯肼(DPPH),美国Sigma公司;双氧水、三氯甲烷、乙醇、正丁醇、苯酚、石油醚、浓硫酸、葡萄糖、抗坏血酸、水杨酸钠、硫酸亚铁、磷酸氢二钠和磷酸二氢钠等均为分析纯。
LL1500型冻干机,美国Thermo公司;UV-2800A型紫外可见分光光度计,尤尼柯上海仪器有限公司;HERA Cell 240型CO2细胞培养箱,美国Thermo公司;Sorvall ST16型高速冷冻离心机,美国Thermo公司。
1.2杜香叶多糖的提取
采用水提醇沉法[16]提取杜香叶多糖:称取20 g干燥的杜香叶粉末置于圆底烧瓶中,加入100 mL石油醚,80 ℃下水浴回流1.5 h,收集沉淀,加入一定量的水,于一定温度下回流提取一定时间,收集提取液,离心,得上清液。将上清液浓缩后与 Sevage试剂(氯仿与正丁醇体积比5∶1)按4(体积比)∶1混合振荡,离心,除去介于提取液与Sevage试剂交界处的变性蛋白,得上清液。加入等体积乙醇,放置过夜后离心得沉淀,用丙酮、乙醚各洗涤3次,干燥后即得杜香叶多糖,备用。提取得率=干燥后杜香叶多糖质量/干燥杜香叶粉末质量×100%。
1.3杜香叶多糖的含量测定
采用硫酸-苯酚法测定杜香叶多糖含量,以葡萄糖为参照制作标准曲线。精确称取1 g干燥至质量恒定的葡萄糖,加水充分溶解,转移至50 mL容量瓶中,定容得20 g/L葡萄糖标准溶液。分别准确吸取0、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9和1 mL葡萄糖标准溶液,用蒸馏水补足至1.0 mL再加入 6%的苯酚溶液0.5 mL以及2.5 mL浓硫酸,摇匀,反应后冷却至室温于490 nm处测定吸光度。以吸光值为纵坐标(Y),葡萄糖质量浓度为横坐标(X),绘制标准曲线,得标准曲线回归方程为:Y=16.684X-0.025 7,R2=0.995 8。结果表明:葡萄糖在1~5 g/L范围内线性关系良好。
1.4杜香叶多糖的抗氧化和抗肿瘤活性测定
1.4.1总抗氧化能力的测定 采用总抗氧化能力(T-AOC)测定试剂盒测定杜香叶多糖总抗氧化能力。
分别准确配制不同浓度的杜香叶多糖(最佳提取条件下获得,下同)和抗坏血酸(Vc)溶液样品,按照T-AOC测定试剂盒说明书进行操作。
混匀,放置10 min,在520 nm测定测定管样品吸光度(A测定)和对照管吸光度(A对照),根据式(1)计算杜香叶多糖及Vc的总抗氧化能力(η总):
η总=(A测定-A对照)×N×n/(0.01×30)
(1)
式中:N—反应体系稀释倍数(反应液总量/取样量);n—样品测试前稀释倍数,1。
在37 ℃时,每分钟每毫升样品使反应体系的吸光度值每增加0.01时,为一个总抗氧化能力单位。
1.4.2DPPH自由基清除能力的测定 分别取不同浓度的杜香叶多糖和抗坏血酸(Vc)溶液2 mL加入等体积的DPPH乙醇溶液,混匀后室温放置30 min 后,测定其在517 nm处的吸光度(A1)。同时测定不加DPPH的多糖溶液与乙醇混合后的吸光度(A2),不加样品的DPPH乙醇溶液作为空白对照的吸光度(A0)。根据式(2)计算杜香叶多糖及Vc的DPPH自由基清除率(ηDPPH·):
ηDPPH·=(1-(A1-A2)/A0)×100%
(2)
1.4.3OH自由基清除能力的测定 取0.5 mL 2 mmol/L水杨酸钠-乙醇溶液,加入0.5 mL 9 mmol/L硫酸亚铁溶液,分别加入1.5 mL不同浓度多糖和抗坏血酸(Vc)溶液,最后加入0.5 mL 6 mmol/L双氧水。37 ℃反应1 h,在510 nm下测定吸光度(A1′)。同时测定用蒸馏水代替硫酸亚铁溶液的吸光度(A2′),蒸馏水代替样品溶液作为空白对照的吸光度(A0′)。根据式(3)计算杜香叶多糖及VC的OH自由基清除率(η·OH):
η·OH=(1-(A1′-A2′)/A0′)×100%
(3)
1.4.4H2O2清除能力的测定 取2.8 mL由50 mmol/L pH值 7.4的磷酸缓冲液配制的5 mmol/L的H2O2溶液,分别加入1.0 mL不同浓度多糖和抗坏血酸(Vc)溶液,用蒸馏水补足至10.0 mL。25 ℃放置10 min后,在230 nm处测定吸光度(A1″)。同时测定不加H2O2溶液的样品溶液的吸光度(A2″),不加样品的H2O2溶液吸光度(A0″)。根据式(4)计算杜香叶多糖及Vc的H2O2清除率(ηH2O2):
ηH2O2=(1-(A1″-A2″)/A0″)×100%
(4)
1.4.5抗肿瘤活性的测定 HepG2肝癌细胞用含5%胎牛血清的培养液,在37 ℃、5% CO2传代培养箱中培养。取对数生长期的HepG2细胞接于96 孔白板,使每孔细胞密度约为8×103个/mL,于37 ℃、5% CO2下培养4 h后,移去残余培养基,磷酸盐缓冲液(PBS)清洗1 次。其中,样品孔中加入含100 μL不同浓度杜香叶多糖的培养基,对照孔中加入100 μL的培养基,于37 ℃、5% CO2条件下培养72 h后开始测板,移去96 孔板内残余培养基,PBS清洗1 次,加50 μL/孔亚甲基蓝溶液,于培养箱中放置1 h,然后移去染色液,并用去离子水清洗该96 孔板至清洗液无色,吸去板中多余水分并风干2~3 min,加100 μL/孔由50%乙醇、49% PBS、1%醋酸配制成的洗脱液,然后置于摇床上振荡20 min,使孔内已染色的细胞形成均匀的细胞悬浮液,最后于570 nm波长读取各孔中染色细胞悬浮液的吸光度A样品组和A对照组。每个质量浓度的杜香叶多糖做3次平行测定。根据式(5)计算杜香叶多糖的细胞增殖抑制率(y):
y=(1-A样品组/A对照组)×100%
(5)
2 结果与讨论
2.1不同条件对杜香叶多糖提取得率的影响
2.1.1液料比 在提取温度80 ℃、提取时间2 h条件下,液料比对杜香叶多糖提取的影响见图1(a)。由图1(a)可见,液料比由20∶1(mL∶g,下同)上升到30∶1时,多糖溶出增加,得率上升。然而,随着液料比进一步增加,其他水溶性成分对多糖的溶解竞争可能增大,多糖得率降低。考虑到液料比增加会使后续浓缩环节能耗增大,从而造成提取成本的增加。因此,液料比为30∶1时,提取效果最好。一般情况下,在保证提取率的前提下,液料比越小越好。本研究中尝试过液料比为10∶1的情况,由于过筛后的干粉吸水性强,所以在液料比10∶1时几乎无法得到溶液,导致无法进行有效的提取和后续的实验测定。
2.1.2提取温度 在液料比30∶1、提取时间2 h条件下,温度对杜香叶多糖提取的影响见图1(b)。由图1(b)可见,提取温度由60 ℃上升到80 ℃过程中,多糖溶出增加,得率上升。然而,随着温度进一步上升,多糖得率有所降低。考虑到温度升高可能引起多糖的降解和提取成本的增加。因此,提取温度为80 ℃时,提取效果最好。
2.1.3提取时间 在液料比30∶1、提取温度80 ℃下,时间对杜香叶多糖提取的影响见图1(c)。由图1(c)可见,提取时间由1 h上升到3 h过程中,多糖溶出增加。然而,随着时间进一步增加,多糖得率基本不变。综合考虑提取效率以及提取时间延长造成提取成本增加。因此,提取时间为3 h时,提取效果最好。

图1 不同条件对杜香叶多糖提取得率的影响
2.2正交试验优化
正交试验设计及结果分析见表1。由表1可见,极差为C>A>B,即3因素对提取得率影响顺序依
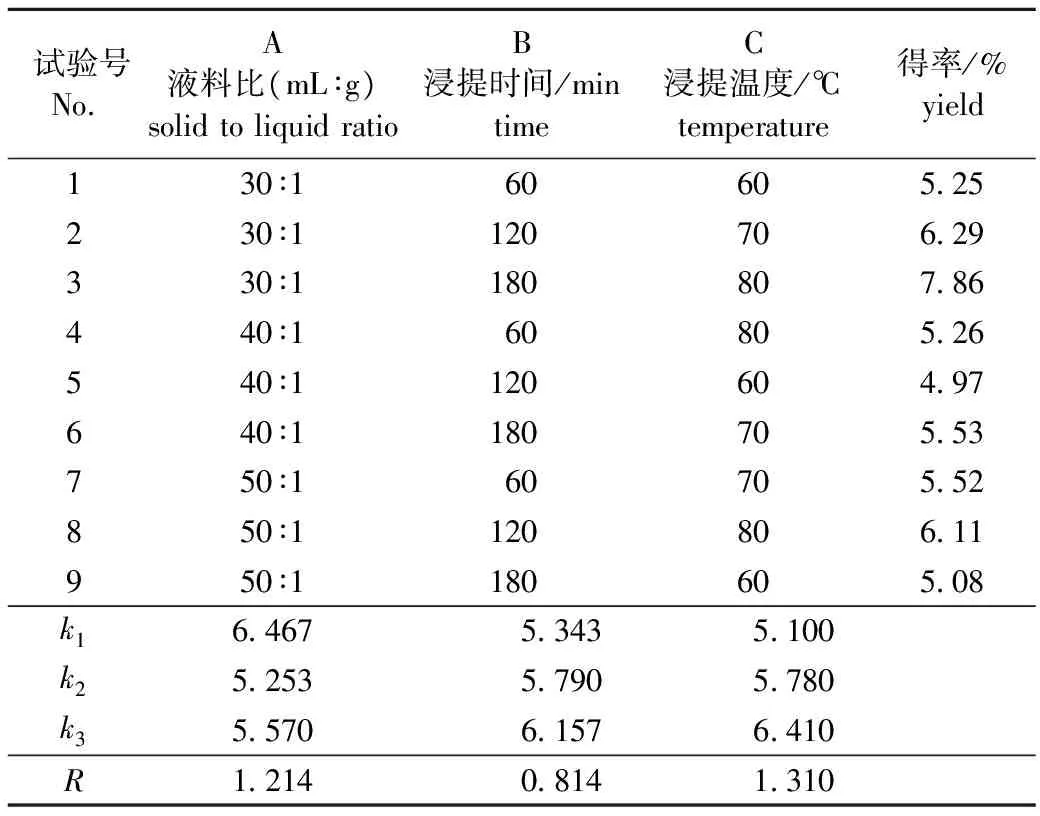
表1 正交试验设计及结果分析Table 1 The results of extraction orthogonal test
次为:浸提温度>液料比>浸提时间。这与文献[7]得出的结果一致。由正式试验得到的最佳提取条件为:液料比30∶1,提取温度80 ℃,提取时间3 h。在此条件下进行3次验证实验,得到杜香叶多糖提取得率为7.86%±0.16%,多糖纯度为90.06%。
2.3杜香叶多糖的抗氧化及抗肿瘤活性
2.3.1总抗氧化能力 不同质量浓度杜香叶多糖总抗氧化能力见图2。由图2可见,杜香叶多糖总抗氧化能力与Vc的总抗氧化能力接近,并且随着质量浓度增大,抗氧化能力增强。杜香叶多糖质量浓度为5 g/L时,总抗氧化能力为(10.27±0.2) U/mL,达到相同质量浓度的Vc总抗氧化能力(10.70±0.33)U/mL的95%以上。可以看出,杜香叶多糖总抗氧化能力较强。
2.3.2对DPPH自由基清除能力 不同质量浓度杜香叶多糖DPPH自由基清除能力见图3。由图3可见,杜香叶多糖与Vc的DPPH自由基清除能力均随着质量浓度增大具有增强趋势。各浓度杜香叶多糖DPPH自由基清除能力均达到相同质量浓度的Vc 95%以上,说明杜香叶多糖对DPPH自由基清除能力较强。

图2杜香叶多糖总抗氧化能力
Fig.2Totalantioxidantcapabilityofpolysaccharide
图3杜香叶多糖对DPPH自由基清除能力
Fig.3ThescavengingeffectonDPPHfreeradicalofpolysaccharide
2.3.3对OH自由基清`叶多糖对OH自由基清除能力见图4(a)。由图4(a)可见,杜香叶多糖与Vc对OH自由基清除能力均随着质量浓度增大具有增强趋势。5 g/L时杜香叶多糖对OH自由茎清除率为67.05%±0.20%。各浓度杜香叶多糖对OH自由基清除能力均达到相同质量浓度的Vc 90%以上,说明杜香叶多糖对OH自由基清除能力较强。
2.3.4对H2O2清除能力 不同质量浓度杜香叶多糖对H2O2清除能力见图4(b)。由图4(b)可见,杜香叶多糖与Vc对H2O2清除能力均随着质量浓度增大具有增强趋势。杜香叶多糖质量浓度为5 g/L时,对H2O2清除能力基本达到最大,清除率为47.78%±0.33%,达到Vc(79.16%±0.36%)的60%以上。
2.3.5抗肿瘤活性 杜香叶多糖的抗肿瘤活性见图5。由图5可见,杜香叶多糖对HepG2细胞具有抗增殖作用,并且随着质量浓度增大,抗增殖作用增强。杜香叶多糖质量浓度为5 g/L时,HepG2细胞增殖抑制率可以达到57.41%±0.02%。

图4杜香叶多糖对OH(a)和H2O2(b)清除能力
Fig.4ThescavengingeffectonOHfreeradical(a)andH2O2(b)ofpolysaccharide
图5杜香叶多糖对HepG2细胞抗增殖作用
Fig.5AntiproliferativeofpolysaccharideonHepG2cells
3 结 论
3.1通过水提醇沉法从杜香叶中提取多糖,通过单因素和正交试验考察了不同条件对杜香叶多糖提取得率的影响。结果表明:最佳提取条件为:液料比30∶1,提取温度80 ℃,提取时间3 h。此条件下,多糖提取得率为7.86%±0.16%,纯度为90.06%。
3.2通过试剂盒法、化学实验法以及采用人肝癌细胞HepG2为细胞模型评价了杜香叶多糖的体外抗氧化能力及抗肿瘤活性。结果表明:在质量浓度1~5 g/L范围内,随着质量浓度增加,抗氧化能力和抗癌细胞增殖能力增强。5 g/L杜香叶多糖总抗氧化能力为(10.27±0.2) U/mL,达到相同质量浓度的Vc总抗氧化活性的90%以上;各浓度杜香叶多糖DPPH自由基清除能力、OH自由基清除能力均达到相同质量浓度的Vc 90%以上;杜香叶多糖对H2O2清除能力在5 g/L时达到Vc的60%以上;当质量浓度为5 g/L时,杜香叶多糖对HepG2细胞增殖抑制率可以达到57.41%±0.02%。
3.3研究表明,杜香叶多糖具有一定的抗氧化、抗肿瘤活性,可对其资源进一步开发,作为一种新型的天然抗氧化剂和抗癌活性成分应用于保健食品、化妆品和生物制药等行业。特别是近年来中草药提取物的癌症辅助治疗逐渐成为热点,杜香叶有望成为新的有效的抗癌资源。
[1]中国科学院中国植物志编辑委员会.中国植物志[M]. 北京:科学出版社,1999,57(1):4.
China Flora Editorial Board of Chinese Academy of Sciences. Flora of China[M]. Beijing:Science Press,1999,57(1):4.
[2]冯旭,周勇,郭立新. 黑龙江省野生香料植物资源及其利用[J]. 国土与自然资源研究,1995,2(2):68 - 72.
FENF X,ZHOU Y,GUO L X. Wild perfume plant resources and their utilization in Heilongjiang[J].Territory and Natural Resources Study,1995,2(2):68 - 72.
[3]周以良. 中国大兴安岭植被[M]. 北京:科学出版社,1991:239 - 310.
ZHOU Y L. Vegetation in Daxing’ anling Mountain[M]. Beijing:Science Press,1991:239 - 310.
[4]BELOUSOVA N I,KHAN V A. Bicyclic monoterpenoids of the essential oil ofLedumpalustre[J]. Chemistry of Natural Compounds,1990,26(5):532 - 534.
[5]XIU Z L,ZHU X L,ZHANG D J,et al. A new way for chemical degradation of plastic by natural volatile constituents ofLedumpalustre[J]. Chinese Science Bulletin,2010,48(16):1718 - 1721.
[6]张乔会,逄锦慧,杨喆,等. 不同提取方法对杜香熊果酸提取得率的影响[J]. 食品工业科技,2014,35(23):217 - 222.
ZHANG Q H,PANG J H,YANG Z,et al. Effects of different extraction technologies on the extraction yield for Ledum Ursolic acid[J]. Science and Technology and Food Industry,2014,35(23):217 - 222.
[7]张乔会,逄锦慧,杨喆,等. 响应面法优化杜香多糖提取工艺[J]. 天然产物研究与开发,2015,27(6):1105 - 1111.
ZHANG Q H,PANG J H,YANG Z,et al. Optimization of extraction conditions of polysaccharide fromLedumpalustreL.using response surface analysis[J]. Natural Product Research and Development,2015,27(6):1105 - 1111.
[8]赵頔,张敏,武文斌,等.杜香黄酮提取纯化工艺及其抗炎作用研究[J]. 中成药,2012,34(8):1590 - 1594.
ZHAO D,ZHANG M,WU W B,et al. Study on the extraction,purification process and anti-inflammatory action of flavonoids from Du Xiang[J]. Chinese Traditional Patent Medicine,2012,34(8):1590 - 1594.
[9]路博琼,罗书勤,张力平.超临界CO2萃取杜香挥发油工艺优化及成分分析[J]. 现代农业科技,2014(6):173 - 174,178.
LU B Q,LUO S Q,ZHANG L P. Component analysis and technique optimization of super critical carbon dioxide fluid extraction of oils in Ledum[J]. Modern Agricultural Science and Technology,2014(6):173 - 174,178.
[10]姜玮,刘静波,卢静,等. 杜香挥发油研究概述[J]. 食品科学,2010,31(13):337 - 341.
JIANG W,LIU J B,LU J,et al. Research progress of essential oils fromLedumpalustre[J]. Food Science,2010,31(13):337 - 341.
[11]FAN L P,DING S D,AI L Z,et al. Antitumor and immunomodulatory activity of water-soluble polysaccharide fromInonotusobliquus[J]. Carbohydrate Polymers,2012,90(2):870 - 874.
[12]ZHAO W,JIANG X J,DENG W W,et al. Antioxidant activities ofGanodermalucidumpolysaccharides and their role on DNA damage in mice induced by cobalt-60 gamma-irradiation[J]. Food and Chemical Toxicology,2012,50(2):303 - 309.
[13]汲晨锋,岳磊. 抗肿瘤蕈类多糖的研究进展[J]. 林产化学与工业,2014,34(1):128 - 134.
JI C F,YUE L. Review on anti-tumor polysaccharides in mushroom[J]. Chemistry and Industry of Forest Products,2014,34(1):128 - 134.
[14]王莹莹,熊双丽,史敏娟,等. 夏枯草酸性多糖及其衍生物的生物活性研究[J]. 林产化学与工业,2013,33(5):35 - 40.
WANG Y Y,XIONG S L,SHI M J,et al. Biological activities of acidic polysaccharide and its derivatives fromPrunellavulgarisLinn.[J]. Chemistry and Industry of Forest Products,2013,33(5):35 - 40.
[15]周国亮,宋翼升,辛艳飞,等. 灵芝多糖抗氧化和抗肿瘤活性的研究进展[J]. 中华中医药学刊,2015,32(5):1002 - 1005.
ZHOU G L,SONG Ys,XIN YF,et al. Progress in research on anti-oxidation and anti-tumor effect ofGanodermalucidumpolysaccharide[J]. Chinese Archives of Traditional Chinese Medicine,2015,32(5):1002 - 1005.
[16]贺杰. 对紫背菜多糖提取工艺的研究[J]. 求医问药,2011,9(12):533 - 534.
HE J. Study on the extraction technology ofGynurabicolorDC polysaccharide[J]. Seek Medical,2011,9(12):533 - 534.
Extraction and Antioxidant, Antiproliferative Activities of Polysaccharide from Ledum palustre L. Leaves
LI Xue, WANG Hongwei, ZHENG Dongran, ZHANG Hongyu, WANG Yingkui
(Life Science College, Northeast Forestry University, Harbin 150040, China)
The polysaccharide fromLedumpalustreL. leaves was obtained by ethanol precipitation, and its content was determined by phenol-sulfuric acid assay. Based on the single-factor test, a orthogonal test was designed to optimize the extracting conditions.The total antioxidant activity and the scavenging effect on DPPH free radical, OH free radical and H2O2by the polysaccharide fromL.palustreleavesinvitrowere determined by the kit method and chemical method. The antiproliferative activity was evaluated on human liver cancer HepG2 cellsinvivo. The results showed that the best extracting conditions of the polysaccharide were: the liquid-solid ratio 30∶1(v/w), extraction temperature 80 ℃ and extraction time 3 h.Under these conditions,the extraction yield of the polysaccharide was 7.86%±0.16% and the purity reached 90.06%. In the range of 1-5 g/L, the antioxidant and antiproliferative activities increased with an increase of mass concentration. At the mass concentration of 5 g/L, the total antioxidant activity was(10.27±0.2) U/mL and reached more than that of 95% Vc with the same mass concentration. The scavenging effects on DPPH free radical and OH free radical in different concentration reached more than those of 90% of Vc with the same mass concentration. The scavenging effect on H2O2reached more than that of 60% Vc with the same mass concentration and the proliferation inhibitory rate of HepG2 cells was 57.41%±0.02% at the mass concentration of 5 g/L.
LedumpalustreL.; polysaccharide; antioxidant; anti tumor
2017- 02- 03
国家级大学生创新训练项目资助(201510225154)
李 雪(1994— ),女,山东淄博人,本科生,研究方向为生物活性物质的制备与应用
*通讯作者:王宏伟,副教授,研究方向为生物活性物质的制备与应用;E-mail: 84970486@qq.com。
10.3969/j.issn.0253-2417.2017.05.018
TQ35;S789.4
A
0253-2417(2017)05- 0133- 06
李雪,王宏伟,郑东然,等.杜香叶多糖的提取及抗氧化和抗肿瘤活性研究[J].林产化学与工业,2017,37(5):133 - 138.

