胃癌淋巴结转移风险评分预测第一站淋巴结转移
朱登峰 朱松明
·论 著·(临床研究)
胃癌淋巴结转移风险评分预测第一站淋巴结转移
朱登峰 朱松明
目的以D2淋巴结清扫为主的胃癌治疗术式仍存在争议,尤其是对无淋巴结转移或仅有第一站以内淋巴结转移病人接受D2术则增加了其创伤程度;能否通过术前淋巴结转移风险评分预测发生第一站以内的淋巴结转移,从而避免D2淋巴结清扫,为此,进行了这方面的研究。方法收集2012年1月至2014年6月临床胃癌病例276例,回顾性分析术前超声内镜对肿瘤大小、肿瘤浸润深度、淋巴结转移检查评估情况,并结合内镜下活检标本肿瘤常规病理和免疫病理染色显示的肿瘤分化程度、上皮间质转化相关指标E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)、Twist-1染色,建立胃癌淋巴结转移风险评分。将病人根据手术切除标本获得的最后淋巴结分布情况分组,分成第一站以内的淋巴结转移组和超过第一站淋巴结转移组。结果淋巴结转移风险评分≤6分者,发生第一站以上淋巴结转移的风险是1.14%;评分≤6分的病人约占总病人数的31.52%。而评分>6分的病人发生第一站以上淋巴结转移的风险为37.82%。两者之间差异具有统计学意义(P<0.01)。结论淋巴结转移风险评分能较好地预测第一站以内淋巴结的转移风险。
胃癌; 淋巴结转移; 风险评分; 超声内镜; 上皮细胞间质转化
在恶性肿瘤中,胃癌发病率位居第5位[1],死亡率居第3位[2]。在我国和日本等东亚国家,其发病率和死亡率更高。在我国每年约有48.57/10 000人患病,死亡率约为35.60/10 000[3]。据研究表明,原发肿瘤所导致的死亡仅占肿瘤所致死亡的10%,大部分病人是死于肿瘤的远处转移[4]。
众所周知,淋巴转移是胃癌的主要转移方式。D2淋巴结廓清术(D2术)是进展期胃癌主要的手术方式。但有关D2术对预后的影响仍存在争议。近来一个RCT研究发现,D1和D2术后,5年生存率无显著差别[5]。不仅如此,胃癌本身的生物学特性差别巨大,胃癌是否发生淋巴结转移差别也十分明显。对于没有淋巴结转移(N0)或者仅有少量第一站(N1)转移的病人,一味地行D2淋巴结清扫或有过度治疗之嫌疑[6]。因此,前哨淋巴结检测及其转移规律的探索[6]和重视淋巴结微转移的研究显得非常必要[7]。而当前包括超声内镜等临床影像学手段对是否发生淋巴结转移的敏感性无法达到要求[8]。因此,有研究尝试其他方法来更好地确定淋巴结转移并指导手术,如前哨淋巴结活检等[6,9]。但目前尚不能较好地满足临床需求。分析原因是,胃癌的转移受多种因素影响,如肿瘤大小、浸润深度、分化程度、肿瘤转移能力等。由此可见,建立一种能综合上述多种因素的综合评分,来预测胃癌的淋巴结转移显得很有必要。
通常,胃癌病人术前一般都需要病理活检证实,并对恶性程度进行评估。超声内镜术前可观察胃癌浸润深度和内镜下胃周区域淋巴结转移,并日益得到重视。胃癌的上皮细胞间质转化(epithelial mesenchymal transition,EMT)使之具有更强的侵袭和转移能力,并与淋巴结转移密切相关。E-钙黏蛋白(E-cadherin)是上皮细胞的重要蛋白分子,可以介导上皮细胞之间的黏附。有研究表明,在肿瘤的侵袭转移中,E-cadherin表达下降并导致癌细胞的黏附下降[10-11]。N-钙黏蛋白(N-cadherin)和Twist-1是EMT重要的分子标记,其高表达与肿瘤的转移和预后差密切相关[12-13],组织病理活检可对与EMT密切相关的蛋白进行检测并评分。因此,探索这些检测结果对淋巴结转移的综合评估或有较高的临床应用价值。
资料与方法
一、临床资料
收集本院消化内科胃镜检测怀疑为胃癌并行超声内镜观察浸润深度并记录,按标准活检组织行病理检查。活检组织证实为胃癌后入组。排除肝脏和肺转移者、女性卵巢种植转移者。本研究从2012年1月至2014年6月共收集病例276例,其中男性163例,女性113例。年龄29~86岁,平均58.4岁。根据肿瘤的位置,分为贲门部63例,胃体部89例,胃窦部101,全胃23例。肿瘤大小估测在内镜下直接进行。在超声内镜检查中,采用水囊直接接触法检查肿瘤浸润深度[14]。胃壁在超声内镜下分为5层,分别为:第一、二层为黏膜层(m)、第三层为黏膜下层(sm)、第四层为固有肌层、第五层为浆膜和浆膜下层[10]。超声内镜下淋巴结转移标准如下:满足下面二项或二项以上时,为超声内镜下淋巴结转移阳性:①直径大于5 mm;②圆形;③淋巴结内低回声表现;④边缘光滑。参照第7版美国癌症联合委员会(AJCC)的TNM分期标准,对内镜下获得的数据赋予分值(表1)[14-15]。
二、活检组织HE染色确定癌及其分化程度
对内镜下病变组织行常规活检,并予以10%甲醛固定,石蜡包埋,连续切片后进而予以常规组织学染色(HE染色)。由资深病理科医师读片判断病变的良恶性以及分化程度。根据分化程度的不同予以评分(表1)。
三、活检组织进行免疫组织化学染色
对于活检的组织,同时进行EMT相关的蛋白N-cadherin、E-cadherin、Twist-1免疫组织化学染色。免疫组织化学试剂盒购自武汉博士德,操作步骤按照说明书。一抗均购自英国的Abcam公司,以1∶150比例稀释;二抗购自博士德。原发灶组织切片行免疫组织化学染色后,按蛋白表达程度分为阳性和阴性[16]。对于E-cadherin,以细胞膜出现棕黄色颗粒为阳性表达,切片阳性细胞数>50%为阳性;N-cadherin和Twist-1,以细胞膜和(或)细胞质内出现棕黄色颗粒为阳性表达,阳性细胞数>1%为阳性切片[16]。
四、手术方法及标本淋巴结获取
入组病人均接受日本胃癌研究会所推荐的D2淋巴结清扫的标准胃癌根治术[17]。手术切除范围包括近全胃或全胃切除。术中,对于浸润浆膜或周围器官、N2阳性(怀疑者行术中冰冻切片检查)、或者肿瘤浸润肌层且合并活检病理提示低分化或EMT相关因子免疫组织化学评分总和大于2分者行扩大清扫(D3/D3+)。所有淋巴结检测总数需≥15枚,实际摘取淋巴结数目为15~42枚,平均18.34枚/例。按照日本胃癌协会指定的规约对淋巴结予以分组和分站[17]。每一枚淋巴结需切3~5片。
五、统计学处理
用SPSS(21.0版)统计软件行统计学分析,采用Spearman相关性分析胃镜活检组织免疫组织化学染色与手术后标本免疫组织化学染色之间的相关性,各组间淋巴结转移率对比使用χ2检验,P<0.05认为差异有统计学意义。
结 果
一、胃癌活检标本EMT相关指标E-cadherin、N-cadherin、Twist-1的表达(图1)
活检胃癌标本中E-cadherin、N-cadherin和Twist-1的情况见图1,活检的胃癌标本中也有E-cadherin的表达下降,N-cadherin和Twist-1表达升高。我们还将这3个指标在活检标本的阳性结果、手术切除后标本免疫组织化学染色结果进行对比,发现一致性分别为89.49%、94.56%、93.48%,E-cadherin的rs=0.789,P<0.001;N-cadherin的rs=0.883,P<0.001;Twist-1的rs=0.869,P<0.001(表2)。说明活检标本E-cadherin、N-cadherin和Twist-1与EMT相关的蛋白免疫组织化学结果能较客观地反映肿瘤原发灶的实际情况。

表1 胃癌淋巴结转移风险评分表
注:淋巴结转移风险评分=(ET+ EI+EN)+(HD+HN-cadherin+HE-cadherin+HTwist-1)

图1 胃镜活检胃癌组织和癌旁组织E-cadherin、N-cadherin及Twist-1免疫组织化学染色 细胞质内或(和)细胞膜显示棕色染色的为阳性胃癌细胞(×200)
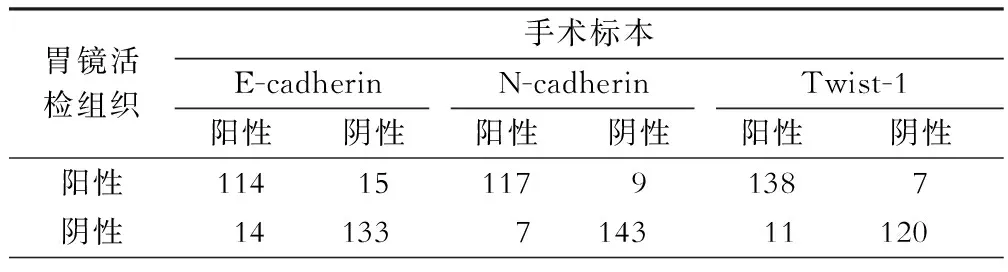
表2 胃镜活检标本与手术标本免疫组织化学染色相关性(例)
二、内镜下的肿瘤指标评分与肿瘤淋巴结转移的相关性
术后淋巴结病理检查结果分为两组,一组是无淋巴结转移或有第一站内淋巴结转移的(A组);另外一组是有第二或第三站淋巴结转移(B组)。我们仅使用超声内镜下的评分(ET+ EI+EN) (表3),发现即使内镜下评分≤1分的病例,也有11.11%(1/9)发生了第二站以上转移的。而评分≤2分和≤3分的发生第二站转移的可能性分别为13.33%(2/15)和13.04%(6/46)。这一结果说明仅用超声内镜下的评分来预测淋巴结转移的风险与实际手术后大体标本的病理结果出入较大。
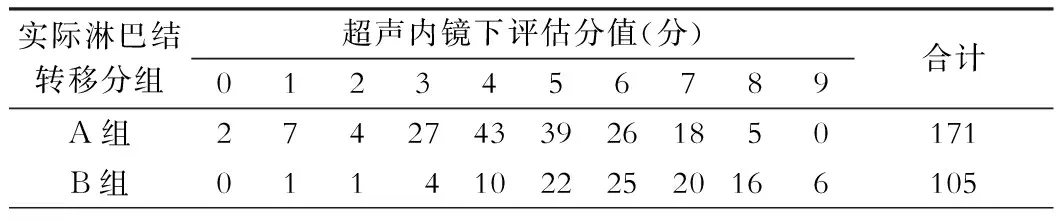
表3 276胃癌病人超声内镜评分和实际淋巴结转移的对应关系(例)
注:A组为N0或N1转移;B组为≥N2转移
三、淋巴结转移风险评分与手术标本淋巴结病理检查相关性
加上内镜活检组织病理学染色的评分,即我们提出的淋巴结转移风险评分进行统计,结果见表4。评分≤5分的,未发现第二站以上转移的病例;而评分≤6分的,其第二站以上淋巴结转移的概率是1.14%(1/88);如果≤7分,概率则达到8.33%(10/120);评分≤6分的病人约占总病人数的31.52%(88/276)。用χ2检验检测,淋巴结转移风险评分≤6分的病人发生第一站以内转移与评分>6分的病人比较差异具有统计学意义(表5)。淋巴结转移风险评分与手术标本淋巴结病理检查相关性较好。
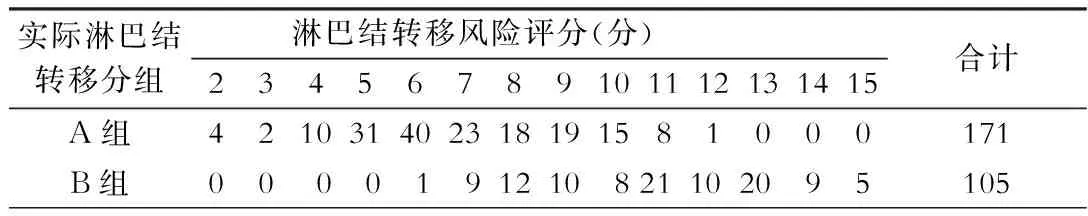
表4 276胃癌病人淋巴结转移风险评分和实际淋巴结转移的对应关系(例)
注:A组为N0或N1转移;B组为≥N2转移

表5 276例胃癌病人淋巴结转移风险评分和实际淋巴结转移分组间的卡方检验(例)
注:A组为N0或N1转移;B组为≥N2转移
讨 论
以淋巴结转移为主要转移方式的胃癌,其手术清扫范围一直存在争议。临床也采取了多种尝试去研究如何能够在术前确定是否存在淋巴结转移而达到个体化治疗,如通过注射示踪剂观察前哨淋巴结等,但仍未能很好地解决问题。
影响胃癌淋巴结的转移是多因素的。肿瘤的大小、浸润深度、肿瘤分化程度、肿瘤转移相关的分子标记等。尽可能综合以上因素来分析淋巴结转移风险才有可能较好地预测淋巴结转移。
近年来,超声内镜已经相对比较普及。在此基础上,可以对胃癌的大小、浸润深度、淋巴结转移情况进行一定程度的估计。在肿瘤大小中,既往的文献发现早期胃癌直径大于3 cm转移风险增加[18]。而对于进展期胃癌,直径大于5 cm的风险较直径小于5 cm的风险增加[19]。因此,本研究在肿瘤大小评分标准选择上,以5 cm和3 cm作为标准。而对于超声内镜下其他参数的标准则参考第7版AJCC的TNM分期。但是,我们的数据发现,仅靠超声内镜的数据对第一站以内淋巴结转移与否的预测不能让人满意。我们分析数据发现,预测出现偏差的多发生在肿瘤分化低与转移相关分子标记阳性的病人身上。
鉴于上面的分析,结合胃癌诊断过程中活检标本的获取十分容易这个特点,我们想能否结合分析活检标本,从而进一步提高预测胃癌第一站淋巴结转移的可能性?上皮来源的癌细胞,转移时要发生表型的变化,如细胞间的连接减少甚至消失、细胞极性散失等。这些表型的变化可以概括为EMT。EMT被认为是肿瘤转移的重要机制[20]。有研究表明,EMT密切相关的分子标记E-cadherin和N-cadherin与胃癌病人的预后相关[21]。Twist-1可以促进胃癌的淋巴结转移[22]。因此,我们在超声内镜评分的基础上,加上活检标本的肿瘤分化程度和E-cadherin、N-cadherin和Twist-1阳性与否的指标建立淋巴结转移风险评分。结果发现,如果加上这些指标,可以较好地预测第一站淋巴结转移与否。重要的是,所预测的第一站以内淋巴结转移的病人可以达到总病人数的31.88%。本研究的实际意义还在于,对于胃癌手术来说,其转移淋巴结的第一站是紧贴胃壁的。因此,只要行胃癌手术,切除第一站淋巴结既相对容易,也不会给病人增加创伤。
当然,本研究是单中心、小样本的回顾性研究,具有一定的局限性。因此,要验证该评分是否真的具有临床指导意义,则需要大样本多中心的研究。而且还需要观察以评分为指导的治疗对预后的影响。
1 Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:Sources,methods and major patterns in GLOBOCAN 2012.Int J Cancer,2015,136:E359-E386.DOI:1002/ijc.29210.
2 Fock KM.Review article:the epidemiology and prevention of gastric cancer.Aliment Pharmacol Ther,2014,40:250-260.DOI :10.1111/apt.12814.
3 Chen W,Zheng R,Zhang S,et al.Report of incidence and mortality in China cancer registries,2009.Chin J Cancer Res,2013,25:10-21.DOI:10.3978/j.issn.1000-9604.2012.12.04.
4 Tirino V,Desiderio V,Paino F,et al.Cancer stem cells in solid tumors:an overview and new approaches for their isolation and characterization.FASEB J,2013,27:13-24.DOI:10.1096/fj.12-218222.
5 Degiuli M,Sasako M,Ponti A,et al.Randomized clinical trial comparing survival after D1 or D2 gastrectomy for gastric cancer.Br J Surg,2014,101:23-31.DOI:10.1002/bjs.9345.
6 Kitagawa Y,Takeuchi H,Takagi Y,et al.Sentinel node mapping for gastric cancer:a prospective multicenter trial in Japan.J Clin Oncol,2013,31:3704-3710.DOI:10.1200/JCO.2013.50.3789.
7 姜波健,吴巨刚,俞继卫,等.胃癌淋巴管生成、淋巴管浸润、淋巴结微转移的临床意义.中国普外基础与临床杂志,2008,12:903-909.
8 Son SY,Park JY,Ryu KW,et al.The risk factors for lymph node metastasis in early gastric cancer patients who underwent endoscopic resection:is the minimal lymph node dissection applicable? A retrospective study.Surg Endosc,2013,27:3247-3253.DOI:10.1007/s00464-013-2901-z.
9 Lee JH,Park do J,Kim YH,et al.Clinical implementations of preoperative computed tomography lymphography in gastric cancer:a comparison with dual tracer methods in sentinel node navigation surgery.Ann Surg Oncol,2013,20:2296-2303.DOI:10.1245/s10434-012-2855-8.
10Tarin D.The fallacy of epithelial mesenchymal transition in neoplasia.Cancer Res,2005,65:5996-6000.DOI:10.1158/0008-5472.CAN-05-0699.
11Elias MC,Tozer KR,Silber JR,et al.Twist is expressed in human gliomas and promotes invasion.Neoplasia,2005,9:824.
12Bock C,Kuhn C,Ditsch N,et al.Strong correlation between N-cadherin and CD133 in breast cancer:role of both markers in metastatic events.J Cancer Res Clin Oncol,2014,140:1873-1881.DOI:10.1007/s00432-014-1750-z.
13Zhang L,Xu Z,Xu X,et al.SALL4,a novel marker for human gastric carcinogenesis and metastasis.Oncogene,2014,33:5491-5500.DOI:10.1038/onc.2013.495.
14Feng XY,Wang W,Luo GY,et al.Comparison of endoscopic ultrasonography and multislice spiral computed tomography for the preoperative staging of gastric cancer-results of a single institution study of 610 Chinese patients.PLoS One,2013,8:e78846.DOI:10.1371/journal.pone.0078846.
15Washington K.7th edition of the AJCC cancer staging manual:stomach.Ann Surg Oncol,2010,17:3077-3079.DOI:10.1245/s10434-010-1362-z.
16霍莉莉,李慧,魏枫,等.乳腺癌中FoxP3 表达与上皮间质转化的相关性及其意义.中国肿瘤临床,2014,41:158-161.DOI:10.3969/j.issn.1000-8179.20131533.
17吴孟超,吴在德,主编.黄家驷外科学.第7版.北京:人民卫生出版社,2010.1447.
18何新阳,邵峰,梁伟,等.215例早期胃癌淋巴结转移的危险因素分析.中国肿瘤临床,2013,40:97-99.DOI:10.3969/j.issn.1000-8179.2013.02.009
19丁小兵,贺咏宁,李玉梅,等.进展期胃癌淋巴结转移规律的探讨.重庆医学,2010,39:58-61.DOI:10.3969/j.issn.1671-8348.2010.01.021.
20Thiery JP.Epithelial-mesenchymal transitions in tumour progression.Nat Rev Cancer,2002,2:442-454.DOI:10.1038/nrc822.
21Kamikihara T,Ishigami S,Arigami T,et al.Clinical implications of N-cadherin expression in gastric cancer.Pathol Int,2012,62:161-166.DOI:10.1111/j.1440-1827.2011.02774.x.
22张虹,陈新宇,朱永良,等.Twist-1表达促进胃癌细胞淋巴结转移的可能机制.中华老年医学杂志,2012,31:485-487.DOI:10.3760/cma.j.issn.0254-9026.2012.06.012.
上海市崇明县科委基金项目(CKY2016-13)
202150 上海,上海交通大学医学院附属新华医院崇明分院普外科
朱松明,Email:zhusongming2007@126.com
R656.6
A
10.3969/j.issn.1003-5591.2017.05.019
2016-04-18)

