费氏弧菌急性毒性微孔板检测方法优化
余露军,刘卫丽,陈小曲,李建军
(1. 广东省实验动物监测所/广东省实验动物重点实验室,广东 广州 510663;2. 中海油田服务股份有限公司,河北 三河 065201)
费氏弧菌急性毒性微孔板检测方法优化
余露军1,刘卫丽2,陈小曲1,李建军1
(1. 广东省实验动物监测所/广东省实验动物重点实验室,广东 广州 510663;2. 中海油田服务股份有限公司,河北 三河 065201)
为优化费氏弧菌(Vibrio fischeri)急性毒性微孔板法测试条件,以发光强度或发光抑制率为指标,研究温度、盐度、pH、反应体系、稀释比例、传代次数对费氏弧菌新鲜菌液生物毒性测试的影响。结果表明:费氏弧菌适宜培养温度为15~20℃;检测适宜温度为15℃,盐度为15‰~35‰,pH为5~10,检测体系为1∶10,传代次数不宜超过10代,不同稀释比例对新鲜培养的生长平台期费氏弧菌毒性测试无显著影响。基于优化后的方法,七水硫酸锌、氯化汞、十二烷基硫酸钠、苯酚对费氏弧菌急性毒性具有显著的剂量-效应关系,表明该优化方法适用于上述物质的毒性评价。
费氏弧菌;急性毒性;微孔板;影响因子
随着工业化进程的推进,环境污染问题日益突出,大量有毒有害污染物被排放到河流、湖泊和海洋,对水生生态及人体健康造成严重危害,发展快速高效的水环境监测技术对环境保护具有重要意义。以微孔板为反应载体的发光细菌光度计法是近年快速发展的一种毒性检测技术,已应用于重金属[1]、环境激素类物质[2]、有机磷农药[3]等多种污染物的毒性评价,具有灵敏度高、测量范围广、高通量等优点[4]。
费氏弧菌、明亮发光杆菌、青海弧菌是目前应用较为广泛的几种海、淡水发光细菌[5-7],由于海水、淡水环境的差异,如盐度和离子差异直接影响污染物的结构形态或解吸附效应等[8],从而改变污染物的毒性大小,因此海水、淡水发光细菌的应用各有侧重。刘保奇等[9]系统研究了pH、菌密度、反应时间等试验条件对淡水发光细菌青海弧菌急性毒性微孔板法测试的影响,而海洋发光细菌急性毒性微孔板法影响因子研究较少。为此,我们研究了温度对费氏弧菌生长和发光强度的影响,系统开展了盐度、pH、检测温度、反应体系、稀释比例及传代次数对费氏弧菌微孔板法毒性测试影响研究,并采用七水硫酸锌等参比毒物验证优化后的测试方法,为建立稳定、可重复的费氏弧菌急性毒性微孔板测试方法提供依据。
1 材料与方法
1.1 试验材料
费氏弧菌(Vibrio fischeri)由国家海洋局第一海洋研究所崔志松博士惠赠,-80℃保存。实验用七水硫酸锌(ZnSO4·7H2O)、氯化汞(HgCl2)、十二烷基硫酸钠(SDS)、苯酚为分析纯试剂。
主要仪器:微孔板生物发光光度计(瑞士TECAN公司,Spark 10M),生化培养箱(上海一恒科学仪器有限公司,BPMJ-250F),恒温培养摇床(上海一恒科学仪器公司,THZ-300C),分光光度计(岛津仪器有限公司,UV1800),盐度计(梅特勒-托利,S7),pH计(梅特勒-托利,S8)。
1.2 试验方法
1.2.1 温度对生长密度与发光强度的影响 将菌种接种于2216E平板,20℃培养48 h,挑取单菌落接种到2216E液体培养基,20℃、180 r/min培养24 h至对数期;按2%转接至100 mL 2216E培养基中,分别于15、20、25℃温度下,180 r/min培养,定时取样(1 mL菌液)测定发光强度(20 μL菌液)和OD600吸光值。
1.2.2 盐度、pH对发光抑制率的影响 用NaCl配制不同盐度的水溶液(pH 7.0±0.2),设定0‰~45‰盐度梯度(间隔5‰),以20‰盐度为对照,每个浓度处理3次重复,测定15 min的发光抑制率;配制盐度为20‰的NaCl溶液,用NaOH和HCl调节pH为4~10.5(间隔0.5),以pH 7.0为对照,每个处理3次重复,测定15 min的发光抑制率。
微孔板发光测定方法:20℃、180 r/min条件下培养30(±2)h的新鲜菌液,用20‰ NaCl溶液洗涤处理后,取20 μL加入96孔全白微孔板,测定初始发光强度;立即加入180 μL试验溶液,15℃恒温15 min后测定发光强度;发光抑制率计算方法参照 ISO 11348-1:2007[5]。
1.2.3 反应体系、检测温度、稀释比例及传代次数对毒性测试的影响 选用七水硫酸锌(ZnSO4·7H2O)作为参比毒物,根据预实验结果设定毒性物质浓度为60、30、15、7.5、3.75 mg/L,以20‰ NaCl溶液为对照,每个处理3次重复,测定步骤和结果计算同1.2.2中微孔板发光测定方法。
反应体系:在15℃检测温度下,利用同一次培养的菌液按1∶10、1∶5、1∶1反应体系(菌液与总试液溶液的体积比)进行毒性测试。
检测温度:按1∶10反应体系分别在15℃和20℃进行测试。
稀释比例:新鲜培养的菌液按不同比例稀释(稀释后初始发光强度分别为1.0×105~2.0×105、3.0×105~1.0×106、2.0×106~3.0×106、大于3.0×106),在反应体系1∶10、检测温度15℃条件下进行测试。
传代次数:将新鲜培养的菌液按2%转接进行传代培养,每30(±2)h传代1次,传至20代,在反应体系1∶10、检测温度15℃条件下,每5代进行毒性测试评价。
1.2.4 费氏弧菌微孔板法测试ZnSO4·7H2O、HgCl2、SDS、苯酚毒性 根据预实验结果,ZnSO4·7H2O设定浓度同1.2.3,HgCl2浓度设定为 0.1、0.067、0.045、0.03、0.02 mg/L,SDS浓度设定为 200、100、50、25、12.5 mg/L,苯酚浓度设定为 400、200、100、50、25 mg/L,以 20‰NaCl溶液为对照,每个处理3次重复,每个污染物测试5次,测定方法和结果计算同1.2.2中微孔板发光测定方法。
采用SPSS17.0软件进行回归分析和毒性测试结果显著分析,毒性测试数据对数转换后,EXCEL拟合曲线并作图。
2 结果与分析
2.1 培养温度对费氏弧菌生长密度(OD600)及发光强度的影响
由图1可知,15℃条件下,费氏弧菌24 h进入生长对数期(OD600达0.7),36 h进入生长平台期(OD600达1.6),60 h OD600达到峰值2.1,之后缓慢下降,发光强度在60 h达到峰值(1.2×107),56~72 h发光强度大于最大发光强度的60%;20℃条件下,费氏弧菌9 h进入生长对数期(OD600达0.6),18 h进入生长平台期(OD600达1.6),39 h OD600达到峰值2.1,之后缓慢下降,发光强度在34 h达到峰值(1.045×107),24~42 h发光强度大于最大发光强度的60%;25℃条件下,费氏弧菌6 h进入生长对数期(OD600达0.47),15 h进入生长平台期(OD600达1.4),33 h OD600达到峰值1.7,之后缓慢下降,发光强度在24 h达到峰值(3.91×106),12~29 h发光强度大于最大发光强度的60%。结果表明15℃和20℃条件下费氏弧菌最大生长密度和发光强度没有明显差别,发光稳定(大于最大发光强度的60%时间较长),20℃条件下费氏弧菌更快达到生长平台期和发光峰值,但15℃和20℃条件下的生长密度和发光峰值明显高于25℃条件下的生长密度和发光峰值,表明费氏弧菌适宜培养温度为15~20℃。
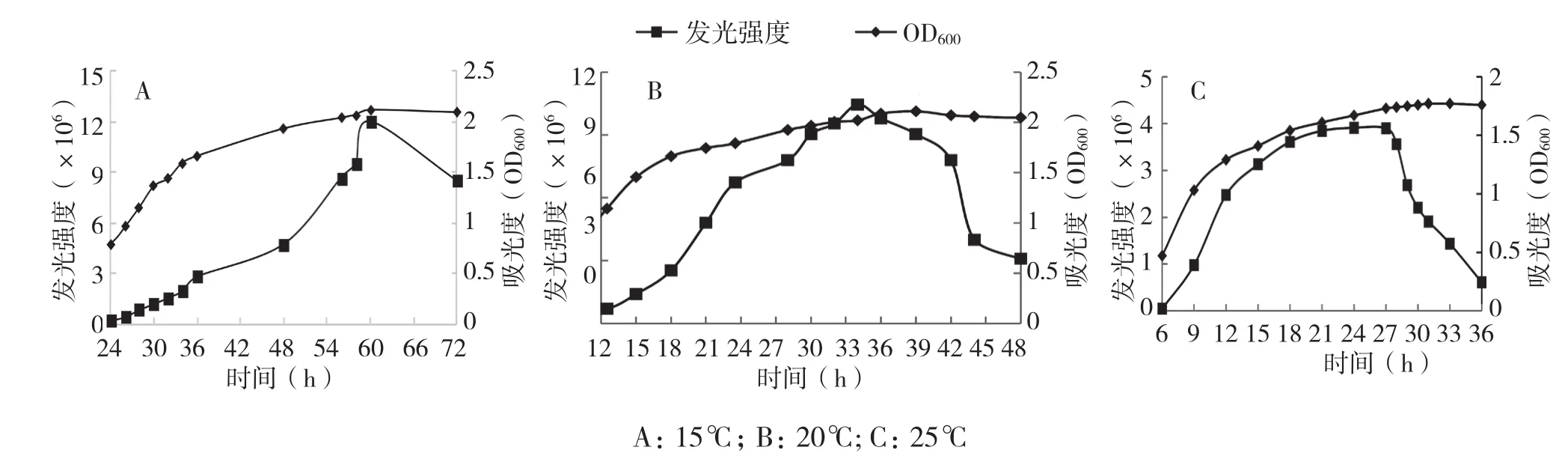
图1 不同温度费氏弧菌发光强度及生长密度变化规律
2.2 盐度和pH对费氏弧菌发光抑制率的影响
从图2可见,盐度15‰~35‰的水体对费氏弧菌发光抑制率小于10%,表明费氏弧菌适宜盐度为15‰~35‰;从图3可见,pH 5~10的水体对费氏弧菌发光抑制率小于10%,表明费氏弧菌适宜pH为5~10。
2.3 反应体系、检测温度、稀释比例对费氏弧菌毒性测试的影响
ZnSO4·7H2O对不同反应体系费氏弧菌的半数抑制浓度EC50差异极显著,1∶10反应体系下ZnSO4·7H2O对费氏弧菌EC50最低(表1)。
15℃条件下ZnSO4·7H2O对费氏弧菌EC50极显著高于20℃条件下检测结果,但20℃条件下的变异系数为58%,高于15℃条件下的变异系数19%(表1)。
ZnSO4·7H2O对不同稀释比例(不同初始发光强度)的菌液毒性测试结果表明,不同初始发光强度对费氏弧菌EC50没有显著差异(表1)。

图2 盐度对费氏弧菌发光抑制作用

图3 pH对费氏弧菌发光抑制作用
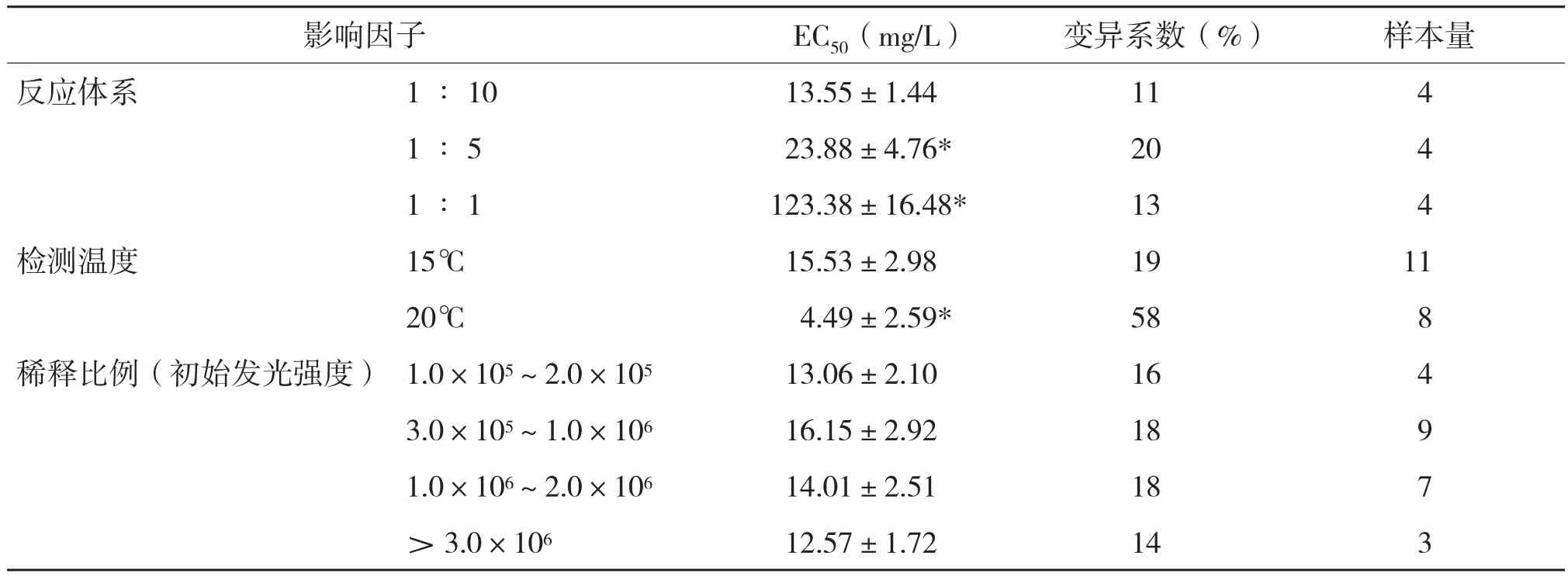
表1 反应体系、检测温度、稀释比例对发光细菌毒性检测的影响
2.4 传代次数对费氏弧菌毒性测试的影响
费氏弧菌连续传代20代,ZnSO4·7H2O对不同传代次数费氏弧菌毒性测试结果(表2)显示,ZnSO4·7H2O 对 F1、F5、F10代费氏弧菌EC50无显著差异,传代至F15代、F20代时,ZnSO4·7H2O对其EC50显著降低,表明过多的传代次数可显著影响发光细菌毒性测试结果。
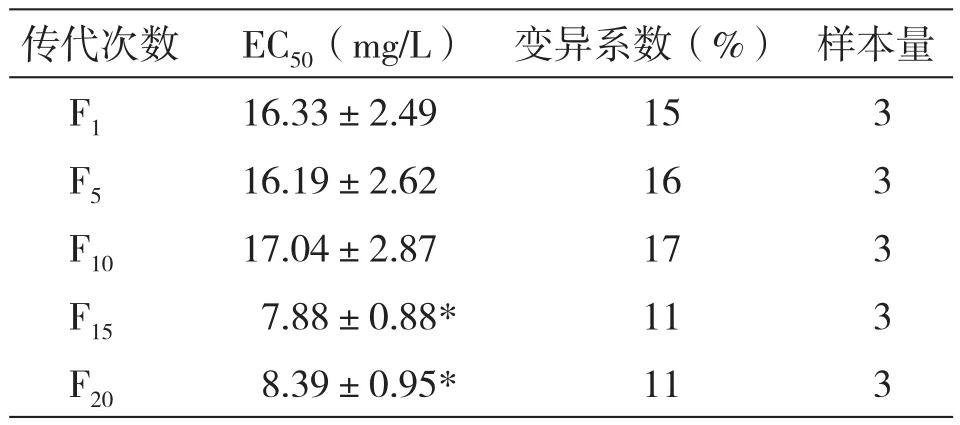
表2 ZnSO4·7H2O对不同传代次数费氏弧菌半数抑制浓度
2.5 ZnSO4·7H2O、HgCl2、苯酚、SDS毒性测试结果
由图 4可知,ZnSO4·7H2O、HgCl2、苯酚、SDS浓度与费氏弧菌发光抑制度具极显著的剂量—效应关系(R2=0.98~0.99,P<0.01);ZnSO4·7H2O、HgCl2、苯酚、SDS对费氏弧菌 EC50分别为 16.4±2.2、0.045±0.01、96.7±13.9、37.0(±5.5)mg/L,变异系数分别为13%、12%、14%、15%。
3 结论与讨论

图4 费氏弧菌急性毒性微孔板法测试结果拟合曲线
pH、盐度对重金属、多环芳烃等多种石油污染物的存在形态、吸附与解吸、迁移性具有不同程度的影响[10-12],从而影响污染物的生态毒性,因此生物毒性评价时应尽可能不改变样品的pH、盐度等特性。已有研究表明明亮发光杆菌适宜pH为5.5~8.0[13],青海弧菌适宜pH为5.0~9.0[14],而本研究结果显示,费氏弧菌适宜pH为5~10,适宜盐度为15‰~35‰,与赵洋甬等[15]研究结果类似,表明费氏弧菌具有较宽的pH和盐度适应范围,在环境污染物的毒性评价中具有一定优势。
国内现有方法多以氯化汞作为参比毒物[6,16]。王丽莎等[17]研究表明 Zn2+具有毒性中等、结果稳定、便宜易得等优点,且Zn2+与Hg2+毒性之间存在一定相关性,因此本研究毒性测试选择ZnSO4·7H2O作为参比毒物。在现有的发光细菌毒性研究中,发光细菌反应体系各不相同[5,18-19],崔志松等[19]研究表明,发光细菌RecA反应体系在1∶100时毒性效应最明显。本试验中,反应体系1∶10时费氏弧菌毒性效应最强,且测试结果变异系数相对较小,证实反应体系显著影响费氏弧菌毒性测试结果,因此建议费氏弧菌急性毒性微孔板测试方法最佳反应体系为1∶10。另外,费氏弧菌在15℃和20℃条件下最大生长密度和发光峰值没有明显差异,但不同检测温度下费氏弧菌毒性测试结果具有显著差异,检测温度20℃时ZnSO4·7H2O对费氏弧菌毒性测试结果变异系数(58%)明显高于15℃条件下的变异系数(19%),因此建议费氏弧菌检测温度宜控制在15(±1)℃。
发光细菌急性毒性测试应用商品化的冻干菌最为普遍,但也存在不同冻干粉批次间活性差异较大、检测前需要复苏等缺点[20]。而新鲜菌液则在一定质控条件下可实现连续、大批量培养,更加经济、易得。目前,费氏弧菌培养条件已开展相关研究[21],但费氏弧菌传代次数对其毒性测试的影响未见报道。本研究发现,经过连续多次传代后(15代以上),费氏弧菌毒性测试结果出现显著差异,这种变化可能由发光调控相关基因缺少或突变所致[22],具体作用机制有待进一步研究。采用新鲜菌液进行毒性测试时,建议使用F10代之前的菌液,并应建立新鲜菌液的质控方法,如依据参比毒物的毒性数据制定质量控制图。
采用优化后的微孔板法对ZnSO4·7H2O、HgCl2、苯酚、SDS进行毒性评价验证,费氏弧菌发光抑制度与上述污染物浓度具有极显著的剂量-效应关系,相关系数和变异系数与经典方法基本一致。如ZnSO4·7H2O、HgCl2与费氏弧菌发光抑制度线性相关系数R2为0.99,优于 Microtox法[23]的 0.95、0.97,ZnSO4·7H2O半数发光抑制浓度EC50变异系数为13%,与ISO11348-1:2007[5]结果一致,表明该方法适用于上述污染物的急性毒性评价,且具有较好的重复性,为建立稳定、可重复的费氏弧菌急性毒性微孔板测试方法提供了基础数据。值得注意的是,发光细菌作为一种原核生物,在毒性评价时也存在一些缺陷。王东等[24]研究认为发光细菌法与糠虾法毒性测试结果相关性系数仅为0.3;Aruoja等[25]研究表明苯胺类化合物和酚类化合物对月牙藻、费氏弧菌毒性趋势并不一致;发光细菌毒性结果不能完全真实地反映环境中污染物对所有生物的急性毒性效应[26]。因此,发光细菌毒性测试方法存在一定局限性,其适用于哪些物质的毒性评价还需分别试验验证。
[1]真,苗晶晶,潘鲁青. 6种重金属的发光菌毒性效应及其海洋生物物种敏感度分析[J]. 海洋环境科学,2015(2):176-183.
[2]张超,王莎,邓小云. 淡水发光菌青海弧菌Q-67对环境激素类物质毒性检测应用研究进展[J]. 绿色科技,2016(12):95-97.
[3]Zhang Y H,Liu S S,Song X Q,et al. Prediction for the mixture toxicity of six organophosphorus pesticides to the luminescent bacterium Q67.[J].Ecotoxicology and environmental safety,2008,71(3):880-888.
[4]徐广飞,崔志松,栾晓,等. 基于发光细菌法和鱼类暴露实验评价6种化学消油剂的遗传毒性[J]. 应用与环境生物学报,2017(1):146-151.
[5]ISO11348-1:2007,Water quality — Determination of the inhibitory effect of water samples on the light emission of Vibrio fischeri (Luminescent bacteria test)—Part 1:Method using freshly prepared bacteria[S]. 2007.
[6]GB/T 15441-1995,水质急性毒性的测定发光细菌法[S]. 1995.
[7]卓平清,王弋博,薛林贵,等. 青海弧菌在环境污染物监测中的应用研究进展[J]. 天水师范学院学报,2014(2):22-26.
[8]黄廷林,沈晋. 环境化学条件对水体沉积物中重金属释放影响的研究述评[J]. 陕西机械学院学报,1993,9(4):285-292.
[9]刘保奇,葛会林,刘树深. 测定环境污染物对青海弧菌发光强度抑制的微板发光法研究[J].生态毒理学报,2006,1(2):186-191.
[10]高春梅,朱晓芸,储鸣,等. 温度、盐度、pH对剩余污泥铜、铅溶出效应的影响分析[J]. 上海海洋大学学报,2015,24(5):880-885.
[11]平立凤,骆永明. 有机质对多环芳烃环境行为影响的研究进展[J]. 土壤,2005,37(4):362-369.
[12]楚伟华. 石油污染物在土壤中迁移及转化研究[D]. 大庆:大庆石油学院,2006.
[13]萍. 发光菌急性毒性测试方法的完善及其在工业废水水质监督与管理中的应用研究[D].上海:上海师范大学,2012.
[14]陈水松,王英才,胡文,等.不同条件对2种发光菌毒性测试的影响研究[J].环境科学与技术,2013,36(12M):1-5.
[15]赵洋甬,胡建林,邵立军. 发光菌毒性测试的影响因子研究[J]. 现代科学仪器,2010(3):75-78.
[16]Q/SY 111-2007,油田化学剂、钻井液生物毒性分级及检测方法 发光细菌法[S]. 2007.
[17]王丽莎,魏东斌,胡洪营. 发光细菌毒性测试条件的优化与毒性参照物的应用[J]. 环境科学研究,2004,17(4):61-62,66.
[18]许道艳,李伟,张芳,等. 用发光细菌法监测海洋沉积物综合毒性的可行性研究[J]. 海洋环境科学,2009,28(5):570-572.
[19]崔志松,栾晓,高伟,等. 发光细菌法在环渤海污水样品遗传毒性检测中的应用[J]. 海洋与湖沼,2015,46(1):228-232.
[20]蒋媛媛,孟芹,苏嘉缘,等. 明亮发光杆菌连续培养条件的优化[J]. 华东理工大学学报(自然科学版),2016(1):48-53,109.
[21]Scheerer S,Gomez F,Lloyd D,et al. Bioluminescence ofVibrio fischeriin continuous culture:optimal conditions for stability and intensity of photoemission[J]. Journal of microbiological methods,2006,67(2):321-329.
[22]付乔芳,邱军强,胡鲲,等. 嗜水气单胞菌毒力基因在传代过程中的稳定性研究[J]. 生物技术通报,2011(9):130-135.
[23]杨虹. 常见重金属对费氏弧菌的生物毒性研究[J]. 环境科学与管理,2015,40(10):140-142.
[24]王东,冯定,张兆康. 海上油田废弃钻井液的毒性评价及无害化处理技术研究进展[J]. 环境科学与管理,2011,36(6):78-83.
[25]Aruoja V,Sihtmae M,Dubourguier H,et al.Toxicity of 58 substituted anilines and phenols to algae Pseudokirchneriella subcapitata and bacteriaVibrio fischeri:comparison with published data and QSARs[J]. Chemosphere,2011,84(10):1310-1320.
[26]再兴,尹青,赵俊娜,等. 发光细菌法测定水质急性毒性研究进展[J]. 河北科技大学学报,2014,35(5):480-486.
Optimization of acute toxicity test method using microplate for Vibrio fischeri
YU Lu-jun1,LIU Wei-li2,CHEN Xiao-qu1,LI Jian-jun1
(1. Guangdong Laboratory Animals Mornitoring Institute/Key Laboratory of Guangdong Laboratory Animals,Guangzhou 510663,China;2. China Oilfield Services Limited,Sanhe 065201,China)
In order to determine the optimal conditions of acute toxicity test method using microplate for luminescent bacteria (Vibrio fischeri),the effects of temperature,salinity,pH,detection temperature,testing system,dilution ratio,passages on the bioassay ofV. fischeriwere systematically studied with Luminous intensity or inhibitory effect on luminescent bacteria. The results showed that the growth curve ofV. fischerireached plateau and peak value faster at 20℃,but there was no significant difference of growth density and peak value at 15℃ and 20℃. The appropriate culture temperature ofV. fischeriwas 15℃-20℃;The optimal test temperature,salinity,pH value and test system were 15℃,15‰-35‰,5-10 and 1∶10,respectively. The bioassay results were significantly affected by both test temperature and test system ofV. fischeri. There was no significant difference of bioassay results in different dilution ratio (the range of initial luminescence intensity from 10 w to 600 w),but the acute toxicity test results ofV. fischeriwere significantly affected after 15 times of passages. The toxicity of ZnSO4·7H2O,HgCl2,SDS,phenol forV. fischerihad time responses and dose responses by the method above. It showed that the acute toxicity test method using microplate forV. fischeriwas suitable for the toxicity assessment of pollutants above.
Vibrio fischeri;acute toxicity;microplate;influence factor
X502
A
1004-874X(2017)07-0076-07
余露军,刘卫丽,陈小曲,等. 费氏弧菌急性毒性微孔板检测方法优化[J].广东农业科学,2017,44(7):76-82.
2017-04-11
中海油田服务股份有限公司油田化学事业部项目“钻井液环保性能评价平台建设”(YHB16YF009)
余露军(1982-),男,工程师,E-mail:ljyu1212@163.com
李建军(1972-),男,高级工程师,E-mail:ljj@gdlami.com
(责任编辑 杨贤智)

