基于3种载体蛋白的莱克多巴胺抗原的合成与检测
贾爱娟,刘 姚,张 挺,沈 兴
(1.广东美味鲜调味食品有限公司,广东 中山 528400;2.广东省食品质量与安全重点实验室/畜禽产品精准加工与安全控制技术国家地方联合工程研究中心,广东 广州 510642;3.广州城市职业学院食品系,广东 广州 510405)
基于3种载体蛋白的莱克多巴胺抗原的合成与检测
贾爱娟1,刘 姚2,张 挺3,沈 兴2
(1.广东美味鲜调味食品有限公司,广东 中山 528400;2.广东省食品质量与安全重点实验室/畜禽产品精准加工与安全控制技术国家地方联合工程研究中心,广东 广州 510642;3.广州城市职业学院食品系,广东 广州 510405)
为制备高效莱克多巴胺(Ractopamine,RAC)抗体,将人工合成的RAC-琥珀酸酯半抗原与3种载体蛋白(BSA、OVA和KLH)偶联合成人工抗原,采用紫外光谱扫描、测定偶联比和ESI-MS进行鉴定;通过免疫小鼠获得抗血清,采用ELISA比较其效价,对3种人工抗原的免疫原性进行评定,结果显示3种抗血清效价为4 000~32 000,表明合成的3种人工抗原都具有免疫原性,其中以KLH为载体蛋白的抗原的免疫效果较好,可用于制备高效RAC抗体。
莱克多巴胺;载体蛋白;半抗原;人工抗原;免疫原性
莱克多巴胺(ractopamine,RAC)又称为雷托巴胺,化学名4-{3-〔2-羟基-2-(4-羟基苯基)-乙基〕氨基丁基}苯酚,分子式为C18H23NO3。RAC属于β-肾上腺素受体激动剂类药物,能选择性激动支气管平滑肌的β-受体,临床上用于治疗呼吸道疾病,如支气管炎、哮喘、慢性支气管炎、肺气肿等[1]。然而,一些不法商人将RAC用于畜牧业和养殖业,这是由于当RAC的使用量达到临床用量的5~10倍时,具有增加动物的日增重、提高饲料利用率、促进家禽肌肉的生长、降低脂肪含量等效果[2]。在动物养殖中过度使用RAC,会使其残留在动物性食物中,并通过食物链进入人体,给消费者带来极大的安全隐患。RAC主要危害人体心血管和中枢神经系统,引起肌肉震颤、心动过速和头痛[3]。目前,全球超过150个国家已明确禁止RAC作为饲料添加剂在养殖业中使用[4],但RAC非法使用的现象依然存在。因此加强动物性食物中RAC的检测至关重要。
RAC传统的仪器检测方法主要有高效液相(HPLC)[5-6]、液质联用法(LC–MS/MS)[7-8]、气质联用法[9-10]、毛细管电泳[11-12]、拉曼光谱[13]等。仪器检测方法具有很好的灵敏度及检测线,但是样品前处理复杂、耗时长、仪器费用昂贵,且不利于大量样品的筛选。免疫检测法是基于抗原抗体相互作用发展起来的一项检测技术,具有灵敏度高、特异性高、快速、简单、高通量检测、成本低等特点,目前常用于RAC的免疫检测技术有酶联免疫吸附检测[14]、免疫层析法[15-18]、荧光免疫检测[19-23]等,并在此基础上发展了一些免疫传感器,如电化学[24]、表面等离子共振[3,25]。抗体作为免疫检测技术的核心试剂,对免疫分析的灵敏度、特异性等起着至关重要的作用,而制备高亲和力抗体的关键是抗原的制备。
大多数药物分子质量小于1 000 u,属于仅有反应原性而无免疫原性的半抗原。RAC分子量为337.85,属于小分子化合物,其本身没有免疫原性,因此合成人工抗原是建立免疫检测方法的第一步。载体蛋白本身的抗原性、溶解性和偶联基团数量直接影响免疫过程,由不同的载体蛋白构建的人工抗原,其免疫原性存在差异[26]。本研究选取三种蛋白,卵清白蛋白(OVA)、牛血清白蛋白(BSA)和匙孔血蓝蛋白(KLH)作为载体蛋白,与RAC-琥珀酸酯偶联后合成3种人工抗原,免疫小鼠获得抗血清之后,采用ELISA测定其效价和抑制率,并对其免疫原性进行了比较和评价,为RAC残留免疫学检测方法的建立提供基础。
1 材料和方法
1.1 试验材料
试剂:莱克多巴胺(RAC)标准品、弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)、 牛血清蛋白(BSA)、卵清白蛋白(OVA),Sigma-Aldrich Co. LLC 公司;琥珀酸酐、二环己基碳二亚胺(DCC)、N-羟基琥珀酰亚胺(NHS),百灵威科技;匙孔血蓝蛋白(KLH),PIERCE公司;HRP-标记羊抗鼠抗体,武汉博士德生物公司;薄层层析硅胶板、柱层析硅胶,中国青岛海洋化工集团公司。试验所用到的其他试剂均为分析纯。
主要仪器:U-3010紫外可见光谱扫描仪,日本Hitachi公司;Wallac VICTOR31420多标记分析仪,PE公司;LCQDECA液质联用仪,Finnigan公司;6K 15冷冻离心机,Sigma-Satorius公司;自动洗板机DEM-3型,北京拓普分析仪器有限责任公司;透析袋(最大截留分子量6 000 D),进口分装(美国,BIOSHARP);96孔聚苯乙烯酶标板,深圳金灿华有限公司。
1.2 试验方法
1.2.1 莱克多巴胺半抗原合成 参照文献[27-28]的琥珀酸酐法合成半抗原(RACSA),如图1所示。称取盐酸莱克多巴胺1 020 mg (约3.0 mmol),加入10 mL无水吡啶中,磁力搅拌器上搅拌溶解,然后加入琥珀酸酐360 mg (约3.0 mmol),再室温避光搅拌24 h。反应完成后,加入等体积的饱和碳酸氢钠溶液,混匀;用乙酸乙酯萃取5次除去水相中的吡啶和未反应的原料;用6 mol/L的盐酸调水相pH至5.0左右,用乙酸乙酯萃取5次;取有机相,用无水硫酸钠除水,于旋转蒸发器上蒸干,得到RAC-SA半抗原粗产物,在反应过程中对粗产物进行实时点板(薄层色谱(Thin layer chromatography,TLC),V二氯甲烷∶V甲醇∶V氨水=4∶1∶0.1),观察反应产物点的位置和形态。粗产物经柱层析纯化得到较纯的半抗原,用ESI-MS进行鉴定。
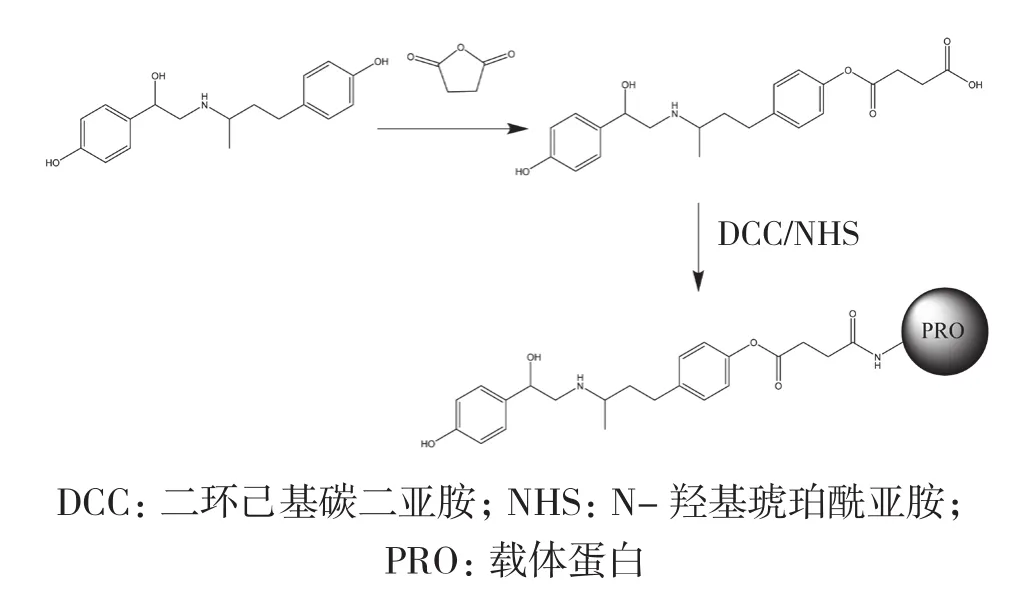
图1 莱克多巴胺人工抗原的合成路线图[28]
1.2.2 莱克多巴胺人工抗原的合成 (1)RACSA-OVA的合成:取RAC半抗原40.1 mg(0.1 mmol),溶于300 μL DMF中,加入DCC 24.7 mg、NHS 13.8 mg,搅拌,室温反应8 h,将反应物10 000 r/min离心10 min,取上清,记为A液;取OVA 90 mg,溶于9 mL预冷的0.1 mol/L、pH 8.5的硼酸缓冲液中搅拌使充分溶解,记为B液。将A液加到B液中,在30 min内加完,置于4℃搅拌过夜。次日,将反应液于4℃、10 000 r/min离心10 min,取上清液装入透析袋中,用生理盐水于4℃透析3 d,每天换4次透析液。透析后,将人工抗原分装于-20℃储存。
(2)RAC-SA-BSA的合成:取BSA 132 mg,溶于10 mL预冷的0.1 mol/L、pH 8.5的硼酸缓冲液中(B液)。半抗原活化方法及其他步骤与RAC-SA-OVA合成相同。
(3)RAC-SA-KLH的合成:取2 mL去离子水注射到KLH瓶中(蛋白质量浓度为10.0 mg/mL)缓慢搅拌使其充分溶解,作为B液。半抗原活化方法及其他步骤与RAC-SA-OVA合成相同。
1.2.3 莱克多巴胺人工抗原的鉴定 将莱克多巴胺半抗原、BSA、OVA、KLH 以及3种人工抗原,配制成一定浓度的溶液,使纯蛋白浓度与人工抗原浓度相同,用紫外扫描仪对200~400 nm波长扫描,得到它们的紫外吸收光谱,比较人工抗原紫外吸收曲线与游离半抗原、载体蛋白差异。根据公式:K=OD值/C(K为摩尔消光系数;C为各物质摩尔浓度) ,分别计算半抗原、BSA、OVA、KLH的摩尔消光系数。在纯蛋白和半抗原的最大波长处检测人工抗原的光吸收值,计算半抗原与蛋白在人工抗原中的摩尔浓度比(人工抗原OD值用OD偶表示)即偶联比[29]:

式中,Ca、Cb分别为RAC和蛋白质的浓度,OD偶280、OD偶274分别为偶联产物在蛋白质特征吸收峰(280 nm)、RAC特征吸收峰(274 nm)的吸光度,KBSA280、KRAC280分别为载体蛋白BSA和RAC在蛋白质特征吸收峰处的消光系数,KBSA274、KRAC274分别为载体蛋白BSA和RAC在RAC特征吸收峰处的消光系数。载体蛋白OVA和KLH的偶联比计算公式与此类似。
1.2.4 莱克多巴胺人工抗原免疫原性检测 将人工抗原用生理盐水稀释至1 mg/mL,50 μL的人工抗原与等体积弗氏完全佐剂充分乳化,在Balb/c小鼠的腹腔和足垫进行注射,50 ng/只。2周后加强免疫,免疫剂量同基础免疫,改用弗氏不完全佐剂,每2周加强免疫1次,从第3次加强免疫开始,免疫后8~10 d尾部采血,所得血样与37℃恒温水浴箱中静止1 h,12 000 r/min离心10 min,取上清即为抗RAC抗血清。
1.2.5 抗血清效价和抑制检测 用RAC-SABSA、RAC-SA-OVA抗原作为RAC-SA-KLH抗血清的包被原,用RAC-SA-OVA抗原作为RAC-SA-BSA抗血清的包被原,用RAC-SABSA作为RAC-SA-OVA抗血清的包被原。分别包被适当的浓度100 μL/孔,4℃过夜,洗板3次;每孔加200 μL封闭液,37℃封闭2 h,洗涤同上。
加样:最后一行作为空白对照组外,其余各列孔加入 100 μL 溶液、50 μL 从 1∶1 000 开始倍比稀释的待检血清、50 μL PBST或50 μL稀释RAC药物,其中加入PBST的用于测定抗血清效价,加入50 μL稀释药物的用于测定抗血清抑制,37℃反应1 h,洗涤同上;加酶标二抗,每孔加入100 μL HRP-羊抗鼠IgG (1∶10 000倍稀释),37℃反应1 h,洗涤同上。
显色:每孔加入新鲜配制的底物显色液(TMB 10 mg/mL 的 100 μL,30% H2O22 μL,溶于10 mL pH 5.0的柠檬酸缓冲液中)100 μL,置于37℃显色15 min。显色终止:每孔加入50 μL的终止液(2 mol/L H2SO4)终止反应。
测定吸光值:用酶标仪测定各孔A450nm的吸光值。在测定抗血清效价组以A450nm值在1附近时抗血清稀释度作为该抗血清效价。计算抗体血清抑制率:
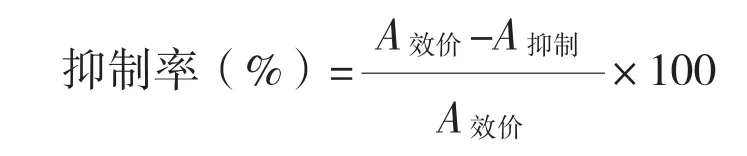
式中,A效价为未加药物的酶标孔在450 nm下的吸光值,A抑制为添加RAC药物的酶标孔在450 nm下的吸光值。
2 结果与分析
2.1 半抗原鉴定
半抗原RAC-SA合成后,经ESI-MS 全扫描质谱验证。从图2可以看出,RAC-SA不纯,436.3组分为本试验设计的半抗原。
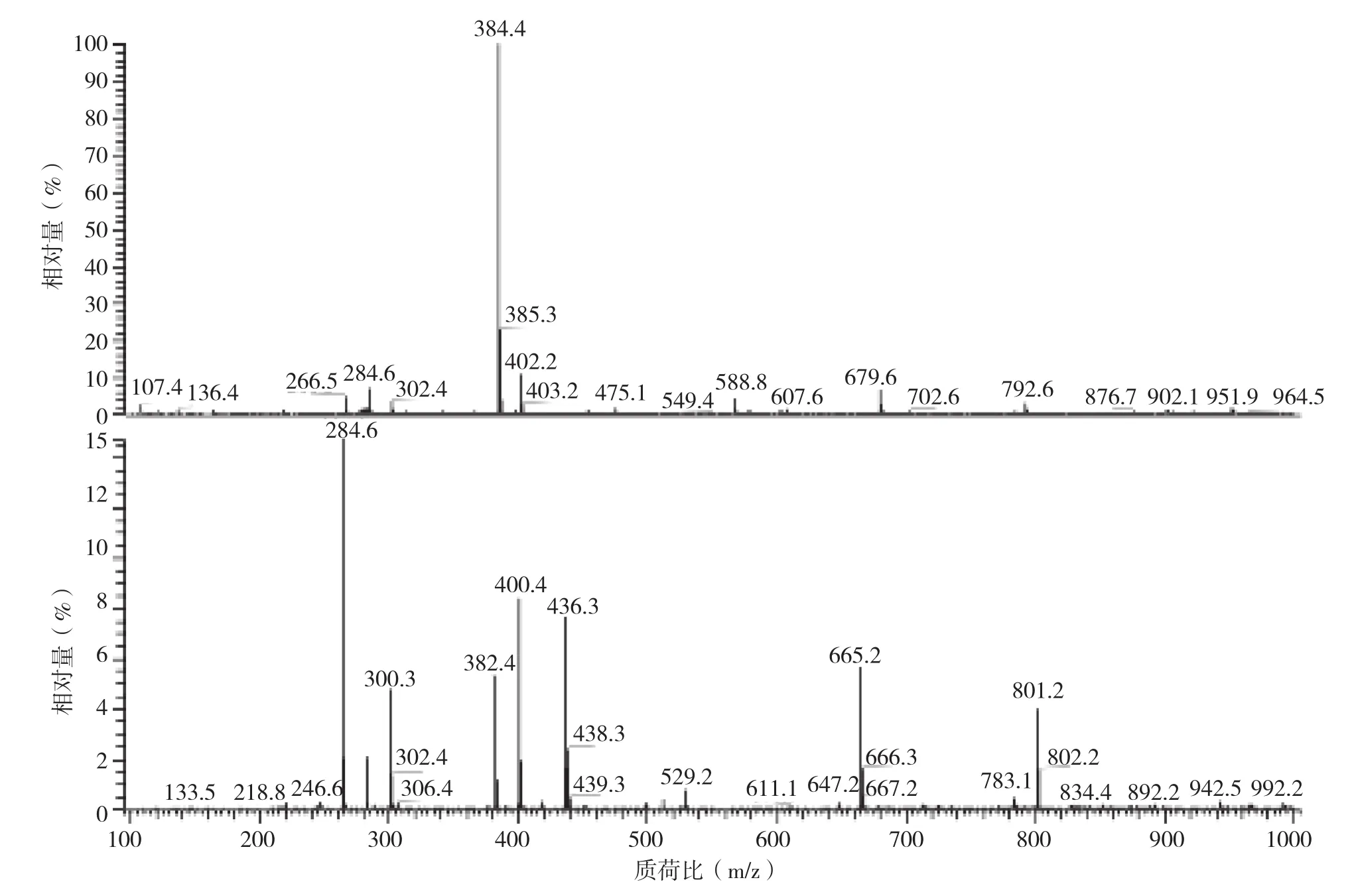
图2 RAC-SA半抗原ESI-MS峰图
2.2 紫外全波长扫描鉴定人工抗原合成
图3分别为抗原RAC-SA-BSA、半抗原莱克多巴胺-琥珀酸酯和BSA的紫外扫描对照图。BSA分别在278、212 nm处有2 个吸收峰,半抗原莱克多巴胺-琥珀酸酯分别在273、266 nm 处有2 个吸收峰,而RAC-SA-BSA 则在278、219 nm处分别有2个吸收峰。RAC-SABSA的蛋白浓度与BSA的浓度均为0.5 mg/mL,而RAC-SA-BSA的吸光值明显高于BSA,偶联前BSA在212 nm吸收峰在偶联后移至219 nm,两谱线在可见光区(300~400 nm) 的差异特别明显,BSA在可见光区几乎没有吸收,而RACSA-BSA则有明显的吸收。这可能是莱克多巴胺-琥珀酸酯与BSA偶联后相互叠加的结果。因此可以基本认定RAC-SA-BSA的偶联是成功的。由此可计算RAC-SA-BSA的偶联比为18∶1。同理,也可推断出RAC-SA–OVA、RACSA–KLH合成成功,偶联比分别为15∶1和50∶1。
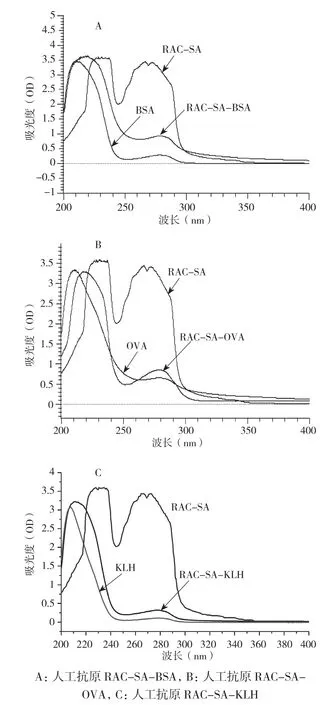
图3 人工抗原紫外扫描图谱
2.3 抗血清效价和抑制检测
成功合成的3个人工抗原免疫小鼠获得抗血清后,用ELISA检测抗血清的效价和抑制率,结果见表1。RAC-SA-BSA 第3次免疫后抗血清检测,包被原为RAC-SA-OVA浓度2.0 μg/mL,抗血清效价为4 000 ,抑制率达到69.2%;RAC-SA-OVA 第3次免疫后抗血清检测,包被原为RAC-SA-BSA浓度2 μg/mL,抗血清效价为8 000,抑制率达到35%;RACSA-KLH 第3次免疫后抗血清检测,包被原为RAC-SA-BSA浓度0.5 μg/mL,抗血清效价为32 000,抑制率达到68%。以上结果说明3种人工抗原免疫小鼠后得到的抗血清中均产生了针对RAC的抗体。
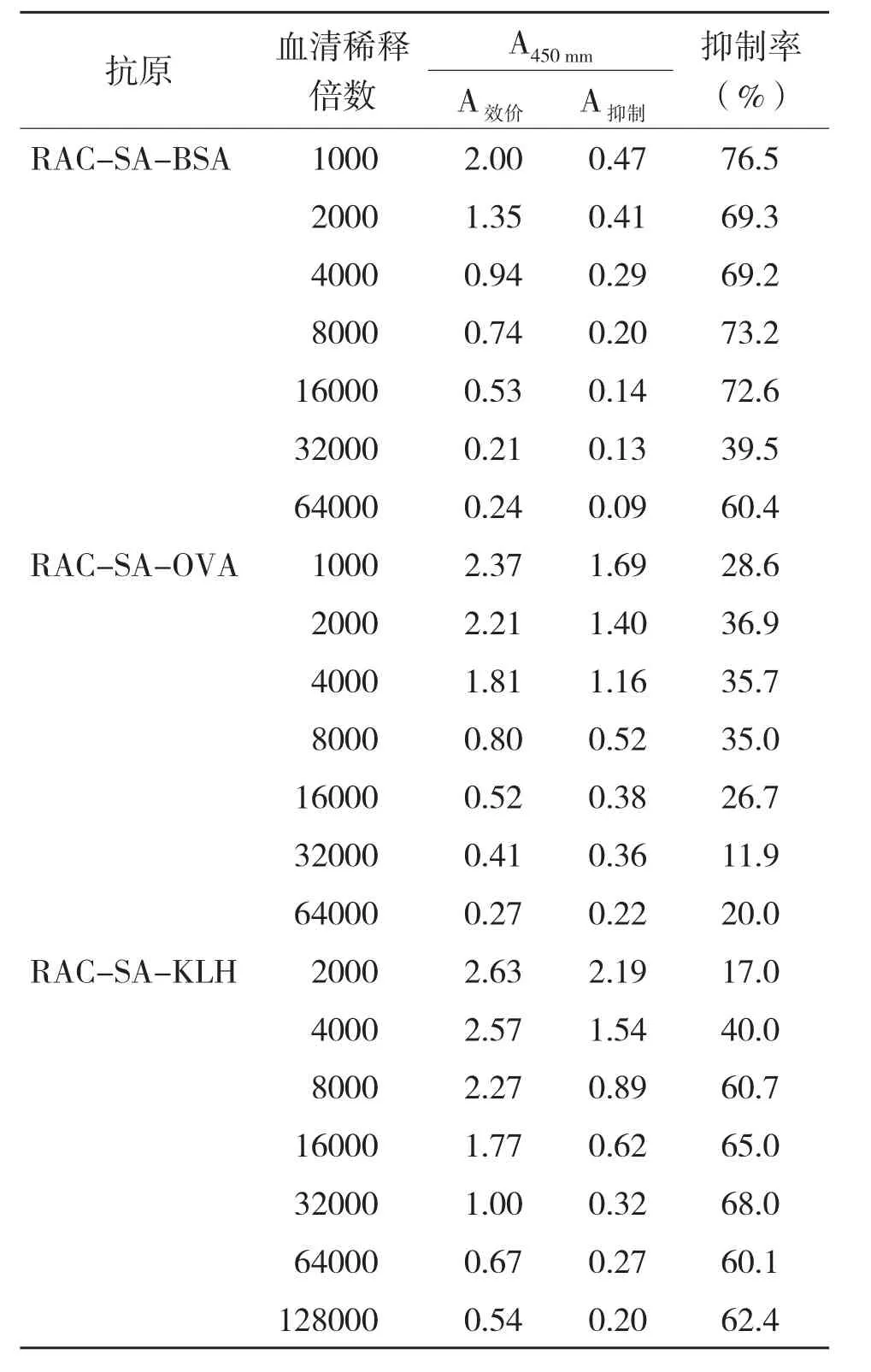
表1 3种人工抗原获得的抗血清效价和抑制率
3 结论
本研究以莱克多巴胺为研究对象,在其酚羟基引入连接臂结构-酯键、用于偶联载体蛋白的活性基团和活性偶联基团-羧基,得到莱克多巴胺的结构衍生物。采用DCC法将该衍生物分别与OVA、BSA和KLH偶联制备3种不同的人工抗原。经紫外扫描后,发现偶联产物具有载体蛋白和RAC的紫外吸收特征峰,表明3种人工抗原制备成功。
3种人工抗原分别免疫Balb/c小鼠,获得针对RAC的特异性抗血清,ELISA鉴定其效价均在4 000~32 000范围内,以KLH为载体蛋白的人工抗原的免疫效果最好。其原因可能与载体蛋白来源不同有关,BAS和OVA来源于哺乳动物血清白蛋白,对于小鼠而言,BSA和OVA本身的免疫原性较弱;KLH来源于无脊椎动物的血蓝蛋白,对于小鼠而言,KLH本身的免疫原性较强。另外,人工抗原需要与佐剂乳化,注射小鼠之后,载体蛋白会有一个复性过程,复性后的蛋白在空间结构上可能会发生一些变化;在这个过程中,KLH不存变形-复性,故能很好的保持原有的天然免疫性[26,30-31]。
为制备抗RAC抗体,建立RAC免疫学检测方法,合成具有抗原性的RAC人工抗原至关重要。本研究获得了抗RAC特异性较强的抗血清,为进一步研究和建立RAC免疫学分析方法奠定了基础。
[1]Ramos F,Silveira I,Silva J M,et al. Proposed guidelines for clenbuterol food poisoning[J]. The American Journal of Medicine,2004,117(5):362.
[2]Uttaro B E,Ball R,Dick P,et al. Effect of ractopamine and sex on growth,carcass characteristics,processing yield,and meat quality characteristics of crossbred swine[J]. J Anim Sci,1993,71(9):2439-2449.
[3]Wang S,Zhao S,Wei X,et al. An improved labelfree indirect competitive SPR immunosensor and its comparison with conventional ELISA for ractopamine detection in swine urine[J].Sensors,2017,17(3):604.
[4]Wang Z,Liu M,Shi W,et al. New haptens and antibodies for ractopamine[J]. Food Chem,2015,183:111-114.
[5]Tang Y,Gao J,Liu X,et al. Determination of ractopamine in pork using a magnetic molecularly imprinted polymer as adsorbent followed by HPLC[J]. Food Chem,2016,201:72-79.
[6]Wu Y,Bi Y,Bingga G,et al. Metabolomic analysis of swine urine treated with β 2-agonists by ultra-high performance liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. J Chromatogr A,2015,1400:74-81.
[7]Chiesa L,Panseri S,Cannizzo F T,et al.Evaluation of nandrolone and ractopamine in the urine of veal calves:liquid chromatographytandem mass spectrometry approach[J]. Drug testing and Analysis,2017,9(4):561-570.
[8]贾涛. 液相色谱-串联质谱法检测饲料中的莱克多巴胺[J]. 饲料广角,2012(7):41-43.
[9]He L,Su Y,Zeng Z,et al. Determination of ractopamine and clenbuterol in feeds by gas chromatography–mass spectrometry[J]. Anim.Feed Sci Technol,2007,132(3):316-323.
[10]Ramos F,Cristino A,Carrola P,et al. Clenbuterol food poisoning diagnosis by gas chromatography–mass spectrometric serum analysis[J]. Analytica Chimica Acta,2003,483(1):207-213.
[11]Anurukvorakun O,Buchberger W,Himmelsbach M,et al. A sensitive non‐aqueous capillary electrophoresis‐mass spectrometric method for multiresidue analyses of β‐agonists in pork[J]. Biomed Chromatogr,2010,24(6):588-599.
[12]Li L,Du H,Yu H,et al. Application of ionic liquid as additive in determination of three β‐agonists by capillary electrophoresis with amperometric detection[J]. Electrophoresis,2013,34(2):277-283.
[13]Xiao X,Yan K,Xu X,et al. Rapid analysis of ractopamine in pig tissues by dummy-template imprinted solid-phase extraction coupling with surface-enhanced Raman spectroscopy[J].Talanta,2015,138:40-45.
[14]Liang J,Liu H,Huang C,et al. Aggregated silver nanoparticles based surface-enhanced Raman scattering enzyme-linked immunosorbent assay for ultrasensitive detection of protein biomarkers and small molecules[J],Anal Chem,2015,87(11):5790-5796.
[15]Wang W,Su X,Ouyang H,et al. A novel immunochromatographic assay based on a time-resolved chemiluminescence strategy for the multiplexed detection of ractopamine and clenbuterol[J]. Anal Chim Acta,2016,917:79-84.
[16]Gao H,Han J,Yang S,et al. Highly sensitive multianalyte immunochromatographic test strip for rapid chemiluminescent detection of ractopamine and salbutamol[J]. Anal Chim Acta,2014,839:91-96.
[17]Ren M L,Chen X L,Li C H,et al. Lateral flow immunoassay for quantitative detection of ractopamine in swine urine[J]. Biomed Environmen Sci,2014,27(2):134-137.
[18]王松柏,张彦,卫艳丽,等. 荧光免疫及磁免疫层析法检测莱克多巴胺的研究[J]. 光谱学与光谱分析,2015(11):3100-3104.
[19]Dong J X,Li Z F,Lei H T,et al. Development of a single-chain variable fragment-alkaline phosphatase fusion protein and a sensitive direct competitive chemiluminescent enzyme immunoassay for detection of ractopamine in pork[J]. Anal Chim Acta,2012,736:85-91.
[20]Han J,Gao H,Wang W,et al. Time-resolved chemiluminescence strategy for multiplexed immunoassay of clenbuterol and ractopamine[J]. Biosens Bioelectron,2013,48:39-42.
[21]Li C,Li J,Jiang W,et al. Development and Application of a Gel-Based Immunoassay for the Rapid Screening of Salbutamol and Ractopamine Residues in Pork[J]. J Agric Food Chem,2015,63(48):10556-10561.
[22]Shen J,Zhang Z,Yao Y,et al. Time-resolved fluoroimmunoassay for ractopamine in swine tissue[J]. Anal Bioanal Chem,2007,387(4):1561-1564.
[23]Wang S B,Zhang Y,Wei Y L,et al. Fluoroimmunoassay and magnetic lateral flow immunoassay for the detection of ractopamine[J]. Guang Pu Xue Yu Guang Pu Fen Xi,2015,35(11):3100-3104.
[24]Wang M Y,Zhu W,Ma L,et al. Enhanced simultaneous detection of ractopamine and salbutamol–Via electrochemical-facial deposition of MnO2nanoflowers onto 3D RGO/Ni foam templates[J]. Biosens Bioelectron,2016,78:259-266.
[25]辉,蔡浩原,陈兴,等. 表面等离子体共振生物传感器连续检测莱克多巴胺[J]. 分析化学,2010,38(3):381-384.
[26]徐加兵,于生兰,欧阳臻,等. 基于不同载体制备黄芪甲苷人工抗原的研究[J]. 中国免疫学杂志,2014(11):1523-1526.
[27]于洪侠,杨曙明. 莱克多巴胺人工抗原的合成与鉴定[J]. 中国兽医科技,2005,35(12):1000-1003.
[28]邓发亮,刘晓云,唐时幸,等. 莱克多巴胺人工抗原的合成与鉴定[J]. 食品科学,2013,34(18):146-149.
[29]陈臣,罗顺菁,刘成梅,等. 对氯甲基苯甲酸链接的莱克多巴胺人工抗原的合成与鉴定[J].食品科学,2013,34(1):180-184.
[30]潘萌,蒋浩琴,周芸,等. 弗氏佐剂与氢氧化铝佐剂对诱导小鼠获得性免疫应答作用的比较[J]. 现代免疫学,2006,26(2):98-101.
[31]包义风,应莲芳,蒋琳. 包涵体蛋白复性技术研究进展[J]. 微生物学免疫学进展,2012,40(2):84-88.
Synthesis and testing the ractopamine antigens conjugating with three different carrier proteins
JIA Ai-juan1,LIU Yao2,ZHANG Ting3,SHEN Xing2
(1. Guangdong Meiweixian seasoning Food Co.,Ltd.,Zhongshan 528400,China;2. Guangdong Provincial Key Laboratory of Food Quality and Safety/ National-Local Joint Engineering Research Center for Processing and Safety Control of Livestock and Poultry Products,Guangzhou 510642,China;3. Department of Food,Guangzhou City Polytechnic,Guangzhou 510405,China)
In order to prepare anti-RAC antibody with high affinity,the synthesized hapten RAC-succinic acid ester was conjugated with three different carrier proteins (BSA,OVA,KLH). After identified by UV spectroscopy scanning,ESI-MS and conjugation ratio,the successfully synthesized artificial antigens were used to immunize mouse.The titers of the obtained antiserum was detected by ELISA. The titers of the three artificial antigens were 4 000-32 000.The results showed that the three artificial antigens had satisfactory immunogenicity,and the immunogenicity of KLH was better than that of BSA and OVA. Therefore,the antigen can be used to prepare high affinity antibody.
ractopamine;carrier protein;hapten;artificial antigen;immunogenicity
S816.7
A
1004-874X(2017)07-0125-07
贾爱娟,刘姚,张挺,等. 基于3种载体蛋白的莱克多巴胺抗原的合成与检测[J].广东农业科学,2017,44(7):125-131.
2017-07-03
国家自然科学基金(31601555)
贾爱娟(1974-),女,硕士,高级工程师,E-mail:zlb@mwx.cn
沈兴(1987-),女,博士,副教授,E-mail:shenxing325@163.com
(责任编辑 邹移光)

