24个油棕品种对3种真菌性叶斑病的抗病性评价及生防细菌的分离、筛选
郑 丽,张海鹏,林 江,王娇娇,李梦倩,潘登浪,李 静,曾宪海
(1.农业部橡胶树生物学与遗传资源利用重点实验室/省部共建国家重点实验室培育基地——海南省热带作物栽培生理学重点实验室/农业部儋州热带作物科学观测实验站/农业部儋州油棕种质资源圃,海南 儋州 571737;2. 中国热带农业科学院广州实验站,广东 广州 510140;3. 华南农业大学农学院,广东 广州 510642;4. 海南大学热带农林学院,海南 儋州 571737)
24个油棕品种对3种真菌性叶斑病的抗病性评价及生防细菌的分离、筛选
郑 丽1,2,3,张海鹏3,林 江4,王娇娇4,李梦倩4,潘登浪1,李 静2,曾宪海1
(1.农业部橡胶树生物学与遗传资源利用重点实验室/省部共建国家重点实验室培育基地——海南省热带作物栽培生理学重点实验室/农业部儋州热带作物科学观测实验站/农业部儋州油棕种质资源圃,海南 儋州 571737;2. 中国热带农业科学院广州实验站,广东 广州 510140;3. 华南农业大学农学院,广东 广州 510642;4. 海南大学热带农林学院,海南 儋州 571737)
通过针刺接种方法,将24个油棕品种对3种病原菌(YZ-4、YZ-6和 YZ-8)的抗病性进行评价,发现对YZ-4抗病性较强的油棕品种为RY-2和RY-6,对YZ-6抗病性较强的油棕品种为RY-9、RY-14、RY-15、RY-31、RY-37、RY-38,对YZ-8抗病性较强的油棕品种为RY-38;可见不同品种对病原菌的抗性存在差异。针对3种病原菌进行生防菌株的分离和筛选,从不同生境(根、叶、土壤)中分离到138株细菌,测定其几丁质酶、蛋白酶、纤维素酶、葡聚糖酶活性,以及产生吲哚乙酸和嗜铁素等次生代谢物能力,采用平板对峙法进行颉颃活性测定。结果表明,138株菌株产生长素的菌株最多,比例达75.36%;无产几丁质酶和葡聚糖酶的菌株;产蛋白酶、纤维素酶和嗜铁素的比例分别为67.39%、58.70%和63.04%。AR156对YZ-4具有很强颉颃性,综合赋值总分为13;HNLE-4-2和3BS3对YZ-6具有最好颉颃效果,其综合赋值总分为10;3BS3对YZ-8具有最好的颉颃效果,综合赋值总分为10。
油棕;抗性评价;颉颃;水解酶;筛选
油棕(Elaeis guineensisJacq.) 属棕榈科,别名油椰子,是热带地区重要的木本油料作物,除食用外,也可用于工业和生物柴油的生产[1-4]。综合利用价值比较高,是我国长期生产效率最高的油料植物,因此油棕作为“绿色的能源”、“可再生的能源”,具有很好的发展前景[5]。
近10年来,油棕果产量保持稳定,种植面积不断扩大,对维护中国粮油安全、促进农民增收以及推动中国热带农业“走出去”战略具有重要意义[6]。随着种植面积的增大、植株的调运以及面临新环境植株会有新病害的威胁,解决该植物病害引起的损失已经成为油棕发展的主要内容。油棕叶斑病主要危害新老叶片,发病初期黄色小斑点,逐渐扩大至椭圆形至圆形,后期叶片焦枯、死亡、脱落[7]。据报道,炭疽菌是引起叶斑病的重要病原物之一[8]。严重为害植株叶片的病害有拟盘多毛孢属,次要叶部病害有长蠕孢叶斑病、炭疽病、叶斑病、黑斑病、藻斑病等[9-12]。2011 年牛晓庆等[13]鉴定出油棕叶斑病病原物拟茎点霉属以及Nakarin[14]报道的由茶拟盘多毛孢引起油棕叶斑病。
油棕叶斑病是目前油棕生产中的主要病害,尽管化学药剂的使用对油棕叶斑病的防治起了一定成效,但随之而来的环境污染、农药残留超标及病原菌抗药性等问题也引起高度关注[15]。具备改善环境、环境友好型、获得长期的良好防治效益和对人畜安全的生防菌应运而生,符合当前植物病害预防控制的发展方向[16]。研究表明,生防菌分泌的抗生素、酶类物质或类植物激素是生防物质。用于防治棉花黄萎病的内生细菌可产生蛋白酶降解毒素或产生抑制物抑制致病因子[17]。几丁质酶可通过降解真菌菌丝生长末端新合成的几丁质而破坏菌丝端部生长,达到抑制病原真菌生长的目的[18]。纤维素酶中的β-1,3-葡聚糖酶直接攻击真菌菌丝上的葡聚糖,抑制真菌的生长[19]。嗜铁素通过配基的螯合使环境中的铁浓度降低,从而使病原微生物缺铁而不能生长繁殖,进而达到控制植物病害的目的[20]。
本研究针对本研究室前期从油棕苗期植株上分离的3种真菌性叶斑病病原物拟盘多毛孢菌、炭疽菌和草茎点霉菌,在油棕上测定新引进的24个油棕品种对3种病原菌的抗病性,随后开展生防菌株筛选,拟寻找到最具潜力的生防菌,为下一步的田间防效测评提供优选材料和理论依据。
1 材料与方法
1.1 试验材料
植物材料:中国热带农业科学院橡胶研究所油棕试验基地种植的24种2龄油棕,分别为:RY-1、RY-2、RY-3、RY-4、RY-5、RY-6、RY-7、RY-8、RY-9、RY-10、RY-11、RY-12、RY-14、RY-15、RY-31、RY-32、RY-33、RY-34、RY-35、RY-36、RY-37、RY-38、RY-39和 RY-40。
病原物:热科院广州实验站植保实验室保存,小孢拟盘多毛孢菌Pestalotiopsis microspora(YZ-4)、炭疽菌Anthracnosespp.(YZ-6)、草茎点霉菌Phoma herbarum(YZ-8)。
7个颉颃细菌 AR156、Ze90、XY21、DS22、HS10、IBS4、3BS3来自南京农业大学郭坚华教授的绿色防控植保实验室。
1.2 试验方法
1.2.1 品种抗病性测定 参照李超萍[21]的方法测定24种油棕对其苗期3种真菌性病害的致病力。采用针刺法将已纯化的病原菌接种于田间盆栽的健康油棕叶片上,具体方法为:用脱脂棉蘸70%的酒精少许,在叶片接种部位涂拭消毒,晾干后用灭菌的束针刺伤叶片形成伤口,再将预先准备的直径为5 mm的菌饼贴于伤口,接种完成后表面覆盖已灭菌的吸水纸,保湿培养,采用保鲜膜缠绕保湿,以无菌琼脂块接种为对照。5~7 d后观察记录发病情况并拍照。
1.2.2 样品采集 参照Morris等[22]的方法,从海南儋州红卫农场的8龄油棕8个生境采集样品。
1.2.3 颉颃菌株分离 参照杨敬辉等[23]的方法,就以上采集的样品进行生防菌的分离,保存于-70℃超低温冰箱,备用。
1.2.4 平板颉颃活性测定 采用Berg等[24]的方法,采用平板对峙培养法测定菌株的平板颉颃活性。病原菌于PDA平板预培养6~7 d,在菌落边缘取直径为5 mm的菌饼,接种于水琼脂培养基中央,然后以病原菌为中心,呈十字状接种细菌,细菌接种处距离菌饼约2.7 cm,每平板接种细菌4次,每个处理3次重复。以仅接种病原菌的作为对照,28℃培养7 d观察抑菌圈,记录数据并拍照。
1.2.5 产酶和代谢物活性测定 水解酶活性测定:参照杨敬辉等[23]的方法测定蛋白酶活性,参照Roberts等[25]的方法测定几丁质酶活性,参考Ghose[26]的方法测定纤维素酶活性; 参照Shin等[27]的方法测定产嗜铁素活性,参照杨威[28]的方法测定产吲哚乙酸活性测定,参照Sarwar等[29]的方法测定β-1,3-葡聚糖酶活性。
1.2.6 抗病性分级 对3种病原菌进行抗病性接种,每个菌株重复3次,参照徐杰[31]的方法根据病斑大小制定对应抗病性评价标准(表1)。
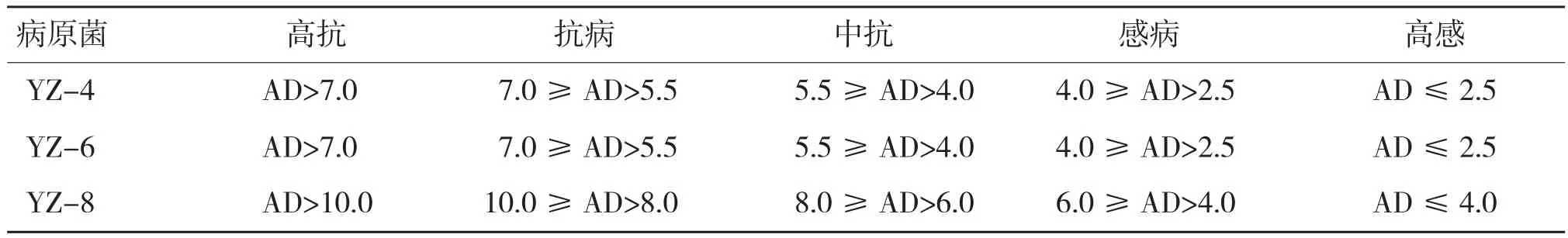
表1 抗病性分级标准(mm)
1.2.7 赋值评估 参照Berg等[30]的方法赋值。根据抑菌圈/水解圈(颉颃圈外径与内径之差)大小分为4级:0级,无颉颃/水解活性;1级,颉颃圈/水解圈大小在1~3 mm之间(含3 mm);2级,颉颃圈/水解圈大小在3~6 mm之间(含6 mm);3级,颉颃圈/水解圈大小在6 mm以上。赋予的值分别为0、1、2、3。其中吲哚乙酸活性根据液面颜色变化赋值:0,不变色;1,变为浅红色;2,变为红色;3,变成深红色。
采用Microsoft Excel对平板的抑菌圈、酶活等数据进行处理、分析。
2 结果与分析
2.1 抗病性测定结果
3种病原菌接种在不同油棕品种上致病性见图1(封三),不同品种的抗性表现见表2。其中YZ-4接种24个油棕品种后,表现出强感病性的品种主要有RY-1和RY-5,病斑平均直径均为7.70 mm,而RY-2和RY-6则表现出高抗病性,病斑平均直径分别为2.40、2.50 mm。YZ-6接种不同油棕品种后,RY-7、RY-8和RY-11表现出强感病性,病斑平均直径分别达7.90、10.80、7.80 mm;表现出强抗病性的品种有6个,分别为 RY-9、RY-14、RY-15、RY-31、RY-37和RY-38。YZ-8接种24个油性品种后,表现出强感病性和强抗病性的品种各有1个分别为RY-4和RY-38,病斑平均直径为10.90、3.86 mm。以上结果显示,同一病原菌对不同油棕品种的致病能力是不一样的,不同病原菌对同一油棕品种的致病能力也存在一定差异。

表2 24个油棕品种对3种病原菌的抗病性测定( mm)

图1 病原菌接种油棕叶片的发病情况
2.2 菌株分离结果
样品分离结果显示,不同生态位菌落的丰富性存在差异(表3)。无病害苗圃的健康植株-叶-外生菌(HNLP)微环境分离得到的细菌数量最多,为16株,占分离菌株总数的11.59%;病害地块健康植株的根围土(DR)和病害地块染病植株的根围土(DHR)微环境分离得到的细菌数量仅次于HNLP微环境,均为15株,占分离菌株总数的10.87%。而病害地块的健康植株-叶-外生菌(DLP)微环境分离得到的细菌数量最少,只有2株,占分离菌株总数的1.45%。
2.3 颉颃细菌产酶、次生代谢物及颉颃活性测定结果
初步测定145个颉颃细菌对3种病原菌(YZ-4、YZ-6和YZ-8)的平板颉颃活性,发现对YZ-4颉颃活性较好的菌株为HR-6-1、HNLP-6-6、HNLE-4-2、DS22、IBS4和 Ze90;对YZ-6颉颃效果较好的菌株为HR-5-2、DHR-4-4、DS22、AR156、HS10、IBS4、Ze90和XY21,其中活性最好的菌株为DS22和AR156;对YZ-8具颉颃活性的菌株为HR-5-2、HNLP-6-6、HNLE-4-2、DS22、AR156、HS10、IBS4、Ze90和XY21(图2,封三)。
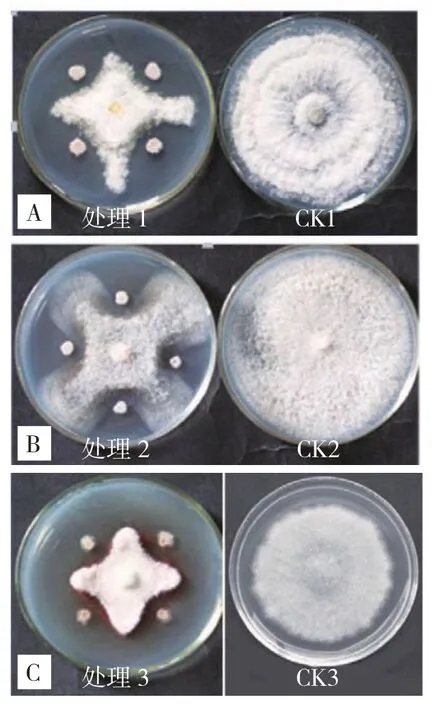
图2 平板颉颃活性测定结果
将获得的细菌菌株进行颉颃活性测定,结果(表4)表明,具有颉颃活性的菌株有5株,占总菌株数的3.62%,这些菌株主要来自HR、DHR、HNLP和HNLE等4个生境。其中来自HR的菌株占具有颉颃活性菌株数的40%,DHR、HNLP 和HNLE中分离到的颉颃菌株均占具有颉颃活性菌株数的20%。
对颉颃细菌的产酶活性和次生代谢产物分析,结果(表4)显示,所有生境中分离得到的菌株都无葡聚糖酶和几丁质酶能力,分离的菌株中产IAA的菌株所占比例最高,为75.36%,产蛋白酶的菌株比例为67.39%,产纤维素酶和嗜铁素的菌株占菌株总数的58.70%和63.04%,而DLP生境中分离的菌株均不产生纤维素酶。
2.4 颉颃菌株综合赋值评价
对7株外来生防菌株和5株分离得到的菌株进行病原菌颉颃性评估,结果(表5)表明,
AR156对YZ-4具有很强颉颃性,综合赋值总分为13;HNLE-4-2和3BS3对YZ-6具有最好颉颃效果,其综合赋值总分为10,是这种病原菌潜在的生防菌;3BS3对YZ-8具有最好的颉颃效果,综合赋值总分为10。分离得到的5个菌株的综合赋值总分平均值为11.6,而其他来源的7个菌株的综合赋值总分为10.4,由此可以看出从这些病原菌的生境中分离得到的菌株具有更好的生防效果。根据菌株对病原菌的综合赋值得分,拟选择其中拮抗效果和综合赋值总分较高的菌株开展后续温室防效试验。
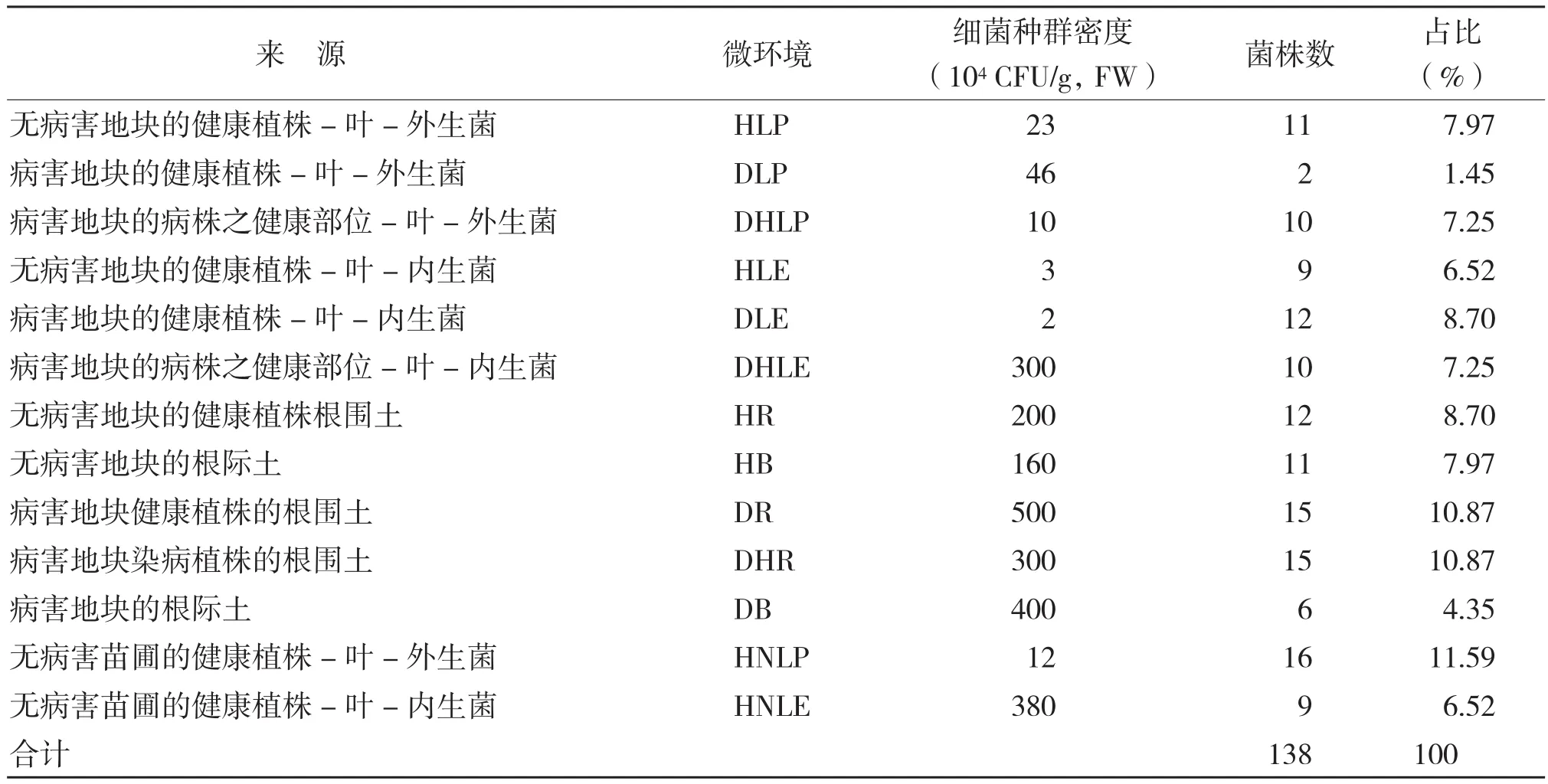
表3 不同生境颉颃菌的分布情况
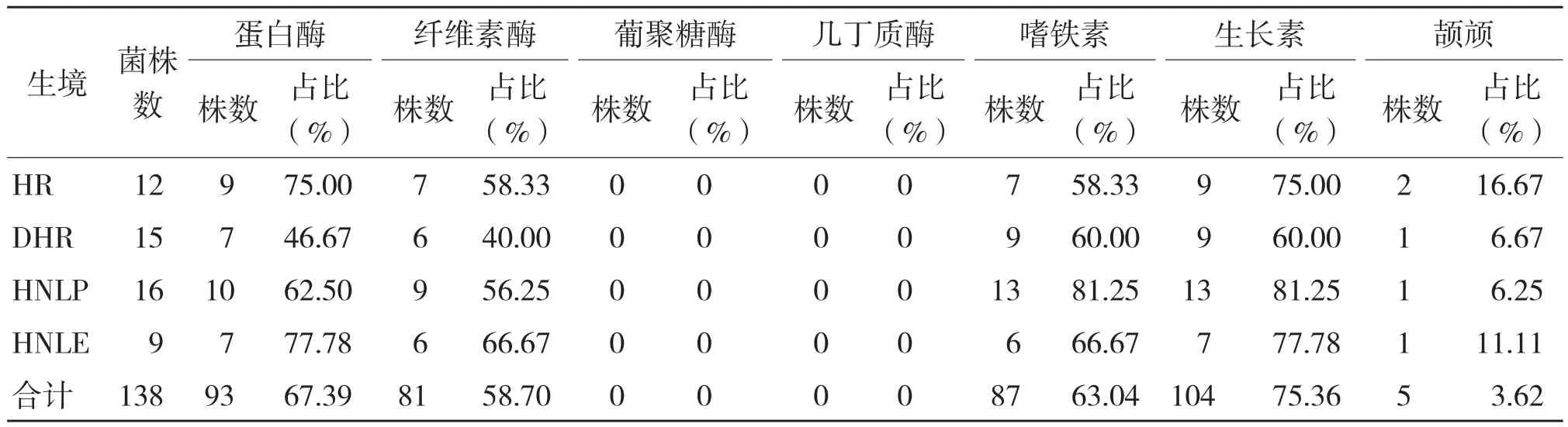
表4 5株生防菌的酶活和次生代谢产物的生产情况
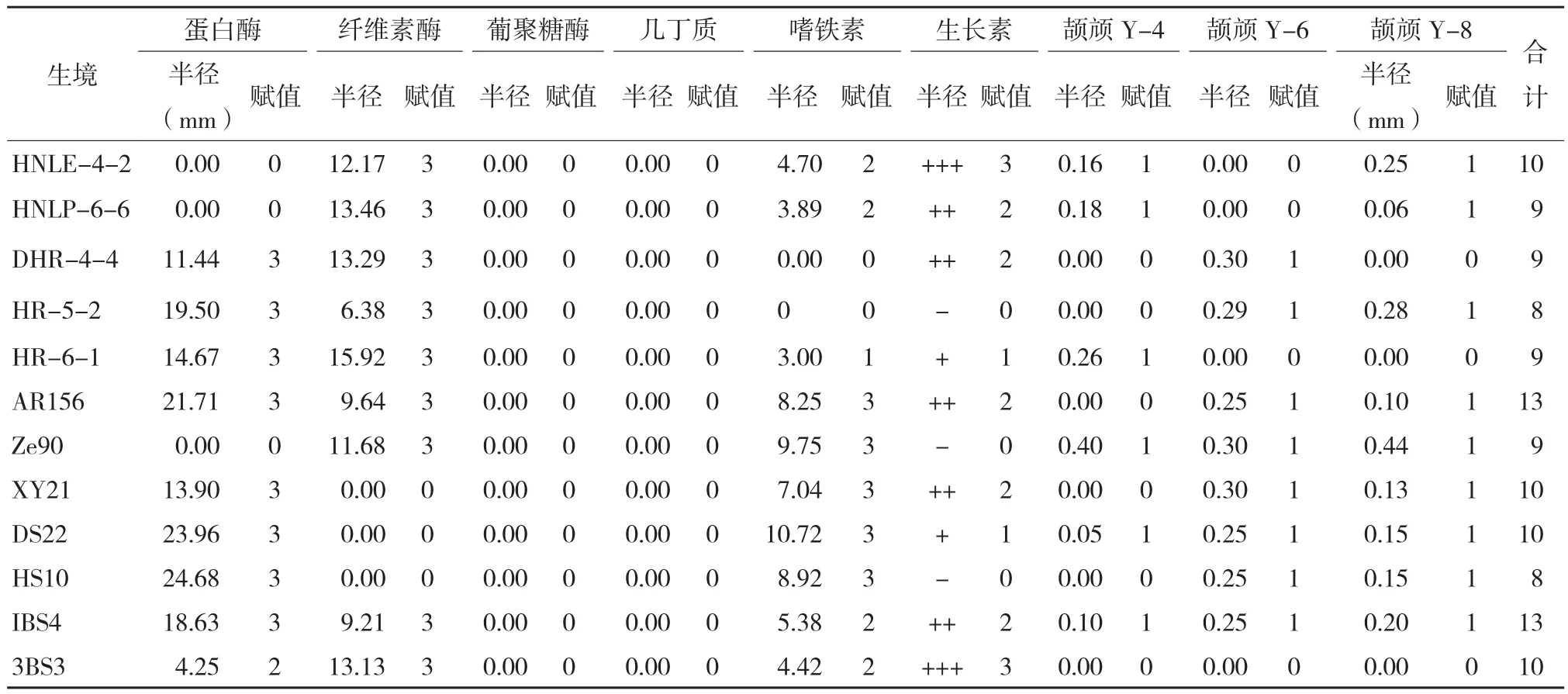
表5 13株生防潜力菌株综合赋值
3 结论与讨论
将3种真菌性病原菌分别接种于24个不同油棕品种,结果表明同一品种油棕对不同病原菌抗病性存在差异,不同品种油棕对同一病原菌的抗病性也存在差异,这与大多数学者的研究结果是一致的,如曹世勤等[32]发现将条锈菌接种于26个不同品种小麦上,不同品种小麦表现出不一样的抗病性;刘振阳等[33]将细菌性溃疡病原菌接种于10个不同杨树品种上,不同杨树品种表现出不同的抗病性;高润蕾[34]将丁香假单胞菌黄瓜致病变种接种于不同的哈密瓜品种上,发现高感品种有10个、中感品种23个、中抗品种10个;胡俊等[35]也报道过不同哈密瓜品种对细菌性果斑病的抗病性存在差异。张自启等[36]发现不同病原菌对同一油葵品种具有不同的致病力;据报道,将不同的条锈菌接种于小麦上,不同品种的小麦表现出不一样的抗病性[32];张丹丹[37]将多个地区获得的菌株接种于玉米上,发现玉米对不同病原菌的抗病性存在差异,对禾谷镰刀菌的抗病性最差。
本研究就分离的138株菌株和其他来源的7个菌株进行对3种病原物的颉颃活性测定,结果表明不同菌株的颉颃效果存在差异,可能与不同菌株采集的地理位置、产酶条件以及适宜的培养基类型有关,如徐杰[31]、金迪等[38]的研究结果发现对应细菌只有在温度、pH、培养时间合适时才能最好发挥好的活性。此外,本研究采用其他来源的菌株,发现其颉颃活性较好。可见,生防菌株来源可以多样化,并不仅仅局限于从油棕生境分离的细菌。
本研究结果表明不同生防菌菌株可能会产生不同类型的代谢产物。研究表明,多数生防细菌能够在其生长发育过程中产生多种颉颃性或竞争性的代谢产物,通过直接或间接作用,达到阻碍或杀死病原菌的效果;能够产生拮抗物质的细菌种类很多,且产生的颉颃物质也是多种多样,不仅同一种细菌相同菌株可以产生多种拮抗物质,且一种拮抗物质也可从多株细菌的代谢产物中检测到[39]。Yoshida 等[40]发现解淀粉芽孢杆菌作为生防菌时能够产生一种拮抗炭疽菌的物质;Kim等[41]发现某些大肠杆菌可以用作生防菌抑制炭疽菌,主要是该菌会产生一种脂酶抑制炭疽菌的附着胞形成,从而达到控制病害发展的效果。
本研究在试验过程中均只采用了单菌株的平板活性测试,可能可以考虑在复合生防菌的利用过程中加入适当的颉颃性中等或颉颃性弱的生防菌,从而提高生防效果[42]。考虑加入某些生防真菌,以增强相应生防菌的颉颃作用[43]。
本研究后续工作将抗性品种进行田间试验,并测定油棕各类抗性品种受到病原菌入侵时,抗病相关酶活的变化情况。此外,将筛选得到的12株细菌测定其温室盆栽防效试验,筛选到稳定、持续防效的生防菌株。
[1]Cao H X,Sun C X,Shao H B,et al. Effects of low temperature and drought on the physiological and growth changes in oil palm seedlings[J].African Journal of Biotechnology,2011,10(14):2630-2637.
[2]Corley R H V,Tinker P B. The oil palm(Fourth Edition)[M]. John Wiley &Sons,Hoboken,NJ,2003.
[3]林位夫. 中国油棕种植利用现状及其发展前景分析[M]. 北京:中国农业科学技术出版社,2010.
[4]曹建华,林位夫,张以山. 中国油棕发展战略研究[M]. 北京:中国农业出版社,2011.
[5]艳,王必尊,刘立云,等. 我国油棕研究现状与发展对策[J]. 现代农业科技,2007(23):216-217.
[6]雷新涛,曹红星. 油棕[M]. 北京:中国农业出版社,2013.
[7]牛晓庆,唐庆华,余凤玉,等. 油棕叶斑病的病原鉴定及其生物学特性[J]. 江西农业学报,2011(11):103-105,108.
[8]郑丽,沈会芳,李静,等. 油棕病害调查及叶部病害的病原真菌初步鉴定[J]. 广东农业科学,2014,41(14):66-69.
[9]Aderungboye F O,张开明. 油棕的病害[J]. 世界热带农业信息,1979(4):31-43.
[10]Chinchilla C,Escobar R. Red ring and other diseases of the oil palm in central and south America[J]. ASD Oil Palm,2007,30:1-27.
[11]巴希,吴恭恒. 油棕的虫害与动物害[J]. 世界热带农业信息,1963,3(2):64-66.
[12]谢龙莲. 沙捞越州发现油棕新病害[J]. 世界热带农业信息,2006(9):23-24.
[13]牛晓庆,唐庆华,余凤玉,等. 油棕叶斑病的病原鉴定及其生物学特性[J]. 江西农业学报,2011,23(11):103-105.
[14]Nakarin S,Kanaporn S,Jaturong K,et al. First report of leaf spot disease on oil palm caused by Pestalotiopsis the-aein in Thailand[J]. J Gen Plant Pathol,2013,79:277-279.
[15]韩长志. 植物病害生防菌的研究现状及发展趋势[J]. 中国森林病虫,2015(1):33-37,25.
[16]苏琴. 化学防治与生物防治的优缺点浅析[J].内蒙古农业科技,2011(6):84-85,132.
[17]孔庆科,丁爱云. 内生细菌作为生防因子的研究进展[J]. 山东农业大学学报(自然科学版),2001(2):256-260.
[18]王焰玲,秦敏,周青,等. 抑制稻瘟病菌生长的几丁酶产生菌的分离和鉴定[J]. 植物保护学报,1998(4):289-294.
[19]孙娣,汪洋,张丽娟,等. β-1,3-葡聚糖酶及其抗真菌作用[J]. 黑龙江医药,2005(6):416-417.
[20]谭周进,肖罗,谢丙炎,等. 假单胞菌的微生态调节作用[J]. 核农学报,2004(1):72-76.
[21]超萍. 国内木薯病害调查与细菌性枯萎病防治技术研究[D].海口:海南大学,2011.
[22]Morris S J,Zink T,Conners K,et al. Comparison between fluorescein diacetate and differential fluorescent staining procedures for determining fungal biomass in soils[J]. Applied Soil Ecology,1997(6):161–167.
[23]Yang J H,Liu H X,Zhu,G M,et al. Diversity analysis of antagonists from rice-associated bacteria and their application in biocontrol of rice diseases[J]. Journal of Applied Microbiology,2008,104:91–104.
[24]Berg G,Fritze A,Roskot N,et al. Evaluation of potential biocontrol rhizobacteria from different host plants ofVerticillium dahliaeKleb[J].Journal of Applied Microbiology,2001,91(6):963–971.
[25]Roberts W K,Selitrennikoff C P. Plant and bacterial chitinases differ in antifungal activity[J]. Journal of General Microbiology,1988,134:169-176.
[26]Ghose T K. Measurement of cellulase activities[J]. Pure and Applied Chemistry,1987,59:257-268.
[27]Shin S H,Lim Y,Lee S E,et al. CAS agar diffusion assay for the measurement of siderophores in biological fluids[J]. Journal of Microbiological Methods,2001,44(1):89-95.
[28]杨威. 姜青枯病的生物防治及生防菌株对土壤环境的影响研究[D]. 南京:南京农业大学,2011.
[29]Sarwar M,Kremer R J. Determination of bacterially derived auxins using a microplate method[J]. Letter Applied Microbiology,1992,20:282-285.
[30]Berg G,Krechel A,Ditz M,et al. Endophytic and ectophytic potato associated bacterial communities differ in structure andantagonistic function against plant pathogentic fungi[J].FEMS Microbiology Ecology,2005,51:215-229.
[31]徐杰. 水稻秸秆降解放线菌的分离鉴定及其降解机理研究[D]. 哈尔滨:哈尔滨工业大学,2011.
[32]曹世勤,吕小欢,黄瑾,等. 甘肃省26个春小麦品种(系)苗期抗条锈基因分析及成株期抗病性评价[J]. 麦类作物学报,2013(4):771-776.
[33]刘振阳. 不同抗性杨树品种对欧美杨细菌性溃疡病抗病性的初步研究[D]. 北京:北京林业大学,2015.
[34]高润蕾. 哈密瓜细菌性叶斑病病原鉴定及不同品种抗病性测定[D]. 呼和浩特:内蒙古农业大学,2009.
[35]胡俊,黄俊霞,刘双平,等. 不同哈密瓜品种对细菌性果斑病抗病性及发展动态的研究[J].华北农学报,2006(6):107-110.
[36]张自启,刘长营,段爱菊. 油葵不同品种田间病害调查及成株期抗病性鉴定[J]. 安徽农学通报(上半月刊),2009(21):106-107.
[37]张丹丹. 河南省玉米茎基腐病病原菌种类鉴定及致病性测定[D]. 郑州:河南农业大学,2010.
[38]金迪,彭清静,易浪波,等. 一株纤维素降解细菌的筛选、鉴定及产酶条件分析[J]. 中国微生态学杂志,2010(4):289-292,295.
[39]海峰. 枯草芽孢杆菌7Ze3次生代谢产物研究[D]. 南京:南京农业大学,2009.
[40]Yoshida S,Hiradate S,Tsukamoto T,et al. Anfimicrobiol acdvity of culture filtrate ofBacillus amyloliquefaciens RC-2 isolated from mulberry leaves[J].Phytopathology,2001,91(2):181-187.
[41]Kim P I,Chung K C. Production of an antifungal protein for control ofColletotrichum lagenariumbyBacillus amyloliquefaciens[J]. FEMS Microbiol Lett,2004,234:177-183.
[42]Roberts D P,Lohrke S M,Meyerb S L F,et al.Biocontrol agents applied individually and in combination for suppression of soilborne diseases of cucumber[J]. Crop Protection,2005,24(2):141-155.
[43]谭兆赞,林捷,刘可星,等. 复合微生物菌剂对番茄青枯病和土壤微生物多样性的影响[J].华南农业大学学报,2007,28(1):45-49.
Resistance evaluation of 24 oil palm species to three fungal pathogens and the isolation and screening of biological control agents
ZHENG Li1,2,3,ZHANG Hai-peng3,LIN Jiang4,WANG Jiao-jiao4,LI Meng-qian4,PAN Deng-lang1,LI Jing2,ZENG Xian-hai1
(1. Opening Project Fund of Key Laboratory of Rubber Biology and Genetic Resource Utilization,Ministry of Agriculture / State Key Laboratory Breeding Base of Cultivation &Physiology for Tropical Crops / Danzhou Investigation & Experiment Station of Tropical Crops,Ministry of Agriculture/Germplasm Repository of Oil Palm, Danzhou City,Ministry of Agriculture,Danzhou 571737,China; 2. Guangzhou Experimental Station,Chinese Academy of Tropical Agricultural Sciences,Guangzhou 510140,China;3. College of Agriculturure,South China Agricultural University,Guangzhou 510642,China;4. Institute of Tropical Agriculture and Forestry,Hainan University,Danzhou 571737,China)
The resistances of 24 oil palm species to pathogens of YZ-4,YZ-6 and YZ-8 were evaluated by the method of needle inoculation. The results showed that different cultivars behaved different resistances to different pathogens. RY-2 and RY-6 had higher disease resistance to YZ-4. RY-9,RY-14,RY-15,RY-31,RY-37 and RY-38 showed good resistance to YZ-6,and YZ- 8 showed weak pathogenicity to RY-38. In addition,the antagonistic activity,production of hydrolytic enzymes and secondary metabolites was carried out on 138 strains isolated from different habitats (roots,leaves,soil). Results showed that strains produced IAA had the largest percentage according to 75.36 percent and no strain produced chitinase and Glucanase,the strains producing protease,cellulase and siderophore were 67.39% ,58.70% and 63.04%,respectively. Further result showed that AR156 and 3BS3 were proved to have antagonistic activity on YZ-4 and YZ-8,which reached to 13 and 10 scores respectively. HNLE-4-2 and 3BS3 showed well antagonistic activity on YZ-6 and comprehensive score was 10. The results provide the preliminary research foundation for obtaining high quality of biocontrol bacteria resources.
oil palm;resistance evaluation;antagonistic;hydrolytic enzymes;screening
S765.5
A
1004-874X(2017)07-0096-08
郑丽,张海鹏,林江,等.24个油棕品种对3种真菌性叶斑病的抗病性评价及生防细菌的分离、筛选[J].广东农业科学,2017,44(7):96-103.
2017-04-20
中国热带农业科学院橡胶研究所重点实验室开放课题(RRI-KLOF201508);农业部热作种质资源保护项目(151721301354052014);中国热带农业科学院基本科研业务费专项(1630112017002)
郑丽(1984-),女,在职博士生,助理研究员,E-mail:catas_lzheng@163.com
曾宪海(1976-),男,博士,副研究员,E-mail:zxh200888@126.com
(责任编辑 杨贤智)

