中国汉族癌症患者紫杉醇相关外周感觉神经病变的单核苷酸基因多态性
窦雪琳,麦毓麟,孙 昭,王颖轶,邵亚娟,程月娟,周 娜,骆 飞,张 彪,白春梅,马水清
1中国医学科学院 北京协和医学院 北京协和医院肿瘤内科,北京 100052 2中国医学科学院 北京协和医学院 北京协和医院内科,北京 100730 3中国医学科学院基础医学研究所 北京协和医学院基础学院 流行病与卫生统计系,北京 100005 4中国医学科学院 北京协和医学院 北京协和医院妇产科,北京100730
·论著·
中国汉族癌症患者紫杉醇相关外周感觉神经病变的单核苷酸基因多态性
窦雪琳1,麦毓麟2,孙 昭1,王颖轶1,邵亚娟1,程月娟1,周 娜1,骆 飞1,张 彪3,白春梅1,马水清4
1中国医学科学院 北京协和医学院 北京协和医院肿瘤内科,北京 1000522中国医学科学院 北京协和医学院 北京协和医院内科,北京 1007303中国医学科学院基础医学研究所 北京协和医学院基础学院 流行病与卫生统计系,北京 1000054中国医学科学院 北京协和医学院 北京协和医院妇产科,北京100730
目的在中国汉族人群中研究与2/3级紫杉醇介导的外周感觉神经病变(PSN)相关的单核苷酸基因多态性(SNP)位点及临床特点。方法以2014年5月至2016年12月在北京协和医院接受紫杉醇方案化疗的216例患者为研究对象,提取外周血DNA,选取8个候选SNP位点,采用SequenomMassARRARYiPLEX平台测定基因型。依据美国国家癌症研究院-不良反应常见术语评定标准,由受训的临床医生完成患者随访及PSN分级。结果共有209例患者最终纳入分析。在候选SNP位点中,仅rs4141404∶A>C(LIMK2)与2/3级PSN显著相关(OR:4.32,95%CI:2.37~7.89,P<0.0001)。多因素Logistic 回归分析结果显示,rs4141404∶A>C(LIMK2)多态性及既往使用铂类制剂(OR:2.70,95%CI:1.32~5.51,P=0.007)与2/3级PSN发生风险相关。结论rs4141404∶A>C(LIMK2)多态性可能是中国汉族人群发生紫杉醇介导的2/3级PSN的风险因素。
紫杉醇;外周感觉神经病变;化疗不良反应;中国汉族人群
化疗介导的周围神经病变(chemotherapy-induced peripheral neuropathy,CIPN)是在癌症患者中常见的治疗相关不良反应,影响患者生活质量并常导致药物减量或停用[1],目前已引起临床医生的广泛重视。2014年,美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)首次发布了关于CIPN的预防和治疗指南[2],常见的引起CIPN的药物包括紫杉类、铂类、长春碱类和沙利度胺等。紫杉醇是一种可应用于多种实体瘤的细胞周期特异性化疗药,广泛用于乳腺癌、卵巢癌、胃癌等治疗[3],其不良反应之一即为紫杉醇介导的外周感觉神经病变(peripheral sensory neuropathy,PSN),主要引起感觉神经的受累,运动和自主神经受累少见[4]。据文献报道,约80%的患者接受紫杉醇治疗后可能会出现PSN,其中约1/3的患者症状严重[5]。
近年来,随着药物基因组学研究技术的发展,有证据表明CIPN的发生更受遗传因素,即单核苷酸多态性(single nucleotide polymorphism,SNP)的影响[6],而非完全由临床因素决定。目前根据已有的相关全基因组关联分析(genome wide association study,GWAS)筛查结果[7- 8],国外研究小组在欧洲、非洲裔人群中曾经开展候选SNP位点独立验证研究[7,9],但目前缺乏在中国汉族人群中的较大规模独立验证研究数据。本研究在中国汉族人群接受紫杉醇化疗治疗的癌症患者中开展了与2/3级PSN相关的SNP 风险位点研究,并结合临床病理资料分析风险因素,以期提供中国癌症患者的相关数据,指导不良反应及个体化临床化疗方案的选择。
对象和方法
对象2014年5月至2016年12月在北京协和医院接受紫杉醇方案化疗的患者216例。纳入标准:(1)年龄≥18岁;(2)中国汉族人群癌症患者;(3)接受含紫杉醇化疗方案。排除标准:(1)2型糖尿病;(2)自身免疫病;(3)其他周围神经病变病史。剔除标准:紫杉醇周疗或联用奥沙利铂的患者。本研究经北京协和医院伦理委员会批准(审批号:JS- 894),取得患者知情同意。
评估及随访由事先接受培训的临床医生对接受紫杉醇化疗的患者跟踪随访。评估标准按照国际惯例,采用美国国家癌症研究院-不良反应常见术语评定标准(National Cancer Institute-Common Terminology Criteria for Adverse Events,NCI-CACTE v.4.03),具体为:(1)0级:症状及查体无任何异常;(2)1级:无症状性的腱反射消失或感觉异常;(3)2级:中度症状,日常体力活动受损;(4)3级:重度症状,个人自理能力受损。日常体力活动:做饭、购买杂货及衣物、使用电话、整理财务等。个人自理能力:洗澡、穿衣、脱衣、吃饭、如厕、吃药、不持续卧床。由于2级以上CIPN不良反应是主要的剂量限制因素,并明显影响患者生活质量,按照惯例[7- 11],将患者分为PSN 0/1级组及2/3级组。随访间隔为每3周至2个月,对患者的外周神经病变相关的症状和体征进行问诊、查体,评估后进行分级记录,患者出现PSN2/3级为随访终点。
SNP位点选择首先在NHGRI-EBI数据库(http://www.ebi.ac.uk/gwas)进行关于紫杉醇PSN的GWAS研究搜索,在搜索栏中输入“paclitaxel induced neuropathy”,再点击“Download association results”,保存“MyGWAS-search.xls”。采用“AND”“OR”组合,在PubMed数据库搜索“paclitaxel”、“chemotherapy induced peripheral neuropathy”、“paclitaxel induced neuropathy”、“paclitaxel toxicity”等关键词,搜索其他未纳入NHGRI-EBI数据库的GWAS研究。确定既往GWAS研究中报道与2级以上紫杉醇介导的PSN有相关性的SNP位点,查阅美国国家生物技术中心(National Center for Biotechnology Information,NCBI)-dbSNP数据库中相应的中国汉族人群的最小等位基因频率(minor allele frequency,MAF),筛选出MAF≥0.05的位点。此外,由于rs9501929位点多态性与PSN相关性曾被两个独立的研究队列所证实[9,12],且其MAF≥0.05,最终候选位点亦纳入了该位点。
DNA提取和基因型测定收集患者全血,使用试剂提取DNA,采用SequenomMassARRARYiPLEX质谱方法对所选SNP位点进行基因分型。
统计学处理对比PSN 0/1级及PSN 2/3级患者的临床资料,针对连续变量采用Mann-Whitney非参数检验,分类变量采用卡方检验。对所有SNP位点首先进行哈迪-温伯格遗传平衡检验,以确定样本是否具有代表性。针对每个位点等位基因进行卡方检验,选取与PSN分级相关的有意义位点,然后分别在加性、隐性、显性模型下进行Logistic回归分析。选取性别、年龄、疾病、化疗方案、单次剂量、累计剂量、是否有既往铂类用药史、给药计划等临床因素,分别进行单因素Logistic回归。结合基因型及病理因素,采用逐步回归法进行变量筛选。所有的统计分析由plink(1.9,http://www.cog-genomics.org/plink2)[13]及R(3.3.0,http://www.r-project.org)[14]完成。在各SNP位点的等位基因相关性分析中,采用Bonferroni校正P值,即P<0.006 25为有统计学意义;其余分析均以P<0.05为有统计学意义。
结 果
一般情况共有216例患者入组,中位年龄58(25~80)岁,其中91例年龄≥60岁;诊断多为消化道来源恶性疾病;化疗方案包括紫杉醇单药、紫杉醇联合铂类制剂、紫杉醇联合5-氟尿嘧啶及其衍生物制剂(表1);中位治疗周期4(2,5)个周期,平均单次输注剂量(150.6±21.4)mg/m2,平均紫杉醇累计剂量(637.8±395.5)mg/m2。剔除紫杉醇周疗或联用奥沙利铂的患者后,最终有209例患者纳入分析,其中,PSN 0级41例(19.6%),PSN 1级101例(48.3%),PSN 2级49例(23.4%),PSN 3级18例(8.6%)。PSN 0/1级组和2/3级组患者在年龄、性别、治疗方案等方面差异均无统计学意义(P均>0.05),两组患者的铂类药物用药史差异有统计学意义(P=0.028)(表2)。

表 1 所有入组患者的临床特点Table 1 Clinical features of all subjects
与紫杉醇介导的2/3级PSN发生相关的风险SNP位点在209例患者中对共8个已报道的相关SNP位点进行基因型测定,结果显示所有位点的基因型均符合哈迪-温伯格遗传平衡(P均>0.05),rs4141404∶A>C(LIMK2)多态性与PSN2/3级的发生显著相关(OR:4.32,95%CI:2.37~7.89,P<0.0001)(表3)。rs4141404位点CC、CA、AA基因型分别有154(76.2%)、43(21.3%)、5例(2.5%),另外7例由于该位点基因分型结果未通过质控而被排除。进一步在加性模型、显性模型、 隐性模型中进行单因素Logistic回归分析,结果显示,在加性模型中,以CC基因型作为对照,CA基因型及AA基因型(OR:4.29,95%CI:2.27~8.12,P=0.023)差异具有统计学意义;在显性模型中,CA基因型及AA基因型对比CC基因型差异亦有统计学意义(OR:5.00,95%CI:2.51~9.96,P<0.0001);但在隐性模型中,AA基因型对比CA及CC基因型则为差异有临界统计学意义(OR:8.92,95%CI:0.98- 81.46,P=0.05)(表4)。针对rs4141404位点,以出现PSN 2/3级为结局参数,以出现该结局时的紫杉醇累计剂量为时间参数,绘制其Kaplan-Meier生存曲线,结果显示AA及CA基因型患者出现2/3级PSN的累计剂量明显低于CC基因型患者(log-rankP<0.0001)(图1)。
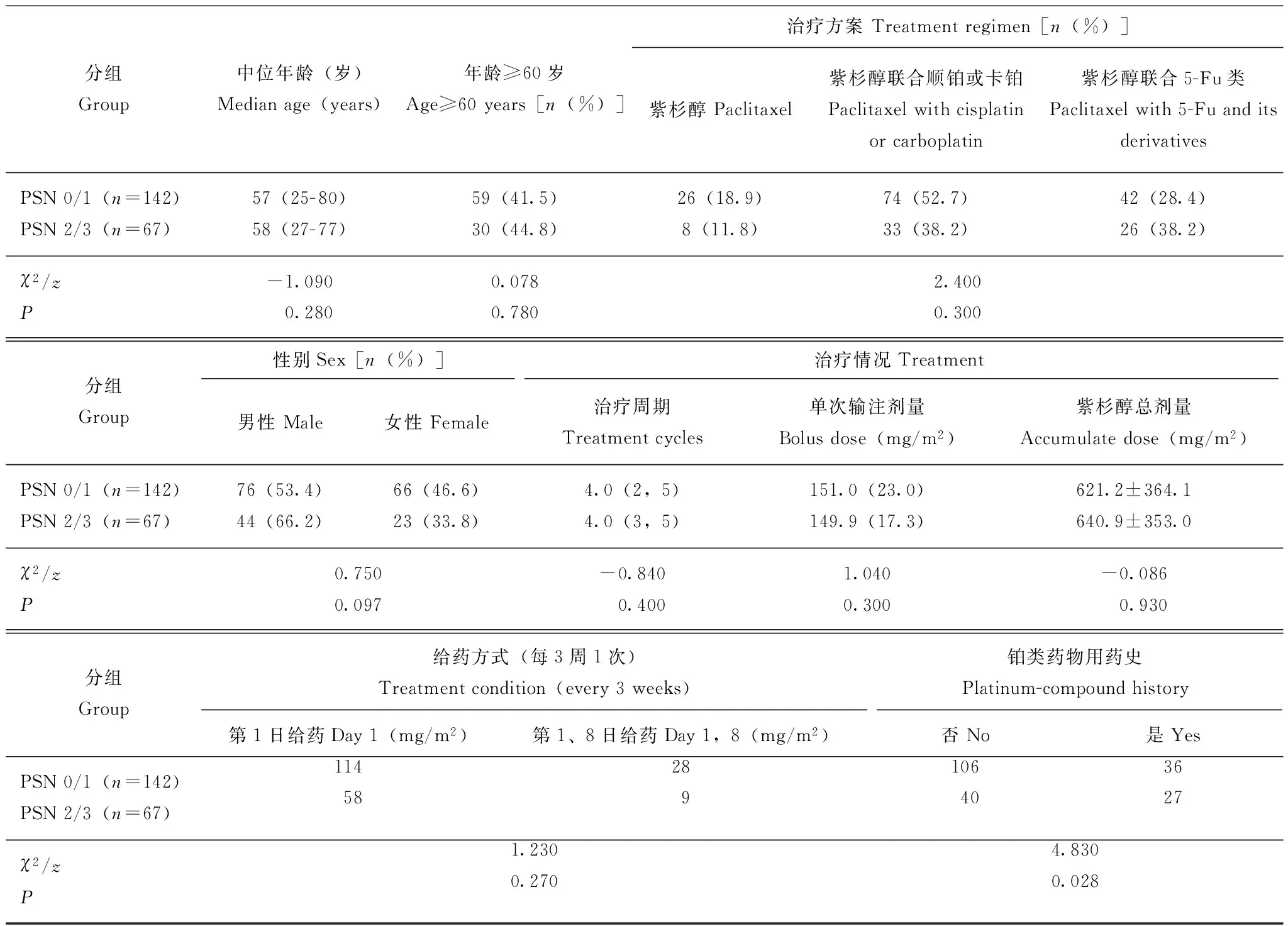
表 2 PSN 0/1级组与2/3级组患者临床特点的比较Table 2 Comparison of clinical features between PSN 0/1 and 2/3 grade groups
PSN:外周感觉神经病变
PSN:peripheral sensory neuropathy
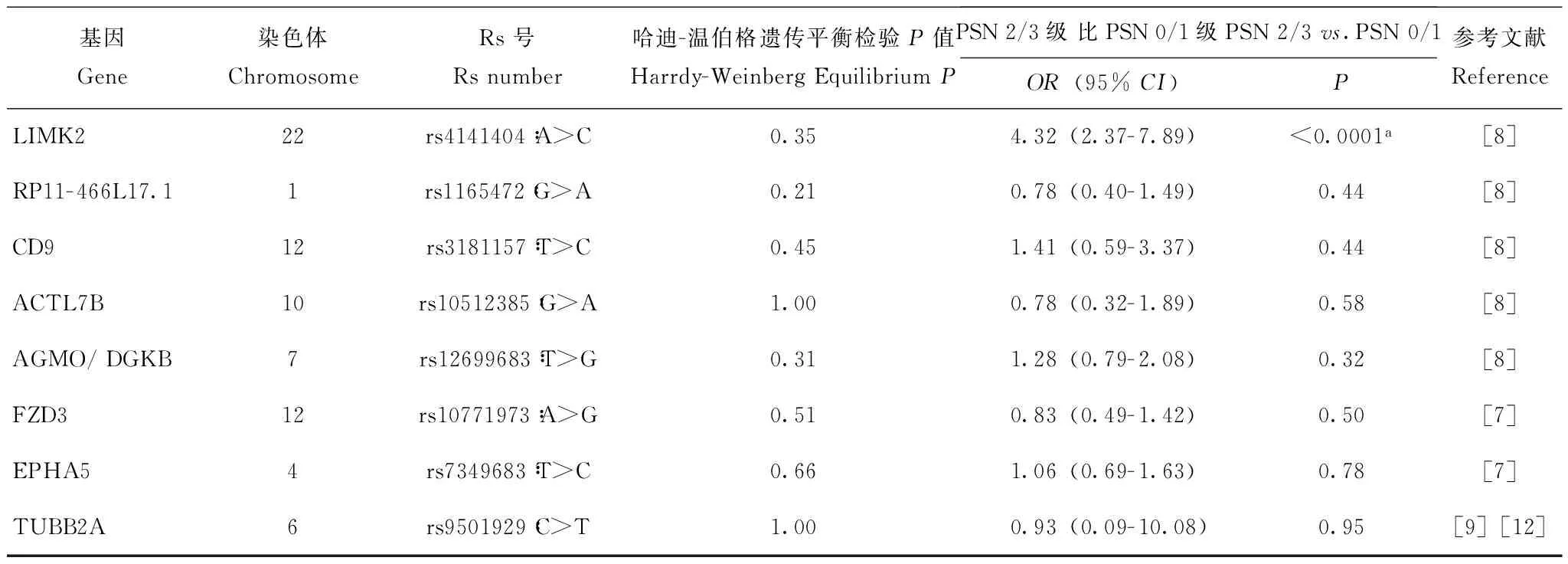
表 3 候选SNP位点与PSN分级的相关性Table 3 Associations of the candidate SNP with PSN grades
a:P<0.00625(Bonferronni校正P临界值);每个SNP位点的OR根据高PSN分级组进行计算,OR大于1代表携带该风险等位基因在PSN 2/3组的频率高于PSN 0/1组
a:P<0.00625(Bonferronni adjustedPthreshold);ORare calculated for variant allele with higher PSN grade subgroup,ORgreater than 1 represents higher frequency of variant allele in grade 2/3 than in grade 0/1 subgroup
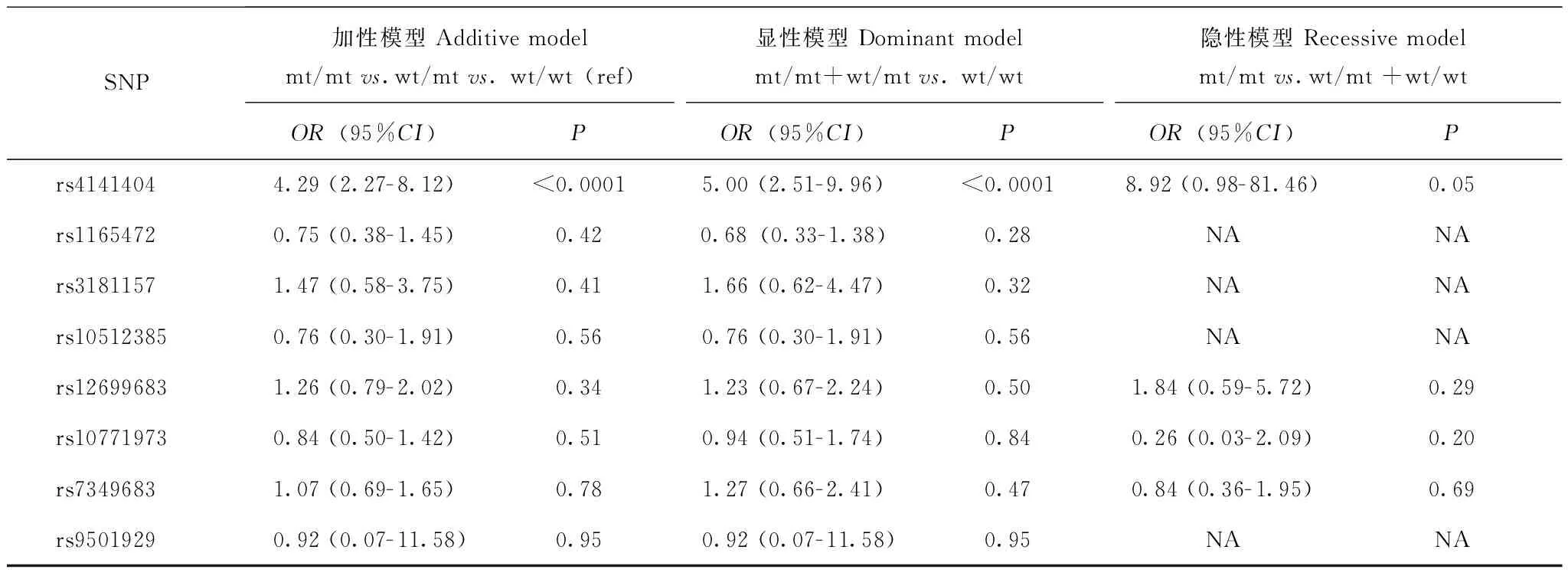
表 4 各位点在加性、显性、隐性模型下的Logistic回归结果Table 4 Logistic regression for all gene under additive,dominant and recessive models
SNP:单核苷酸多态性;NA:不可用;wt:野生型;mt:突变型
SNP:single nucleotide polymorphism;NA:not available;wt:wild type;mt:mutant type
基因型结合临床病理特点的2/3级PSN风险因素选取年龄、性别、疾病种类(消化道肿瘤对比非消化道肿瘤)、化疗方案(紫杉醇单药、紫杉醇联合铂类、紫杉醇联合5-Fu类)、给药方式(第1日给药对比第1、8日给药)、单次给药剂量、累计剂量是否大于1000 mg/m2、既往铂类用药史这8项临床病理因素,分别进行单因素Logistic回归分析,结果显示仅有既往铂类用药史与2/3级PSN显著相关(OR:1.99,95%CI:1.07~3.69,P=0.03)(表5)。然后在加性模型下采用Logistic逐步回归法,确立最优多因素Logistic回归模型,最终纳入rs4141404基因型、既往铂类用药史、给药计划、紫杉醇累计剂量>1000 mg/m2及年龄5项因素,经多因素Logistic回归分析结果显示,rs4141404基因型CA(OR:6.39,95%CI:2.93~13.96,P<0.0001)、AA (OR:12.50,95%CI:1.21~128.85,P=0.03)及铂类用药史(OR:2.70,95%CI:1.32~5.51,P=0.007)差异仍具有统计学意义,给药计划中第1、8日给药较第1日给药可能是发生2/3级PSN的保护因素,但差异未达统计学意义(OR:0.40,95%CI:0.16~1.01,P=0.05)。紫杉醇累计剂量>1000 mg/m2(OR:2.92,95%CI:0.95~9.00,P=0.06)及年龄(OR:1.03,95%CI:1.00~1.06,P=0.09)差异均未达统计学意义。
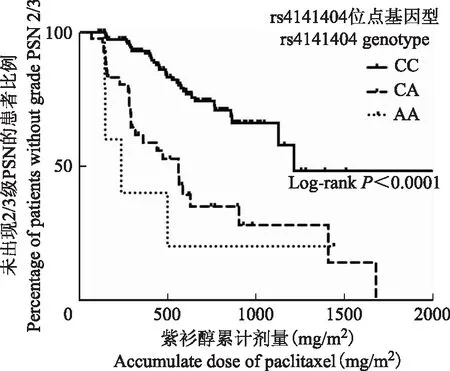
以紫杉醇累计剂量为时间,以出现2/3级PSN为结局事件,可见携带等位基因A的患者风险明显升高
With cumulative dose of paclitaxel as time and development of grade 2/3 peripheral sensory neuropathy as event,those carrying 1 or 2 variant alleles had a significantly higher risk
图1 rs4141404位点不同基因型患者Kaplan-Meier生存曲线
Fig1 Kaplan-Meier analysis according to CC/AC/AA genotype for rs.rs4141404
讨 论
紫杉醇是常用的癌症化疗药物,其作用机制是通过结合微管蛋白的β亚基,稳定微管,从而阻断细胞有丝分裂,介导细胞死亡,发挥抗癌作用,临床应用广泛[3]。紫杉醇介导的PSN典型临床表现为肢体远端对称性的麻木样、针刺样感觉,呈“手套、袜套样”分布,PSN发生机制包括感觉神经轴突转运功能的受损、神经元和施万细胞的损伤等[4]。目前公认的PSN评判标准为NCI-CACTE(v.4.03),对于2级以上的患者,由于生活质量及下一步治疗方案受到较大影响,研究多集中于识别 CIPN 2级以上的患者的风险因素[6,8,10]。
随着药物基因组学领域的发展,多种基因SNP与重度紫杉醇介导PSN的相关性得到了广泛证实。对855例接受紫杉醇化疗乳腺癌患者的GWAS研究结果显示,rs7349683(EPHA5)在欧洲裔和非洲裔患者中均与2级以上PSN发生相关[15- 16]。Leandro-García等[8]在接受紫杉醇/卡铂的144例欧州裔癌症患者中筛选出rs17348202(EPHA4)、rs4141404(LIMK2)等与发生2级以上PSN相关的位点。Abraham等[9]对既往报道的紫杉醇介导2级以上PSN相关位点进行验证,发现rs3213619(ABCB1)和rs9501929(TUBB2A)等与紫杉醇PSN的相关性,且rs9501929(TUBB2A)曾被其他独立的验证队列报道[12]。然而,以上验证队列研究均只曾在非中国汉族人群中开展,目前尚缺乏关于中国汉族人群的相关风险SNP位点研究信息。其次,一些位点如前述的rs17348202(EPHA4)等,在dbSNP数据库中,在中国汉族人群中的MAF<0.05,显然这些位点不适合作为中国患者的标记物。
本研究选取了8个曾在GWAS研究中发现的与2级以上紫杉醇介导PSN可能相关,且在NCBI数据库中中国汉族人群MAF>0.05的SNP位点,通过在209例临床资料完善的患者中分析,发现了rs4141404A>C(LIMK2)与2级以上紫杉醇介导的PSN相关,该位点在加性模型、显性模型中均有显著统计学意义。虽然隐性模型中未达统计学意义,但考虑为纯合AA基因型者(n=5)过少所致。值得注意的是,rs9501929 C>T(TUBB2A)既往曾在两个独立的队列研究中得到验证[9,12],但本研究并未证实其与2级以上PSN的相关性,说明中国汉族人群的易感位点可能不同于其他人种。
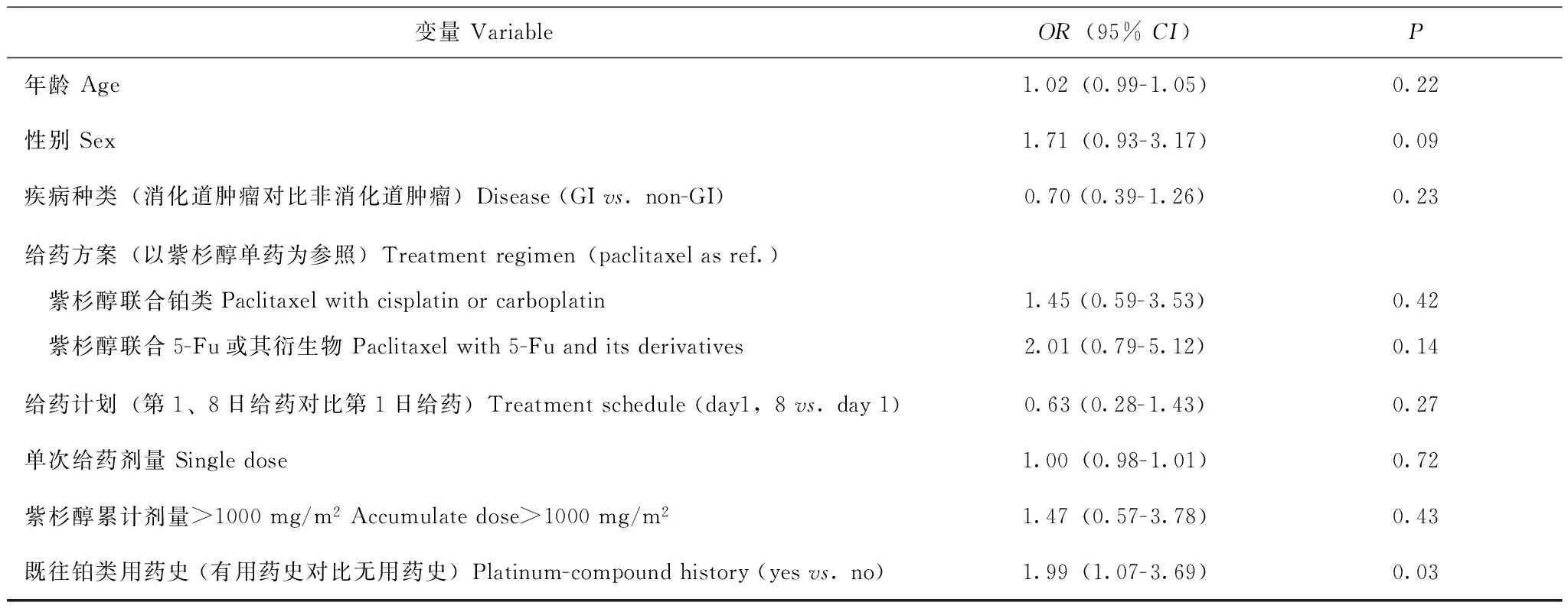
表 5 发生2/3级PSN的临床因素-单因素Logistic回归Table 5 Univariate Logistic regression of clinical variables for high risk of Grade 2/3 PSN
rs4141404位于22号染色体上LIMK2基因的3’非翻译区(3’UTR),LIMK2基因是一个蛋白编码基因。LIM激酶家族是参与肌动蛋白聚合和微管解聚的丝氨酸蛋白激酶[17]。在人体内,神经纤维瘤蛋白的GTP酶活化蛋白相关域(GTPase-activating protein related domain,GRD)表达可下调Rho-ROCK-LIMK2通路,通过调节肌动蛋白微丝动力,进而增强细胞运动性[18- 19]。近年来,有研究认为LIMK2表达与程序性坏死性神经元死亡相关[20- 21]。可以推测,rs4141404∶A>C可能通过影响信使RNA剪接、稳定性或蛋白折叠结构而发挥转录后调节功能,影响LIMK2表达,进而导致不同基因型患者具有不同的PSN易感性,这有赖于更进一步的体外或体内功能研究。
本研究初始纳入了216例患者,最终分析剔除了7名联用奥沙利铂或接受周疗方案的患者。原因如下:(1)奥沙利铂周围神经毒性较大[16,22],且在国外报道的紫杉醇介导PSN相关SNP研究中,如纳入联合铂类制剂的患者,往往纳入周围神经毒性相对较小的联合顺铂或卡铂方案[8,12],故最终分析剔除了紫杉醇联合奥沙利铂的患者。(2)目前关于周疗对比每3周1次的给药计划,何种方案更易引起较严重的PSN,研究结果不一[15,23- 24],本研究仅纳入了3例周疗患者,例数较少,在最终分析中剔除。此外,其余接受每3周1次化疗的患者中,有39例患者给药计划是第1、8日给药,这部分患者的临床特点中,其单次剂量按照第1、8日的剂量加和计算,但纳入了两种给药计划(第1、8日给药对比第1日给药)对PSN分级的影响分析。
临床特点方面,过去研究报导了一些可能导致2级以上紫杉醇介导PSN的临床病理因素,如年龄、既往接受神经毒性药物病史、糖尿病病史、自身免疫疾病病史等[4,15,25],但各研究结论不一,仅针对临床病理特点,目前尚无有效的严重紫杉醇介导PSN发生标记物[4,26- 29]。本研究纳入年龄、性别等9项临床病理因素,分析显示仅既往铂类用药史这一项临床特点显著与2/3级PSN相关。同时,化疗联用铂类制剂则未达统计学效应,这提示铂类制剂的累积神经毒性可能对PSN影响更大,符合既往报道的铂类制剂的毒性特点[30]。本研究部分患者的紫杉醇给药计划为第1、8日,其在多因素研究中显示出对发生2级以上PSN一定的保护效应(OR:0.40,95%CI:0.16~1.01,P=0.05),虽未达统计学意义,但可能是本身该给药计划的患者数目有限所致(共37例,占总分析患者17.7%),为临床实践中第1、8日给药计划提供了一定支持。此外,既往曾有研究报道紫杉醇累计剂量>1000 mg/m2与2级以上PSN相关[15- 16],本研究并未证实该结论,通过查阅原始引文发现,实际原作者也并未得出这一结论[29],与我们在临床观察中的经验类似,患者PSN多出现于2~4程化疗,如患者耐受良好,往往在剂量递增的过程中,患者依然可以耐受。本研究中出现3级PSN患者17例,平均出现3级毒性的紫杉醇累计剂量为425 mg/m2。故基因多态性而非药物累计剂量,在2/3级PSN发生中所起的作用更大。过去有研究认为年龄是影响PSN的危险因素,但近期有研究推翻了这一结论[26],在本研究的多因素分析中,年龄亦未达到统计学意义。
本研究的局限性在于,样本量不够大型,且多态性研究如果能够选取较多的候选基因位点,寻找有意义的单体型,则能够进行更具有效力的相关性研究。但本研究证实,中国汉族人群的紫杉醇相关PSN多态性位点分布可能与其他族裔人群有所不同,并在完善临床资料的前提下,筛选出了有意义的临床病理因素。
药物基因组学通过寻找有预测意义的基因多态性指导患者用药或预测风险发生,根据患者的个体情况来保证最大疗效的同时将不良反应降到最低,可以帮助探索合理的方法来优化药物治疗方案,实现个体化疗治疗。本研究希望能为中国汉族人群接受紫杉醇化疗者提供化疗引起的外周神经毒性相关易感SNP级临床信息,以指导方案选择及预后判断。
[1] Cavaletti G,Marmiroli P.Chemotherapy-induced peripheralneurotoxicity[J].Nat Rev Neurol,2010,6(12):657- 666.doi:10.1038/nrneurol.2010.160.
[2] Hershman DL,Lacchetti C,Dworkin RH,et al. Prevention and management of chemotherapy-induced peripheral neuropathy in survivors of adult cancers:American Society of Clinical Oncology clinical practice guideline[J].J Clin Oncol,2014,32(18):1941- 1967.doi:10.1200/JCO.2013.54.0914.
[3] Crown J,O’Leary M.The taxanes:an update[J].Lancet,2000,355(9210):1176- 1178.doi:10.1016/S0140-6736(00)02074- 2.
[4] Argyriou AA,Koltzenburg M,Polychronopoulos P,et al. Peripheral nerve damage associated with administration of taxanes in patients with cancer[J].Crit Rev Oncol Hematol,2008,66(3):218- 228.doi:10.1016/j.critrevonc.2008.01.008.
[5] Majithia N,Temkin SM,Ruddy KJ,et al. National Cancer Institute-supported chemotherapy-induced peripheral neuropathy trials:outcomes and lessons[J].Support Care Cancer,2016,24(3):1439- 1447.doi:10.1007/s00520- 015- 3063- 4.
[6] Cavaletti G,Alberti P,Marmiroli P.Chemotherapy-induced peripheral neurotoxicity in the era of pharmacogenomics[J].Lancet Oncol,2011,12(12):1151- 1161.doi:10.1016/S1470- 2045(11)70131- 0.
[7] Baldwin RM,Owzar K,Zembutsu H,et al. A genome-wide association study identifies novel loci for paclitaxel-induced sensory peripheral neuropathy in CALGB 40101[J].Clin Cancer Res,2012,18(18):5099- 5109.doi:10.1158/1078- 0432. CCR- 12- 1590.
[8] Leandro-García LJ,Inglada-Pérez L,Pita G,et al. Genome-wide association study identifies ephrin type A receptors implicated in paclitaxel induced peripheral sensory neuropathy[J].J Med Genet,2013,50(9):599- 605.doi:10.1136/jmedgenet- 2012- 101466.
[9] Abraham JE,Guo Q,Dorling L,et al. Replication of genetic polymorphisms reported to be associated with taxane-related sensory neuropathy in patients with early breast cancer treated with paclitaxel[J].Clin Cancer Res,2014,20(9):2466- 2475.doi:10.1158/1078- 0432.CCR- 13- 3232.
[10] Kanai M,Kawaguchi T,Kotaka M,et al. Large-scale prospective pharmacogenomics study of oxaliplatin-induced neuropathy in colon cancer patients enrolled in the JFMC41- 1001-C2(JOIN Trial)[J].Ann Oncol,2016,27(6):1143- 1148.doi:10.1093/annonc/mdw074.
[11] Hertz DL.Germline pharmacogenetics of paclitaxel for cancer treatment[J].Pharmacogenomics,2013,14(9):1065- 1084.doi:10.2217/pgs.13.90.
[12] Leandro-Garcia LJ,Leskela S,Jara C,et al. Regulatory polymorphisms in-tubulin IIa are associated with paclitaxel-induced peripheral neuropathy[J].Clin Cancer Res,2012,18(16):4441- 4448.doi:10.1158/1078- 0432.CCR- 12- 1221.
[13] Chang CC,Chow CC,Tellier LC,et al. Second-generation PLINK:rising to the challenge of larger and richer datasets[J].Gigascience,2015,4:7.doi:10.1186/s13742- 015- 0047- 8.
[14] R Development Core Team.R:a language and environment for statistical computing.Vienna,Austria:the R foundation for statistical computing[CP].ISBN:3- 900051- 07- 0. http://www.R- project.org/.
[15] Argyriou AA,Kyritsis AP,Makatsoris T,et al. Chemotherapy-induced peripheral neuropathy in adults:a comprehensive update of the literature[J].Cancer Manag Res,2014,6:135- 147.doi:10.2147/CMAR.S44261.
[16] Grisold W,Cavaletti G,Windebank AJ.Peripheral neuropathies from chemotherapeutics and targeted agents:diagnosis,treatment,and prevention[J].Neuro Oncol,2012,14(Suppl 4):iv45-iv54.doi:10.1093/neuonc/nos203.
[17] Bernard O.Lim kinases,regulators of actin dynamics[J].Int J Biochem Cell Biol,2007,39(6):1071- 1076.doi:10.1016/j.biocel.2006.11.011.
[18] Ozawa T,Araki N,Yunoue S,et al. The neurofibromatosis type 1 gene product neurofibromin enhances cell motility by regulating actin filament dynamics via the Rho-ROCK-LIMK2-cofilin pathway[J].J Biol Chem,2005,280(47):39524- 39533.doi:10.1074/jbc.M503707200.
[19] Starinsky-Elbaz S,Faigenbloom L,Friedman E,et al. The pre-GAP-related domain of neurofibromin regulates cell migration through the LIM kinase/cofilin pathway[J].Mol Cell Neurosci,2009,42(4):278- 287.doi:10.1016/j.mcn.2009.07.014.
[20] Ko AR,Hyun HW,Min SJ,et al. Endothelin- 1 induces LIMK2-mediated programmed necrotic neuronal death independent of NOS activity[J].Mol Brain,2015,8:58.doi:10.1186/s13041- 015- 0149- 3.
[21] Kim JE,Ryu HJ,Kim MJ,et al. LIM kinase- 2 induces programmed necrotic neuronal death via dysfunction of DRP1-mediated mitochondrial fission[J].Cell Death Differ,2014,21(7):1036- 1049.doi:10.1038/cdd.2014.17.
[22] McWhinney SR,Goldberg RM,McLeod HL.Platinum neurotoxicity pharmacogenetics[J].Mol Cancer Ther,2009,8(1):10- 16.doi:10.1158/1535- 7163.MCT- 08- 0840.
[23] Alsharedi M,Gress T,Dotson J,et al. Comparison of toxicity profile and tolerability between two standard of care paclitaxel-based adjuvant chemotherapy regimens in breast cancer[J].Med Oncol,2016,33(3):27.doi:10.1007/s12032- 016- 0740- 1.
[24] Loesch D,Greco FA,Senzer NN,et al. PhaseⅢ multicenter trial of doxorubicin plus cyclophosphamide followed by paclitaxel compared with doxorubicin plus paclitaxel followed by weekly paclitaxel as adjuvant therapy for women with high-risk breast cancer[J].J Clin Oncol,2010,28(18):2958- 2965.doi:10.1200/JCO.2009.24.1000.
[25] Hershman DL,Till C,Wright JD,et al. Comorbidities and risk of chemotherapy-induced peripheral neuropathy among participants 65 years or older in Southwest Oncology Group Clinical Trials[J].J Clin Oncol,2016,34(25):3014- 3022.doi:10.1200/JCO.2015.66.2346.
[26] Argyriou AA,Polychronopoulos P,Koutras A,et al. Is advanced age associated with increased incidence and severity of chemotherapy-induced peripheral neuropathy[J].Support Care Cancer,2006,14(3):223- 229.doi:10.1007/s00520- 005- 0868- 6.
[27] Mauri D,Kamposioras K,Tsali L,et al. Overall survival benefit for weeklyvs.three-weekly taxanes regimens in advanced breast cancer:A meta-analysis[J].Cancer Treat Rev,2010,36(1):69- 74.doi:10.1016/j.ctrv.2009.10.006.
[28] Fountzilas G,Dafni U,Dimopoulos MA,et al. A randomized phase Ⅲ study comparing three anthracycline-free taxane-based regimens,as first line chemotherapy,in metastatic breast cancer[J].Breast Cancer Res Treat,2008,115(1):87- 99.doi:10.1007/s10549- 008- 0047- 9.
[29] Lee JJ,Swain SM.Peripheral neuropathy induced by microtubule-stabilizing agents[J].J Clin Oncol,2006,24(10):1633- 1642.doi:10.1200/JCO.2005.04.0543.
[30] Avan A,Postma TJ,Ceresa C,et al. Platinum-induced neurotoxicity and preventive strategies:past,present,and future[J].Oncologist,2015,20(4):411- 432.doi:10.1634/theoncologist.2014- 0044.
SingleNucleotidePolymorphismsofPaclitaxel-inducedPeripheralSensoryNeuropathyinChineseHanPopulation
DOU Xuelin1,MAI Yulin2,SUN Zhao1,WANG Yingyi1,SHAO Yajuan1,CHENG Yuejuan1,ZHOU Na1,LUO Fei1,ZHANG Biao3,BAI Chunmei1,MA Shuiqing4
1Department of Medical Oncology,PUMC Hospital,CAMS and PUMC,Beijing 100052,China2Department of Medicine,PUMC Hospital,CAMS and PUMC,Beijing 100730,China3Department of Epidemiology and Health Statistics,Institute of Basic Medicine Science,CAMS and PUMC,Beijing 100005,China4Department of Obstetrics and Gynecology,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
BAI Chunmei Tel:010- 69158315,E-mail:baichunmei1964@163.com;
ObjectiveTo study the single nucleotide polymorphisms (SNPs)that predict a patient’s risk of grade 2- 3 paclitaxel-induced peripheral sensory neuropathy (PSN) in Chinese Han populations.MethodsTotally 216 patients
paclitaxel in Peking Union Medical College Hospital from May 2014 to December 2016 were enrolled.DNA was isolated from peripheral blood.Genotyping for eight candidate SNPs was performed on Sequenom-MassARRARYiPLEX platform.Patients were followed up and PSN was assessed by trained physicians according to National Cancer Institute-Common Terminology Criteria for Adverse Events v4.03.ResultsA total of 209 patients entered the final analysis.Among the candidate SNPs,only rs4141404∶A>C(LIMK2) was significantly associated with grade 2/3 PSN (OR:4.32,95%CI:2.37- 7.89,P<0.0001).In multivariate logistic regression analysis,both rs4141404∶A>C(LIMK2) and history of receiving platinum compound (OR:2.70,95%CI:1.32- 5.51,P=0.007) were associated with grade 2/3 PSN.Conclusionrs4141404∶A>C(LIMK2) may be the markers of risk of grade 2/3 PSN.
paclitaxel;peripheral sensory neuropathy;toxicity of chemotherapy;Chinese Han population
国家自然科学基金(81472785、61435001)和北京协和医学院研究生创新基金Supported by the National Natural Sciences Foundation of China(81472785,61435001) and the Graduate Student Innovation Fund of Peking Union Medical College
白春梅 电话:010- 69158315,电子邮件:baichunmei1964@163.com; 马水清 电话:010- 69155637,电子邮件:mashuiqing1964@163.com
R730.53
A
1000- 503X(2017)05- 0593- 09
10.3881/j.issn.1000- 503X.2017.05.001
MA Shuiqing Tel:010- 69155637,E-mail:mashuiqing1964@163.com
ActaAcadMedSin,2017,39(5):593-601
2017- 02- 17)

