FOXC2对卵巢癌血管生成及作用机制的研究
周英姿 赵学军 徐锦屏 王小婕
FOXC2对卵巢癌血管生成及作用机制的研究
周英姿 赵学军 徐锦屏 王小婕
目的探讨叉头框C2(forkhead box C2,FOXC2)对人卵巢癌肿瘤血管生成及作用机制。方法应用FOXC2慢病毒基因转染技术,将FOXC2-LV和空载体基因分别转染到人卵巢癌A2780细胞株。细胞分为未转染组、空载体组和FOXC2过表达组。Matrigel基质胶血管形成实验和Transwell小室检测各组细胞上清作用下人脐静脉内皮细胞(HUEVCs)成管能力和迁移能力的变化。RT-PCR检测各组细胞FOXC2、DLL4/Notch1、内皮细胞粘附分子(Platelet endothelial cell adhesion molecule-1,CD31)和基质金属蛋白酶2(matrix metalloproteinase-2,MMP2) mRNA表达,Western blot检测各组细胞FOXC2、DLL4/Notch1、CD31和MMP2蛋白表达。结果FOXC2过表达组A2780细胞上清诱导HUEVCs闭合小管数和迁移细胞数均显著高于未转染组、空载体组(P<0.05)。FOXC2过表达组DLL4/Notch1、CD31和MMP2 mRNA表达水平均显著高于未转染组和空载体组(P<0.05)。FOXC2过表达组DLL4/Notch1、CD31和MMP2 mRNA蛋白表达水平均显著高于未转染组和空载体组(P<0.05)。结论FOXC2可能通过上调 DLL4/Notch1、CD38及MMP2表达促进HUEVCs成管能力和迁移能力,影响卵巢癌发展。
FOXC2;卵巢癌;肿瘤;血管生成;作用机制
(ThePracticalJournalofCancer,2017,32:1591~1595)
随着肿瘤基因学研究的发展,诸多报道称[1-3],部分基因及蛋白可调控促血管和抑血管生成因子表达,直接影响卵巢癌等恶性肿瘤发生、发展及转移。FOXC2叉头框C2(Forkhead box C2,FOXC2)作为1种翼状螺旋/FOX蛋白,进化上有高度保守性,编码蛋白结构包含494个氨基酸残基,可调控血管生成、机体组织器官代谢、正常细胞或肿瘤细胞增殖及凋亡、干细胞分化发育和肿瘤细胞迁移浸润等[4-6],但关于该基因对于卵巢癌血管生成影响及作用机制尚未有清晰结论。本文通过慢病毒转染获取高表达FOXC2人卵巢癌A2780细胞,旨在观察FOXC2对内皮祖细胞(endothelial progenitor cells,EPCs)迁移和血管形成能力影响和探讨其作用机制。
1 材料与方法
1.1 细胞株、主要试剂及仪器
人卵巢癌A2780细胞株购自中国科学院上海细胞库,人脐静脉内皮细胞购自上海赛齐生物工程有限公司,FOXC2慢病毒购自上海吉凯基因有限公司,逆转录试(RT-PCR)剂盒购自日本TaKaRa公司,山羊抗人FOXC2和DLL4均购自美国Sigma公司,兔抗人Notch1、兔抗人CD31和兔抗人MMP2多克隆抗体均购自美国Abcam公司,HRP标记兔抗羊IgG二抗购自北京索莱宝科技有限公司,HRP标记羊抗兔IgG二抗购自南京生兴生物技术有限公司,ChampGel全自动凝胶成像分析仪购自北京赛智创业科技有限公司,9703型梯度PCR仪购自中国赛飞有限公司,DU640RNA/蛋白定量仪购自美国贝克曼库尔特公司,霍夫曼相衬倒置显微镜DYS-810购自德国(中国)霍夫曼公司,奥林巴斯CX23荧光显微镜购自日本奥林巴斯公司。
1.2 细胞培养和分组
A2780细胞和HUVECs分别置于含10%胎牛血清RPMI-1640培养基内,于37 ℃、5%CO2条件下培养,2 d换液1次。A2780细胞传2代,4 d/代,1∶2传代,HUVECs传2代,4 d/代,1∶3传代。倒置相差显微镜下观察细胞形态学,待细胞融合至80%时,细胞培养密度≥90%,台盼蓝测定活细胞率≥95%时。分别取5 μl细胞液分为未转染组、空载体组和FOXC2过表达组。
1.3 FOXC2慢病毒转染A2780细胞
根据上海吉凯基因有限公司提供的Lentiviral Vector Particle使用手册将FOXC2慢病毒质粒(FOXC2-LV)转入A2780细胞,设为FOXC2过表达组,同时将空载体质粒(GFP-LV)转入A2780细胞,设为空载体组,而将未转染细胞设为未转染组。取各组生长状态良好的A2780细胞,胰酶消化并计数,调整细胞密度4×104个/孔,接种于24孔培养板内,每组均设3个复孔。培养板置于37 ℃、5%CO2下培养,待细胞融合至40%左右时,按照感染复数(MOI)=20分别滴入30%体积指数FOXC2-LV和GFP-LV液,滴入Polybrene病毒感染增强剂培养12 h后,再更换新培养基继续培养24 h,置于荧光显微镜下观察细胞绿色荧光蛋白表达;根据H.Liu等研究结果[8],于转染72h后观察,待细胞消化后置于培养瓶内扩大培养。上镜观察、计算细胞转染率。转染率=(绿色细胞数/细胞总数)×100%。
1.4基质胶血管形成实验
取各组细胞液3 ml,调整细胞密度5×105ml/孔后接种于培养瓶内,37 ℃、5%CO2培养72 h后收集上清液;将 Matrigel基质胶和RPMI-1649培养基按照1∶9比例混合,轻晃均匀后按照40 μL/孔加入96孔板内,置于37 ℃培养过夜备用。取HUVECs调整至3×103个/孔接种于96孔板中,每组均设置5个复孔,培养3 d后,置于倒置显微镜下观察、照相,任取10个视野拍照,计数成管数。
1.5 体外迁移实验
消化后HUVECs内滴入RPMI-1649培养基重悬至5×105/mL,Transwell小室上室滴入0.4 ml细胞重悬液,下室滴入0.6 mL相应肿瘤上清,37 ℃、5%CO2培养12 h后,置于倒置显微镜下,观察迁移上室至下室细胞数量、形态,取出小室后吸去上室液体后,棉签擦去上室细胞,滴入4%多聚甲醛固定约20 min及苏木精染色3 h后置于载玻片上,中性树胶封片,×400倍光镜观察,随机选取10个视野计数,计算平均值,重复实验3次。
1.6 PCR法测定FOXC2、DLL4/Notch1、CD31和MMP2 mRNA表达
Trizol法提取3组细胞总RNA,逆转录为cDNA,操作方法按照逆转录实验盒说明书执行。FOXC2、DLL4/Notch1、CD31和MMP2引物设计及扩增条件如表1所示,反应体系:SYBR®Premix Ex TaqTM II(2×)10 μl,PCR Forward Primer(10 μM)0.8 μl,Uni-miR qPCR Primer(10 μM)0.8 μl,ROX Reference Dye(50×)0.4 μl,cDNA模板溶液2 μl,dH 206 μl,添加蒸馏水至20 μl。扩增条件:94 ℃预变性4 min,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共循环32次,72 ℃最终延伸7 min。引物电泳后使用Bio-rad成像系统拍照采集图像,使用ImageJ分析软件测定条带灰度值即A值,以GAPDH为参考值,计算各基因mRNA相对表达,重复实验3次取平均值。
1.7 Western blot测定FOXC2、DLL4/Notch1、CD31和MMP2蛋白表达
使用细胞裂解液(RIPA)提取细胞蛋白,操作按照试剂盒附带说明书执行,BCA法测定蛋白浓度,操作按照试剂盒附带说明书执行,Bio-rad凝胶成像系统采集蛋白电泳图像,Quantity one图像分析软件定量分析FOXC2、DLL4/Notch1、CD31和MMP2蛋白表达即A值,以β-action为内参,计算各基因及信号通路蛋白相对表达,重复实验3次取平均值。

表1 引物序列设计及扩增条件
1.8 统计学方法
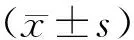
2 结果
2.1 A2780细胞FOXC2转染效率
转染72 h后,FOXC2质粒和空载体质粒转染A2780细胞均显示绿色荧光,空载体组转染率为88.94%,FOXC2过表达组转染率为82.23%,两组差异无统计学意义(χ2=2.25,P=0.119>0.05)。
2.2 各组A2780细胞上清液促进HUVECs成管能力测定结果
培养72 h后,FOXC2过表达组小管样结构为(11.82±1.86)个,空载体组为(4.42±1.19)个,未转染组为(4.64±1.16)个,FOXC2过表达组小管样结构数高于未转染组和空载体组,差异具有统计学意义(F=7.923,P=0.0024<0.01)。
2.3 各组A2780细胞上清液对HUVECs迁移能力的影响
培养72 h后,FOXC2过表达组迁移细胞数为(167.62±6.85)个,未转染组为(104.02±5.68)个,空载体组为(105.35±7.52)个,FOXC2过表达组迁移细胞数高于未转染组和空载体组,差异具有统计学意义(F=6.204,P=0.0062<0.01)。
2.4 各组A2780细胞FOXC2、DLL4、Notch1、CD31和MMP2 mRNA相对表达比较
FOXC2过表达组FOXC2、DLL4、Notch1、CD31和MMP2 mRNA相对表达水平均高于未转染组和空载体组,差异具有统计学意义(P<0.05),见表2和图1。
2.5 各组A2780细胞FOXC2、DLL4、Notch1、CD31和MMP2蛋白相对表达比较
FOXC2过表达组FOXC2、DLL4、Notch1、CD31和MMP2蛋白相对表达水平,均高于未转染组和空载体组,差异具有统计学意义(P<0.05),见表3和图2。
3 讨论
Lin等研究证实[7],FOXC2作为上皮间质转化(epithelial-mesenchymal transition,EMT)诱导因子之一,能够上调上皮标志物E-cadherin表达,并引导乳腺肿瘤上皮细胞去分化及转移。Imayama等[8]通过分析FOXC2加减(+/-)剂量和肿瘤血管生成间的关系得出,FOXC2+剂量可促使肿瘤血管快速生产及发育,而FOXC2-剂量则可致血管生成障碍及生长速度下调。权原等报道称[9],上调EPCs内FOXC2表达,可促使正常血管损伤修复。基于此,因此,我们选择FOXC2做为研究影响卵巢癌肿瘤血管生成机制的靶向因子。
表2 各组FOXC2、DLL4、Notch1、CD31和MMP2 mRNA相对表达水平比较
注:与未转染组比较,*为P<0.05,**为P<0.01;与空载组比较,#为P<0.05,##为P<0.01。
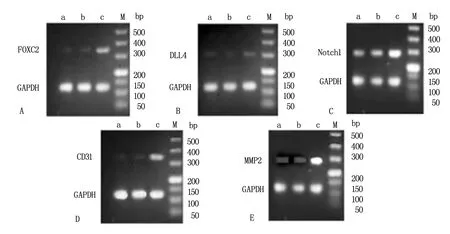
A为未转染组;b为空载体组;c为FOXC2过表达组。
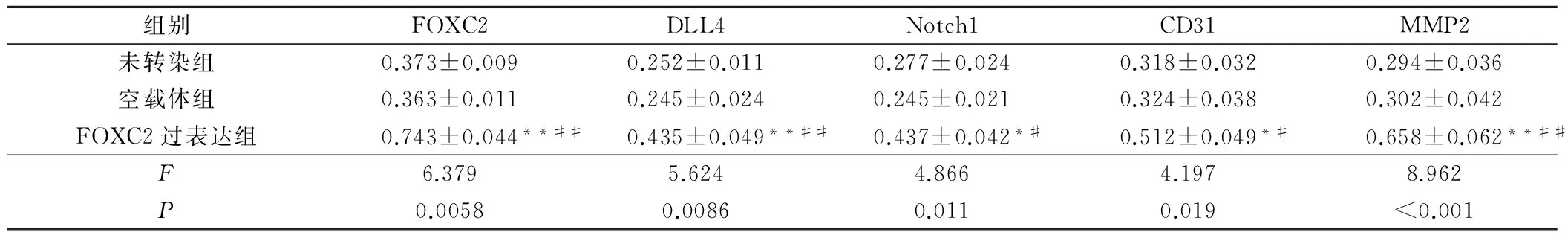
组别FOXC2DLL4Notch1CD31MMP2未转染组0.373±0.0090.252±0.0110.277±0.0240.318±0.0320.294±0.036空载体组0.363±0.0110.245±0.0240.245±0.0210.324±0.0380.302±0.042FOXC2过表达组0.743±0.044**##0.435±0.049**##0.437±0.042*#0.512±0.049*#0.658±0.062**##F6.3795.6244.8664.1978.962P0.00580.00860.0110.019<0.001
注:与未转染组比较,*为P<0.05,**为P<0.01;与空载组比较,#为P<0.05,##为P<0.01。
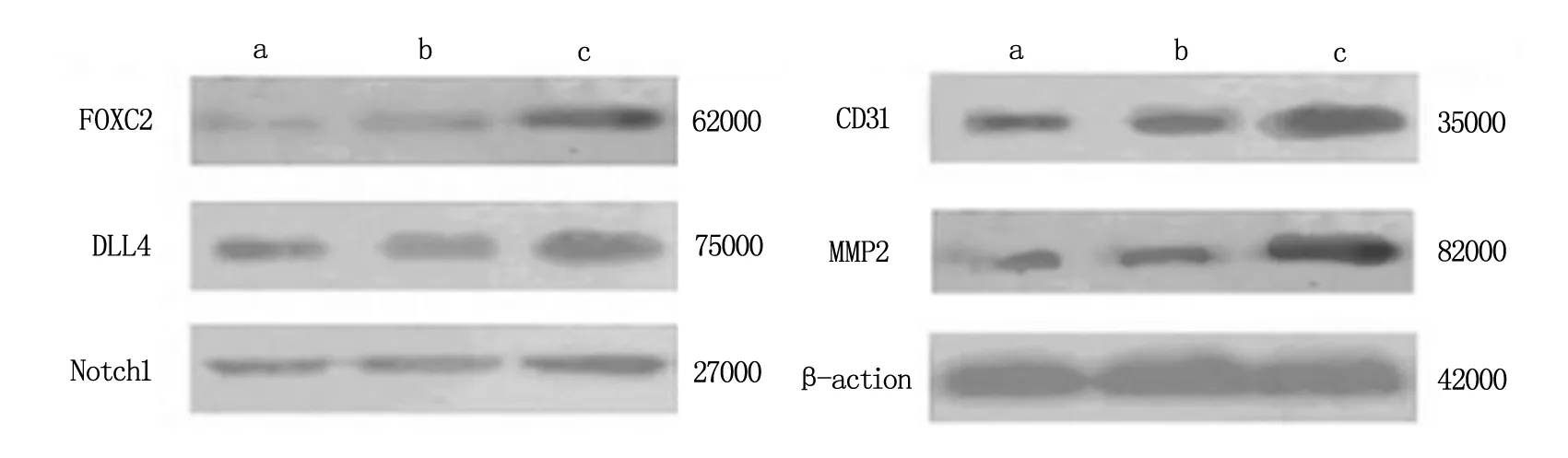
a为未转染组;b为空载体组;c为FOXC2过表达组。
在本研究中,我们选择FOXC2慢病毒质粒和空载体质粒转染经体外分离培养的A2780细胞,转染结果显示,空载体组转染率和FOXC2过表达组转染率差异无统计学意义(P>0.05),证明研究选用转染后的A2780细胞符合实验要求。相关文献显示[10],FOXC2激活、诱导趋化因子受体4(CXCR4) 和整合素-β3启动子转录,引导肿瘤血管生成,并可作为重要的诱导因子启动上皮细胞与间充质间的转化过程,从而开启和促进肿瘤侵袭、转移。在本研究中,笔者选择不同质粒转染或未转染A2780细胞上清液干扰HUVECs成管能力,结果显示,FOXC2过表达组小管样结构数显著高于未转染组和空载体组(P<0.01),这表明FOXC2可促进HUVECs生成新血管和淋巴管,刺激卵巢癌肿瘤生长。Herrera等通过研究乳腺癌细胞株可得[11],FOXC2表达增强可提高肿瘤侵袭和转移能力,在本研究中,FOXC2过表达组迁移细胞数显著高于未转染组和空载体组(P<0.01),结果符合其结论,这表明FOXC2异常表达可能和卵癌细胞向远处侵袭和转移相关。
DLL4和Notch1在具有高度进化保守特征的Notch信号通路重互为配体和受体,DLL4通过结合Notch1,启动前者转录和翻译而上调其表达,并和更多的Notch1结合,决定胎血管向动脉血管或静脉血管分化。Kashatus等[12]研究表明DLL4及其下游靶点Hey基因变异,可致内皮细胞内ephrin-B2表达下降,从而诱发小鼠卵巢癌肿瘤血管重构严重缺陷。在本研究中,FOXC2过表达组FOXC2、DLL4、Notch1 mRNA及蛋白相对表达均高于未转染组和空载体组(P<0.05),这表明FOXC2和DLL4、Notch1 mRNA及蛋白同时高表达时,卵巢癌肿瘤细胞影响下的HUVECs成管能力及向远处转移能力显著得到增强,我们认为FOXC2可能通过Notch信号通路影响卵巢癌等肿瘤血管生成、生长。
Wang等[13]用小干扰RNA(small interfering RNA,siRNA)抑制FOX家族成员FOXM1表达,可显著下调血管内皮标志物MMP2及内皮细胞组织标志物CD31等表达,证明FOXM1可能是治疗胰腺癌的新靶点。我们认为作为同属FOX家族成员的FOXC2也可能具有相同属性,本研究结果显示,FOXC2过表达组FOXC2、CD31和MMP2 mRNA和蛋白相对表达均高于未转染组和空载体组(P<0.05),表明上调FOXC2表达也可提高CD31和MMP2表达,从而刺激卵巢癌肿瘤细胞新血管生成能力,促使肿瘤生长,基于该实验结果提示FOXC2也可能是卵巢癌治疗新基因靶点。
综上所述,高表达FOXC2可促使卵巢癌肿瘤血管生成及肿瘤迁移,其作用机制可能通过上调DLL4/Notch1信号通路及CD31和MMP2表达实现。
[1] 刘 红.FOXC2调控DLL4/Notch1信号通路对乳腺癌血管生成的影响〔C〕.第六届/中-法(国际)乳腺癌高级学术论坛,2014.
[2] 屈洪波,吴诚义,范原铭,等.沉默FOXC2对TGF-β1诱导的MCF-7细胞上皮-间质转化的逆转作用〔J〕.中国病理生理杂志,2013,29(5):850-856.
[3] 郑春花.转录因子FOXC2在宫颈癌发生的研究〔D〕.吉林大学,2014.
[4] 冯 硕.FOXC2在宫颈癌组织中的表达及其临床意义〔D〕.吉林大学,2014.
[5] Koo HY,Shim KS,Liu T,et al.Abstract 18384:Hypoxia-Induced FOXC2 Expression in Human Endothelial Cells is Dependent on the MEK and PI3K Pathways〔J〕.Circulation,2013,6(22):18384.
[6] Sasahira T,Ueda N,Yamamoto K,et al.Prox1 and FOXC2 Act as Regulators of Lymphangiogenesis and Angiogenesis in Oral Squamous Cell Carcinoma〔J〕.Plos One,2014,9(3):92534-92534.
[7] Lin Y,Mckinnon KE,Ha SW,et al.Inorganic phosphate induces cancer cell mediated angiogenesis dependent on forkhead box protein C2(FOXC2) regulated osteopontin expression〔J〕.Molecular Carcinogenesis,2015,54(9):926-934.
[8] Imayama N,Yamada SI,Yanamoto S,et al.FOXC2 expression is associated with tumor proliferation and invasion potential in oral tongue squamous cell carcinoma〔J〕.Pathol Oncol Res,2015,21(3):783-791.
[9] 权 原.胚胎性转录因子FOXC2调控卵巢癌细胞增殖与侵袭的作用机制研究〔D〕.吉林大学,2015.
[10] Lathia JD,Mack SC,Mulkearnshubert EE,et al.Cancer stem cells in glioblastoma.〔J〕.Genes Dev,2015,29(12):1203-1217.
[11] Herrera AC,Victorino VJ,Campos FC,et al.Impact of tu-
mor removal on the systemic oxidative profile of patients with breast cancer discloses lipid peroxidation at diagnosis as a putative marker of disease recurrence〔J〕.Clin Breast Cancer.,2014,14(6):451-459.
[12] Kashatus J,Nascimento A,Myers L,et al.Erk2 Phosphorylation of Drp1 Promotes Mitochondrial Fission and MAPK-Driven Tumor Growth〔J〕.Molecular Cell,2015,57(3):537-551.
[13] Wang ZQ,Bachvarova M,Morin C,et al.Role of the polypeptide N-acetylgalactosaminyltransferase 3 in ovarian cancer progression:possible implications in abnormal mucin O-glycosylation〔J〕.Oncotarget,2014,5(2):544-560.
EffectofFOXC2onAngiogenesisandProliferationofOvarianCancerandItsMechanism
ZHOUYingzi,ZHAOXuejun,XUJinbing,etal.
ShanghaiChangningDistrictMaternalandChildHealthCareHospital,Shanghai,200051
ObjectiveTo investigate the effect of box C2 C2(FOXC2) on the angiogenesis and the mechanism of tumor angiogenesis in human ovarian cancer.MethodsFOXC2-LV and empty vector were transfected into human ovarian cancer cell line A2780 by gene transfer technique.The cells were divided into non transfection group,empty vector group and FOXC2 over expression group.Matrigel Matrigel angiogenesis assay and Transwell assay of human umbilical vein endothelial cells cell supernatant effect(HUEVCs) changes of tube capability and migration capability.The expression levels of mRNA of FOXC2,DLL4/Notch1,detectendothelial cell adhesion molecules(Platelet endothelial cell adhesion molecule-1,CD31) and matrix metalloproteinase 2(matrix,metalloproteinase-2,MMP2) in cells of each group were detected by RT-PCR,Western expression of blot cells were detected with the expression levels of protein of FOXC2,DLL4/Notch1,CD31 and MMP2 in cells of each group were detected by western blot.ResultsThe number and number of HUEVCs cells in A2780 cells of FOXC2 over expression group were significantly higher than those of non transfection group and empty vector group(P<0.05).The expression levels of mRNA of FOXC2,DLL4/Notch1,CD31 and MMP2 in FOXC2 over expression group were significantly higher than those of non transfection group and empty vector group(P<0.05).The protein expressions levels of FOXC2,DLL4/Notch1,CD31 and MMP2 in FOXC2 over expression group were significantly higher than those of non transfection group and empty vector group(P<0.05).ConclusionFOXC2 may promote expression levels of DLL4/Notch1,CD38 and HUEVCs by up regulating the MMP2 tube forming ability and migration ability,and affect the development of ovarian cancer.
FOXC2;Ovarian cancer;Tumor;Angiogenesis;Mechanism of action
200051 上海市长宁区妇幼保健院
10.3969/j.issn.1001-5930.2017.10.008
R737.31
A
1001-5930(2017)10-1591-05
2016-09-08
2017-04-25)
(编辑吴小红)

