颈动脉支架术对血流动力学的急性影响
熊洪亮,车武强,蒋雄京,邹玉宝,董徽,王鹏,刘加林
颈动脉支架术对血流动力学的急性影响
熊洪亮,车武强,蒋雄京,邹玉宝,董徽,王鹏,刘加林
目的:调查颈动脉支架术(CAS)对血流动力学的急性影响。
方法:回顾性分析我院2014-09至2015-09期间连续170例CAS患者围术期资料,调查跨颈内动脉近端支架置入对血压、心率的急性影响,并随访1个月,观察其与围术期不良事件发生的关系。
结果:(1)与术前相比,颈动脉支架置入后全天平均收缩压从126.6±15.1(93~175)mmHg(1mmHg=0.133kPa)下降为 117.7±13.7(87~158)mmHg(P<0.01),全天平均舒张压从 72.8±11.5(49~100)mmHg 下降为 67.3±10.3(48~90)mmHg(P<0.01);全天平均心率由 66.3±6.8(49~84)次 /min下降为 62.6±7.2(49~88)次 /min(P<0.01)。(2)血流动力学不稳定(HI)发生率为51.8%(88/170),其中高血压、低血压和心动过缓的发生率分别为3.5%(6/170)、39.4%(67/170)和22.4%(38/170)。多因素回归分析发现HI的发生与性别、高血压病史、双侧CAS及颈动脉分叉病变关系密切。HI发生后,通过静脉输注血管活性药物血压、心率均可恢复正常水平,其中6例(3.5%)用药时间超过24小时。(3)围术期共有8例(4.7%)患者出现不良事件,包括4例短暂性脑缺血发作、2例小卒中和2例大卒中(其中1例死亡)。非HI患者发生不良事件的比例为2.4%(2/82),HI患者为6.8%(6/88),两者相比,P值为0.32。HI患者中高血压、低血压、心动过缓及低血压合并心动过缓发生不良事件的比例分别为16.7%(1/6)、6.8%(3/44)、0%(0/15)和8.7%(2/23),与整体患者相比,P值分别为0.669、0.723、0.793和0.658。
结论:CAS围术期HI患者发生比例较高,性别、高血压病史、双侧CAS和颈动脉分叉病变是其独立预测因素;及时合理地使用血管活性药物对于预防或者减少HI相关不良事件的发生意义重大。
颈动脉支架术;血流动力学;术后并发症
颈动脉狭窄是缺血性脑卒中的常见病因,20%~30%缺血性脑卒中由颈动脉狭窄引起[1]。在过去的几十年里,颈动脉内膜剥脱术(CEA)为治疗颅外颈动脉狭窄的金标准。近年来随着介入器械不断地进步,颈动脉支架术(CAS)在临床上使用越来越广泛,多项临床随机对照试验表明[2,3],CAS与CEA在安全性及近远期疗效方面没有显著的差异,CAS可作为CEA理想的替代治疗选择,特别是对于CEA高危的患者。
血流动力学不稳定(HI)包括高血压、低血压和心动过缓,是CAS围术期十分常见的现象,其发生可能与年龄、性别、吸烟、糖尿病、狭窄程度以及狭窄部位等多种因素有关[4]。目前虽然有部分研究表明HI会增加不良事件的发生[5,6],但其与不良事件关系究竟如何,在临床上依然存在较大争议。本研究的主要目的是分析CAS围术期HI的发生率、影响因素及其与不良事件发生的关系,以期为临床工作提供参考。
1 资料与方法
1.1 研究对象
诊断为颈动脉粥样硬化性狭窄,且符合以下标准的患者行CAS:(1)无症状性颈动脉狭窄率≥80%,症状性颈动脉狭窄率≥60%,狭窄率计算方法参照北美症状性颈动脉狭窄动脉内膜切除术试验(NASCET)的标准[7];(2)颈动脉解剖适合行CAS。排除标准:(1)病情不稳定,不能耐受介入治疗;(2)慢性完全闭塞病变;(3)造影剂严重过敏;(4)3个月内有严重的卒中史。2014-09至2015-09期间共有245例患者行CAS,最终纳入符合标准的跨颈内动脉近端支架置入患者共170例 (134例行单侧CAS,36例行双侧CAS)。
1.2 术前准备
术前采用弓上动脉计算机断层扫描血管造影(CTA) 或颈部超声评估颈动脉狭窄程度,颅脑CT平扫评估脑部情况。术前常规使用阿司匹林(100 mg/d)和氯吡格雷(75 mg/d)至少2天,如果手术当天开始用药,则给予半负荷剂量氯吡格雷(150 mg)。适当减少β阻滞剂或非二氢吡啶类钙拮抗剂用量,维持基础心率>60次/min。长效降压药调整为短效降压药,另外根据患者血压水平适当地减少或停用降压药,使血压维持在140/90 mmHg(1 mmHg=0.133 kPa)左右。对于精神紧张焦虑的患者,可给予少量的镇静药物。
1.3 CAS和相关用药
所有患者均为股动脉路径入路,穿刺点局部麻醉。采用改良的Seldinger穿刺技术置入下肢鞘,经鞘管一次性注入普通肝素50 mg(若手术时间超过1h,则经静脉追加20 mg肝素),建立动脉内压力监测,评估术中血压、心率。先行主动脉弓、颈动脉和脑血管造影,了解弓上动脉全貌以及颈动脉狭窄情况。在超滑导丝引导下推送指引导管头端接近病变,不同类型的主动脉弓插管方法详见沈松鹤等[8]研究。插管成功后将栓塞保护装置释放于病变远端4~5 cm处,使用的栓塞保护装置主要有FilterWire EZ(美国Boston Scientific公司)和Spider RX(美国EV3公司),少数病变使用MOMA近端保护装置(意大利Invatec公司)。首先使用球囊(直径均为4.0 mm,长度为20~40 mm,压力均为18个标准大气压)进行预扩张,球囊以能覆盖病变全长为宜。若保护装置不易通过狭窄病变,则先用直径2.0 mm或2.5 mm的球囊进行预扩张。球囊扩张后置入直径7~10 mm,长度30~40 mm的颈动脉专用自膨胀支架(包括:开环支架,Cristallo;闭环支架,WALLSTENT),支架长度以能覆盖病变全长并在两端各余5~10 mm为宜。若残余狭窄≥30%,则使用比预扩球囊直径大0.5~1.0 mm的球囊进行后扩张。术中血流动力学的管理为:若球囊扩张前或支架释放前心率<70次/min,则静脉推注阿托品0.5~1.0 mg,提高心率至70次/min以上,若球囊扩张或支架释放后心率<60次/min,则再次静脉推注阿托品(0.5~1.0 mg)1~2次,个别没有应答的患者可置入临时起搏器;若血压低于90/60 mmHg,则静脉推注多巴胺2~3 mg,可重复给药,也可给予静脉持续泵入多巴胺,维持血压>90/60 mmHg;若术中出现收缩压>180 mmHg,则根据血压水平,以一定的速度泵入硝普钠降压,直至血压维持在安全范围内[9]。造影复查血运重建情况,如无血栓、夹层及明显残余狭窄,则回收保护装置。若患者需处理另一侧颈动脉,则用肝素盐水反复冲洗保护装置,洗净复位后,供另一侧颈动脉使用。CAS成功标准:支架成功释放且残余狭窄<30%。
术后常规给予心电、血压和心率监测至少24 h,维持患者血压心率在正常范围,观察患者是否有新发神经系统症状或体征、原有症状改善及加重情况。术后患者口服氯吡格雷(75 mg/d)至少6个月,阿司匹林(100 mg/d)长期维持。
1.4 HI定义及围术期血压心率的评估方式
HI包括高血压、低血压和心动过缓。根据相关研究我们定义:高血压为收缩压>160 mmHg;低血压为收缩压<90 mmHg或收缩压下降超过30 mmHg;心动过缓为心率<60次/min或心率下降超过20次/min[10-12]。另外,HI持续时间超过1h定义为持续性HI。患者术前术后的血压心率通过24小时动态血压监测(ABPM)评估,术中则通过动脉内压力监测动态评估。
1.5 临床事件及随访
围术期临床事件是指:CAS术后30天内发生的短暂性脑缺血发作(TIA)、小卒中、大卒中、心肌梗死和死亡。TIA:出现神经功能缺损,但持续时间<24 h。卒中按改良的Rankin评分系统分为大卒中(>3分)和小卒中(≤3分)[13]。心肌梗死:心肌酶或心电图达到诊断心肌梗死的标准。死亡:神经源性或心源性导致的死亡。
通过电话和门诊两种方式随访患者至CAS后30天,若患者出现相关不良事件,则由神经科和(或)心内科专家根据具体情况加以评估。
1.6 统计学分析
2 结果
2.1 基本情况
170例CAS患者的临床基线特征见表1。

表1 170例CAS患者的临床基线特征[例(%)]
2.2 颈动脉造影和支架术情况
170例患者224处病变共置入206枚支架,其中双侧CAS患者36例(21.2%)。CAS技术成功率为100%,血栓保护装置使用率为99.4%(仅有1例患者未使用),61例患者同时行其他外周血管介入。颈动脉造影和支架术具体情况见表2。

表2 170例患者颈动脉造影和支架术具体情况
2.3 血压心率变化情况
CAS术前术后ABPM变化情况(表3): CAS术后全天平均收缩压、全天平均舒缩压、全天平均心率与术前比较明显降低,差异有统计学意义(P<0.01)。
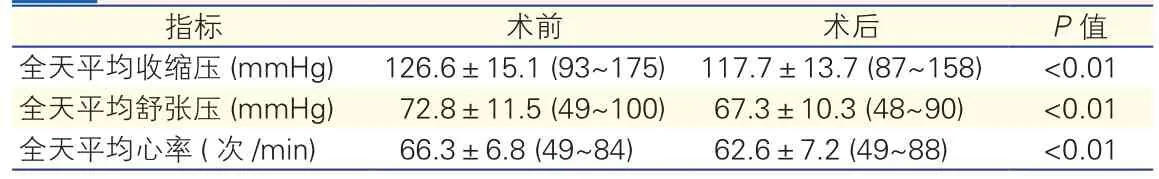
表3 170例CAS术前术后ABPM变化情况(±s)
2.4 HI发生情况
CAS围术期HI发生率较高,可达51.8%(88/170),其中持续性HI占24.1%(41/170)。高血压、低血压和心动过缓的发生率分别为3.5%(6/170)、39.4%(67/170) 和 22.4%(38/170),其中23例(13.5%)患者同时合并低血压和心动过缓。血管活性药物使用比例为77.1%(131/170),其中阿托品为65.9%(112/170),多巴胺为10.5%(18/170),硝普纳为45.9%(78/170)。所有患者HI发生后通过静脉输注血管活性药物血压心率均可恢复正常水平,其中6例(3.5%)用药时间超过24 h(2例心动过缓和4例低血压合并心动过缓)。所有患者均无临时起搏器置入的情况。
2.5 相关因素与HI的分析结果
单因素分析发现:性别、高血压病史、双侧CAS和分叉部病变与HI关系密切(表4)。另外我们通过对心动过缓或低血压的患者进行单因素分析还发现:术中未停用降心率药的患者术后更容易发生心动过缓 [30.0%(20/66) vs 17.3%(18/104),P=0.047];术中仍使用降压药的患者更容易发生术 后 低 血 压 [45.7%(48/105) vs 29.2%(19/65),P=0.033]。
对患者年龄、性别、高血压病史、降压药、降心率药、狭窄程度、对侧颈动脉是否闭塞、单双侧CAS和狭窄部位等进行多因素回归分析发现(表5):性别和分叉部病变为HI的独立预测因素,高血压、双侧CAS和分叉部病变为持续性HI的独立预测因素。
2.6 术后30天内不良事件发生情况
4例(2.4%)患者术后出现TIA发作,2例(1.2%)出现缺血性小卒中,经保守治疗后均康复出院;大卒中出现2例(1.2%),其中1例患者术后第2天出现缺血性大卒中,转院至外院神经内科治疗,出院后未遗留致残性后遗症,另1例为出血性大卒中,术后当天出现支架同侧脑出血,最终抢救无效死亡。
HI患者发生不良事件的比例为6.8%(6/88),非HI患者为2.4%(2/82),差异无统计学意义(P=0.32),另外,持续性HI患者与非持续性HI患者相比不良事件发生率没有差异,发生率分别为 4.9%(2/41)和 4.7%(6/129)。HI患者中高血压、低血压、心动过缓及低血压合并心动过缓发生不良事件的比例分别为16.7%(1/6)、6.8%(3/44)、0%(0/15) 和 8.7%(2/23),与整体患者相比,P值分别为0.669、0.723、0.793和0.658。
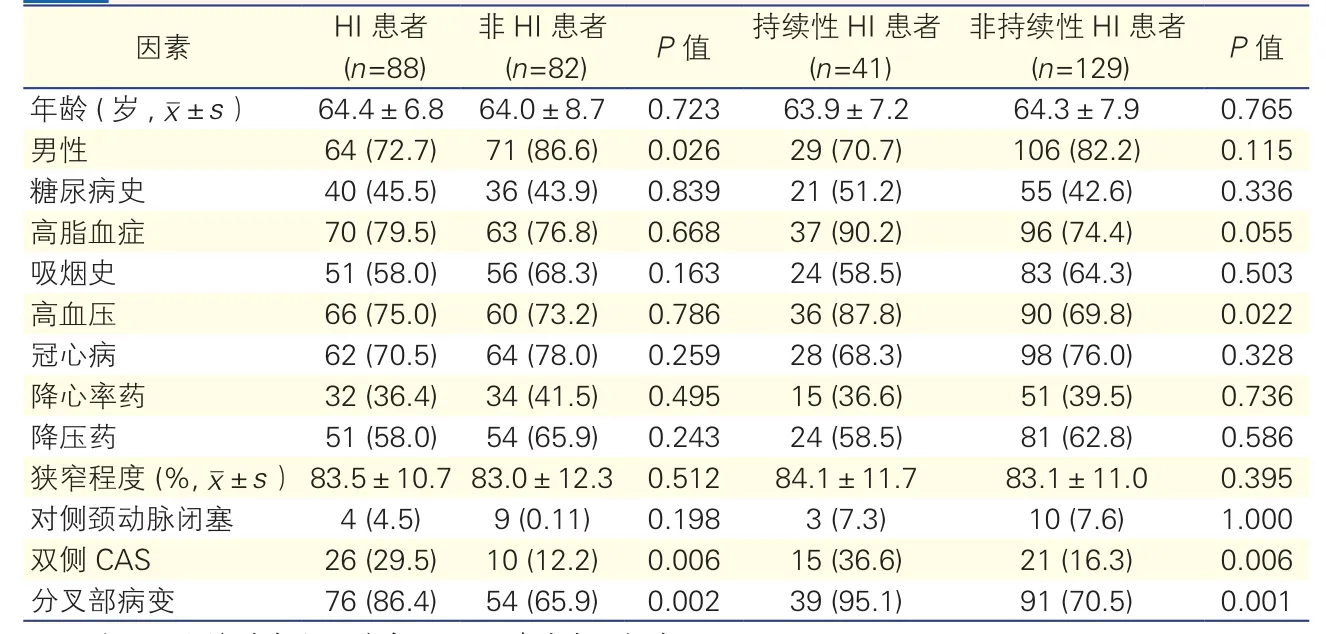
表4 相关因素与HI分析[例(%)]

表5 HI多因素Logistic回归分析
3 讨论
CAS围术期HI的发生几率较高,且可能会增加围术期不良事件发生的风险。既往文献报道[6,14],CAS术后高血压发生率为7%~39%,低血压发生率为5%~76%,心动过缓发生率为14%~28%,总发生率为42%~84%。各研究HI发生率差异较大主要与每个研究定义HI的标准不同有关。本研究HI的发生率大致也在上述范围内,且处于相对较低的水平。本研究联合术中动脉内压力监测和术前术后ABPM实时地观察CAS围术期的血压心率变化,可较为科学合理地评估患者的血流动力学变化情况。
文献表明,CAS患者围术期出现的低血压和心动过缓属于支架或球囊扩张压迫压力感受器导致的血液动力学急性影响,高血压则认为与手术应激和术前停用(或减少)降压药的使用有关[5,14,15]。压力感受器主要分布在颈动脉窦部,对牵张刺激十分敏感,在由传入和传出神经等组成的反射弧配合下,通过调节交感神经和副交感神经来控制血压心率变化。CAS过程中,球囊和支架对颈动脉窦的刺激可引起副交感神经兴奋,引起血压、心率下降。Suh等[16]研究发现CAS术后3h内收缩压可比术前下降9 mmHg,3~24 h可下降21 mmHg,本研究也发现患者术后全天平均收缩压相比于术前可下降8.9 mmHg。
HI的发生与多种因素相关。Trocciola等[17]研究发现,女性是HI发生的独立预测危险因子,女性HI的发生率为男性的近2倍,本研究也有类似的发现,男性相比于女性,更不容易发生HI(HR: 0.428,P=0.043),另外我们还发现在女性患者中,CAS术后发生低血压的比例尤其高,可达60%(21/35),而男性患者仅为34%(46/135),P<0.05。Howell等[18]等一项回顾性研究发现,高血压患者容易出现HI,特别是对于术前收缩压大于180 mmHg的患者,术后发生HI的风险极高。在我们的研究中高血压患者相比于血压正常的患者,虽然HI发生比例没有差异,但持续性HI发生率明显升高(HR: 3.698,P=0.016),这可能与高血压患者颈动脉窦对机械刺激更为敏感有关。
在本研究中我们还发现双侧CAS与HI关系密切,双侧CAS患者HI发生比例为72.2%,而单侧CAS仅为46.3%,P<0.05;且多因素回归分析发现,双侧CAS是持续性HI发生的危险因素(HR: 2.650,P=0.024),这与双侧CAS后两侧颈动脉窦均受到刺激紧密相关。已有研究证实行双侧CAS是安全可行的[19,20],考虑到同期行双侧CAS可减少患者住院次数,减轻患者手术费用,让患者免遭二次手术,因此有部分中心在条件允许的情况下,会考虑行同期双侧CAS。由于同期行双侧CAS容易引起更剧烈的血流动力学变化,增加手术的相关风险,因此对于这类高危患者,一定要密切注意其血流动力学变化。
病变部位也与HI关系密切,本研究中分叉部病变患者HI发生率是58.5%,而非分叉部病变的发生率仅为30%,P<0.05。多因素分析发现分叉部病变发生HI的风险为非分叉部的2.487倍(P=0.024),发生持续性HI的风险更是高达6.977倍(P=0.011)。在Suh等[16]研究中分叉部病变和非分叉部病变HI发生比例分别为41.0%和12.5%,差异也较为明显。分叉部病变行CAS时HI发生率高主要与分叉部压力感受器密度大,敏感性高有关,在处理分叉部病变时,其表现出的压力反射更为强烈,因此球囊扩张或支架释放前预防性使用阿托品等血管活性药物,对于预防术后HI显得尤为重要。
国外多项研究表明,高龄患者CAS术后容易发生HI,这主要与高龄患者心脏调节功能较差,对血压心率变化不能及时作出纠正有关,国外CAS患者的平均年龄一般为70~74岁,而本研究CAS患者平均年龄仅有64.2岁,75岁以上患者所占比重小,这可能是我们未能得出该结论的重要原因[5,21,22]。
另外,我们还发现术中未停用降心率药的患者,术后更容易发生心动过缓,以及术中未停用降压药的患者术后发生低血压的可能性更大,这主要与药物作用有关,因此,术前应充分地评估患者血压、心率,做到合理地减少或停用降压降心率药,以减少围术期HI的发生。
HI与不良事件发生之间的关系目前争议较大,尚未得出统一的结论。一些研究证实HI可增加主要不良事件的发生率[6,18],但在部分其它研究中仅能发现TIA可能与HI存在一定的关系,并不能证明卒中、心肌梗死以及死亡等主要不良事件与HI相关[4,22]。本研究中共有8例患者出现不良事件,其中6例患者存在HI(1例出现术后高血压,3例出现术后低血压,2例同时合并低血压和低心率)。HI患者不良事件发生率明显高于非HI患者,其中以高血压及低血压合并心动过缓的患者居多,差异虽然没有达到统计学意义,这可能与样本量不够大,不良事件发生率低有关。
本研究具有一定的局限性。首先,本研究为单中心回顾性研究,样本量也不够大;其次,在数据收集过程中存在一定的选择偏倚,随访过程会出现随访偏倚。因此需要进一步开展大样本前瞻性研究加以证实。
总之,CAS围术期HI发生率高,性别、高血压病史、双侧CAS和颈动脉分叉病变与HI关系密切,术前应充分认识这些危险因素,并做好相应的预防工作。另外高血压、双侧CAS和颈动脉分叉部病变患者容易发生持续性HI,术后应做到连续持久地监测这类患者的血流动力学变化,以便于及时发现HI。考虑到HI可能会增加围术期不良事件的发生,因此HI发生后,应及时合理地使用血管活性药物,迅速纠正HI,从而减少HI相关不良事件的发生。
[1]Warlow C, Sudlow C, Dennis M, et al. Stroke. Lancet, 2003, 362:1211-1224.
[2]Brott TG, Hobson RW, Howard G, et al. Stenting versus endarterectomy for treatment of carotid-artery stenosis. N Engl J Med, 2010, 363: 11-23.
[3]Murad MH, Flynn DN, Elamin MB, et al. Endarterectomy vs stenting for carotid artery stenosis: a systematic review and meta-analysis. J Vasc Surg, 2008, 48: 487-493.
[4]Mylonas SN, Moulakakis KG, Antonopoulos CN, et al. Carotid artery stenting-induced hemodynamic instability. J Endovasc Ther, 2013, 20:48-60.
[5]Lin PH, Zhou W, Kougias P, et al. Factors associated with hypotension and bradycardia after carotid angioplasty and stenting. J Vasc Surg,2007, 46: 846-853; discussion 853-854.
[6]Ullery BW, Nathan DP, Shang EK, et al. Incidence, predictors, and outcomes of hemodynamic instability following carotid angioplasty and stenting. J Vasc Surg, 2013, 58: 917-925.
[7]Barnett HJM, Taylor DW, Haynes RB, et al. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis. N Engl J Med, 1991, 325: 445-453.
[8]沈松鹤, 蒋雄京, 董徽, 等. 主动脉弓解剖分型对颈动脉支架置入术技术指标的影响. 中国循环杂志, 2015, 30: 34-37.
[9]蒋雄京, 邹玉宝. 冠心病合并颈动脉狭窄的处理策略专家共识. 中国循环杂志, 2016, 31: 1150-1156.
[10]Dangas G, Laird JR, Satler LF, et al. Postprocedural hypotension after carotid artery stent placement: predictors and short- and long-term clinical outcomes. Radiology, 2000, 215: 677-683.
[11]Mendelsohn FO, Weissman NJ, Lederman RJ, et al. Acute hemodynamic changes during carotid artery stenting. Am J Cardiol,1998, 82: 1077-1081.
[12]Qureshi AI, Luft AR, Sharma M, et al. Frequency and determinants of postprocedural hemodynamic instability after carotid angioplasty and stenting. Stroke, 1999, 30: 2086-2093.
[13]de Haan R, Limburg M, Bossuyt P, et al. The clinical meaning of Rankin 'handicap' grades after stroke. Stroke, 1995, 26: 2027-2030.
[14]Gupta R, Abou-Chebl A, Bajzer CT, et al. Rate, predictors, and consequences of hemodynamic depression after carotid artery stenting.J Am Coll Cardiol, 2006, 47: 1538-1543.
[15]Taha MM, Toma N, Sakaida H, et al. Periprocedural hemodynamic instability with carotid angioplasty and stenting. Surg Neurol, 2008,70: 279-285; discussion 285-286.
[16]Suh DC, Kim JL, Kim EH, et al. Carotid baroreceptor reaction after stenting in 2 locations of carotid bulb lesions of different embryologic origin. AJNR Am J Neuroradiol, 2012, 33: 977-981.
[17]Trocciola SM, Chaer RA, Lin SC, et al. Analysis of parameters associated with hypotension requiring vasopressor support after carotid angioplasty and stenting. J Vasc Surg, 2006, 43: 714-720.
[18]Howell M, Krajcer Z, Dougherty K, et al. Correlation of periprocedural systolic blood pressure changes with neurological events in high-risk carotid stent patients. J Endovasc Ther, 2002, 9: 810-816.
[19]董徽, 蒋雄京, 彭猛, 等. 双侧颈动脉支架术治疗双侧颈动脉严重狭窄临床观察. 中华心血管病杂志, 2013, 47: 577-582.
[20]Henry M, Gopalakrishnan L, Rajagopal S, et al. Bilateral carotid angioplasty and stenting. Catheter Cardiovasc Interv, 2005, 64: 275-282.
[21]Obeid T, Arhuidese I, Gaidry A, et al. Beta-blocker use is associated with lower stroke and death after carotid artery stenting. J Vasc Surg,2016, 63: 363-369.
[22]Wu TY, Ham SW, Katz SG. Predictors and consequences of hemodynamic instability after carotid artery stenting. Ann Vasc Surg,2015, 29: 1281-1285.
Acute Effect of Carotid Artery Stenting on Hemodynamics
XIONG Hong-liang, CHE Wu-qiang, JIANG Xiong-jing, ZOU Yu-bao, DONG Hui, WANG Peng, LIU Jia-lin.
Department of Cardiology, National Center for Cardiovascular Disease and Fuwai Hospital, CAMS and PUMC, Beijing(100037), China
Corresponding Author: JIANG Xiong-jing, Email: jxj103@hotmail.com
Objective: To investigate the acute effect of carotid artery stenting (CAS) on hemodynamics.
Methods: We retrospectively analyzed 170 consecutive patients who received CAS in our hospital from 2014-09 to 2015-09. The acute effects of proximal internal CAS on blood pressure (BP) and heart rate (HR) were studied, the patients were followed-up for a month to observe the relationship between CAS and peri-operative adverse events occurrence.
Results:① Compared with pre-operative condition, the all day mean systolic blood pressure (SBP) from (126.6±15.1,93-175) mmHg decreased to (117.7±13.7, 87-158) mmHg,P<0.01, all day mean DBP from (72.8±11.5, 49-100) mmHg decreased to (67.3±10.3, 48-90) mmHg,P<0.01, and all day HR from (66.3±6.8, 49-84) bpm decreased to (62.6±7.2,49-88) bpm,P<0.01.② The incidence of hemodynamic instability (HI) was 51.8% (88/170) and the occurrence rates of thypertension, hypotension and bradycardia were 3.5% (6/170), 39.4 % (67/170) and 22.4% (38/170) respectively.Multivariate regression analysis showed that HI was closely related to gender, history of hypertension, bilateral CAS and carotid bifurcation lesions. Upon HI onset, BP and HR could be restored to normal via intravenous infusion of vasoactive drugs and 6 (3.5%) patients having the medication time more than 24 hours. ③Peri-operative adverse events happened in 8(4.7%) patients including 4 transient is chemic attack, 2 minor stroke and 2 major stroke (1 patient died). The ratio of adverseevents was 2.4% (2/82) in Non-HI group and 6.8% (6/88) in HI group,P=0.32. In HI group, the incidences of hypertension,hypotension, bradycardia and hypotension combining bradycardia were 16.7% (1/6), 6.8% (3/44), 0% (0/15) and 8.7% (2/23)respectively, compared with the overall patients’ group,P=0.669,P=0.723,P=0.793 andP=0.658 respectively.
Conclusion: HI incidence was relatively high in peri-operative period of CAS; gender, history of hypertension,bilateral CAS and carotid bifurcation lesions were the independent predictors for CAS occurrence. It is important to reasonably use vasoactive drugs in time for preventing and reducing HI related adverse events.
Carotid artery stenting; Hemodynamic; Postoperative complications
100037 北京市,北京协和医学院 中国医学科学院 国家心血管病中心 阜外医院 心内科
熊洪亮 硕士研究生 主要从事顽固性高血压及外周血管疾病研究 Email:xhlcmu@163.com 通讯作者:蒋雄京 Email:jxj103@hotmail.com
R541
A
1000-3614(2017)10-0999-06
10.3969/j.issn.1000-3614.2017.10.015
(Chinese Circulation Journal, 2017,32:999.)
2017-03-22)
(编辑:汪碧蓉)

