家族性原发性皮肤淀粉样变性两家系OSMR基因突变
郭独一 康天济 闫慧敏 赵惠娟 姜薇
100191北京大学第三医院皮肤科(郭独一、闫慧敏、赵惠娟、姜薇);黑龙江中医药大学教学实验中心机能实验室(康天济)
·论著·
家族性原发性皮肤淀粉样变性两家系OSMR基因突变
郭独一 康天济 闫慧敏 赵惠娟 姜薇
100191北京大学第三医院皮肤科(郭独一、闫慧敏、赵惠娟、姜薇);黑龙江中医药大学教学实验中心机能实验室(康天济)
目的 检测家族性原发性皮肤淀粉样变性两个家系OSMR基因突变情况并分析与临床表现的关系。方法 收集两个原发性皮肤淀粉样变性家系的临床资料,提取外周血DNA,采用PCR技术扩增两例先证者及其家属OSMR基因18个外显子及其侧翼序列并测序,并以100例健康人作为对照。结果 第1个家系先证者OSMR基因第15号外显子发生c.2081C>T杂合突变,导致氨基酸序列出现p.P694L改变,家族中其他4例患者均带有相同突变位点。第2个家系先证者OSMR基因第11号外显子发生c.1538G>A杂合突变,导致氨基酸序列出现p.G513D改变,其母亲也带有相同突变位点,突变位点与疾病符合共分离。两家系中健康成员及100例健康对照者均未发现相应突变。结论 OSMR基因p.P694L和p.G513D突变可能与原发性皮肤淀粉样变性有关。
淀粉样变,家族性;系谱;突变;皮肤表现;基因,OSMR
原发性皮肤淀粉样变性(primary cutaneous amyloidosis,PCA)是淀粉样蛋白沉积于皮肤中,无其他内脏器官受累的一种局限性疾病。该病发病机制尚不清楚,可能与遗传、病毒(如EB病毒)、长期摩擦[1]有关,大多数为散发病例,10%有显性遗传家族史。家族性原发性皮肤淀粉样变性(familial primary cutaneous amyloidosis,FPCA)在南美洲、东南亚(包括台湾)较为常见[2],该病常于青春期前后起病,多为持久性、瘙痒性皮损,好发于胫前及四肢伸侧。目前发现该病的致病基因分别位于5p13.1的OSMR(601743)基因和位于5q11.2的IL31RA基因(609510)基因[3],其中OSMR基因突变最为常见。我们在临床上发现2个FPCA家系并对其进行OSMR基因突变研究,探讨其发病的分子基础与临床表型之间的关系。
资料和方法
一、临床资料
家系1先证者为55岁男性,23年前双胫前无明显诱因出现瘙痒,逐渐出现针尖大小褐色丘疹,后逐渐增大至黄豆大小,丘疹密集分布但不融合,逐步扩展到上背部、双前臂,瘙痒剧烈。曾外用多种药物治疗,皮疹和瘙痒程度改善不明显。其他系统检查未见异常。家族中共有5个成员受累(图1⁃Ⅱ6),皮损表现及发病过程与先证者基本相似。家族中其他成员否认代谢性疾病史。取先证者左小腿丘疹(图2)行组织病理检查可见真皮乳头增宽,其内可见均一嗜酸性团块状物(图3)。家系2先证者(图4⁃Ⅲ2)为45岁女性,自青春期开始双小腿逐渐出现米粒大小坚实的褐色角化性丘疹,上背部可见褐色斑点,聚合成网状,伴轻度瘙痒。一直未治疗,各系统检查未见异常。家族中先证者母亲是患者(图4⁃Ⅱ3),临床表现与先证者相似,瘙痒严重一些。家族中其他成员否认代谢性疾病史。取先证者左小腿皮损(图5)行组织病理活检可见真皮乳头中均一红染的团块状沉积物(图6)。本研究通过北京大学第三医院医学伦理委员会批准,患者和健康人均签署知情同意书。

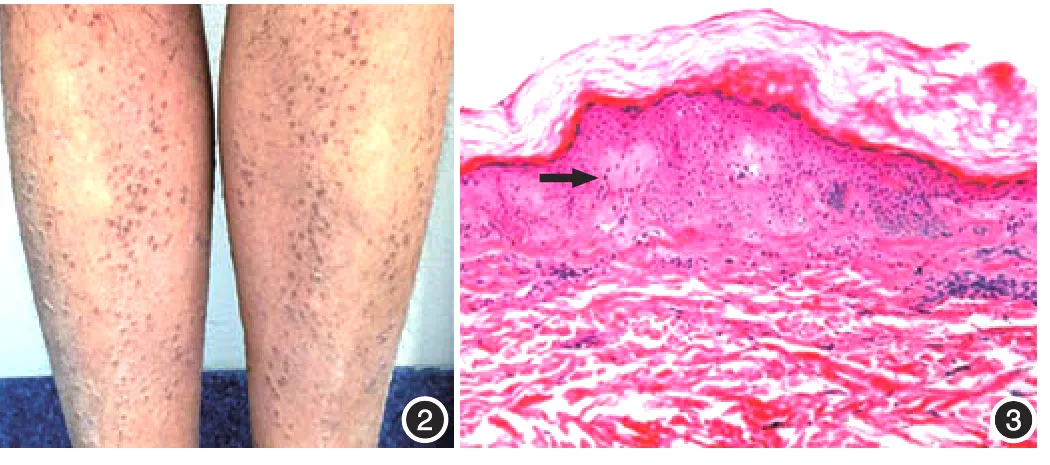
图1 家系1 图2 家系1先证者双胫前黄豆大小褐色丘疹,密集不融合 图3 先证者小腿胫前皮损组织病理 真皮乳头增宽,其内可见均一嗜酸性团块状物(HE×100,箭头)

图4 家系2 图5 家系2先证者双胫前密集米粒大小角化性坚实的褐色丘疹 图6 先证者小腿胫前皮损组织病理 真皮乳头均一红染的团块状沉积物(HE×100,箭头)
二、方法
1.DNA提取:收集2个家系中所有患者和健康成员各5例及100例健康对照外周血4 ml,用DNA提取试剂盒[天根生化科技(北京)有限公司]提取基因组DNA。
2.PCR扩增及DNA测序:根据OSMR基因序列采用软件Primer3设计18对特异性引物扩增该基因全部外显子及其侧翼序列,其中OSMR基因第11号外显子引物序列:上游5′⁃AAGCTGTTTGAATTTTCT GGTG⁃3′,下游5′⁃GGCCCAAAAGAAAATGACTG⁃3′;15号外显子引物为:上游5′⁃TGTCCCAGAAACT CCTAAGGG⁃3′,下游5′⁃TTCCCAGAAACTCCTAAG GG⁃3′。PCR反应采用50 μl体系:上、下游引物各10 pmol∕L,dNTP 10 mmol∕L,MgCl215 mmol∕L,Taq酶2.5 U。PCR扩增条件为94℃预变性5 min后进入循环,94℃变性30 s,58℃退火30 s,72℃延伸30 s,33个循环后72℃延伸7 min。PCR产物用10 g∕L琼脂糖凝胶(溴化乙锭染色)电泳分析,经酶纯化后用ABIPrism377型全自动测序仪测序(北京天一辉远测序公司),并将突变结果进行反向测序验证。
结果
以先证者基因组DNA为模板,18对引物分别扩增出各自产物,对所有产物进行测序,结果与基因库NM_003999(http:∕∕www.ncbi.nlm.nih.gov∕nuccore∕NM_003999)以及 Ensemble数据库(http:∕∕www. ensemble.org∕)所公布的序列相比较,发现家系1先证者OSMR基因第15号外显子中第2081位胞嘧啶C被胸腺嘧啶T替代(c.2081C>T),该突变导致第694号氨基酸序列由脯氨酸P转变为亮氨酸L(p.P694L)(图7)。家系2先证者第11号外显子中第1538位鸟嘌呤G被腺嘌呤A替代(c.1538G>A),导致第513号氨基酸序列由甘氨酸G转变为天冬氨酸D(p.G513D)(图8)。两家系中其他患者均检测到与先证者相同突变位点,而家庭中健康成员及100例健康对照无此发现。两家系中突变位点与疾病符合共分离。

图7 家系1测序 先证者OSMR基因第15号外显子2081位发生C>T替代

图8 家系2测序 先证者OSMR基因第11号外显子1538位发生G>A替代
讨论
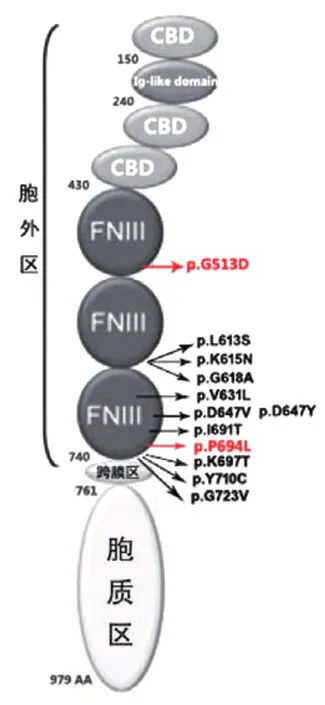
图9 OSMR-β蛋白结构及迄今已报道的FPCA患者OSMR基因突变位点示意图 图中红字显示的突变位点为本研究结果
Lee等[4]应用微卫星标记物对一FPCA家系进行基因组扫描,发现与染色体5pl3.1⁃gll.2存在连锁相关性。Arita等[5]通过连锁分析法将FPCA致病基因定位于致瘤素M受体(oncostatin M receptor,OSMR)。OSMR基因编码制瘤素M特异性受体β(OSMR⁃β),该蛋白是一种由活化的单核细胞和T淋巴细胞产生的细胞因子,属于IL⁃6家族,是OSMⅡ型受体和白细胞介素31(IL⁃31)受体组成部分,与一些功能子域共同构成跨膜细胞因子受体的一部分,参与细胞增殖、分化、凋亡以及炎症反应过程,在调节先天免疫、血管生成、细胞运动等环节中发挥作用[6]。OSMR⁃β蛋白分胞外区、跨膜区和胞质区,胞外区由3个细胞因子结 合 区(cytokine bingding domain,CBD)、IgG样区和纤连蛋白Ⅲ型亚区(fibronectin typeⅢ⁃like domain,FNⅢ)组成(图9),其中细胞因子结合区和IgG样区主要用于形成受体并与配体结合,而FNⅢ区对受体域正确的空间构型和定位起作用,从而影响受体二聚体的形成[7]。OSMR⁃β蛋白胞质区包含与JAK⁃STAT,MAPK以及PI3K∕Akt信号招募功能相关的多个模体,Jak⁃STAT,MAPK和PI3K∕Akt通路为IL⁃6的主要通路,并在一些肿瘤细胞株中发挥抗凋亡作用[8⁃9]。通过文献检索发现,FPCA家系迄今已报道12个OSMR基因突变位点,包括:p.Gly513Asp[10]、p.Leu613Ser[11]、p.Lys615Asn[12]、p.Gly618Ala[5]、p.Val631Leu[13]、p.Asp647Tyr[13]、p.Asp647Val[3]、p.Ile691Thr[5]、p.Pro694Leu[7,14]、p.Lys697Thr[3]、p.Ty710Cys[15]、p.Gly723Val[10],突变方式均为错义突变,而突变位点多集中在与跨膜区相邻的FNⅢ区域内(图9),疾病分布未见明显的地域差异,其中p.Pro694Leu这一突变我国周云等[14]以及英国学者[7]都报道过。本研究发现家系1 c.2081C>T杂合突变,导致第694号氨基酸序列由脯氨酸Pro转变为亮氨酸Leu(p.P694L),此突变位于OSMR⁃β分子上与跨膜区相邻的第3个纤连蛋白(FNⅢ)控制区内,导致Jak⁃STAT、MAPK通路的激活受到影响,对角质形成细胞的迁移和表皮增生起到诱导作用[7]。家系2 c.1538G>A杂合突变导致第513号氨基酸序列由甘氨酸Gly转变为天冬氨酸Asp(p.G513D),该突变位点虽不在热点区域(图9),但也同样位于FNⅢ区域内。该突变位点并未见单独报道,仅在2015年我国学者报道一家族性甲状腺髓样癌(RET)合并淀粉样变的中国家系时,发现试验中所有患淀粉样变并携带RET p.S891A突变的患者均检测出OSMR p.G513D突变,但同时也有4例OSMR p.G513D携带者没有皮肤淀粉样变的临床表现,据此推测OSMR p.G513D可能在携有RET p.S891A突变的淀粉样变患者疾病发生、发展过程中起到一定的修饰作用,并通过影响皮肤相应的信号通路而引起FPCA的发生[10]。总之,我们对2例FPCA家系进行OSMR基因突变检测,并对迄今OSMR基因突变情况进行分析,此结果为进一步研究亚洲FPCA家系基因型与表型之间关系提供数据。
[1]Weyers W,Weyers I,Bonczkowitz M,et al.Lichen amyloidosus:a consequence of scratching[J].J Am Acad Dermatol,1997,37(6):923⁃928.
[2]Lin MW,Lee DD,Lin CH,et al.Suggestive linkage of familial primary cutaneous amyloidosis to a locus on chromosome 1q23[J].Br J Dermatol,2005,152(1):29⁃36.DOI:10.1111∕j.1365⁃2133.2004.06254.x.
[3]Lin MW,Lee DD,Liu TT,et al.Novel IL31RA gene mutation and ancestral OSMR mutant allele in familial primary cutaneous amyloidosis[J].Eur J Hum Genet,2010,18(1):26⁃32.DOI: 10.1038∕ejhg.2009.135.
[4]Lee DD,Lin MW,Chen IC,et al.Genome⁃wide scan identifies a susceptibility locus for familial primary cutaneous amyloidosis on chromosome 5p13.1⁃q11.2[J].Br J Dermatol,2006,155(6): 1201⁃1208.DOI:10.1111∕j.1365⁃2133.2006.07524.x.
[5]Arita K,South AP,Hans⁃Filho G,et al.Oncostatin M receptor⁃beta mutations underlie familial primary localized cutaneous amyloidosis[J].Am J Hum Genet,2008,82(1):73⁃80.DOI: 10.1016∕j.ajhg.2007.09.002.
[6]Finelt N,Gazel A,Gorelick S,et al.Transcriptional responses of human epidermal keratinocytes to Oncostatin⁃M[J].Cytokine, 2005,31(4):305⁃313.DOI:10.1016∕j.cyto.2005.05.005.
[7]Tanaka A,Arita K,Lai⁃Cheong JE,et al.New insight into mechanisms of pruritus from molecular studies on familial primary localized cutaneous amyloidosis[J].Br J Dermatol,2009, 161(6):1217⁃1224.DOI:10.1111∕j.1365⁃2133.2009.09311.x.
[8]Davies FE,Raje N,Hideshima T,et al.Thalidomide and immunomodulatory derivatives augmentnaturalkiller cell cytotoxicity in multiple myeloma[J].Blood,2001,98(1):210⁃216.
[9]Timmermann A,Küster A,Kurth I,et al.A functional role of the membrane⁃proximal extracellular domains of the signal transducer gp130 in heterodimerization with the leukemia inhibitory factor receptor[J].Eur J Biochem,2002,269(11):2716⁃2726.
[10]Qi XP,Zhao JQ,Chen ZG,et al.RET mutation p.S891A in a Chinese family with familial medullary thyroid carcinoma and associated cutaneous amyloidosis binding OSMR variant p.G513D[J].Oncotarget,2015,6(32):33993⁃34003.DOI:10.18632∕oncotarget.4992.
[11]Saeedi M,Ebrahim⁃Habibi A,Haghighi A,et al.A novel missense mutation in oncostatin M receptor beta causing primary localized cutaneous amyloidosis[J].Biomed Res Int,2014,2014:653724. DOI:10.1155∕2014∕653724.
[12]Wang WH,Li LF,Huang ES,et al.A new c.1845A→T of oncostatin M receptor⁃β mutation and slightly enhanced oncostatin M receptor⁃β expression in a Chinese family with primary localized cutaneous amyloidosis[J].Eur J Dermatol, 2012,22(1):29⁃33.DOI:10.1684∕ejd.2011.1565.
[13]Tanaka A,Lai⁃Cheong JE,van den Akker PC,et al.The molecular skin pathology of familial primary localized cutaneous amyloidosis[J].Exp Dermatol,2010,19(5):416⁃423.DOI:10.1111∕j.1600⁃0625.2010.01083.x.
[14]周云,曹先伟,许桂文,等.家族性原发性皮肤淀粉样变一家系的OSMR基因突变检测[J].中华皮肤科杂志,2014,47(8):591⁃592.DOI:10.3760∕cma.j.issn.0412⁃4030.2014.08.017.
[15]Babilas P,Fiebig BS,Aslanidis C,et al.Identification of an oncostatin M receptor mutation associated with familial primary cutaneous amyloidosis[J].Br J Dermatol,2009,161(4):944⁃947.DOI:10.1111∕j.1365⁃2133.2009.09237.x.
·读者·作者·编者·
本刊法定计量单位的书写规则
执行GB 3100∕3101∕3102-1993《国际单位制及其应用∕有关量、单位和符号的一般原则∕(所有部分)量和单位》的有关规定,具体执行可参照中华医学会杂志社编写的《法定计量单位在医学上的应用》第3版(人民军医出版社2001年出版)。凡是涉及人体及动物体内的压力测定,可以使用毫米汞柱(mmHg)或厘米水柱(cmH2O)为计量单位,但首次使用时应注明mmHg或cmH2O与kPa的换算系数(1 mmHg=0.133 kPa,1 cmH2O=0.098 kPa)。一般情况下,统一用L(升)作为表示人体检验组分浓度单位的分母,而不使用ml(毫升)、dl(分升)、mm3(立方毫米)等作分母。但当涉及高精度测试时,可以用ml、μl等作分母。在一个组合单位符号中,斜线不应多于1条。例如:mg∕kg∕d;应写为mg∕(kg·d)或mg·kg-1·d-1。时间的表示方法:作为单位修饰词仅为数字时,天(日)用“d”,小时用“h”,分钟用“min”,秒用“s”。非单位时可用天、小时、分钟、秒。如:在描述第×天、第×小时、第×分钟,或每天、每小时、每分钟等时,均用汉字。表示离心加速作用时,应以重力加速度(g)的倍数形式表达。例如:6 000×g离心10 min。或者在给出离心机转速的同时给出离心半径,例如:离心半径8 cm,12 000 r∕min离心10 min。
Mutation analysis of the OSMR gene in two Chinese families with familial primary cutaneous amyloidosis
Guo Duyi,Kang Tianji,Yan Huimin,Zhao Huijuan,Jiang Wei
Department of Dermatology,Peking University Third Hospital,Beijing 100191,China(Guo DY,Yan HM, Zhao HJ,Jiang W);Functional Laboratory,Experimental Center for Teaching and Learning,Heilongjiang University of Chinese Medicine,Heilongjiang 150040,China(Kang TJ)
Jiang Wei,Email:jiangwei7366@163.com
Objective To detect mutations in the OSMR gene in 2 Chinese families with familial primary cutaneous amyloidosis(FPCA),and to analyze their relationship with clinical manifestations. Methods Clinical data were collected from 2 families with FPCA,and genomic DNA was extracted from peripheral blood samples.PCR was performed to amplify 18 exons and their flanking sequences of the OSMR gene followed by DNA sequencing in 2 probands and their family members.One hundred healthy individuals served as controls.Results In the first family,a heterozygous mutation(c.2081C>T)in exon 15 of the OSMR gene,which leads to a codon change at amino acid position 694(p.P694L),was identified in the proband,as well as in the other 4 patients.In the second family,a heterozygous mutation(c.1538G>A)in exon 11 of the OSMR gene,which causes a codon change at amino acid position 513(p.G513D),was identified in the other proband and her mother,suggesting the cosegregation of the gene mutation with the disease.None of the above mutations were detected in the healthy family members or controls.Conclusion The heterozygous mutations p.P694L and p.G513D in the OSMR gene may be associated with primary cutaneous amyloidosis.
Amyloidosis,familial;Pedigree;Mutation;Skin manifestations;Genes,OSMR
姜薇,Email:jiangwei7366@163.com
10.3760∕cma.j.issn.0412⁃4030.2017.02.005
国家自然科学基金(81201216)
Fund program:National Natural Science Foundation of China(81201216)
2016⁃05⁃18)
(本文编辑:吴晓初)

