喜树碱对HaCaT细胞自噬的影响
郝阳阳 张梁宇 王翔 陆亚琪 朱晓杨 陈杨
313000浙江湖州,安徽医科大学解放军九八临床学院 解放军第九八医院皮肤科(郝阳阳、张梁宇、陆亚琪、朱晓杨、陈杨),药械科(王翔)
·论著·
喜树碱对HaCaT细胞自噬的影响
郝阳阳 张梁宇 王翔 陆亚琪 朱晓杨 陈杨
313000浙江湖州,安徽医科大学解放军九八临床学院 解放军第九八医院皮肤科(郝阳阳、张梁宇、陆亚琪、朱晓杨、陈杨),药械科(王翔)
目的 探讨喜树碱对HaCaT细胞自噬的影响。方法 将HaCaT细胞分为对照组和实验组,对照组用0.1%二甲基亚砜处理,实验组分别用5、10、25、50、100、200 nmol∕L浓度的喜树碱处理。不同浓度喜树碱作用于HaCaT细胞24、48 h,用CCK8法检测细胞增殖情况,流式细胞仪检测药物作用24 h后细胞凋亡情况,免疫印迹法检测自噬相关微管相关蛋白1轻链3(LC3)、p62的变化;选取10 nmol∕L喜树碱作用于HaCaT细胞24 h,间接免疫荧光法检测细胞自噬蛋白LC3的变化。结果5、10 nmol∕L喜树碱对HaCaT细胞增殖、凋亡无显著影响,50、100、200 nmol∕L喜树碱作用HaCaT细胞24 h,增殖抑制率分别为(31.23±1.00)%,(54.21±8.10)%,(66.75±10.70)%;25、50、100、200 nmol∕L喜树碱作用HaCaT细胞48 h,增殖抑制率分别为(25.81±5.99)%、(44.35±5.32)%、(65.81±8.28)%、(73.23±9.59)%,与同时段对照组相比,差异有统计学意义(均P<0.001)。50、100、200 nmol∕L喜树碱作用HaCaT细胞24 h,凋亡率分别为(14.46±2.38)%、(19.15±1.59)%、(29.88±1.37)%,与对照组(3.80±0.13)%比较,差异有统计学意义(均P<0.001)。5、10 nmol∕L喜树碱处理HaCaT细胞24 h后,LC3Ⅱ表达上调,p62蛋白表达下调。间接免疫荧光显示10 nmol∕L喜树碱作用HaCaT细胞24 h后,实验组与对照组自噬体阳性细胞百分率分别为(36.67±4.55)%、(6.23±0.92)%,两组差异有统计学意义(t=6.546,P=0.003)。结论 5、10 nmol∕L喜树碱可诱导HaCaT细胞发生自噬,但对细胞增殖、凋亡无影响。50、100、200 nmol∕L喜树碱抑制HaCaT细胞增殖,促使细胞发生凋亡,自噬水平降低。
银屑病;喜树碱;自噬;凋亡;HaCaT细胞
银屑病是一种慢性炎症性疾病,其发病与自身免疫、炎症密切相关,角质形成细胞过度增殖、角化不全是其发病机制之一[1]。自噬是细胞的一种自我吞噬的过程,在细胞处于饥饿、感染等应激状态时,细胞会发生自噬[2]。喜树碱作为一种生物碱单体,其外用制剂用于治疗寻常性银屑病,尤其是慢性斑块型银屑病,疗效与0.02%丙酸氯倍他索乳膏相当[3]。有研究表明,银屑病皮损的自噬水平较正常表皮下降[4],阻断自噬可使人表皮细胞炎症因子显著上调[5],提高银屑病皮损的自噬水平能否成为治疗银屑病的一种方法?目前喜树碱对人角质形成细胞自噬的影响尚不清楚,我们观察喜树碱对HaCaT细胞的自噬诱导作用并进行初步探讨。
材料与方法
一、主要试剂
喜树碱(含量>95%,日本东京化成工业公司)。HaCaT细胞系购于美国ATCC细胞库。二甲基亚砜(DMSO,美国Sigma公司)。胰酶+乙二胺四乙酸(EDTA)消化液、DMEM培养基、胎牛血清(FBS)购自美国Gibco公司。CCK8试剂盒(日本同仁化学公司),兔抗人自噬相关蛋白微管相关蛋白1轻链3(LC3)单克隆抗体(美国Novus公司),兔抗人p62单克隆抗体(美国Proteintech公司),辣根过氧化物酶标记山羊抗兔二抗(美国Santa Cruz公司)。
二、方法
1.细胞培养:HaCaT细胞用含10%FBS的DMEM培养基,在37℃、5%CO2孵箱中培养,取对数生长期的细胞用于各项实验。
2.药物处理及分组:喜树碱以DMSO溶解后,-20℃避光保存,喜树碱存储浓度为10 mol∕L,使用时用DMEM培养液稀释成工作浓度,DMSO的终浓度≤0.1%。HaCaT细胞分为对照组和实验组,实验组喜树碱的浓度分别为5、10、25、50、100、200 nmol∕L,对照组含0.1%DMSO。5、10、25 nmol∕L为低浓度,50、100、200 nmol∕L为高浓度。
3.CCK8检测细胞增殖抑制率:将对数生长期的HaCaT细胞(1×104∕m1)接种于96孔板,于37℃、5%CO2的孵箱中培养24 h;去上清液,实验组每孔加入含不同浓度(5、10、25、50、100、200 nmol∕L)喜树碱的完全培养基100 μl,每一浓度设置6个复孔,分别培养24、48 h后,每孔加入含10 μl CCK8溶液的无血清培养基100 μl,37℃、5%CO2下孵育1 h,在酶标仪450 nm波长下测量各孔吸光度A值,细胞增殖抑制率=[1-(实验组各浓度平均吸光度值-空白组平均吸光度值)∕(对照组平均吸光度值-空白组平均吸光度值)]×100%,实验重复3次取均值。
4.膜联蛋白-异硫氰酸荧光素∕碘化丙锭(Annexin⁃FITC∕PI)双染法流式细胞仪检测细胞凋亡:取对数生长期的HaCaT细胞按2×105∕ml接种于6孔板中,培养24 h后,弃上清,实验组加入含有不同浓度喜树碱的完全培养基继续培养24 h。细胞用不含EDTA的胰酶消化收集,离心后,用1 ml磷酸盐缓冲液(PBS)清洗细胞2次,弃上清,加入300 μl结合缓冲液重悬细胞,加入5 μl AV⁃FITC混匀后,室温避光孵育10~15 min。上机前,加入5 μl碘化丙锭,开始检测。实验重复3次取均值。
5.Western印迹检测LC3、p62蛋白表达水平:细胞处理同上。去除培养液,用PBS洗涤细胞2遍。加入适量含蛋白酶抑制剂的RIPA裂解液,充分裂解后,高速离心,取上清。用BCA试剂盒检测蛋白浓度。将上样缓冲液与蛋白混合,煮沸。取50 μg蛋白样品进行电泳,转膜。将转有蛋白的聚偏二氟乙烯膜(PVDF)用3%BSA室温封闭2 h,再用稀释过的相应一抗4℃孵育过夜,用二抗孵育2 h后进行化学发光显影。实验重复3次取均值。
6.间接免疫荧光法检测自噬标志蛋白LC3:收集对数生长期细胞,以1×105∕ml的密度接种于内置14 mm盖玻片的24孔板,每孔500 μl,待细胞贴壁以后,加入喜树碱浓度为10 nmol∕L的培养液,并设置只加入0.1%DMSO的对照组,继续培养24 h,PBS洗涤,4%甲醛室温固定10 min,PBS洗涤2次,0.5%Triton X⁃100室温作用5 min,PBS洗涤2次,5%BSA室温封闭1 h,加入LC3抗体(1∶200),阴性对照以PBS代替一抗,室温孵育1 h,PBS洗涤2次,加入相应荧光二抗,PBS洗涤,加入DAPI,PBS洗涤,甘油封片,荧光显微镜观察。实验重复3次取均值。在核周和胞质出现3个以上高密度绿色荧光点为自噬体阳性细胞。在显微镜(×200)下随机选取5个视野,统计每个视野中自噬体阳性的细胞数,计算阳性细胞百分率。
7.统计学分析:用SPSS 16.0进行统计分析,计量资料以±s表示。各均数经Levene检验方差齐。不同浓度喜树碱对细胞增殖抑制以及凋亡的总体差异用单因素方差分析,组间的多重比较用Dunnett t检验,自噬体阳性细胞率比较采用独立样本t检验。P<0.05为差异有统计学意义。
结果
一、不同浓度喜树碱对HaCaT细胞增殖的影响
0.1%DMSO对照组、5、10、25、50、100、200 nmol∕L喜树碱对细胞的增殖抑制率在24 h分别为(1.51± 0.59)%、(3.21±0.78)%、(3.79±1.17)%、(5.59± 1.23)%、(31.23±1.00)%、(54.21±8.10)%、(66.75± 10.70)%。与DMSO组相比,50、100、200 nmol∕L组差异均有统计学意义(F=55.05,P<0.001)。各组增殖抑制率在48 h分别为(2.10±0.88)%、(2.62± 0.86)%、(2.80±1.03)%、(25.81±5.99)%、(44.35± 5.32)%、(65.81±8.28)%、(73.23±9.59)%,与DMSO组相比,25、50、100、200 nmol∕L组差异有统计学意义(F=86.78,P<0.001),喜树碱对HaCaT细胞增殖抑制作用呈时间和浓度依赖性。见表1。
表1 不同浓度喜树碱作用HaCaT细胞24 h、48 h增殖抑制率(%,±s)
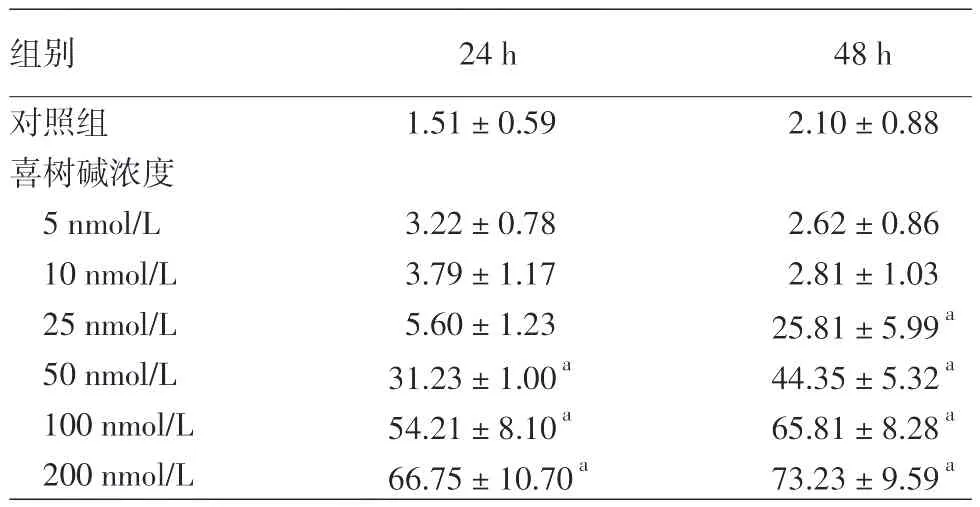
表1 不同浓度喜树碱作用HaCaT细胞24 h、48 h增殖抑制率(%,±s)
注:n=3,a:与同时段对照组比较,P<0.001
组别对照组喜树碱浓度5 nmol∕L 10 nmol∕L 25 nmol∕L 50 nmol∕L 100 nmol∕L 200 nmol∕L 24 h 1.51±0.59 48 h 2.10±0.88 3.22±0.78 3.79±1.17 5.60±1.23 31.23±1.00a 54.21±8.10a 66.75±10.70a 2.62±0.86 2.81±1.03 25.81±5.99a 44.35±5.32a 65.81±8.28a 73.23±9.59a
二、不同浓度喜树碱对HaCaT细胞凋亡的影响
以Annexin V阳性细胞为凋亡细胞,对照组凋亡率为(3.80±0.13)%,5、10、25、50、100、200 nmol∕L喜树碱作用HaCaT细胞24 h,其凋亡率分别为(4.02± 0.09)%、(4.19±1.01)%、(5.25±0.60)%、(14.46± 2.38)%、(19.15±1.59)%、(29.88±1.37)%。与对照组相比,50、100、200 nmol∕L组的凋亡率差异有统计学意义(F=186.90,P<0.001)。见表2。
表2 不同浓度喜树碱作用HaCaT细胞24 h凋亡率(%,±s)

表2 不同浓度喜树碱作用HaCaT细胞24 h凋亡率(%,±s)
注:n=3,a:与对照组比较,P<0.001
组别对照组喜树碱浓度5 nmol∕L 10 nmol∕L 25 nmol∕L 50 nmol∕L 100 nmol∕L 200 nmol∕L 24 h(%)3.80±0.13 4.02±0.09 4.20±1.01 5.25±0.60 14.46±2.38a 19.15±1.59a 29.88±1.37a
三、喜树碱作用于HaCaT细胞后LC3、p62蛋白的表达
不同浓度喜树碱作用于HaCaT细胞24 h,LC3⁃Ⅱ蛋白在喜树碱为5、10 nmol∕L浓度时表达上调最为显著,50、100、200 nmol∕L组LC3⁃Ⅱ表达下调。p62蛋白表达以5、10 nmol∕L喜树碱组下调明显。见图1。
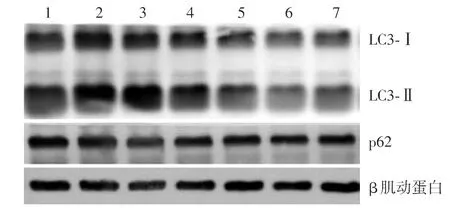
图1 不同浓度喜树碱对HaCaT细胞LC3、p62表达的影响 1:对照组;2:5 nmol∕L喜树碱;3:10 nmol∕L喜树碱;4:25 nmol∕L喜树碱;5:50 nmol∕L喜树碱;6:100 nmol∕L喜树碱;7:200 nmol∕L喜树碱
四、喜树碱作用后自噬水平的变化
以10 nmol∕L喜树碱处理细胞24 h,LC3间接免疫荧光染色显示细胞核及胞质呈现高密度绿色荧光点,喜树碱处理组绿色荧光较对照组增强。见图2。对照组和实验组自噬体阳性细胞百分率分别为(6.23±0.92)%、(36.67±4.55)%,差异有统计学意义(t=6.546,P=0.003)。
讨论
喜树碱具有抗肿瘤活性,对多种肿瘤细胞有促凋亡作用,它可使DNA链不能正常闭合,引起非致死性DNA单链断裂,阻断DNA合成,使细胞周期停滞在S期,最终导致细胞死亡;另外,喜树碱还通过抑制细胞端粒酶活性诱导细胞凋亡[6⁃7]。喜树碱的外用制剂主要用于治疗慢性斑块型银屑病,其治疗机制主要是诱导角质形成细胞凋亡,并且促进角质形成细胞终末分化,临床上有较为满意的疗效[8]。细胞自噬是一种普遍存在于真核细胞中的保护性机制,细胞自噬通过形成自噬溶酶体来清除失去功能和变性受损的细胞器、大分子物质以及入侵的微生物等,维持细胞的稳态和更新[9⁃10]。LC3是自噬的特征性标志物,哺乳动物LC3和酵母自噬相关基因(ATG)8为同源物,它包括LC3⁃Ⅰ、LC3⁃Ⅱ两种形式,LC3⁃Ⅰ以溶解状态存在于胞质中,当细胞自噬发生时,LC3⁃Ⅰ被泛素化加工修饰后,与自噬泡膜表面脑磷脂酰乙醇胺相结合,从而形成LC3⁃Ⅱ,LC3⁃Ⅱ特异地定位于自噬前体及自噬体的内外膜上,因此,其含量的高低可反映细胞自噬水平[11]。抗代谢药如5氟尿嘧啶、雷帕霉素等可诱导细胞产生自噬[12⁃13],同为抗代谢药的羟喜树碱可诱导人Tenon囊成纤维细胞发生自噬[14]。

图2 间接免疫荧光检测LC3观察自噬体形成 对照组LC3绿色荧光弥散分布于胞质中,10 nmol∕L喜树碱作用细胞24 h可见LC3绿色荧光聚集成较大的绿色荧光点,分布于核周及胞质中2A:10 nmol∕L喜树碱组(×100);2C:对照组(×100);2B、2D:分别为A、C的局部放大(×400)
本研究中,25、50、100、200 nmol∕L喜树碱均能抑制HaCaT细胞的增殖,并且随着药物浓度和作用时间的增加,其对细胞的增殖抑制作用增强,呈时间和浓度依赖性,5、10 nmol∕L喜树碱对HaCaT细胞增殖几乎不产生影响,与以往研究一致[15]。50、100、200 nmol∕L喜树碱作用于HaCaT细胞24 h,细胞凋亡率明显增加,且与浓度呈正相关,而5、10、25 nmol∕L喜树碱对细胞凋亡没有显著影响。在诱导细胞自噬方面,5、10 nmol∕L喜树碱作用24 h可引起HaCaT细胞产生自噬,LC3⁃Ⅱ蛋白表达升高,p62水平下降,免疫荧光可见LC3绿色荧光聚集点增多,透射电镜可观察到双层膜的自噬体机构,证明细胞的自噬水平升高,p62的降解增加[16],在此浓度下,药物对细胞的增殖产生轻度的抑制,对细胞凋亡几乎不产生影响。本研究表明,喜树碱在低浓度下诱导细胞产生自噬,而高浓度喜树碱对细胞主要为促凋亡作用。研究表明,自噬和凋亡存在十分密切的关系,在不同的研究体系中,自噬和凋亡可能共同促进细胞的死亡,也可能是相互抑制,自噬可通过抑制凋亡而使细胞继续存活[17]。因此我们推测,低浓度喜树碱对HaCaT细胞主要为诱导产生自噬,自噬对凋亡可能有一定的抑制作用,而在高浓度喜树碱条件下,对细胞的凋亡作用占主导,自噬水平降低,此时凋亡对自噬产生抑制效应。本研究提示,喜树碱可在对细胞增殖、凋亡不产生影响的浓度范围内诱导HaCaT细胞自噬,该浓度喜树碱治疗银屑病的作用机制可能区别于诱导细胞凋亡的机制。然而,喜树碱诱导HaCaT细胞自噬的机制以及自噬与角质形成细胞的增殖、分化、炎症的关系尚待更深入的研究。
[1]Perera GK,Di Meglio P,Nestle FO.Psoriasis[J].Annu Rev Pathol,2012,7:385⁃422.DOI:10.1146∕annurev⁃pathol⁃011811⁃132448.
[2]Jo EK,Shin DM,Choi AM.Autophagy:cellular defense to excessive inflammation[J].Microbes Infect,2012,14(2):119⁃25.DOI:10.1016∕j.micinf.2011.08.014.
[3]中国医师协会皮肤科医师分会中西医皮肤科亚专业委员会.中成药治疗寻常性银屑病专家共识(2014)[J].中华皮肤科杂志,2014,47(3):154⁃156.DOI:10.3760∕cma.j.issn.04124030. 2014.03.018.
[4]Haruna K,Suga Y,Muramatsu S,et al.Differentiation⁃specific expression and localization of an autophagosomal marker protein(LC3)in human epidermal keratinocytes[J].J Dermatol Sci, 2008,52(3):213⁃215.DOI:10.1016∕j.jdermsci.2008.07.005.
[5]Lee HM,Shin DM,Yuk JM,et al.Autophagy negatively regulates keratinocyte inflammatory responses via scaffolding protein p62∕SQSTMl[J].J Immunol,2011,186(2):1248⁃1258.DOI: 10.4049∕jimmunol.1001954.
[6]郭晓鹏,冯思良,王金辉,等.拓扑异构酶1及其喜树碱类抑制剂的临床研究进展[J].国际药学研究杂志,2013,40(4):405⁃414.DOI:10.13220∕j.cnki.jipr.2013.04.013.
[7]Liu X,Lin J,Bao Y,et al.Camptothecin⁃mediated apoptosis and antiproliferation effect is accompanied by down⁃regulation of telomerase activity in HaCaT cells[J].J Dermatol Sci,2006,42(3):262⁃264.DOI:10.1016∕j.jdermsci.2006.02.003.
[8]赵婕,朱桂芝,宋文荣,等.喜树碱软膏治疗银屑病47例[J].中华皮肤科杂志,1999,32(2):134⁃135.DOI:10.3760∕j.issn:0412⁃4030.1999.02.035.
[9]White E,Karp C,Strohecker AM,et al.Role of autophagy in suppression of inflammation and cancer[J].Curr Opin Cell Biol, 2010:22(2):212⁃217.DOI:10.1016∕j.ceb.2009.12.008.
[10]Mizushima N,Komatsu M.Autophagy:renovation of cells and tissues[J].Cell,2011,147(4):728⁃741.DOI:10.1016∕j. cell.2011.10.026.
[11]Levine B,Klionsky DJ.Development by self⁃digestion:molecular mechanisms and biological functions of autophagy[J].Dev Gell, 2004,6(4):463⁃477.DOI:10.1016∕S1534⁃5807(04)00099⁃1.
[12]Pan X,Zhang X,Sun H,et al.Autophagy inhibition promotes 5⁃fluorouraci⁃induced apoptosis by stimulating ROS formation in human non⁃sinail cell lung cancer A549 cells[J].PLoS One, 2013,8(2):e56679.DOI:10.1371∕journal.pone.0056679.
[13]Ravikumar B,Vaeher C,Berger Z,et al.Inhibition of mTOR induces autophagy and reduces toxicity ofpolyglutamine expansions in fly and moose models of Huntington disease[J]. Nat Genet,2004,36(6):585⁃95.DOI:10.1038∕ng1362.
[14]徐心雨,童俊,范舒欣,等.羟喜树碱对体外培养的人Tenon囊成纤维细胞自噬的诱导作用[J].中华实验眼科杂志,2015,33(3):196⁃200.DOI:10.3760∕cma.j.issn.2095⁃0160.2015.03.002.
[15]张梁宇,王翔,陆亚琪,等.喜树碱对HaCaT细胞低氧诱导因子1α表达的影响[J].中华皮肤科杂志,2015,48(6):400⁃403. DOI:10.3760∕cma.j.issn.0412⁃4030.2015.06.010.
[16]Klionsky DJ,Abdalla FC,Abeliovich H,et al.Guidelines for the use and interpretation of assays for monitoring autophagy[J]. Autophagy,2012,8(4):445⁃544.DOI:10.1080∕15548627.2015. 1100356.
[17]Maiuri MC,Zalckvar E,Kimchi A,et al.Self⁃eating and self⁃killing:crosstalk between autophagy and apoptosis[J].Nat Rev Mol Cell Biol,2007,8(9):741⁃752.DOI:10.1038∕nrm2239.
Effects of camptothecin on the autophagy of HaCaT cells
Hao Yangyang,Zhang Liangyu,Wang Xiang,Lu Yaqi,Zhu Xiaoyang,Chen Yang
Department of Dermatology,98th Hospital of People′s Liberation Army,98th Clinical College of People′s Liberation Army,Anhui Medical University,Huzhou 313000,Zhejiang,China(Hao YY,Zhang LY,Lu YQ, Zhu XY,Chen Y);Department of Drug and Equipment,98th Hospital of People′s Liberation Army,98th Clinical College of People′s Liberation Army,Anhui Medical University,Huzhou 313000,Zhejiang,China(Wang X)
Chen Yang,Email:98cy@163.com
Objective To evaluate effects of camptothecin on the autophagy of HaCaT cells. Methods Some cultured HaCaT cells were divided into several groups to be treated with camptothecin at concentrations of 5,10,25,50,100 and 200 nmol∕L,and 0.1%dimethyl sulfoxide(DMSO)(control group),respectively.Cell counting kit⁃8(CCK⁃8)assay was conducted to estimate the proliferative activity of HaCaT cells after 24⁃and 48⁃hour treatment,flow cytometry to evaluate cell apoptosis after 24⁃hour treatment,and Western blot analysis to measure the expression of autophagy⁃related proteins microtubule⁃associated protein 1 light chain 3(LC3)and p62.Some HaCaT cells were divided into 2 groups to be treated with 10 nmol∕L camptothecin and 0.1%DMSO for 24 hours,respectively.Then,indirect immunofluorescence assay(IFA)was performed to determine the LC3 expression.Results Camptothecin at low concentrations of 5 and 10 nmol∕L had no significant effects on the proliferation and apoptosis of HaCaT cells.Compared with the control group,the cellular proliferative rates were significantly inhibited by(31.23±1.00)%,(54.21±8.10)%and(66.75±10.70)%in the 50⁃,100⁃and 200⁃nmol∕L camptothecin groups after 24⁃hour treatment respectively,and by(25.81±5.99)%,(44.35±5.32)%,(65.81±8.28)% and(73.23±9.59)%in the 25⁃,50⁃,100⁃and 200⁃nmol∕L camptothecin groups after 48⁃hour treatment respectively(all P<0.001).After 24⁃hour treatment,the apoptosis rates were significantly higher in the 50⁃, 100⁃and 200⁃nmol∕L camptothecin groups(14.46%±2.38%,19.15% ±1.59%,29.88%±1.37%, respectively)than in the control group(3.80%±0.13%,all P<0.001).After 24⁃hour treatment with 5 and 10 nmol∕L camptothecin,the protein expression of LC3Ⅱwas significantly up⁃regulated,while p62 protein expression was significantly down⁃regulated.IFA showed that the percentage of autophagosome⁃positive cells was significantly higher in the 10⁃nmol∕L camptothecin group than in the control group after 24⁃hour treatment(36.67%±4.55%vs.6.23%±0.92%,t=6.546,P=0.003).Conclusions Camptothecin at low concentrations of 5 and 10 nmol∕L can induce autophagy of HaCaT cells,but has no obvious effects on cell proliferation and apoptosis.Camptothecin at concentrations of 50,100 and 200 nmol∕L can inhibit cell proliferation,promote cell apoptosis,and decrease autophagy levels.
Psoriasis;Camptothecin;Autophagy;Apoptosis;HaCaT cells
陈杨,Email:98cy@163.com
10.3760∕cma.j.issn.0412⁃4030.2017.02.003
全军医学科技青年培育项目(13QNP045);南京军区医学科技创新重点项目(12Z03)
Fund programs:Military Youth Training Program for Medical Science and Technology(13QNP045); Key Project for Medical Science and Technology Innovation of Nanjing Military Area(12Z03)
2016⁃08⁃09)
(本文编辑:吴晓初)

