白细胞介素23在呼吸道合胞病毒感染致Th1、Th2及Th17细胞分化中的作用及机制
冯净净,陈家君,王盛美,揭志军
复旦大学附属上海市第五人民医院呼吸科,上海 200240
·论著·
白细胞介素23在呼吸道合胞病毒感染致Th1、Th2及Th17细胞分化中的作用及机制
冯净净,陈家君,王盛美,揭志军
复旦大学附属上海市第五人民医院呼吸科,上海 200240
本研究旨在探讨白细胞介素23(interleukin 23,IL-23)在呼吸道合胞病毒(respiratory syncytial virus,RSV)感染支气管上皮细胞BEAS-2B后对Th1、Th2和Th17细胞分化的影响及作用机制。将RSV感染BEAS-2B后的上清液与淋巴细胞共孵育,并分别阻断IL-23受体(IL-23 receptor,IL-23R)、IL-23p19亚基及p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)信号通路。应用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测上清液中细胞因子γ干扰素(interferon γ,IFN-γ)、IL-4、IL-17的浓度。同时,应用实时聚合酶链反应(polymerase chain reaction,PCR)检测相关转录因子(t-bet、gata3、rorγt)和信号转导子(stat4、stat6、stat3)的表达。结果显示,RSV感染后IFN-γ、IL-4和IL-17蛋白表达上调,转录因子及信号转导子的表达也有所增加。阻断IL-23和p38 MAPK信号通路后,Th1、Th2和Th7细胞分泌的细胞因子及转录因子表达均明显下降。结果提示,阻断IL-23后可在基因转导层面抑制RSV感染上皮细胞后诱导的Th1、Th2和Th17细胞分化,此过程可能与p38 MAPK信号通路有关。
呼吸道合胞病毒;白细胞介素23受体;白细胞介素23 p19亚基;p38丝裂原活化蛋白激酶信号通路;T辅助细胞;转录因子
呼吸道合胞病毒(respiratory syncytial virus,RSV)属副黏病毒科肺炎病毒属[1]。RSV感染是儿童肺炎和毛细支气管炎最常见的病因,也是5岁以下幼儿急性呼吸道感染的最重要病原体[2]。临床研究发现,婴幼儿时期因RSV所致毛细支气管炎住院的儿童,成年后发生哮喘的概率显著增加[3]。但目前为止,其发病机制尚未完全明了。
Th17细胞亚群是近年来发现的一种CD4+辅助T细胞亚群,主要分泌白细胞介素17A (interleukin 17A,IL-17A)、IL-17F、IL-21、IL-22等炎性细胞因子,在防御胞外菌感染,介导慢性炎症、自身免疫病和肿瘤等过程中发挥重要作用[4]。虽然众多研究发现Th17细胞参与RSV感染导致的宿主免疫过程,但具体机制还不清楚,其既有促进炎症反应的作用,又具备抑制炎症反应的功能[5-6]。IL-23是促进Th17细胞亚群增殖和分化不可或缺的细胞因子,由一个新发现的蛋白 p19 与 IL-12 共用亚基 p40 组成[7]。随着研究的深入,发现IL-23不仅参与Th17细胞的增殖和分化,还参与其他Th细胞的分化。如在溃疡性结肠炎模型中,IL-23受体(IL-23 receptor,IL-23R)的缺失不仅导致Th17细胞减少,Th1细胞数量也有所减少[8]。在哮喘模型中,IL-23可通过调节Th2细胞发挥作用。Wakashin等[9]发现,即使在IL-17缺乏的情况下,IL-23 也能介导Th2相关细胞因子的生成和气道嗜酸性粒细胞的募集,提示IL-23无须依赖IL-17即可参与气道过敏性炎症。体外实验中,IL-23/IL-23R信号通路能增加Th2细胞的表达[10]。
在本课题组前期研究中,用RSV感染支气管上皮细胞BEAS-2B,收集感染及未感染RSV的BEAS-2B上清液,与正常人淋巴细胞共孵育,通过流式细胞术检测Th1、Th2、Th17细胞,发现RSV感染后Th1、Th2及Th17细胞均增加。同时还发现,阻断淋巴细胞表面IL-23R后,不仅Th17细胞分化受抑制,Th1和Th2细胞分化也显著受抑制[11]。IL-23通过何种途径影响Th1和Th2细胞分化,猜测阻断IL-23R后,Th1和Th2细胞分化的信号途径被抑制,导致Th1和Th2细胞数量降低。本研究同时阻断IL-23p19,观察其对后续Th细胞系信号转录因子的影响。
p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)是MAPK家族成员之一,通过对细胞内信号的传递,参与细胞对外界刺激的调节反应,是细胞外多种刺激传向胞内信号转导通路的交汇点,抑制MAPK信号转导通路能减少炎性细胞因子的释放。本研究采用p38 MAPK通路抑制剂(SB203580),探讨该信号通路在RSV感染后Th1、Th2和Th17细胞系转录因子及所分泌的细胞因子γ干扰素(interferon γ,IFN-γ)、IL-4、IL-17变化中的作用。
1 材料与方法
1.1 材料
1.1.1试剂DMEM培养基、杜氏磷酸盐缓冲液(Dulbecco’s phosphate buffered saline,DPBS)购自Hyclone公司,胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,RNA抽提试剂盒Qiagen RNeasy Min Kit、反转录-聚合酶链反应(reverse transcriptase-polymerase chain reaction,RT-PCR)试剂盒 One Step PrimeScript RT-PCR Kit购自宝生物工程(大连)有限公司,p38 MAPK 抑制剂SB203580购自Sigma Aldrich公司,IL-23R及对照抗体购自Santa Cruz Biotechnology公司,IL-23p19及对照抗体购自eBioscience公司,刺激剂佛波酯(phorbol-12-myristate-13-acetate,PMA)和离子霉素(ionomycin)购自美国BD公司,人细胞因子INF-γ、IL-4和IL-17检测用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自欣博盛生物科技有限公司。
1.1.2病毒和细胞RSV A2 株由上海中医药大学喻晓惠赠,来自美国标准生物品收藏中心(American Type Culture Collection,ATCC);人喉癌上皮细胞Hep-2、永生型人支气管上皮细胞BEAS-2B由复旦大学附属上海市公共卫生临床中心保存。 Hep-2细胞于含10% FBS的DMEM培养基中,37 ℃、5% CO2培养。待细胞长满单层,将RSV接种于Hep-2细胞,继续在含2% FBS的DMEM维持液中培养,3~5 d后细胞可出现病变,待病变达80%时收获病毒,测半数组织培养感染剂量(50% tissue culture infective dose,TCID50)为1×107/mL时,冻存于-80 ℃备用[12]。
1.2 方法
1.2.1RSV感染BEAS-2B细胞BEAS-2B细胞于含10% FBS的DMEM培养基中,5% CO2、37 ℃培养。将BEAS-2B细胞接种于24孔板,每孔2×105个,每孔培养体积1 mL;次日观察上皮细胞贴壁达60%~70%,弃培养基,用DPBS洗2次;加入感染复数(multiplicity of infection,MOI)为5的RSV悬液300 μL,轻轻摇匀,置37 ℃培养箱中吸附2 h(每30 min轻摇培养瓶1次);弃去未吸附的病毒液,用DPBS洗细胞2次,加入细胞培养液,72 h后收集细胞培养上清液,800g离心5 min去除细胞杂质。
1.2.2RSV感染BEAS-2B细胞的上清液与淋巴细胞共孵育分离健康人外周血单核细胞,培养箱中静置3 h。因巨噬细胞为贴壁细胞,悬浮的细胞即为淋巴细胞,3 h后轻轻收取悬浮的淋巴细胞。用正常和感染RSV 72 h的BEAS-2B细胞上清液分别处理淋巴细胞,分为6组进行以下干预。①淋巴细胞组(L组):用1 mL正常BEAS-2B细胞上清液重悬淋巴细胞,调整细胞密度为2×106/mL;②RSV+淋巴细胞组(RL组):用1 mL感染RSV的BEAS-2B细胞上清液重悬淋巴细胞,调整细胞密度为2×106/mL;③RSV+淋巴细胞+anti-IL-23R组(RL+aIL-23R组):先将抗anti-IL-23R(5 μg/孔)加入淋巴细胞作用1 h,后加至1 mL感染RSV的BEAS-2B细胞上清液中,调整细胞密度为2×106个/mL;④RSV+淋巴细胞+anti-IL-23R对照抗体组(RL+aIL-23R cab组):先将抗anti-IL-23R(5 μg/孔)对照抗体anti-rabbit IgG加入淋巴细胞中作用1 h,后加至1 mL感染RSV的BEAS-2B细胞上清液中,调整细胞密度为2×106个/mL;⑤RSV+淋巴细胞+anti-IL-23p19组(RL+aIL-23p19组):先将抗anti-IL-23p19(0.5 μg/孔)加入BEAS-2B细胞上清液中作用1 h,后加入淋巴细胞,调整细胞密度为2×106个/mL;⑥RSV+淋巴细胞+anti-IL-23p19对照抗体组(RL+aIL-23p19 cab组):先将抗anti-IL-23p19(0.5 μg/孔)对照抗体mouse IgG1加入BEAS-2B细胞上清液中作用1 h,后加入淋巴细胞,调整细胞密度为2×106个/mL。
干预淋巴细胞时,各组同时加入PMA(50 ng/mL)和离子霉素(1 μg/mL)以激活淋巴细胞,培养箱中作用12 h,然后收集淋巴细胞及上清液。
1.2.3阻断p38MAPK信号通路后Th细胞相关转录因子的变化淋巴细胞的获取步骤同前,实验分两组:RSV+淋巴细胞组(RL组)和RSV+淋巴细胞+SB203580组(RL+SB203580组)。先将20 μmol/L[13]SB203580加入淋巴细胞中作用1 h,后加至1 mL感染RSV的BEAS-2B细胞上清液中。后续步骤同前。
1.2.4ELISA检测各组上清液中IL-17、IL-4、IFN-γ的变化按ELISA试剂盒说明书检测细胞培养上清液中IFN-γ、IL-4、IL-17表达水平。
1.2.5实时PCR检测淋巴细胞中Th1、Th2和Th17细胞分化相关转录因子根据说明书步骤抽提各组淋巴细胞总RNA,实时定量PCR检测Th1、Th2、Th17细胞亚群分化相关转录因子(t-bet、gata3、rorγt)和信号转导子(stat4、stat6、stat3)的变化,GAPDH作为管家基因。反应体系共25 μL,包括2×Buffer 12.5 μL、ExTaqHS 0.5 μL、Enzyme Mix 0.5 μL、上下游引物各0.75 μL、H2O 6.25 μL、RNA模板2.5 μL,用VII7扩增仪进行。反应条件为:反转录42 ℃ 30 min,预变性95 ℃ 1 min,然后变性95 ℃ 5 s,退火延伸60 ℃ 30 s,40个循环。于退火延伸温度时收集荧光信号,绘制溶解曲线。引物序列见表1。将每个反应管内荧光信号达设定域值时所经历的循环数(cycle threshold,CT),经2-ΔΔCT计算,获得相对表达量。实验技术路线见图1。
1.3 统计学分析
采用 GraphPad Prism 5 统计软件处理数据,数据以mean±SEM表示,两组间比较用独立样本t检验。组间数据为非正态分布或方差不齐时,采用多个独立样本的Kruskal-WallisH检验,P<0.05为有显著性差异。
表1PCR引物
Tab.1PrimersusedforPCR

PrimerSequence(5'-3')Size(bp)GAPDHF5'-ACGGATTTGGTCGTATTGGG-3'218R5'-ATCTCGCTCCTGGAAGATGG-3'T-betF5'-CCTGTTGTGGTCCAAGTTCA-3'129R5'-GAAGGACAGGAATGGGAACA-3'GATA3F5'-GGGCAATCAGTGTTACCGTT-3'278R5'-ACCACCTTAGGCCAACTGAA-3'STAT4F5'-AATCAGCAAATGGGAGCCTGTC-3'116R5'-CTGCGTTTCAAAGCTGATGGAG-3'STAT3F5'-ACCAGCAGTATAGCCGCTTC-3'106R5'-GCCACAATCCGGGCAATCT-3'RORγtF5'-CCAGTCCACTGATCTTGGGT-3'278R5'-CAAGAGAGGTTCTGGGCAAG-3'STAT6F5'-GCACTGACTGGAAGGGAAGT-3'145R5'-AACCTGTGCTCTTACCCAGC-3'

图1实验技术路线
Fig.1Schemeoftheexperimentalroute
2 结果
2.1 上清液中IFN-γ、IL-4、IL-17的变化
ELISA结果显示,RSV感染BEAS-2B细胞的上清液能使淋巴细胞分泌IFN-γ、IL-4、IL-17增多,但阻断IL-23受体及亚基p19后,IFN-γ、IL-4、IL-17表达均有所下降,不同阻断剂之间无明显差异(图2)。
2.2Th1、Th2和Th17细胞分化相关转录因子的变化
与对照组相比,RNA水平上RSV感染的BEAS-2B细胞上清液使Th1、Th2和Th17细胞分化相关转录因子(t-bet、gata3、rorγt)和信号转导子(stat4、stat6、stat3)表达均有不同程度的升高。不论阻断IL-23受体还是阻断亚基p19,Th1、Th2和Th17细胞的信号转导途径均被不同程度抑制,不同阻断剂之间Th1、Th17细胞相关转录因子(t-bet、rorγt)和信号转导子(stat4、stat3)的表达无显著差异。但阻断IL-23p19后,Th2细胞分化相关转录因子gata3及信号转导子stat6较阻断IL-23R有更明显的下降趋势(图3)。
2.3阻断p38MAPK信号通路后Th1、Th2、Th17细胞分泌细胞因子及相关转录因子的变化阻断p38 MAPK信号通路后,Th1、Th2和Th17细胞分泌IFN-γ、IL-4、IL-17均有不同程度下降。Th1、Th2和Th17细胞亚群分化相关转录因子(t-bet、gata3、rorγt)和信号转导子(stat4、stat6、stat3)mRNA的表达也均有不同程度下降(图4)。
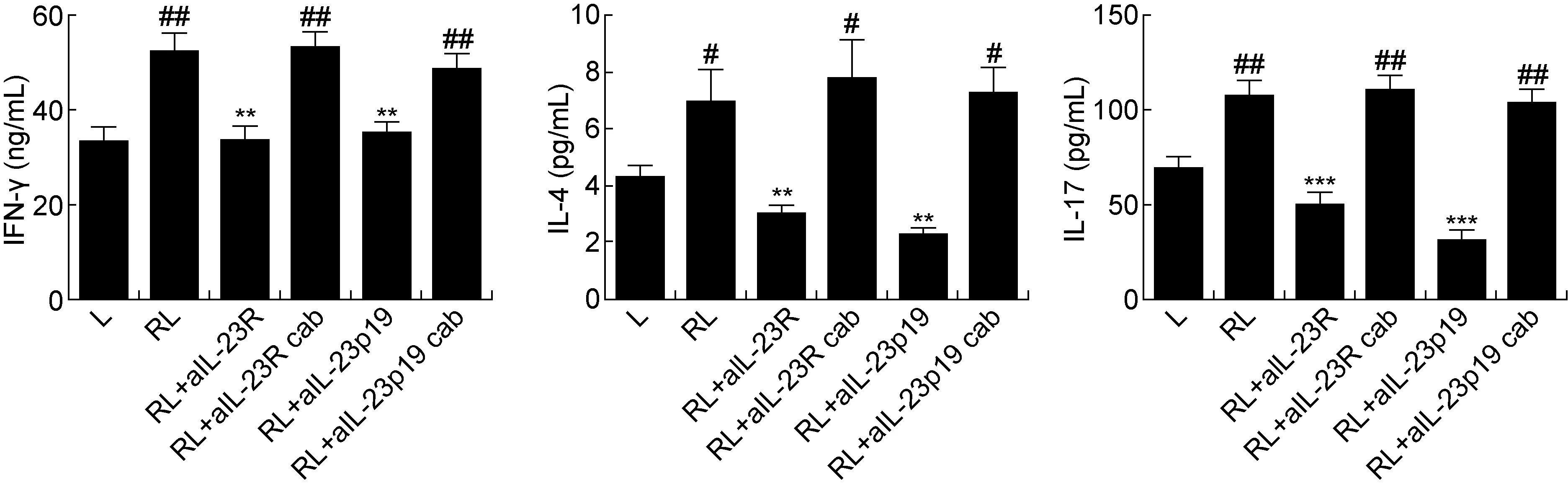
#P<0.05,##P<0.01 compared with L group;*P<0.05,**P<0.01 compared with RL group.
图2阻断淋巴细胞表面IL-23R、培养体系IL-23p19后IFN-γ、IL-4、IL-17分泌的变化
Fig.2ConcentrationsofIFN-γ,IL-4andIL-17insupernatantsafterblockageofIL-23RandIL-23p19

#P<0.05,##P<0.01 compared with L group;*P<0.05,**P<0.01 compared with RL group;△P<0.05,△△△P<0.001.
图3阻断淋巴细胞表面IL-23R、培养体系IL-23p19后Th1、Th2和Th17细胞相关转录因子的变化
Fig.3RelativeexpressionsoftranscriptionfactorsinlymphocytesafterblockageofIL-23RandIL-23p19

*P<0.05,**P<0.01,***P<0.001 compared with RL group.
图4阻断p38MAPK信号通路后Th1、Th2和Th17细胞分泌细胞因子及相关转录因子的变化
Fig.4ConcentrationsofIFN-γ,IL-4andIL-17insupernatantsandrelativeexpressionsoftranscriptionfactorsinlymphocytesafterblockageofp38MAPKsignalpathway
3 讨论
人支气管上皮细胞受感染后能分泌前炎性细胞因子,从而激活宿主的免疫防御机制。RSV无论感染原代气道上皮细胞(primary airway epithelial cell,AEC)还是气道上皮细胞系BEAS-2B,均能产生IL-8、IL-6、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)等介质[14]。本课题组前期研究发现,RSV感染BEAS-2B细胞后,能刺激细胞分泌Th1和Th17分化相关的细胞因子IL-12、IL-23、IL-6、转化生长因子β(transforming growth factor β, TGF-β),在这些细胞因子的作用下引起Th细胞亚群的异常漂移。Qin 等[15]建立RSV持续感染人气道上皮细胞(human bronchial epithelial cell,HBEC)模型,其上清液能促使Th细胞亚群向Th1、Th2、Th17方向分化。本课题组前期研究也发现,RSV感染BEAS-2B细胞的上清液使Th1、Th2、Th17细胞分化增加,但阻断IL-23/IL-23R通路后,三细胞系的比例均下降。本研究沿用以前建立的实验体系,即通过建立体外RSV感染BEAS-2B细胞模型,将RSV感染的上皮细胞上清液与人外周淋巴细胞共孵育,分别阻断淋巴细胞表面IL-23R和IL-23p19,检测Th细胞分化相关调控基因的变化,以探讨阻断IL-23后三细胞系下降的原因。
结果显示,RSV感染后三细胞系分泌的细胞因子IFN-γ、IL-4和IL-17均有不同程度升高。相应地,相关转录因子在RSV刺激下表达较对照组有所增加。阻断IL-23后,三细胞系分化相关转录因子均有不同程度下降,表明IL-23可在基因转导层面影响三细胞系的分化。很多研究证实,Th1与Th17细胞关系密切,且IL-23在其中起重要作用。Ahern等[8]发现,缺失IL-23R信号后,炎症性肠病中Th1和Th17细胞数量有所减少。近期动物实验证实,Th17有向Th1细胞转化的可塑性[16]。人Th17细胞表面不但表达CCR6和IL-23R,还表达IL-12Rβ2和CD161,以及Th1和Th17细胞相关转录因子t-bet和rorc。一部分细胞同时能产生IFN-γ和IL-17A,称为Th1/Th17细胞[17]。本研究结果也显示,阻断IL-23后Th1和Th17细胞相关转录因子(t-bet、rorγt)和信号转导子(stat4、stat3)的基因表达有所下降。不同的阻断途径,即阻断IL-23R与IL-23p19之间,两系细胞转录因子的表达无显著差异。
IL-23与Th2细胞亚群的关系也非常密切。Wakashin等[9]研究显示,不论是正常小鼠还是IL-17缺乏小鼠,IL-23均能介导抗原诱导的Th2细胞因子产生和气道嗜酸性粒细胞募集,提示IL-23可能不依赖IL-17途径调节过敏性气道炎症。Peng等[10]的研究也证明,IL-23缺乏可通过减少嗜酸性粒细胞募集和Th2细胞产生来减轻气道炎症反应,T细胞特异性IL-23R 的过度表达能加重Th2样反应和气道炎症,缺乏IL-23能部分抑制Th2细胞的分化,IL-23敲除小鼠脾细胞中Th2细胞亚群的量也显著减少;体外实验表明,IL-23能独立调控Th2细胞的致病作用,而不通过它促进Th17细胞的作用,IL-23/IL-23R信号能促使GATA-3和Th2细胞因子的表达。Cosmi等[18]发现,有少部分细胞能同时分泌IL-17A和IL-4,即Th17/Th2细胞,其表面可少量表达IL-23R。因此,阻断IL-23后,Th2细胞相关转录因子gata3、stat6及特异分泌因子IL-4的表达也降低。本研究还显示,相对于阻断IL-23R,阻断IL-23p19后IL-4分泌有更下降的趋势,但无统计学意义,而转录因子和信号转导子gata3及stat6明显下降。可能相对于蛋白层面,基因层面表现得更突出、更敏感。但阻断IL-23p19导致Th2细胞转录因子进一步下降的原因还不清楚,是否IL-23p19的阻断影响其他途径的Th2细胞产生方式,还需进一步研究。
MAPK是多种细胞外刺激传向胞内信号通路的交汇处。p38 MAPK是MAPK家族成员之一,抑制MAPK信号通路能减少炎性细胞因子的释放。Janus激酶/信号转导和转录活化因子(Janus kinase/signal transducer and activator of transcription, JAK/STAT)信号通路在多种炎症性疾病中也发挥重要作用。Shan等[19]研究发现,胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin, TSLP)可通过MAPK和STAT3信号通路刺激人气道平滑肌细胞表达炎性细胞因子。Wang等[20]研究发现,人肺微血管内皮细胞在组织缺氧情况下分泌IL-6,IL-6激活JAK/STAT途径,抑制p38 MAPK信号通路,可抑制IL-6产生,从而使p-STAT3减少。这些研究提示,STAT3与 p38 MAPK信号通路可能相关。Choi等[21]研究表明,p38 MAPK信号通路的激活与RSV和甲型流感病毒的感染及复制关系密切,抑制该信号通路后可抑制两种病毒复制。Migita等[22]发现,血清类淀粉样蛋白A能刺激类风湿关节炎患者滑膜细胞分泌IL-23p19,该过程可被p38 MAPK抑制剂完全抑制,推测RSV感染引起的IL-23分泌可能是通过p38 MAPK信号途径。本研究通过阻断淋巴细胞中p38 MAPK信号通路,观察其对RSV感染导致Th细胞系分泌细胞因子及转录因子升高的影响。结果显示,三系细胞分泌的细胞因子及分化相关转录因子在SB203580作用下均表达下降,与阻断IL-23的结果一致,提示阻断IL-23信号导致的三系细胞分泌细胞因子下降可能与p38 MAPK信号通路有关。
综上所述,本研究发现RSV感染支气管上皮细胞后,能促进Th1、Th2和Th17相关细胞因子及转录因子的表达,而阻断IL-23或使用p38 MAPK抑制剂能显著抑制这些因子的表达。因此,IL-23在调控RSV感染上皮细胞后诱导的Th1、Th2和Th17细胞分化过程中起重要作用,这可能与p38 MAPK信号通路有关。本研究有助于阐明RSV感染后的宿主免疫反应和免疫调控机制。
[1] Hacking D, Hull J. Respiratory syncytial virus—viral biology and the host response [J]. J Infect, 2002, 45(1): 18-24.
[2] Bezerra PG, Britto MC, Correia JB, Duarte Mdo C, Fonceca AM, Rose K, Hopkins MJ, Cuevas LE, McNamara PS. Viral and atypical bacterial detection in acute respiratory infection in children under five years [J]. PLoS One, 2011, 6(4): e18928.
[3] Sigurs N, Aljassim F, Kjellman B, Robinson PD, Sigurbergsson F, Bjarnason R, Gustafsson PM. Asthma and allergy patterns over 18 years after severe RSV bronchiolitis in the first year of life [J]. Thorax, 2010, 65(12): 1045-1052.
[4] Weaver CT, Harrington LE, Mangan PR, Gavrieli M, Murphy KM. Th17: an effector CD4 T cell lineage with regulatory T cell ties [J]. Immunity, 2006, 24(6): 677-688.
[5] Mukherjee S, Lindell DM, Berlin AA, Morris SB, Shanley TP, Hershenson MB, Lukacs NW. IL-17-induced pulmonary pathogenesis during respiratory viral infection and exacerbation of allergic disease [J]. Am J Pathol, 2011, 179(1): 248-258.
[6] Newcomb DC, Boswell MG, Reiss S, Zhou W, Goleniewska K, Toki S, Harintho MT, Lukacs NW, Kolls JK, Peebles RS. IL-17A inhibits airway reactivity induced by respiratory syncytial virus infection during allergic airway inflammation [J]. Thorax, 2013, 68(8): 717-723.
[7] Oppmann B, Lesley R, Blom B, Timans JC, Xu Y, Hunte B, Vega F, Yu N, Wang J, Singh K, Zonin F, Vaisberg E, Churakova T, Liu M, Gorman D, Wagner J, Zurawski S, Liu Y, Abrams JS, Moore KW, Rennick D, de Waal-Malefyt R, Hannum C, Bazan JF, Kastelein RA. Novel p19 protein engages IL-12p40 to form a cytokine,IL-23,with biological activities similar as well as distinct from IL-12 [J]. Immunity, 2000, 13(5): 715-725.
[8] Ahern PP, Schiering C, Buonocore S, McGeachy MJ, Cua DJ, Maloy KJ, Powrie F. Interleukin-23 drives intestinal inflammation through direct activity on T cells [J]. Immunity, 2010, 33(2): 279-288.
[9] Wakashin H, Hirose K, Maezawa Y, Kagami S, Suto A, Watanabe N, Saito Y, Hatano M, Tokuhisa T, Iwakura Y, Puccetti P, Iwamoto I, Nakajima H. IL-23 and Th17 cells enhance Th2-cell-mediated eosinophilic airway inflammation in mice [J]. Am J Respir Crit Care Med, 2008, 178(10): 1023-1032.
[10] Peng J, Yang XO, Chang SH, Yang J, Dong C. IL-23 signaling enhances Th2 polarization and regulates allergic airway inflammation [J]. Cell Res, 2010, 20(1): 62-71.
[11] Feng J, Hu Y, Song Z, Liu Y, Guo X, Jie Z. Interleukin-23 facilitates Th1 and Th2 cell differentiation in vitro following respiratory syncytial virus infection [J]. J Med Virol, 2015, 87(4): 708-715.
[12] 冯净净, 胡芸文, 宋志刚, 揭志军, 郭雪君.呼吸道合胞病毒感染小鼠Th17细胞亚群的变化 [J].中国呼吸与危重监护杂志, 2013, 12(1): 49-54.
[13] 兰爱平, 梅卫义, 孟金兰, 胡芬, 杨春涛, 杨战利, 陈培熹, 冯鉴强.硫化氢通过抑制p38 MAPK保护PC12细胞对抗化学性缺氧损伤 [J].中国药理学通报, 2010, 26(10): 1339-1343.
[14] Fonceca AM, Flanagan BF, Trinick R, Smyth RL, McNamara PS. Primary airway epithelial cultures from children are highly permissive to respiratory syncytial virus infection [J]. Thorax, 2012, 67(1): 42-48.
[15] Qin L, Hu CP, Feng JT, Xia Q. Activation of lymphocytes induced by bronchial epithelial cells with prolonged RSV infection [J]. PLoS One, 2011, 6(12): e27113.
[16] Lee YK, Turner H, Maynard CL, Oliver JR, Chen D, Elson CO, Weaver CT. Late developmental plasticity in the T helper 17 lineage [J]. Immunity, 2009, 30(1): 92-107.
[17] Annunziato F, Cosmi L, Santarlasci V, Maggi L, Liotta F, Mazzinghi B, Parente E, Filì L, Ferri S, Frosali F, Giudici F, Romagnani P, Parronchi P, Tonelli F, Maggi E, Romagnani S. Phenotypic and functional features of human Th17 cells [J]. J Exp Med, 2007, 204(8): 1849-1861.
[18] Cosmi L, Maggi L, Santarlasci V, Capone M, Cardilicchia E, Frosali F, Querci V, Angeli R, Matucci A, Fambrini M, Liotta F, Parronchi P, Maggi E, Romagnani S, Annunziato F. Identification of a novel subset of human circulating memory CD4+T cells that produce both IL-17A and IL-4 [J]. J Allergy Clin Immunol, 2010, 125(1): 222-230.e1-e4.
[19] Shan L, Redhu NS, Saleh A, Halayko AJ, Chakir J, Gounni AS. Thymic stromal lymphopoietin receptor-mediated IL-6 and CC/CXC chemokines expression in human airway smooth muscle cells: role of MAPKs (ERK1/2, p38, and JNK) and STAT3 pathways [J]. J Immunol, 2010, 184(12): 7134-7143.
[20] Wang G, Qian P, Jackson FR, Qian G, Wu G. Sequential activation of JAKs, STATs and xanthine dehydrogenase/oxidase by hypoxia in lung microvascular endothelial cells [J]. Int J Biochem Cell Biol, 2008, 40(3): 461-470.
[21] Choi MS, Heo J, Yi CM, Ban J, Lee NJ, Lee NR, Kim SW, Kim NJ, Inn KS. A novel p38 mitogen activated protein kinase (MAPK) specific inhibitor suppresses respiratory syncytial virus and influenza A virus replication by inhibiting virus-induced p38 MAPK activation [J]. Biochem Biophys Res Commun, 2016, 477(3): 311-316.
[22] Migita K, Koga T, Torigoshi T, Motokawa S, Maeda Y, Jiuchi Y, Izumi Y, Miyashita T, Nakamura M, Komori A, Ishibashi H. Induction of interleukin-23 p19 by serum amyloid A (SAA) in rheumatoid synoviocytes [J]. Clin Exp Immunol, 2010, 162(2): 244-250.
. JIE Zhijun, E-mail: jiezjlxh@163.com
Roleofinterleukin23infacilitatingTh1,Th2andTh17differentiationafterrespiratorysyncytialvirusinfection
FENG Jingjing, CHEN Jiajun, WANG Shengmei, JIE Zhijun
DepartmentofRespiratoryMedicine,ShanghaiFifthPeople’sHospital,FudanUniversity,Shanghai200240,China
The present paper aims to investigate the role of interleukin 23 (IL-23) in facilitating Th1, Th2 and Th17 differentiation during respiratory syncytial virus (RSV) infection of epithelial cells (BEAS-2B). Lymphocytes were treated by supernatants from BEAS-2B cells with RSV or mock infection. Then they were blocked by specific anti-IL-23R antibody, anti-IL-23p19 antibody and p38 mitogen-activated protein kinase (MAPK) inhibitor (SB203580). The concentrations of cytokines such as interferon γ (IFN-γ), IL-4 and IL-17 were detected by enzyme-linked immunosorbent assay (ELISA). The mRNA expressions of transcription factors (t-bet,gata3,rorγt), signal transducers (stat4,stat6,stat3) were determined by real-time polymerase chain reaction (PCR). The results showed that the concentrations of cytokines (IFN-γ, IL-4 and IL-17) were significantly increased after RSV infection, accompanied with the enhanced expressions of transcription factors. However, these cytokines and transcription factors were significantly decreased when IL-23 pathway was blocked by antibodies. The blockage of p38 MAPK signal pathway showed the same results. The results suggest that IL-23 could facilitate Th1, Th2 and Th17 differentiation in RSV-infected BEAS-2B cells, which might be associated with p38 MAPK signal pathway.
Respiratory syncytial virus; Interleukin 23 receptor;Interleukin 23 p19 subunit; p38 mitogen-activated protein kinase signal pathway; T helper cell; Transcription factor
上海市闵行区自然科学基金(2014MHZ056),上海市卫生和计划生育委员会科研课题(20164Y0264)
揭志军
2017-02-10)

