677例新生儿咽拭子细菌培养及病原菌的耐药性分析
李兆娜, 王萍, 寇晨, 武玮, 王淑荣, 刘尊杰, 韩冬, 张亚南, 张巍, 马建荣
首都医科大学附属北京妇产医院新生儿重症监护室,北京 100026
·论著·
677例新生儿咽拭子细菌培养及病原菌的耐药性分析
李兆娜, 王萍, 寇晨, 武玮, 王淑荣, 刘尊杰, 韩冬, 张亚南, 张巍, 马建荣
首都医科大学附属北京妇产医院新生儿重症监护室,北京 100026
为观察首都医科大学附属北京妇产医院新生儿重症监护室(neonatal intensive care unit,NICU)患儿主要定植细菌及其抗生素耐药情况,以便采取相应措施及时控制医院内感染,本研究选择2014年8月1日—2015年5月31日住院患儿的咽试子标本进行细菌培养,同时进行耐药性分析。677例新生儿咽拭子培养结果显示,230例阳性(34.0%),其中革兰阳性球菌159例(69.1%),革兰阴性杆菌71例(30.9%)。定植细菌中,革兰阳性球菌主要为草绿色链球菌、克氏库克菌及表皮葡萄球菌,革兰阴性杆菌主要为大肠埃希菌、鲍曼不动杆菌及肺炎克雷伯菌。各细菌对常用抗生素的耐药率不同,同时进行药敏试验有助于指导临床用药。
细菌定植;新生儿;新生儿重症监护室
新生儿重症监护室(neonatal intensive care unit,NICU)集中收治危重新生儿患者,是医院内感染的易感人群和易感因素集中场所,其医院内感染的发生率比普通病房高,是医院内感染管理的重点科室,也是预防和控制的重点、难点。研究发现,14.5%的NICU住院新生儿可发生医院内感染[1],其中15%可预防[2]。细菌定植是发生医院内感染的前提,细菌定植率在一定程度上代表了发生该细菌感染的风险。当NICU患儿获得病原菌尤其是多重耐药菌定植后,机体免疫力减低时,定植细菌就可能转变为致病菌而传播[3],从而发生感染,威胁生命安全,影响疾病愈后,严重者可因感染而死亡。因此,了解定植细菌的种类及其耐药性,对有效控制医院内感染具有非常重要的临床意义。
为了解首都医科大学附属北京妇产医院(以下简称本院)NICU细菌定植及其耐药性特点,更有效地控制NICU医院内感染,本研究对2014年8月1日—2015年5月31日NICU住院患儿进行咽部定植细菌研究和耐药性分析,为NICU感染控制及抗生素使用提供一定临床依据。
1 材料与方法
1.1 研究对象
以2014年8月1日—2015年5月31日本院NICU新生儿(住院时间>24 h)作为研究对象,共计677例。所有患儿均在家长签署知情同意书后,于入院时采集咽拭子进行细菌培养。
1.2 研究方法
患儿入院时行咽拭子检查,取样严格按照《全国临床检验操作规程》(第3版)操作。将采集的咽拭子标本送微生物室进行细菌培养,并对培养阳性的优势菌株进行药敏试验。统计分析采用SPSS 22软件,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
1.3 主要仪器及试剂
采用法国Vitek2全自动细菌鉴定仪鉴定细菌,药敏试剂盒均为法国梅里埃公司产品。
2 结果
2.1 一般情况
符合本研究纳入标准的患儿共677例,男368例,女309例。剖宫产患儿396例,自然分娩患儿281例。胎龄27~36周的早产儿共344例,肺炎139例,低出生体重35例,新生儿窒息35例,高胆红素血症54例,湿肺28例,低血糖症29例,肺动脉高压7例,气胸2例,胸腔积液1例,消化道出血1例,胎母输血1例,肺出血1例。患儿出生体重800~4 710 g,其中体重<1 500 g 95例,1 500~2 500 g 232例,>2 500 g 350例。早产儿,低出生体重儿,窒息、肺动脉高压、气胸、胸腔积液、胎母输血、湿肺、肺出血患儿共454例,均为出生后第1天即转入NICU,同时行咽拭子采集。肺炎、高胆红素血症、消化道出血、低血糖患儿,部分出生后即转入NICU,部分由母婴同室转入NICU;全部入院时即行咽拭子采集,其中出生后第1天采集80例,出生后第2天采集53例,出生后第3天采集55例,出生后第4天采集35例。
2.2 细菌培养病原学分析
677例咽拭子培养结果显示,230例细菌培养为阳性,阳性率34.0%。其中,剖宫产患儿141例(61.3%),自然分娩患儿89例(38.7%)。447例细菌培养阴性患儿中,剖宫产患儿255例,自然分娩患儿192例(表1),不同分娩方式之间细菌培养阳性率差异无统计学意义(χ2=1.134,P>0.05)。230例细菌培养阳性菌中,革兰阴性杆菌71例(30.9%),革兰阳性球菌159例(69.1%)。革兰阴性杆菌中前3位分别是大肠埃希菌15株(21.1%),鲍曼不动杆菌12株(16.9%),肺炎克雷伯菌11株(15.5%)。革兰阳性球菌中前3位分别是草绿色链球菌54例(34.0%),克氏库克菌41例(25.8%),表皮葡萄球菌33例(20.8%)(表2)。
表1不同分娩方式患儿中细菌培养结果
Tab.1Cultureresultsofdifferentdeliverymode

分娩方式阳性阴性剖宫产 141255自然分娩89192
χ2=1.134,P=0.287.
2.3 主要细菌药敏试验及耐药性分析
对230例培养阳性的菌株进行耐药性分析,主要革兰阴性杆菌对头孢曲松及头孢唑林耐药率高,对头孢吡肟及哌拉西林/他唑巴坦耐药率低(表3),主要革兰阳性球菌对万古霉素耐药率低,对其他抗生素耐药率较高(表4)。
表2 230株咽部定植细菌的分布和构成比(%)
Tab.2Thedistributionandconstituentratio(%)of230strainsofpharyngealcolonizationbacterium

菌种菌株名称株数(%)革兰阴性大肠埃希菌15(21.1) 杆菌(71株)鲍曼不动杆菌12(16.9)肺炎克雷伯菌11(15.5)嗜麦芽假单胞菌10(14.1)弗氏柠檬酸菌5(7.0)洋葱伯克霍尔德菌5(7.0)阴沟肠杆菌4(5.6)脑膜脓毒性伊丽莎白金菌4(5.6)胶黏罗斯菌2(2.8)铜绿假单胞菌1(1.4)恶臭假单胞菌1(1.4)黏质沙雷菌1(1.4)革兰阳性草绿色链球菌54(34.0) 球菌(159株)克氏库克菌41(25.8)表皮葡萄球菌33(20.8)溶血葡萄球菌11(6.9)粪肠球菌8(5.0)人葡萄球菌亚种5(3.1)金黄色葡萄球菌3(1.9)克里斯廷微球菌2(1.3)路邓葡萄球菌1(0.6)无乳糖链球菌B群1(0.6)
表3主要革兰阴性杆菌对常用抗生素的耐药率(%)
Tab.3Resistancerates(%)ofmainGram-negativebacillitocommonlyusedantibiotics
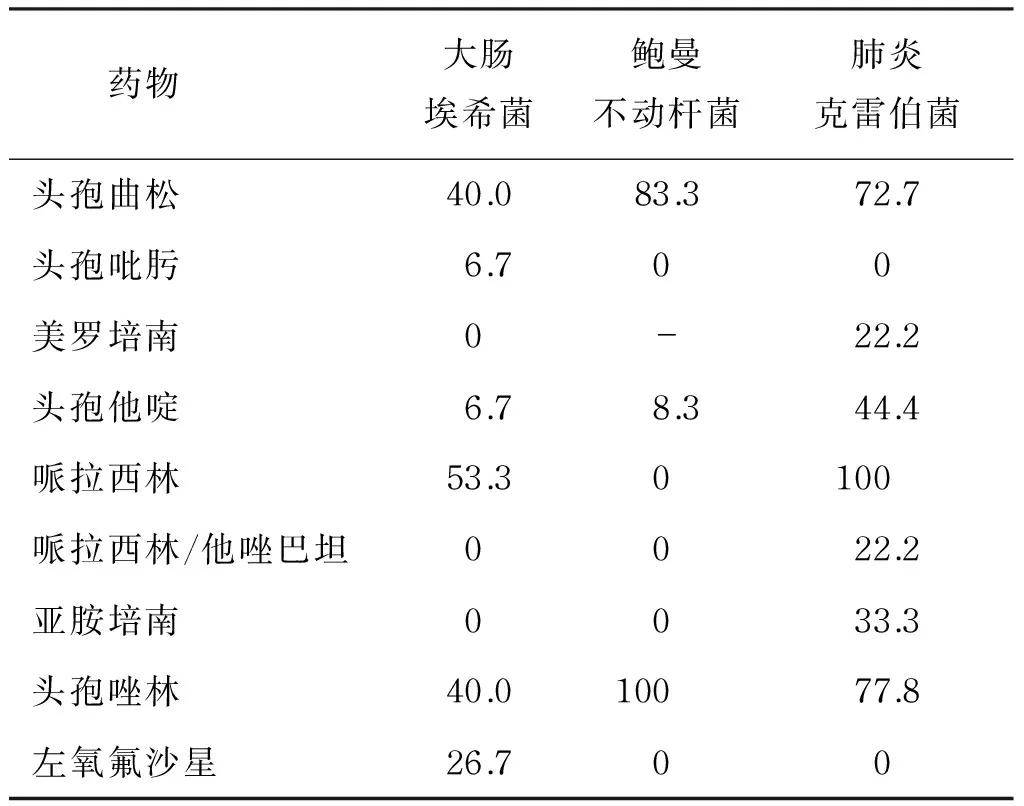
药物大肠埃希菌鲍曼不动杆菌肺炎克雷伯菌头孢曲松40.083.372.7头孢吡肟6.700美罗培南0-22.2头孢他啶6.78.344.4哌拉西林53.30100哌拉西林/他唑巴坦0022.2亚胺培南0033.3头孢唑林40.010077.8左氧氟沙星26.700
表4主要革兰阳性球菌对常用抗生素的耐药率(%)
Tab.4Resistancerates(%)ofmainGram-positivecoccustocommonlyusedantibiotics

药物草绿色链球菌克氏库克菌表皮葡萄球菌万古霉素0-0青霉素--97.0利奈唑胺--0左氧氟沙星--36.3头孢吡肟74.091.4-头孢曲松81.590.2-红霉素77.525.875.6头孢他啶72.793.8-
-:未行药敏试验。
3 讨论
细菌定植是细菌感染的前提,是指从患者体内分离出细菌但没有导致感染的症状。在人体与外界相通的很多部位,存在大量条件致病菌定植。正常足月儿围生期从产道获得细菌定植,出生后通过哺乳,或从医护人员及周围环境中获得细菌定植。出生后第2天咽部获得革兰阳性球菌定植,第3天肠道获得肠球菌及大肠埃希菌定植。Mahul等[4]关于肠杆菌定植路径的研究认为,消化道定植发生在咽部定植前,细菌在咽部定植后,再因微量吸入而发生肺部定植。胃部和粪便细菌监测对新生儿免疫功能障碍起预示作用[5]。新生儿入院时即完成细菌学检测,有助于及早发现宫内和产时发生的细菌定植。NICU细菌定植率高,患儿接触感染源的机会增多,医院内感染的可能性增大。此外,患儿胎龄越小、出生体重越低、住院时间越长,发生医院内感染的机会越多,而医院内感染已成为早产儿后期死亡的主要原因。存在致病菌定植的新生儿发生医院内感染的概率高于无细菌定植的新生儿,致病菌定植与医院内感染密切相关[6-7]。国外有研究报道,定植耐甲氧西林金黄色葡萄球菌发生感染的概率为11%~38%,定植产超广谱 β-内酰胺酶(extended-spectrum β-lactamase,ESBL)革兰阴性杆菌发生感染的概率为25%[8-9]。因此,明确定植菌的种类及其特点有助于对医院内感染的发生发展进行评估及预防。定植菌与导致感染的病原菌未必完全相同,但了解NICU定植菌的分布状态对患儿后期感染的发生有一定预警作用。
本院NICU收治的高危新生儿于出生后即住院,或由母婴同室转入。了解这部分患儿细菌定植状态及分布特点,有助于对医院内感染进行评估、预防、控制和及时治疗。本研究通过对NICU患儿入院后所采集的咽拭子进行细菌培养,监测细菌定植情况,筛选主要定植菌,同时对细菌耐药性进行分析,了解其特点,有助于指导临床用药。
本研究共收集677例患儿咽拭子标本并进行细菌培养,其中230例阳性,阳性率为34%,与国内其他研究报道有较大差异。如张丽红等[10]报道NICU患儿细菌定植率为10.47%,而王晶晶等[11]及陈先云等[12]报道NICU细菌定植率高于70%。陈兴艳等[13]对209例入院新生儿咽拭子进行培养,发现感染性疾病患儿咽拭子阳性率达94.3%,非感染性疾病患儿咽拭子阳性率达74%。对不同分娩方式下的细菌培养结果进行分析,结果显示分娩方式对细菌培养阳性率无明显影响。陈启蓉等[14]研究指出,剖宫产患儿产ESBL肠杆菌阳性率高于自然分娩患儿,而耐甲氧西林金黄色葡萄球菌在剖宫产与自然分娩患儿中的定植无明显差异。本研究中革兰阳性球菌和阴性杆菌分别为159例和71例,阳性球菌为主,主要菌群为草绿色链球菌和克氏库克菌。而刘健慧等[15]研究显示早产儿细菌定植主要为表皮葡萄球菌,张志玲等[16]研究发现NICU主要定植菌为大肠埃希菌、肺炎克雷伯菌等革兰阴性杆菌。各研究中主要定植菌存在较大差异,考虑可能与研究对象为不同群体及地域和纳入标准不同有关。本院NICU主要收治本院分娩的新生儿,出生后即住院或由母婴同室转入,为早期新生儿,而无门诊收治患儿。胎儿大多在子宫内无菌环境中生长发育,适宜细菌生长的pH值为6.8~7.4,正常羊水pH值为7.0~7.5[17],因此一般细菌可在羊水中繁殖,早期感染新生儿的细菌多源自宫内。新生儿出生后,口咽、肠道等各部位获得细菌定植。正常情况下,宿主黏膜表面存在保护机制,阻碍细菌定植,细菌在口咽部定植前需先依赖细菌与组织细胞间的特异识别系统进行识别而黏附[18]。但细菌表面特征及局部微环境异常改变有利于致病菌定植,吸入口咽部定植菌能导致支气管炎、菌血症、深部脓肿、肺炎等一系列疾病[19-20]。因此,对新生儿定植细菌的研究,有利于早期发现感染,及时采取措施。
近年来,由于抗生素在临床上大量应用,病原菌的种类和构成发生了很大改变,对抗生素的敏感性也明显改变。多重耐药菌的检出率逐渐升高,耐药率明显上升,导致临床治疗时间延长,发病率和死亡率增高。因此,监测定植细菌的药物敏感性,对新生儿医院内感染的预防和控制具有重大意义。本研究对培养阳性的细菌进行药敏试验,发现革兰阴性杆菌中占主要地位的大肠埃希菌对美罗培南、亚胺培南及哌拉西林/他唑巴坦敏感,对头孢吡肟的敏感性也较高;鲍曼不动杆菌对头孢曲松、头孢唑啉的耐药率较高,对其他抗生素敏感性均较高;肺炎克雷伯菌对头孢吡肟、左氧氟沙星敏感,对美罗培南敏感性较高。革兰阳性球菌中占主要地位的草绿色链球菌对万古霉素完全敏感,对其他抗生素耐药率较高;克氏库克菌对抗生素的耐药率均较高;表皮葡萄球菌对万古霉素、利奈唑胺敏感,对其他抗生素的耐药率较高。因此,在未明确致病菌前,可根据咽拭子细菌培养及药敏结果初步选取抗生素进行经验治疗。
定植是细菌与宿主之间建立长期共生或无害关系的最后一步,也可转化为细菌感染和疾病发生发展的第一步[21]。细菌定植率随住院时间的延长而上升[16],因此对NICU细菌定植及感染情况进行动态监测,可为医院内感染相关因素的及时发现和控制提供有利条件。早期进行系统的定植细菌检测,及时发现定植的致病菌;对伴有高危因素的患儿进行密切观察随访;发现感染后,根据药敏结果立即选用敏感抗生素杀灭病原菌,将有利于消除感染源,降低医院内感染的发生率。
[1] Brito DV, de Brito CS, Resende DS, Moreira doJ, Abdallah VO, Gontijo Filho PP. Nosocomial infections in a Brazilian neonatal intensive care unit: a 4-year surveillance study [J]. Rev Soc Bras Med Trop, 2010, 43(6): 633-637.
[2] Ligi I, Arnaud F, Jouve E, Tardieu S, Sambuc R, Simeoni U. Iatrogenic events in admitted neonates: a prospective cohort study [J]. Lancet, 2008, 371(9610): 404-410.
[3] 常文秀, 王勇强, 李健, 邢迎红, 曹书华.重症监护病房多器官功能障碍综合征患者医院感染病原菌分布及耐药分析 [J].中华医院感染学杂志, 2008, 18(8): 1175-1178.
[4] Mahul P, Auboyer C, Jospe R, Ros A, Guerin C, El Khouri Z, Galliez M, Dumont A, Gaudin O. Prevention of nosocomial pneumonia in intubated patients: respective role of mechanical subglottic secretions drainage and stress ulcer prophylaxis [J]. Intensive Care Med, 1992, 18(1): 20-25.
[5] Patel K, Konduru K, Patra AK, Chandel DS, Panigrahi P. Trends and determinants of gastric bacterial colonization of preterm neonates in a NICU setting [J]. PLoS One, 2015, 10(7): e0114664.
[6] Apisarnthanarak A, Pinitchai U, Thongphubeth K, Yuekyen C, Warren DK, Fraser VJ. Thammasat University Pandrug-Resistant Acinetobacter baumannii Control Group. A multifaceted intervention to reduce pandrug-resistant Acinetobacter baumannii colonization and infection in 3 intensive care units in a Thai tertiary care center:a 3-year study [J]. Clin Infect Dis, 2008, 47(6): 760-767.
[7] 李茂军, 陈昌辉, 陈先云, 王晓敏, 陈丽娜, 李兰, 李晶.新生儿重症监护室细菌定植和医院感染的监测 [J].实用儿科临床杂志, 2011, 26(10): 762-763, 783.
[8] Toltzis P, Blumer JL. Nosocomial acquisition and transmission of antibiotic-resistant Gram-negative organisms in the pediatric intensive care unit [J]. Pediatr Infect Dis J, 2001, 20(6): 612-618.
[9] Donskey CJ. Antibiotic regimens and intestinal colonization with antibiotic-resistant Gram-negative bacilli [J]. Clin Infect Dis, 2006, 43(Suppl 2): S62-S69.
[10] 张丽红, 柴建华, 常洪美.某院新生儿重症监护室定植菌筛查及临床意义 [J].中国感染控制杂志, 2013, 12(2): 120-122.
[11] 王晶晶.细菌定植与新生儿NICU住院患儿感染之间的关系 [J].中国保健营养(中旬刊), 2013(9): 163-163.
[12] 陈先云, 李茂军, 王晓敏, 林贇, 周娟, 魏道琼.新生儿重症监护病房定植菌筛查临床应用研究 [J].中华医院感染学杂志, 2011, 21(20): 4237-4239.
[13] 陈兴艳, 钟敏, 刘昌桃.209例新生儿入院时咽拭子培养结果分析探讨 [J].四川医学, 2009, 30(10): 1548-1549.
[14] 陈启蓉, 李瑛, 张心梅, 李佳静.新生儿定植菌筛查阳性结果分析及相关因素研究 [J].医学信息, 2016, 29(20): 78-79.
[15] 刘健慧, 王丹华.新生儿重症监护病房早产儿细菌定植的临床研究 [J].中国实用儿科杂志, 2006, 21(1): 41-44.
[16] 张志玲, 卢凤英.新生儿重症监护病房中新生儿细菌定植及其相关因素 [J].岭南急诊医学杂志, 2016, 21(5): 494-496.
[17] 沈关心.微生物学与免疫学 [M].第5版.北京: 人民卫生出版社, 2004: 141-142.
[18] Nayak DM, Kumar N, Bhaskaranand N, Nayak C. Bacterial profile of the oropharynx in infants: an assessment of the confounding factors for colonization [J]. Indian J Pediatr, 2011, 78(7): 807-811.
[19] Niederman MS. Gram-negative colonization of the respiratory tract: pathogenesis and clinical consequences [J]. Semin Respir Infect, 1990, 5(3): 173-184.
[20] El Attar MM, Zaghloup MZ, Elmenoufr HS. Role of periodontitis in hospital-acquired pneumonia [J]. East Mediterr Health J, 2010, 16(5): 563-569.
[21] 李涛, 熊自忠, 徐元宏, 王中新.临床分离大肠埃希菌耐药性监测 [J].中华医院感染学杂志, 2005, 15(2): 207-209.
. MA Jianrong, E-mail: majian3706@163.com
Bacterialcultureofpharyngealswabspecimensfrom677newbornsandanalysisofbacterialdrugresistance
LI Zhaona, WANG Ping, KOU Chen, WU Wei, WANG Shurong, LIU Zunjie, HAN Dong, ZHANG Yanan, ZHANG Wei, MA Jianrong
NeonatalIntensiveCareUnit,BeijingObstetricsandGynecologyHospital,CapitalMedicalUniversity,Beijing100026,China
To establish the characteristics of bacterial colonization and antibiotic resistance in the newborn in Neonatal Intensive Care Unit (NICU) of Beijing Obstetrics and Gynecology Hospital, Capital Medical University, pharyngeal swab specimens of hospitalized newborns in NICU were collected from August 1, 2014 to May 31, 2015, and subjected to bacterial culture and drug resistance analysis. A total of 677 swabs were included in this study and 34.0% were positive on culture detection. Among these positive cases, 159 (69.1%) were Gram-positive cocci, and 71 (30.9%) were Gram-negative bacilli.Streptococcusviridans,KocuriakristinaeandStaphylococcusepidermidiswere the main colonized Gram-positive cocci.Escherichiacoli,AcinetobacterbaumanniiandKlebsiellapneumoniaewere the main colonized Gram-negative bacilli. Drug resistance of the isolates to commonly used antibiotics was studied and presented.
Bacterial colonization; Newborn; Neonatal intensive care unit
马建荣
2017-02-13)

