果寡糖对水飞蓟宾治疗非酒精性脂肪肝的增效作用研究
李秀侠,文雪华,王燕平,吴 萍,徐寅生
(1.四川省医学科学院四川省人民医院城东病区药剂科,四川 成都 610106;2. 电子科技大学医学院,四川 成都 611731)
果寡糖对水飞蓟宾治疗非酒精性脂肪肝的增效作用研究
李秀侠1,2,文雪华1,2,王燕平1,2,吴 萍1,2,徐寅生1,2
(1.四川省医学科学院四川省人民医院城东病区药剂科,四川 成都 610106;2. 电子科技大学医学院,四川 成都 611731)
目的探讨果寡糖(fructo-oligosaccharide,FOS)对水飞蓟宾(silybin, Sil)治疗非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)的增效作用。方法小鼠分为正常对照组(正常饮食NCD)和模型组 (高脂饮食HFD)。于d 70,模型组随机分为6组(n=8):模型组,药物干预组为Sil(30 mg·kg-1)、FOS(2 000 mg·kg-1)、Sil(30 mg·kg-1)分别与FOS高、中、低剂量联用,每天灌胃1次,模型组给予等体积的溶媒,继续高脂饮食,记录小鼠的体质量和进食量。实验d 120,检查小鼠空腹血糖值、胰岛素水平和口服葡萄糖耐受;d 130,处死动物、收集肝脏和血液,计算肝脏指数,检测血清TG、TC、ALT、AST、肝脏组织病变。结果Sil(30 mg·kg-1)改善NAFLD小鼠血清AST、TG、TC、肝系数、空腹胰岛素水平、胰岛素抵抗、口服葡萄糖耐受等糖脂代谢指数,FOS(2 000 mg·kg-1)能使其治疗效果变得明显,同时降低了肝脏组织病变和脂质沉积,FOS(4 000 mg·kg-1)给药剂量翻倍,但是增效作用无明显优势;而对于改善NAFLD小鼠体质量,FOS(4 000 mg·kg-1)增效作用明显。结论益生元FOS可能通过调节肠道微生态平衡,提高Sil对NAFLD治疗效果。
果寡糖;水飞蓟宾;非酒精性脂肪肝;增效;高脂饮食;肠道微生物
果寡糖(fructo-oligosaccharide, FOS)又称为低聚果糖或果聚糖,具有化学性质稳定、安全无毒、黏度大等特点,广泛存在于3万多种植物中,其中菊芋中含量最高,多达块茎干重的70%~80%,商品FOS主要来源于微生物发酵。FOS分子中存在β糖苷键,使其不能被胃肠道酶消化吸收,作为营养基质选择性促进双歧杆菌等有益微生物生长。而有害微生物如沙门氏菌、大肠杆菌等,由于不能分泌果糖苷酶而使自身生长受抑,从而阻止了病原菌定植和入侵,改善了肠道微生物群,降低血清胆固醇和中性脂肪含量[1]。
研究报道,FOS能够降低血清胆固醇含量,改善血糖值,提高动物免疫功能,促进营养物质的吸收。关于FOS的研究,长期以来一直集中在替代抗生素的优良饲料添加剂[2]。FOS是否能够通过优化人体肠道微生物群,而用于疾病治疗?越来越多的资料表明,非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)发生与肠道微生物失衡密切相关[3-4],NAFLD患者肠道微生态平衡失调,有益菌(双歧杆菌、拟杆菌、乳杆菌)明显减少,有害菌明显增多。因此,通过调节肠道菌群结构将成为治疗该类疾病的新的重要手段之一。FOS能否优化NAFLD肠内微生态平衡治疗该疾病?
对于NAFLD的治疗,临床常用调脂药物(如他汀类、贝特类等)、护肝药物,疗效欠佳。从植物中提取有效成分,已经逐渐成为研究治疗脂肪肝的新途径[5-7]。水飞蓟宾(silybin, Sil)是从水飞蓟种子中提取出来的黄酮类化合物[8],具有保护肝细胞膜、对抗自由基和脂质过氧化、增进蛋白质合成、促进损伤后肝细胞再生等作用,临床常用于肝病的辅助治疗[9]。FOS能否通过调节肠道微生物群,与Sil协同治疗非酒精性脂肪肝?
高脂饮食可以诱导小鼠肠道微生态失衡[10],本实验通过高脂饮食构建小鼠NAFLD模型,选择临床上广泛用于保护肝细胞的Sil和调节肠道菌群平衡的FOS,联合治疗NAFLD,探讨FOS对Sil的增效作用。
1 材料与方法
1.1动物SPF 级♂ C57BL/6J小鼠, 8周龄,体质量19.7~21.0 g,购自四川省医学科学院实验动物研究所。
1.2药品与试剂水林佳胶囊:每粒含Sil 35 mg,天津天士力制药股份有限公司生产,批号550711182;FOS购于上海榕柏生物技术有限公司。
1.3仪器全自动生化检测仪AU600(奥林巴斯);超低温保存箱(Haier);转轮式切片机(徕卡-2016);TSJ-Ⅱ型全自动封闭式组织脱水机(常州市中威电子仪器有限公司);BMJ-Ⅲ型包埋机、PHY-Ⅲ型病理组织漂烘仪(常州市中威电子仪器有限公司);数码三目摄像显微镜(BA400Digital,麦克奥迪实业集团有限公司)等。
1.4方法
1.4.1动物分组与给药处理 动物饲养于室温(20 ℃~27 ℃)、相对湿度(60%~70%)、安静的环境。70只小鼠随机分为14笼,5只/笼。随机选取10只小鼠作为正常对照(normal chow diet, NCD)为a组,给予普通鼠料(根据D12450B配方);另外60只小鼠开始制备模型:给予高脂饲料,由北京华阜康生物科技有限公司配制(根据D12492配方)。于第10周末,根据文献,体质量超过NCD组体质量20%的小鼠视作肥胖小鼠,剔除不达标的小鼠后,共计48只,随机分组(n=8),继续高脂饲料饮食,b组为模型(high-fat diet, HFD),每天给予等体积的0.5% CMC;给药干预组包括:c组给予Sil(30 mg·kg-1)、d组给予FOS(2 000 mg·kg-1)、e组给予Sil(30 mg·kg-1)+FOS(500 mg·kg-1),f组给予Sil(30 mg·kg-1)+FOS(2 000 mg·kg-1),g组给予Sil(30 mg·kg-1)+FOS(4 000 mg·kg-1),自第10周,每天下午6点,灌胃给药,每5 d记录1次小鼠的体质量和进食量。给药干预 8周后,禁食、禁水,眼球取血待做生化分析,摘取新鲜肝组织、称重、计算肝脏指数,肝指数(liver index)/%=肝脏湿重/体质量×100%。
1.4.2小鼠空腹血糖、胰岛素水平测定,胰岛素抵抗指数计算 在实验的d 120,小鼠均禁食12 h,断尾取血,用罗氏血糖仪检测小鼠空腹血糖值,选用小鼠胰岛素检测试剂盒(北京信诺美特)对血清胰岛素进行定量,操作步骤参照试剂盒说明书。小鼠胰岛素抵抗指数计算公式:
胰岛素抵抗指数(HOMA-IR)=空腹胰岛素(FINS)mU·L-1×空腹血糖(FPG)mmol·L-1/22.5
1.4.3口服葡萄糖耐量实验(OGTT实验) d 120,各组小鼠禁食15 h至次晨9点,剪尾取血,用血糖仪测定血糖值,而后以3 g·kg-1葡萄糖剂量给予小鼠灌胃,分别检测服糖后15、30、60、90、120 min血糖,绘制OGTT曲线。
1.4.4血液生化分析 取“1.4.1”中小鼠禁食过夜后,眼球取血分离而得的血清,于四川省医学科学院/四川省人民医院城东病区检验科全自动生化分析仪检测血清中总胆固醇(TC)、甘油三酯(TG)、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)水平。
1.4.5肝脏病理学检测 取部分肝脏于4%多聚甲醛固定液中固定,制作石蜡切片, HE染色、拍照并进行组织病理学评分;另取一部分肝脏于液氮中,制作冰冻切片,油红O染色,在光学显微镜下观察各组小鼠肝组织病理学变化。
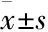
2 结果
2.1FOS联合Sil对高脂诱导的NAFLD小鼠体质量和摄食量的影响从高脂诱导d 5开始,高脂饮食组体质量明显比普通饲料组增高,到d 70,平均每只小鼠体质量比普通饲料组高(8.90±1.57)g。如Tab 1所示,与模型组比较,FOS(4 000 mg·kg-1)+Sil(30 mg·kg-1)给药组,实验的d 85(即给药15 d后),小鼠的体质量增加受到明显抑制(P<0.05),后d 105,体质量增长受到更加明显的抑制(P<0.01),并持续至实验结束;FOS(2 000 mg·kg-1)+ Sil(30 mg·kg-1)给药组,从实验的d 105开始至实验结束,小鼠体质量受到明显抑制(P<0.05)。其他各给药组小鼠体质量与模型组相比无明显差异。

Tab 1 Effects of FOS and Sil on body weight gain(g) in mice(n=8)
After 70 days of dietary induction of obesity, chow-and HFD-fed mice were treated daily with either 0.5% CMC or Sil(30 mg·kg-1), FOS(2 000 mg·kg-1), Sil(30 mg·kg-1)+FOS(500 mg·kg-1), Sil(30 mg·kg-1)+FOS(2 000 mg·kg-1), Sil(30 mg·kg-1)+FOS(4 000 mg·kg-1), by intragastric gavage for two months.#P<0.05,##P<0.01vsHFD group
2.2FOS联合Sil对高脂诱导的NAFLD小鼠口服葡萄糖耐受的影响如Fig 1A、1B、1C所示,与正常对照组比较,模型组小鼠空腹血糖明显上升(P<0.05),胰岛素水平以及胰岛素抵抗指数(HOMA-IR)明显升高(P<0.01)。与模型组比较,FOS(2 000 mg·kg-1)+Sil(30 mg·kg-1)给药组,小鼠空腹血糖水平、空腹胰岛素水平以及HOMA-IR均明显降低(P<0.05),而其他各给药组虽有下降,但是下降不明显。与正常对照组比较,无论空腹或是口服葡萄糖后,HFD组小鼠体内血糖值均明显升高。由Fig 1D可看出,与HFD组比较,各给药处理均改善了小鼠体内血糖水平,其中FOS(500 mg·kg-1)+Sil(30 mg·kg-1)、FOS(2 000 mg·kg-1)+Sil(30 mg·kg-1)和FOS(4 000 mg·kg-1)+Sil(30 mg·kg-1)处理,在口服葡萄糖120 min后,小鼠血糖值均明显降低,与FOS(2 000 mg·kg-1)联用组比较,FOS(4 000 mg·kg-1)联用Sil无明显优势。
2.3FOS联合Sil对高脂诱导的NAFLD小鼠血脂和酶水平的影响如Tab 2所示,与NCD组比较,HFD组小鼠血清血脂水平TC(P<0.05)、TG(P<0.01)明显升高,除FOS(2 000 mg·kg-1)给药组外,其他各给药组均改善了小鼠血清血脂水平,与HFD组比较,FOS(2 000 mg·kg-1)+Sil(30 mg·kg-1)给药组小鼠血脂水平明显降低(P<0.05),FOS(4 000 mg·kg-1)+Sil(30 mg·kg-1)给药组小鼠血脂水平降低不明显。

Fig 1 Effects of FOS and Sil on glucose-insulin homeostasis in mice with NAFLD(n=8)
A:Fasting blood glucose;B:Fasting insulin;C:HOMA-IR;D:Curve of OGTT.1:NCD;2:HFD;3:HFD+Sil(30 mg·kg-1);4:HFD+FOS(2 000 mg·kg-1);5:HFD+Sil(30 mg·kg-1)+FOS(500 mg·kg-1);6:HFD+Sil(30 mg·kg-1)+FOS(2 000 mg·kg-1);7:HFD+Sil(30 mg·kg-1)+FOS(4 000 mg·kg-1).*P<0.05,**P<0.01vsNCD;#P<0.05,##P<0.01vsHFD

Tab 2 Effects of FOS and Sil on serum biochemical index, liver index in mice with NAFLD(n=8)
a:NCD;b:HFD;c:HFD+Sil(30 mg·kg-1); d: HFD+FOS(2 000 mg·kg-1);e: HFD+Sil(30 mg·kg-1)+FOS(500 mg·kg-1); f: HFD+Sil(30 mg·kg-1) +FOS(2 000 mg·kg-1); g:HFD+Sil(30 mg·kg-1)+FOS(4 000 mg·kg-1).*P<0.05,**P<0.01vsNCD;#P<0.05,##P<0.01vsHFD
2.4FOS联合Sil对高脂诱导的NAFLD小鼠血清中肝功能指标和肝系数的影响与对照组相比,模型组AST、AST水平均明显升高(Tab 2),差异有显著性(P<0.01)。与模型组相比,Sil(30 mg·kg-1)+FOS(2 000 mg·kg-1)和Sil(30 mg·kg-1)+FOS(4 000 mg·kg-1)干预组小鼠血清AST含量明显下降(P<0.01),ALT水平也下降,但差异无显著性;其他各给药组均改善了小鼠血清转氨酶水平,但是差异不明显。在肝指数方面,HFD小鼠比NCD组明显增加(P<0.05),各给药组小鼠均较模型组明显下降(P<0.05),其中Sil(30 mg·kg-1)+FOS(4 000 mg·kg-1)给药组下降最明显(P<0.01)。
2.5FOS联合Sil对高脂诱导的NAFLD小鼠肝组织病理学的影响小鼠肝脏组织经HE染色后,镜下观察(Fig 2A),正常饲料组(NCD)肝细胞结构完整,排列整齐,肝小叶清晰可见。HFD组小鼠肝脏组织结构紊乱,肝小叶分界不清、肝细胞体积增大、肿胀,胞质内可见较大的空泡。经药物干预后,各组小鼠肝组织炎症反应均有所减轻,各组小鼠肝脏仍然可见一定程度的肝细胞脂肪变,与FOS(2 000 mg·kg-1)、Sil(30 mg·kg-1)给药组比较,FOS(500 mg·kg-1)+Sil(30 mg·kg-1)组小鼠肝脏组织病变程度并未减轻,而Sil(30 mg·kg-1)+FOS(2 000 mg·kg-1)和Sil(30 mg·kg-1)+FOS(4 000 mg·kg-1)给药组,小鼠肝细胞数量增加,排列趋向整齐,脂肪变性改善,但是组织病理学评分显示,各给药组与HFD组比较差异无显著性。油红O染色分析显示(Fig 2B),与正常组比较,HFD组小鼠肝脏组织存在大量红染油滴,各给药组小鼠肝组织内脂滴均有所减少,其中Sil(30 mg·kg-1)+FOS(2 000 mg·kg-1)和Sil(30 mg·kg-1)+FOS(4 000 mg·kg-1)给药组,小鼠肝脏组织病变缓解最明显。
3 讨论
关于NAFLD的发病机制,尚不十分清晰,目前已知的主要发病机制是“二次打击”学说[11],初次打击是指脂质代谢紊乱和胰岛素抵抗导致脂质沉积于肝细胞,形成单纯性脂肪肝;二次打击主要指脂质过氧化损伤、各种原因所致的氧化应激引起NAFLD,进展为脂肪性肝纤维化和脂肪性肝硬化。Sil能够清除氧自由基、保护细胞内酶系统、稳定细胞膜,从而保护肝细胞、改善肝功能,其作用机制遵守了“二次打击”学说。
肠道菌群与肥胖的关系是近年来研究的热点之一[12]。越来越多的研究表明,高脂饮食能够导致人类肠道微生物群结构失衡,从而引发各种代谢性疾病,包括NAFLD、糖尿病、高血压等[10,13]。本实验通过高脂饮食诱导小鼠肠道微生物群紊乱,进而导致肥胖和NAFLD,选择益生元FOS优化NAFLD小鼠肠道微生物群,同时利用Sil对肝脏的保护作用,研究FOS对Sil治疗高脂诱导NAFLD的增效作用。
高脂诱导过程中HFD小鼠体质量不断增加,Sil(30 mg·kg-1)与高剂量的FOS(4 000 mg·kg-1)联用时,对Sil肥胖小鼠体质量改善作用最明显。各给药处理组均明显改善了小鼠肝指数,小鼠肝脏组织病理学结果显示,对于Sil(30 mg·kg-1)抑制肝组织脂肪沉积作用,FOS(2 000、 4 000 mg·kg-1)均具有明显的增效作用。
中剂量的FOS与Sil(30 mg·kg-1)联用时,明显降低了小鼠血脂水平(P<0.05),而高剂量的FOS与Sil(30 mg·kg-1)联用时对小鼠血脂水平无明显改善。中、高剂量的FOS与Sil联用时均明显降低了血清AST含量,与中剂量联用组比较,FOS高剂量联用处理对小鼠AST的改善无明显优势;其他各处理均对小鼠血脂水平、AST无明显改善作用。中剂量 FOS联用组小鼠空腹血糖、空腹胰岛素水平、HOMA-IR以及小鼠血糖清除能力得到明显改善;而高剂量 FOS联用组,仅小鼠血糖清除能力得到明显改善;除低剂量FOS联用处理明显改善了小鼠血糖清除能力外,其他各给药处理组对小鼠体内糖代谢能力均无明显改善。说明中、高剂量FOS对Sil改善NAFLD血脂以及AST均具有明显的增效作用,且中剂量的作用效果好于高剂量。同时,对于Sil改善NAFLD小鼠体内糖代谢,FOS(2 000 mg·kg-1)增效作用最明显,FOS(4 000 mg·kg-1)次之。为何中剂量FOS增效作用好于高剂量FOS呢?我们推测在给予益生元时(低、中、高剂量),寄主体内益生菌开始繁殖,肠道微生态趋于平衡,而继续增加益生元给药量可能导致益生菌大量繁殖,原本趋于平衡的肠道微生态发生变化,反而不利于疾病的恢复。

Fig2HepatichistopathologyinmicefromdifferentgroupsA: Effects of FOS and Sil on tissue morphology of liver(HE staining, ×400); B: Effects of FOS and Sil on lipid accumulation of liver(ORO staining, ×400).1:NCD;2:HFD;3:HFD+Sil(30 mg·kg-1);4:HFD+FOS(2 000 mg·kg-1);5:HFD+Sil(30 mg·kg-1)+FOS(500 mg·kg-1);6:HFD+Sil(30 mg·kg-1)+FOS(2 000 mg·kg-1);7:HFD+Sil(30 mg·kg-1)+FOS(4 000 mg·kg-1).*P<0.05,**P<0.01vsNCD
AST和 ALT是反映肝损害的敏感指标,ALT位于肝细胞质内,而AST位于肝细胞质和线粒体内,正常情况下AST较ALT稍高。当肝细胞轻度病变时, ALT上升幅度较AST大,比值降低;肝炎恢复期,比值逐渐上升至正常;肝细胞严重损害时,血清AST升高幅度较ALT为大,比值继续增加。本研究发现, FOS与Sil联用时,对AST的作用大于对ALT的作用。因此,Sil联合FOS对血清AST改善效果好于ALT水平,可能与小鼠肝脏病变程度有关。
FOS(2 000 mg·kg-1)单独用于治疗NAFLD未发现具有临床意义的疗效,但是与Sil合用时提高了其疗效,那么除了能够保护肝脏细胞和酶系统,Sil是否也影响肠道微生物群,从而与FOS协同治疗NAFLD?有报道,益生元与益生菌组合起来的合生元,能够有效治疗NAFLD[14],Sil是否能够抑制有害菌或者促进有益菌生长?如果进一步添加了益生菌,FOS的作用是否更加明显?有待于进一步的机制研究。
综上所述,FOS(2 000、4 000 mg·kg-1)对Sil治疗NAFLD均具有一定的增效作用。由于FOS (4 000 mg·kg-1)给药剂量翻倍,但是增效作用并未明显增加,因此,对于改善NAFLD小鼠体内糖脂代谢,FOS(2 000 mg·kg-1)对Sil(30 mg·kg-1)增效作用更具有经济性、有效性和可行性。FOS联合Sil治疗NAFLD的临床意义有待进一步探讨。
(致谢:本实验于四川省医学科学院四川省人民医院实验室完成,感谢实验室所提供的帮助与支持。)
[1] Respondek F, Gerard P, Bossis M, et al. Short-chain fructo-oligosaccharides modulate intestinal microbiota and metabolic parameters of humanized gnotobiotic diet induced obesity mice[J].PLoSOne, 2013,8(8):1-12.
[2] 胡 静, 郭春艳, 王 鑫,等. FOS在动物生产中的研究进展[J]. 粮食与饲料工业, 2014,12(2):56-9.
[2] Hu J, Guo C Y, Wang X, et al. Studies on application of FOS in animals[J].CerealFeedInd, 2014,12(2):56-9.
[3] Leung C, Rivera L R, Furness J B, et al. The role of the gut microbiota in NAFLD[J].NatRevGastroHepat, 2016,13(7): 412-25.
[4] Abdou R M,Zhu L,Baker R D,et al.Gut microbiota of nonalcoholic fatty liver disease[J].DigestDisSci,2016,61(5):1268-81.
[5] 陈 成, 韩秀清, 刘春花, 等. 海星皂苷对非酒精性脂肪肝大鼠肌肉胰岛素信号通路的影响[J]. 中国药理学通报, 2017,33(4):512-6.
[5] Chen C, Han X Q, Liu C H, et al. Effects of starfish saponins on insulin signaling pathway in muscle of NAFLD rats[J].ChinPharmacolBull, 2017,33(4):512-6..
[6] 王 杏, 王 超, 宋光耀, 等. 氧化苦参碱对高脂诱导胰岛素抵抗ApoE-/-小鼠肝脏脂代谢相关基因的影响[J]. 中国药理学通报, 2015,31(12):1688-92.
[6] Wang X, Wang C, Song G Y, et al. Effect of oxymatrine on lipid metabolism regulated genes in liver of fat-induced insulin resistance in ApoE-/-mice[J].ChinPharmacolBull, 2015,31(12):1688-92.
[7] 高 雅, 张可兰, 钟明利,等. 狗肝菜多糖通过抗炎抗氧化抑制酒精高糖高脂引起的大鼠肝损伤[J].中国药理学通报, 2016,32(12):1665-9.
[7] Gao Y, Zhang K L, Zhong M L, et al. Effects of DCP on alcoholic fatty liver disease in ratsvia anti-inflammation and antioxidation[J].ChinPharmacolBull, 2016,32(12):1665-9.
[8] 陈 科, 徐 君, 何红晖, 等. 水飞蓟宾对高脂饮食小鼠胰岛β细胞的保护作用[J]. 中南大学学报医学版, 2015,40(2):165-70.
[8] Chen K, Xu J, He H H, et al. Protective effects of silybinin on islet β cells in C57BL/6J mice fed a high-fat diet[J].JCentSouthUniv, 2015,40(2):165-70.
[9] 李青权, 周 强, 牛俊奇,等. 水飞蓟素药理机制新进展及临床价值再探讨[J]. 临床肝胆病杂志, 2015,31(2):315-6.
[9] Li Q Q, Zhou Q, Niu J Q, et al. New advances in pharmacological mechanism of silymarin and re-investigation of its clinical values[J].JClinHepatol, 2015,31(2):315-6.
[10] Daniel H,Gholami A M,Berry D,et al.High-fat diet alters gut microbiota physiology in mice[J].ISMEJ,2013,8(2):295-308.
[11] Vanni E E. The gut-liver axis in nonalcoholic fatty liver disease: another pathway to insulin resistance[J] ?Hepatology, 2009,49(6):1790-2.
[12] Patterson E, Ryan P M, Cryan J F, et al. Gut microbiota, obesity and diabetes[J].PostgradMedJ, 2016,92(1087): 286-300.
[13] Iv E C O, Dong R Z, Johnson D A. Non-alcoholic fatty liver disease and the gut microbiota: exploring the connection[J].JGastrointestDigSyst, 2014,4(6):1-11.
[14] 张 扬. 合生元调整肠道微生态治疗NAFLD及其对TLR4的影响[D]. 广州:广东药学院, 2014.
[14] Zhang Y. Synbiotics adjusted the intestinal microecologe to treat NAFLD and influenced TLR4[D].Guangzhou: Guangdong Pharmaceutical University, 2014.
Modulationoffructo-oligosaccharideduringsilybin-meditatedimprovementofnonalcoholicfattyliver
LI Xiu-xia1,2, WEN Xue-hua1,2,WANG Yan-ping1,2, WU Ping1,2, XU Yin-sheng1,2
(1.DeptofPharmacy,EastBranchofSichuanAcademyofMedicalSciences&SichuanProvincialPeople′sHospital,Chengdu610106,China; 2.SchoolofMedicine,UniversityofElectonicScienceandTechnologyofChina,Chengdu611731,China)
AimTo examine weather fructo-oligosaccharides(FOS) and silybin(Sil) could exhibit synergetic effect on treating obesity-associated non-alcoholic fatty liver disease(NAFLD).MethodsSeventy mice were randomly divided into two groups: control group(NCD, fed with normal chow diet), the other sixty mice were fed with high-fat diet (HFD) to establish NAFLD model. Seventy days after the establishment of experimental model, the latter group was then randomly subdivided into six groups: model(HFD), Sil(30 mg·kg-1), FOS(2 000 mg·kg-1), Sil(30 mg·kg-1) combined with FOS of high, medium and low dose respectively. The NCD and HFD group were given 0.5% CMC, and the other groups were fed with high-fat diet and given 10 mL·kg-1by gavage daily, then body weight and food intake were recorded. Fasting blood glucose, insulin, homeostasis model of assessment for insulin resistence index(HOMA-IR) and oral glucose tolerance tests(OGTT) were measured after 120 days. All mice were sacrificed after 130 days, and blood and liver were collected. Levels of TC, TG, ALT, AST in serum were detected, and liver index and pathology were also examined.ResultsFOS(2 000 mg·kg-1) showed obvious synergism for Sil-mediated attenuation of levels of TC, TG, ALT, AST in serum, fasting blood glucose, insulin, HOMA-IR, OGTT curve, liver index and pathology, but FOS(4 000 mg·kg-1) could not bring superiority with a double dose, except for its improvement in body weight of mice with NAFLD.ConclusionsIn the treatment of NAFLD, FOS exhibits synergetic effect with Sil. This agent might be a potent candidate for obesity and NAFLD prevention, through modulating the composition of gut microbiota.
fructo-oligosaccharide; silybin; non-alcoholic fatty liver disease; synergetic effect; high-fat diet; gut microbiota
A
1001-1978(2017)11-1535-07
R-332;R322.47;R343.3;R575.5;R975.505;R977.6
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.024.html
10.3969/j.issn.1001-1978.2017.11.012
2017-07-18,
2017-08-25
国家自然科学基金资助项目(No 81402987)
李秀侠(1981-),女,博士,主管药师,助理研究员,研究方向:药理学,通讯作者,E-mail: lxx_0824@163.com

