芍药苷抑制肌球蛋白轻链激酶缓解肠上皮细胞屏障功能紊乱
王 亮,杨 芳,回斯美,周子娟,陈 军,詹红微,陈大朋,王靖宇
(大连医科大学实验动物中心,辽宁 大连 116044)
芍药苷抑制肌球蛋白轻链激酶缓解肠上皮细胞屏障功能紊乱
王 亮,杨 芳,回斯美,周子娟,陈 军,詹红微,陈大朋,王靖宇
(大连医科大学实验动物中心,辽宁 大连 116044)
目的考察芍药苷对肿瘤坏死因子α(TNF-α) 所致Caco-2模拟的肠上皮细胞屏障功能紊乱的保护作用及相关机制。方法体外培养Caco-2细胞,采用MTT法研究芍药苷对Caco-2细胞活性的影响; 建立TNF-α所致Caco-2细胞的屏障功能紊乱模型,研究芍药苷对屏障功能的影响。结果TNF-α孵育Caco-2细胞,明显降低了Caco-2细胞屏障的跨膜电阻,肌球蛋白轻链激酶 (MLCK) 表达明显增加,紧密连接蛋白occludin和ZO-1表达明显下降,提示Caco-2细胞屏障功能紊乱;芍药苷明显逆转TNF-α所造成的Caco-2细胞屏障功能紊乱,即抑制MLCK的表达,促进紧密连接蛋白occludin和ZO-1的表达,芍药苷的这种保护细胞屏障的作用可被MLCK的小分子干扰RNA(small interfering RNA, siRNA)所阻断。结论芍药苷可明显缓解TNF-α诱导的肠上皮屏障功能紊乱,该作用与降低MLCK, 促进紧密连接蛋白表达有关。
溃疡性结肠炎;芍药苷;肿瘤坏死因子α;Caco-2细胞;肠上皮屏障;肌球蛋白轻链激酶
炎性肠病(inflammatory bowel disease, IBD)为肠道炎症性疾病,表现为正常通过肠道的内容物即可刺激肠黏膜屏障,诱发黏膜免疫功能失调,伴随反复发作的慢性炎症性反应,临床分型主要包括克罗恩病(Crohn′s disease, CD)和溃疡性结肠炎(ulcerative colitis, UC)[1]。随着生活水平的提高,IBD在我国的发病率以及确诊率近些年来明显增加[2]。IBD可影响青少年身体发育,中重度结肠炎患者结肠癌罹患率明显增加,严重危害人们健康[1]。IBD的具体病理机制尚未阐明,研究表明肠道黏膜屏障功能紊乱是IBD非常重要的病理机制之一,维持黏膜屏障的稳定性对于IBD症状的缓解以及治疗具有重要的意义[3]。
芍药汤是中药中对肠道炎症性疾病具有治疗作用的经典中药复方,芍药是芍药汤中一味重要的中药[4]。芍药苷是芍药中的主要活性组分之一,分子式C23H28O11,分子质量为480.4[5-6]。芍药苷具有广泛的药理学活性,比如降血糖、免疫调节、抗肿瘤等[7]。鉴于芍药汤对IBD良好的治疗作用,本文拟考察作为芍药汤中重要组分的芍药苷,对肠上皮细胞屏障功能的保护作用,初步探索其相应的机制。肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)是肠道上皮细胞增殖和凋亡的主要促炎因子,是IBD发生的重要致病因子。因此,本研究通过考察芍药苷的安全使用剂量,观察其对TNF-α所致Caco-2模拟肠上皮细胞屏障功能损伤的缓解作用,考察芍药苷对肠上皮细胞紧密连接功能紊乱的致病因子——肌球蛋白轻链激酶(myosin light chain kinase,MLCK)的影响,以探究芍药苷对上皮细胞屏障功能损伤保护作用的机制。
1 材料
1.1细胞人结肠腺癌细胞系Caco-2细胞购自中国科学院上海细胞所。
1.2试剂芍药苷(纯度≥98%)购自阿拉丁试剂有限公司;TNF-α购自Sigma公司;抗MLCK抗体、紧密连接蛋白occludin与ZO-1抗体、辣根过氧化物酶(HRP)标记二抗,均购自武汉三鹰生物技术有限公司;细胞转染试剂盒购自宝生物工程(大连)有限公司。
1.3仪器上海精科紫外可见分光光度计;蔡司倒置显微镜;电泳仪、转膜仪等购自大连捷迈步;美国Millipore Millicell-ERS细胞电阻仪。
2 方法
2.1细胞培养Caco-2细胞用含10%胎牛血清的RPMI 1640细胞培养液培养,其中含105U·L-1青霉素、105U·L-1链霉素。于37℃、5% CO2培养箱内培养Caco-2细胞,待细胞覆盖80%,采用胰蛋白酶消化细胞,制备成细胞悬液,根据具体实验要求,改变相应密度,接种于培养板中,进行后续研究。
2.2MTT检测芍药苷对Caco-2细胞的作用首先考察芍药苷对正常Caco-2细胞活力的作用,借此选择合适的药物浓度进行后续研究。收集对数生长期的Caco-2细胞,在96孔板中,给予不同终浓度的芍药苷(5、10、20、40、80、160 μmol·L-1)分别处理24 h后,弃上清,PBS洗涤各孔3次。弃去PBS,更换成MTT(5 mg·L-1)工作液100 μL,孵育4 h后,加入100 μL DMSO,微孔振荡器上震荡10 min,用酶标仪检测570 nm下的吸光度值。细胞生存率/%=各组吸光度值/空白组吸光度值×100%。
2.3Caco-2细胞屏障跨膜电阻测定[8]Caco-2单层细胞于Transwell小室内培养,采用欧姆表检测小室内外两侧电阻差值即为跨膜电阻(transmembrane resistance,TER)。Caco-2细胞培养20 d后,跨膜电阻电阻差值稳定,大约为300 Ω/cm2左右。用跨膜电阻来表征肠上皮屏障功能,跨膜电阻越小,表明肠上皮屏障损伤越严重。
2.4细胞转染采用Lipofectamine 2000(Invitrogen)转染试剂,将含有靶向干扰MLCK的siRNA的质粒或空质粒转染入Caco-2 细胞。MLCK的siRNA 序列为:5′-CGTACGCGGAATACTTCGA-3′。
2.5Westernblot检测Caco-2细胞处理后,冰浴裂解细胞,经BCA法进行蛋白定量,后经SDS-PAGE 进行电泳。电泳完毕后,将蛋白转印至硝酸纤维素膜上,5%脱脂奶粉封闭1 h后,用相应蛋白抗体(根据抗体说明书选择合适的稀释浓度)孵育过夜,再以HRP标记的二抗室温孵育2 h后,ECL显影,以目标蛋白与内参蛋白的比值作为目的蛋白的相对表达量。
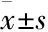
3 结果
3.1芍药苷对小肠上皮细胞Caco-2活力的影响芍药苷 (5、10、20、40、80、160 μmol·L-1)孵育Caco-2细胞24 h,细胞存活率如Fig 1所示。芍药苷在40 μmol·L-1以下浓度对细胞存活率没有明显的影响,因此,本研究选择5、10、20 μmol·L-1芍药苷进行后续研究。

Fig 1 Effect of paeoniflorin on viability of Caco-2 cells(n=6)
*P<0.05,**P<0.01vscontrol
3.2TNF-α对Caco-2细胞屏障功能的影响TNF-α(5、10、20 μg·L-1)分别孵育Caco-2细胞12、24 h,检测跨膜电阻变化。如Fig 2所示,10 μg·L-1TNF-α孵育Caco-2细胞24 h,可明显降低Caco-2细胞屏障跨膜电阻,又不至于破坏严重。因此,本研究采用10 μg·L-1TNF-α孵育Caco-2细胞24 h模拟屏障损伤,进行后续研究。

Fig 2 Effect of TNF-α on transmembrane resistance(TER) of Caco-2 cell barrier function(n=6)
*P<0.05,**P<0.01vscontrol
3.3芍药苷对TNF-α降低Caco-2细胞屏障跨膜电阻的作用如Fig 3所示,相对于对照组,10 μg·L-1TNF-α可明显降低Caco-2细胞屏障跨膜电阻,说明屏障通透性增加,屏障功能紊乱。5、10、20 μmol·L-1芍药苷可逆转TNF-α的作用,其跨膜电阻随着芍药苷浓度增加而逐步增加。

Fig 3 Effect of paeoniflorin on TNF-α induced reductionof TER in Caco-2 cells(n=6)
**P<0.01vscontrol;#P<0.05,##P<0.01vsTNF-α
3.4芍药苷对紧密连接蛋白的影响如Fig 4所示,相对于正常对照组,TNF-α可明显降低紧密连接蛋白的表达,occludin和ZO-1表达均明显下降,表明TNF-α可通过降低紧密连接蛋白含量,诱发上皮细胞屏障功能紊乱。5、20 μmol·L-1芍药苷可剂量依赖性地逆转TNF-α导致的紧密连接蛋白表达下降,恢复上皮屏障功能。

Fig 4 Paeoniflorin reversed TNF-α induced reduction of tight junction proteins(n=6)
A:Effect of paeoniflorin on TNF-α induced reduction of occludin;B:Effect of paeoniflorin on TNF-α induced reduction of ZO-1.**P<0.01vscontrol;##P<0.01vsTNF-α
3.5芍药苷抑制MLCK缓解上皮屏障功能紊乱如Fig 5A所示,相对于正常对照组,10 μg·L-1TNF-α可明显增加MLCK表达,导致黏膜屏障紧密连接功能紊乱;5、20 μmol·L-1芍药苷呈剂量依赖性抑制TNF-α引起的MLCK高表达。如Fig 5B所示,芍药苷可以明显逆转TNF-α造成的黏膜屏障紊乱,表现为芍药苷可以抑制TNF-α导致的跨膜电阻下降,而这种逆转保护作用可被针对MLCK的siRNA明显阻断。结果表明,MLCK可能是芍药苷逆转TNF-α导致屏障功能紊乱的药物靶点。

Fig 5 Effects of paeoniflorin on TNF-αinduced high expression of MLCK(n=6)
A:Paeoniflorin inhibited TNF-α induced high expression of MLCK;B:Effects of siRNA of MLCK on paeoniflorin induced increase in TER.**P<0.01vscontrol;##P<0.01vsTNF-α
4 讨论
本研究考察了芍药苷对TNF-α诱导的Caco-2细胞屏障功能紊乱的保护作用和相应机制。芍药苷在5~20 μmol·L-1的浓度范围内,可明显逆转TNF-α造成的屏障功能紊乱,包括增加跨膜电阻值、增加紧密连接蛋白表达、抑制MLCK表达。
IBD目前的病理机制尚未阐明,肠上皮屏障功能紊乱是IBD的重要发病机制[9-10]。肠上皮屏障功能紊乱会增加肠通透性,进而会诱发和加重炎性肠病[11]。肠上皮细胞能分泌多种受体,可以与细胞因子结合,参与免疫级联反应,加重炎症反应[10]。有研究表明[12],肠上皮中包含潘氏细胞和杯状细胞等免疫细胞。潘氏细胞的缺失会增加IBD患病率,完整状态的肠上皮屏障还可以有效防止肠道病原菌的侵袭。肠上皮屏障功能紊乱会加重肠道免疫反应,破坏肠道菌群的平衡。鉴于肠上皮屏障在IBD中的重要作用,探索缓解上皮屏障功能紊乱的方法是研究治疗IBD的重要方向[11]。TNF-α是一种促炎因子[13],可诱导结肠上皮细胞屏障功能紊乱,从而增加肠道上皮细胞通透性。因此,本研究采用TNF-α体外制备上皮细胞屏障功能紊乱模型,考察芍药苷对上皮细胞屏障功能紊乱的作用。TNF-α可促进结肠上皮细胞MLCK表达,MLCK过表达可导致紧密连接蛋白的表达下降,诱发和加重肠上皮屏障紊乱[13]。
本研究通过体外研究证实,芍药苷可以明显改善TNF-α所造成肠上皮细胞屏障功能紊乱,MLCK可能是芍药苷的潜在靶点。MLCK的siRNA可明显抑制芍药苷对肠上皮细胞屏障功能紊乱的保护作用,进一步证实MLCK是芍药苷潜在的靶点。本研究为IBD的治疗提供了一定的科学参考,但是基于MLCK在不同组织以及细胞具有广泛分布的特点,应用芍药苷抑制MLCK治疗IBD,其潜在的副作用也是以后研究的重要方向。在以后的研究中,如何增加芍药苷对不同组织细胞中MLCK的选择性,也非常重要。
[1] Fish D, Kugathasan S. Inflammatory bowel disease[J].AdolescMedClin, 2014,15(1):67-90.
[2] 郑家驹,史肖华,郭志荣.我国炎症性肠病的流行病学研究概况[J].中华内科杂志, 2009,48(4):344-5.
[2] Zheng J J,Shi X H,Guo Z R. Overview of epidemiologic study in inflammatory bowel disease in China[J].ChinJInternMed,2009,48(4):344-5.
[3] Xiong Y,Wang J,Chu H,et al. Salvianolic acid B restored impaired barrier function via downregulation of MLCK by microRNA-1 in rat colitis model[J].FronPharmacol, 2016,7:134.
[4] 韩 涛,谭 丹,张 毅,等.中药复方治疗溃疡性结肠炎研究探要[J]. 中国实验方剂学杂志, 2007,13(3):69-71.
[4] Han T,Tan D,Zhang Y,et al.The investigation of herbal formulae for ulcerative colitis[J].ChinJExpTraditMedFormul,2007,13(3):69-71.
[5] 孙丽荣,曹 雄,侯凤青,等.芍药苷研究进展[J]. 中国中药杂志, 2008,33(18):2028-32.
[5] Sun L R,Cao X, Hou F Q,et al.Progressive studies of paeoniflorin[J].ChinaJChinMaterMed,2008,33(18):2028-32.
[6] 胡建春,侯 佳,李月婷,等.赤芍提取物中两种主要成分在Caco-2细胞中的摄取特性研究[J]. 中国药理学通报, 2016,32(9):1329-31.
[6] Hu J C, Hou J, Li Y T,et al. Uptake characteristics of two components from Paeonia Lactiflora Pall. in Caco-2 cell monolayer model[J].ChinPharmacolBull,2016,32(9):1329-31.
[7] 郑世存,李晓宇,欧 阳,等.芍药苷药理作用研究新进展[J].中国药物警戒, 2012,9(2):100-3.
[7] Zheng S C,Li X Y,Ou Y,et al. Research development on pharmacological of paeoniflorin[J].ChinJPharmacovigil, 2012,9(2):100-3.
[8] 林 楠,许玲芬,滕 旭,等Toll样受体2对肠上皮细胞屏障通透性的保护作用及机制[J].国际儿科学杂志, 2016,43(6): 484-7.
[8] Lin N,Xu L F,Teng X,et al.The protective effect and mechanism of TLR2 on permeability of intestinal epithelial barrier[J].IntJPediatr,2016,43(6): 484-7.
[9] 王灿红,何晓山,张丽静,等.羧甲基茯苓多糖对氟尿嘧啶致肠炎小鼠的保护作用[J]. 中国药理学通报, 2016,32(4):484-9.
[9] Wang C H,He X S,Zhang L J, et al. Protective effects of CMP on 5-Fu-induced intestinal mucositis of mice[J].ChinPharmacolBull,2016,32(4):484-9.
[10] 丁少桢,丁 浩,梅 俏,等.同型半胱氨酸调控MEK-ERK-MLCK通路影响结肠炎大鼠肠黏膜通透性的实验研究[J].中国药理学通报, 2016,32(4):498-502.
[10] Ding S Z,Ding H,Mei Q, et al. Effect of homocysteine on the intestinal permeability by regulating MEK-ERK-MLCK signal transduction in experimental colitis rats[J].ChinPharmacolBull,2016,32(4):498-502.
[11] Su L,Nalle S C,Shen L,et al. TNFR2 activates MLCK-dependent tight junction dysregulation to cause apoptosis-mediated barrier loss and experimental colitis[J].Gastroenterology, 2013,145(2):407-15.
[12] Tlaskalová-Hogenová H,Stěpánková R,Kozáková H,et al. The role of gut microbiota(commensal bacteria) and the mucosal barrier in the pathogenesis of inflammatory and autoimmune diseases and cancer: contribution of germ-free and gnotobiotic animal models of human diseases[J].CellMolImmunol, 2011,8(2):110-20.
[13] Flannigan K L,Geem D,Harusato A,et al. Intestinal epithelial cells: regulators of barrier function and immune homeostasis[J].NatRevImmunol, 2014,14(3), 141-53.
PaeoniflorinalleviatesTNF-αinducedintestinalbarrierdysfunctionbyinhibitionofMLCK
WANG Liang, YANG Fang, HUI Si-mei, ZHOU Zi-juan, CHEN Jun, ZHAN Hong-wei, CHEN Da-peng, WANG Jing-yu
(AnimalExperimentCentre,DalianMedicalUniversity,DalianLiaoning116044,China)
AimTo investigate the protective effect of paeoniflorin on TNF-α induced intestinal epithelial barrier dysfunction and its mechanisms.MethodsThe Caco-2 cells were cultured and the MTT assay was used to determine the effects of the paeoniflorin on Caco-2 cell activity. The Caco-2 cell intestinal epithelial barrier dysfunciton model was established through incubation of cells with TNF-α. The effects of paeoniflorin on intestinal epithelial barrier dysfunciton were studied.ResultsThe transmembrane resistance in Caco-2 epithelial barrier was significantly reduced by TNF-α incubation; MLCK significantly increased, while tight junction protein occludin and ZO-1 significantly decreased by TNF-α. These changes were significantly reversed by paeoniflorin, which reduced MLCK expression and enhanced expression of occludin and ZO-1. The protective effects against epithelial barrier dysfunction could be abrogated by small interfering RNA(siRNA) of MLCK.ConclusionsPaeoniflorin alleviates the epithelial barrier dysfunction induced by TNF-α through down-regulation of MLCK and enhancement of tight junction protein occludin and ZO-1. This study supplies a potential candidate drug for the clinical treatment of inflammatory bowel diseases.
ulcerative colitis; paeoniflorin; tumor necrosis factor alpha; Caco-2 cells; intestinal epithelial barrier; myosin light chain kinase
A
1001-1978(2017)11-1541-05
R284.1;R322.45;R329.24;R345.57;R574.022
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.026.html
10.3969/j.issn.1001-1978.2017.11.013
2017-07-09,
2017-08-12
国家自然科学基金资助项目(No 81600440,31272392)
王 亮(1980 -),男,硕士,讲师,研究方向:比较医学,E-mail:wangliang_dl@163.com; 陈大朋(1987-),男,博士,讲师,研究方向:胃肠病药理学,通讯作者,E-mail:cdp.9527@163.com; 王靖宇(1964-),男,博士,教授,研究方向:实验动物与动物行为学,通讯作者,E-mail:wangjingyus@163.com

