糖尿病大鼠脑额叶皮层血流量的经时变化
杨明艳,王 玥,毕田田,毕玉莹,王冬雪,赵 瑛
(哈尔滨商业大学药学院,黑龙江 哈尔滨 150076)
糖尿病大鼠脑额叶皮层血流量的经时变化
杨明艳,王 玥,毕田田,毕玉莹,王冬雪,赵 瑛
(哈尔滨商业大学药学院,黑龙江 哈尔滨 150076)
目的探讨糖尿病大鼠脑额叶皮层血流量的动态变化,初步研究其与主要血管活性物质变化的关系,为进一步研究糖尿病认知障碍以及中枢神经系统功能变化提供前期基础。方法34只♂ Wistar大鼠随机分为空白对照组和糖尿病模型组。模型组腹腔注射链脲佐菌素(STZ)60 mg·kg-1复制糖尿病模型,葡萄糖氧化酶法测定72 h空腹血糖≥16.7 mmol·L-1作为成模标准,血糖仪连续动态测定FBG,Morris水迷宫检测糖尿病大鼠学习记忆能力,双通道激光多普勒血流仪检测大鼠90 d额叶皮层血流量。另取34只♂ Wistar大鼠分组造模同前,连续动态监测造模d 0、7、14、21、28、35、42、56、75额叶皮层血流量;ELISA法检测脑脊液中iNOS、cNOS和ET-1的浓度。结果Morris水迷宫检测显示,糖尿病模型组大鼠从训练第6次逃避潜伏期明显延长(P<0.05),额叶皮层血流量/100 g体重明显降低(P<0.05);额叶皮层血流量动态监测结果显示,糖尿病大鼠造模d 21脑血流量/100 g体重下降(P<0.05),并在相似水平持续到成模d 75(P<0.01,P<0.05);与对照组相比,模型组脑脊液中iNOS和cNOS浓度明显升高(P<0.05),ET-1浓度明显下降(P<0.01)。结论糖尿病认知障碍大鼠额叶皮层血流量减少,提示脑血流量的减少可能是导致糖尿病发生认知障碍的因素之一。糖尿病动态脑血流量检测显示脑血流量减少发生在糖尿病早期,之后并无明显继续恶化。脑血流减少可能与NO、ET-1浓度变化无明显关系,但脑血流的变化趋势可能与二者变化有关。
糖尿病;脑额叶皮层;脑血流量;双通道激光多普勒血流仪;NOS;ET-1糖尿病(diabetes mellitus,DM)是一种以高血糖为主要特征的慢性代谢性疾病,其发病率逐年增高[2],并伴有多种并发症,涉及心脏、眼、肾脏、神经系统等[1]。有关DM中枢神经病变及其与血管病变的关系,近年正逐渐引起重视。文献报道,DM患者及DM动物模型中常伴有脑血流量(cerebral blood flow,CBF)减少的现象[2-3]。同时,有报道称临床DM患者脑血流量下降多出现在DM早期[4-5]。那么,DM大鼠脑血流下降发生在何时,呈现什么样的变化趋势,是否与糖尿病认知障碍发生发展有关,机制如何?为此,本论文采用链脲佐菌素(streptozocin,STZ)复制DM大鼠模型,在明确DM认知障碍大鼠脑血流量变化的基础上,动态监测DM大鼠模型建立后,额叶皮层血流量的连续变化,分析变化趋势,并初步探讨其变化的机制。
1 材料与方法
1.1实验动物♂Wistar大鼠,SPF级,购自长春市亿斯实验动物技术有限责任公司。许可证号:SCXK(吉)-2011-0004,合格证号:201600012587。控制室温在(23±2)℃的范围内,相对湿度45%~55%,动物自由饮水摄食。
1.2试剂与仪器链脲佐菌素(美国Sigma公司);水合氯醛(天津市光复精细化工研究所);内皮素-1(endothelin 1,ET-1)试剂盒(上海酶联生物科技有限公司);一氧化氮合酶(nitric oxide synthase,NOS)试剂盒(南京建成生物科技有限公司);葡萄糖测定试剂盒(上海荣盛生物药业有限公司)。moorVMS双通道激光多普勒监测仪(英国Moor instruments公司);Stoelting标准型单臂脑立体定位仪(美国Stoelting公司);RT-6000酶标分析仪(RAYTO公司);T6紫外分光光度计(北京普析通用仪器有限责任公司);血糖仪(测利得雅思血糖仪公司)。
1.3实验动物头颅预处理实验前1周,所有大鼠麻醉后俯卧,放置于脑立体定位仪上,固定头部,采取平颅固定法进行大鼠头颅的立体定位。之后头部剃毛,剪开头部皮肤2 cm,用过氧化氢擦拭清除软组织,暴露出颅骨。参照Paxions-Watson大鼠脑立体定位图谱(第6版)[6],确定额叶(FrA)位置(中心点为前囟前5 mm,矢状缝右侧旁开2 mm),为后期正式实验做准备。
1.4麻醉、生物节律对脑血流量变化的影响
1.4.1麻醉时间对脑血流量变化的研究 取♂Wistar大鼠8只,体质量180~220 g,适应性喂养1周后,腹腔注射10%水合氯醛0.3 g·kg-1麻醉,用moorVMS激光多普勒血流检测仪(LDF)进行数据收集和处理,将多普勒光纤探头固定至额叶处,记录麻醉10、20、30、40、50 min后脑血流量,并在不同时间点均连续观测10 min,通过软件分析每10 min的平均脑血流量(Flux)、红细胞浓度(Conc)、红细胞运动速度(Speed)、回光强度(DC)。
1.4.2生物节律对大鼠脑血流量变化的影响 动物适应性喂养1周后,取♂Wistar大鼠9只,体质量180~220 g,在8 ∶00测定脑血流,连续测定3 d,随后在12 ∶00测定脑血流,连续测定3 d,最后在16 ∶00测定脑血流,连续测定3 d,观察日间不同时间点的Flux、Conc、Speed、DC变化。另取♂Wistar大鼠9只,分别在同一天8 ∶00、12 ∶00、16 ∶00 3个时间段测定Flux、Conc、Speed、DC,测定方法与“1.4.1”中步骤相同。
1.5DM认知障碍大鼠脑额叶皮层血流量变化研究
1.5.1动物模型建立 34只♂ Wistar大鼠,体质量180~220 g。适应性喂养1周后,随机分为对照组(n=10)、DM模型组(n=24)。禁食不禁水16 h,以冰浴的柠檬酸-柠檬酸钠缓冲液将STZ粉末溶解,冰浴避光操作,新鲜配制1%的STZ溶液。模型组按照给药剂量60 mg·kg-1腹腔注射,冰上避光操作,10 min内注射完毕,避免STZ溶液失效。对照组腹腔注射相同剂量柠檬酸-柠檬酸钠缓冲液。
1.5.2血糖水平连续测定 STZ腹腔注射72 h后,测空腹血糖,实验前1 d更换垫料,禁食12 h,自由饮水。采用肝素化的毛细管,眼底静脉丛取血0.5 mL,3 500 r·min-1离心10 min,分离血浆,采用葡萄糖氧化酶法测定血糖,具体操作按试剂盒说明书进行。选择空腹血糖≥16.7 mmol·L-1动物纳入实验[7-8]。造模后d 30、45、60、80用血糖仪测定空腹血糖(fast blood glucose,FBG)。血糖恢复的动物剔除。
1.5.3Morris水迷宫实验 造模d 80对各组大鼠进行水迷宫实验,所有大鼠在正式实验前1 d,在不放平台及标记物的水迷宫中自由游泳2 min,以适应水中环境,避免大鼠应激反应。Morris水迷宫为直径150 cm、高50 cm的圆形水池,水池内壁被漆为黑色,水池被4个等距点分为4个象限,分别在4个象限池壁的中心贴上不同标记物,为三角形、正方形、圆形和五角星白色纸片。平台放入其中1个象限的中心,低于水面2 cm,控制水温在(23.0±2.0)℃。对大鼠进行Morris水迷宫学习训练,实验时将大鼠在除目标象限(平台所在象限)之外的3个象限随机面对池壁放入水中,记录大鼠的登台时间(逃避潜伏期,以下统称潜伏期)作为评价学习成绩的指标,潜伏期下降即学习成绩提高。大鼠在90 s内找到平台后,允许大鼠在平台上停留10 s,潜伏期为大鼠找到平台的时间;如果大鼠在90 s内未找到平台,则潜伏期记为90 s,然后将大鼠引导登上平台,允许其在平台上停留10 s,让其根据4个象限的参照物进行空间学习记忆,并减少大鼠紧张。每次训练完成后将大鼠取出擦干,以防止低体温造成的应激。
1.5.4DM认知障碍大鼠脑额叶皮层血流量测定 在模型建立d 90,大鼠腹腔注射10%水合氯醛0.3 g·kg-1麻醉,用moorVMS激光多普勒血流检测仪(LDF)进行数据收集和处理,将多普勒光纤探头固定至额叶处,麻醉20 min后,连续观测10 min,通过软件分析每10 min的平均Flux,并计算Flux/100 g=Flux÷大鼠体质量×100 g。
1.6DM大鼠脑额叶皮层血流量的动态测定
1.6.1DM模型建立 另取34只♂Wistar大鼠,体质量180~220 g。适应性喂养1周后,随机分为对照组(n=10)、DM模型组(n=24)。造模方法见“1.5.1”。
1.6.2血糖测定水平连续测定 测定方法与“1.5.2”操作步骤相同。分别在造模后d 3、18、32、46、60、73用血糖仪测定FBG,造模后d 11、25、39、53、67用血糖仪测定随机血糖(random blood glucose,RBG)。
1.6.3大鼠脑额叶皮层血流量的动态测定 测定方法与“1.5.4”操作步骤相同。分别在造模d 0、7、14、21、28、35、42、56、75测定大鼠脑血流量,并计算Flux/100 g=Flux÷大鼠体质量×100 g。
1.7大鼠脑脊液中NOS和ET-1的测定大鼠采用10%水合氯醛0.3 g·kg-1腹腔注射麻醉。将大鼠固定于脑立体定位仪上,保证操作台水平,两侧耳杆在同一直线,门齿杆较耳杆低0.33 cm。以食指摸后脑的三角区域,在三角区域上方插入已磨至2~3 mm的头皮针,末端连接1 mL注射器,慢慢抽取脑脊液。若未见脑脊液流出,可轻微旋转针体。采集脑脊液后,用ELISA法检测结构型一氧化氮合酶(constitutive nitric oxide synthasec,NOS)=神经型(neuronal nitric oxide synthase,nNOS)+内皮型(endothelial nitric oxide synthase,eNOS)、诱导型一氧化氮合酶(induced nitric oxide synthase,iNOS)和ET-1的浓度,各项指标测定严格参照试剂盒说明书操作。
2 结果
2.1麻醉、生物节律对大鼠脑血流量的影响
2.1.1麻醉后不同时间对大鼠脑血流量的影响 大鼠在麻醉后10、20、30、40、50 min分别使用多普勒血流仪检测,由Tab 1可见,Flux、Conc、Speed、DC均没有明显变化(P>0.05),即在麻醉后10~50 min内选择任意时间开始检测脑血流均可。本研究在后续实验中,每只大鼠均在腹腔注射水合氯醛后20 min开始测脑血流量。
2.1.2生物节律对大鼠脑血流量的影响 Tab 2~4结果显示,大鼠日间、日内Flux、Conc、Speed、DC均没有明显变化(P>0.05)。生物节律对大鼠脑血流量的测定没有影响。
2.2DM认知障碍大鼠实验中相关指标检测结果
2.2.1DM成模状况 本次实验以注射STZ 72 h后,空腹血糖≥16.7 mmol·L-1为成模标准,24只模型组大鼠,成模19只,成模率为79.2%。整个实验期间死亡8只,死亡率为42.1%。
2.2.2DM大鼠空腹血糖变化 如Fig 1所示,造模d 3、30、45、60、80,模型组大鼠的血糖明显高于对照组(P<0.01),一直维持高血糖状态。
2.2.3Morris水迷宫实验结果 Tab 5水迷宫实验结果显示,DM大鼠从训练第6次开始,与对照组相比潜伏期明显延长(P<0.01),并持续至训练第10次。DM大鼠在行为学上出现认知障碍表现。
2.2.4DM认知障碍大鼠脑血流量比较 DM认知障碍大鼠在造模d 90测定脑血流量变化,如Fig 2所示,与对照组相比,DM模型鼠脑血流量明显降低(P<0.05)。
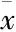
Tab 1 Anesthesia at different time of CBF in rats(±s, n=8)
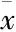
Tab 2 Day 8 ∶00 AM and 12 ∶00 AM cerebral blood flow changes(±s, n=9)
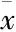
Tab 3 Day 16 ∶00 cerebral blood flow changes(±s, n=9)
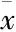
Tab 4 Intraday cerebral blood flow changes(±s, n=9)
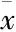
Tab 5 Morris water maze latency(±s,s)
*P<0.05,**P<0.01vscontrol

Fig 1 Fast blood glucose level(±s)
**P<0.01vscontrol
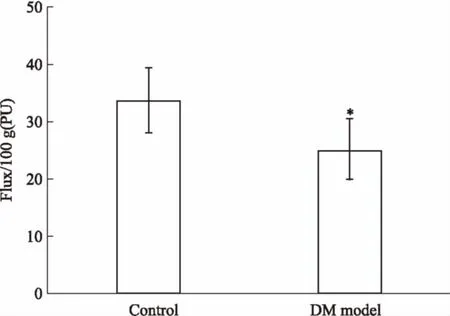
Fig 2 Cerebral blood flow changes(±s)
*P<0.05vscontrol
2.3DM大鼠动态脑额叶皮层血流量的变化中相关指标结果
2.3.1DM成模状况及代谢情况 24只模型组大鼠,成模20只,成模率为83.3%,整个实验期间死亡6只,死亡率为30%。模型组的食量、水量,在造模的d 8、15、22、29、36、43、50、57、64均明显高于对照组。模型组体质量从造模d 15开始,与对照组相比差异有显著性,且模型组体质量在50 d内一直维持恒定(Tab 6)。
2.3.2血糖水平变化 模型组的FBG在造模的第72 h(注射STZ的d 4)、d 18、32、46、60、73均明显高于对照组(P<0.01);模型组的RBG在造模的d 11、25、39、53、67均明显高于对照组(P<0.01),见Fig 3、4。

Fig 3 Changes in fast blood glucose level(±s )
**P<0.01vscontrol
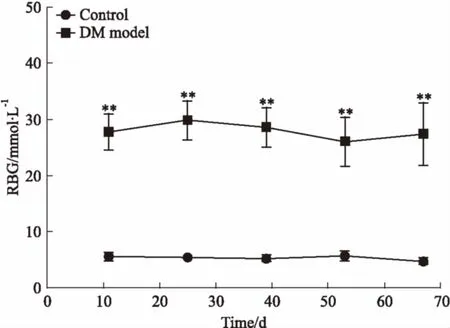
Fig 4 Changes in random blood glucose level(±s)
**P<0.01vscontrol
2.3.3DM大鼠脑额叶皮层血流量动态变化 实验期间,对照组大鼠体质量有明显变化,为避免体质量对脑血流量的影响,脑血流量各指标均采用每100 g体重值比较(Tab 7)。DM模型建立75 d内,对照组Flux/100 g没有明显变化(P>0.05),模型组Flux/100 g在造模d 21自身比较有明显降低(P<0.05),并持续至d 75。
2.4DM大鼠脑脊液中iNOS、cNOS和ET-1的变化如Tab 8所示,DM造模d 75,与对照组相比,模型组大鼠脑脊液中iNOS和cNOS明显升高(P<0.05),ET-1明显下降(P<0.01)。提示DM脑血流量的降低引发机体脑内发生自我保护反应。
3 讨论
经颅多普勒较常用于大鼠脑血流量的检测,但是在实验过程中变化因素较多,麻醉时间、生物节律等是否会对大鼠脑血流量产生影响,尚不明确。为了客观描述这些因素对实验结果的干扰,本实验首先对以上两个方面对大鼠脑血流量的影响进行研究。结果发现,麻醉后10~50 min内,各时间点之间大鼠脑血流量没有明显变化,选择其中任意一个时间点开始检测脑血流量均可,在后期实验研究中选择注射水合氯醛20 min后开始检测脑血流量。人和动物都存在有规律的循环往复的周期性运动,即“生物节律”。本研究发现,在8 ∶00、12 ∶00、16 ∶00大鼠脑血流量无论是日间还是日内均没有明显变化。因此,生物节律对脑血流量的变化无影响,且麻醉次数对脑血流量也没有影响,日间每天麻醉1次、连续麻醉3 d、日内1 d麻醉3次,对脑血流量均没有影响。排除生物节律对脑血流量的影响后,为了进一步防止时间顺序可能造成的影响,在实验中又采用随机数字表抽取实验动物。

Tab 6 Changes in body weight, food intake and water intake
**P<0.01vscontrol
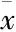
Tab 7 Changes in Flux/100 g in control group and diabetic group(±s,PU)
*P<0.05,**P<0.01vsd 7
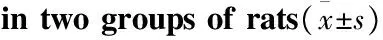
Tab 8 Comparison of iNOS, cNOS and ET-1
*P<0.05,**P<0.01vscontrol
本实验采用STZ 60 mg·kg-1一次性大剂量注射复制DM大鼠模型,与对照组大鼠相比,DM大鼠在90 d内血糖升高并维持稳定,体质量下降,食量、水量均明显增多,符合DM大鼠模型特征[9-10]。通过经典的Morris水迷宫方法对两组大鼠进行学习和记忆能力的行为学评价,发现STZ诱导的DM模型大鼠较对照组大鼠潜伏期延长,出现学习记忆能力下降的表现。
脑血流量的变化是很多脑血管疾病的病理生理基础之一。DM患者和动物中多伴有脑血流量减少的现象[2-3],但DM认知障碍大鼠是否也有脑血流量的异常变化,未见报道。因此,本实验首先对DM认知障碍大鼠在模型建立d 90测定脑额叶皮层血流量,发现认知障碍大鼠脑额叶皮层血流量明显降低。但DM发生认知障碍前,大鼠脑血流量的动态变化轨迹以及何时出现脑血流量减少?实验进一步研究发现,DM大鼠在造模d 21 Flux/100 g开始出现明显减少,并持续至d 75,说明DM在发生认知障碍前脑血流量就出现明显降低,提示脑血流量的减少可能是导致DM发生认知障碍的因素之一。与临床中DM患者脑血流量下降出现在DM早期的结果相符[4-5]。脑血流指标均采用每100 g体重值比较,实验期间对照组大鼠体质量出现明显增多,为更科学地比较脑血流量变化,对照组与模型组均用Flux/100 g比较。
DM认知障碍大鼠脑血流量下降的原因尚不明确,脑缺血可以引发严重的神经损伤,影响病人的神经功能恢复和预后[11]。iNOS、cNOS和ET-1作为血管活性物质,检测其在脑脊液中的浓度发现,与对照组相比,DM大鼠cNOS、iNOS浓度明显升高,ET-1浓度明显下降,其原因可能是脑血流量的减少引发机体本身发生自我保护作用(即自身调节功能)所致;而DM脑脊液内cNOS、iNOS浓度升高,ET-1浓度下降,也可能是DM后期脑血流量不再持续下降的原因之一。iNOS作为病理性的一氧化氮合酶,其浓度增加可能使NO生成增多,NO作为活性氧,诱发氧化应激反应,脑内出现氧化损伤,进而造成脑组织的氧化损伤,这也可能是造成认知障碍的因素之一。脑血流量下降的原因可能是:① DM患者长期高血糖引起毛细血管基底膜增厚,患者中枢神经系统和外周神经纤维出现神经元退行性病变,神经元功能减退,葡萄糖利用减少而导致脑局部供血量不足[4-5];② DM患者常伴随脂质代谢紊乱,造成血液黏稠度升高,血流缓慢,基底膜糖类沉积,脂肪样和透明样变性,微小血管内皮细胞功能失调,长期DM患者的脑血流自动调节受损,导致脑血流减少[12];③ 患有DM时,有血内韦氏因子和血小板黏附力增加,对二磷酸腺苷、肾上腺素、胶原纤维、花生四烯酸的敏感性增加,血管收缩强烈,可明显增加血流阻力,使脑缺血程度明显加重,脑缺血时间明显延长。实验室将在后续实验中进一步对其下降机制进行研究。
[1] WHO. About diabetes[C]. Geneva, Switzerland: World Health Organization, 2014.
[2] Kelly-Cobbs A I, Prakash R, Coucha M, et al. Cerebral myogenic reactivity and blood flow in type 2 diabetic rats: role of peroxynitrite in hypoxia-mediated loss of myogenic tone[J].JPharmacolExpTher, 2012,342(2): 407-15.
[3] Duckrow R B, Beard D C, Brennan R W. Regional cerebral blood flow decreases during chronic and acute hyperglycemia[J].Stroke, 1987,18: 52-8.
[4] 张人玲, 关 乐, 孙素花, 等. 糖尿病患者及糖尿病大鼠脑血流灌注的临床特点[J]. 中国医学影像技术, 2002,18(1): 9-11.
[4] Zhang R L, Guang Y, Sun S H, et al. Clinical characteristics of 2DM patients and cerebral blood perfusion of diabetic rats[J].ChinJMedImagingTechnol, 2002,18(1): 9-11.
[5] 齐 颖, 张人玲. 糖尿病患者脑血流灌注及糖代谢的临床特点[J]. 中华糖尿病杂志, 2005,13(4): 272-3.
[5] Qi Y, Zhang R L. Clinical characteristics of cerebral blood perfusion and metabolism of galactoside in type 2 diabetic patients[J].ChinJDiabetes, 2005,13(4): 272-3.
[6] Paxinos G, Watson C. 大鼠脑立体定位图谱(第6版)[M]. 北京: 人民卫生出版社, 2010.
[6] Paxinos G, Watson C.Theratbraininstereotaxiccoordinates(6thedition)[M]. Beijing: People’s Medical Publishing House, 2010.
[7] 卢俞任, 刘 义. 小剂量阿司匹林对糖尿病大鼠肾脏保护作用研究[J]. 中国动脉硬化杂志, 2013,21(5): 419-23.
[7] Lu Y R, Liu Y. Renal protection research of low-dose aspirin in diabetic rats[J].ChinJArterioscler, 2013,21(5): 419-23.
[8] 赵圆宇, 王艺蓉, 徐彩婷, 等. 性别差异对1型糖尿病大鼠造模的影响[J]. 川北医学院学报, 2014,29(5): 421-4.
[8] Zhao Y Y, Wang Y R, Xu C T, et al. Impact of gender difference in type 1 diabetic rats modeling[J].JNorthSichuanMedColl, 2014,29(5): 421-4.
[9] 刘月婷, 杨明艳, 张 爽, 等. STZ诱导的1型糖尿病大鼠模型稳定性及中医外观表征变化[J]. 中医药学报, 2016,44(2): 43-5.
[9] Liu Y T, Yang M Y, Zhang S, et al. STZ-induced stability of type 1 diabetic rats and changes of TCM appearance[J].ActaChinMedPharmacol, 2016,44(2): 43-5.
[10] 苏力担卡扎·仇曼, 何铁英, 林 海, 等. 链脲佐菌素建立1型糖尿病大鼠模型的最优剂量研究[J]. 中国普外基础与临床杂志, 2016,23(1): 84-5.
[10] Su L D K Z·C M, He T Y, Lin H, et al. The optimal dose of streptozotocin in the model of type 1 diabetic rats[J].ChinJBasesClinGenSurg, 2016,23(1): 84-5.
[11] 许淑红, 康 辰, 陈美灵, 等. 大鼠脑缺血/再灌注后早期AQP4的动态表达及其与脑水肿关系的研究[J]. 中国药理学通报, 2016,32(10): 1433-41.
[11] Xu S H, Kang C, Chen M L, et al. Dynamic expression of AQP4 in early stageof ischemia/reperfusion rats and cerebral edema[J].ChinPharmacolBull, 2016,32(10): 1433-41.
[12] 孙 倩, 于 瀛, 胡玉川, 等. 2型糖尿病脑改变的fMRI研究进展[J]. 放射学实践, 2016,31(2): 138-40.
[12] Sun Q, Yu Y, Hu Y C, et al. Advances in fMRI of brain changes in type 2 diabetic patients[J].RadiolPract, 2016,31(2): 138-40.
Dynamicchangesofbloodflowinfrontalcortexofdiabeticrats
YANG Ming-yan, WANG Yue, BI Tian-tian, BI Yu-ying, WANG Dong-xue, ZHAO Ying
(1.CollegeofPharmacy,HarbinUniversityofCommerce,Harbin150076,China)
AimTo investigate the changes of cerebral blood flow in rats with diabetic cognitive impairment by two-channel laser Doppler flowmeter, and to explore the changes of cerebral blood flow in diabetic rats with cognitive impairment and to investigate the changes of cerebral blood flow lesions and the central nervous system function changes in the study to provide pre-foundation.MethodsThirty-four male Wistar rats were randomly divided into two groups: blank control group and diabetic model group. The rats in the model group were treated with streptozotocin(STZ) 60 mg·kg-1, and the glucose oxidase method was used to determine fasting blood glucose≥16.7 mmol·L-1as the standard of the model. The Water maze was used to observe the behavioral changes of diabetic rats. Dual-channel laser doppler flowmeter was used to measure cerebral blood flow in diabetic rats with cognitive impairment. Another 34 male Wistar rats were randomly divided into two groups: control group and diabetic model group. Dual-channel laser doppler flowmeter was used to dynamically monitor cerebral blood flow on 0 d, 7 d, 14 d, 21 d, 28 d, 35 d, 42 d, 56 d and 75 d. ELISA was applied to detect the concentration of iNOS, cNOS and ET-1 in cerebrospinal fluid.ResultsMorris water maze test showed that the time of the platform (latency) was significantly longer than that of the blank control group(P<0.05). The cerebral blood flow/100 g of diabetic rats with cognitive impairment was significantly lower than that of the control group(P<0.05), and the blood flow in the model group was significantly lower than that in the model group(P<0.05).Compared with control group, iNOS and cNOS concentrations were markedly elevated, while ET-1 concentration obviously decreased.ConclusionsThe decrease of blood flow in the frontal cortex of diabetic rats with cognitive impairment suggests that it may be one of the factors leading to cognitive impairment in diabetes mellitus. Cerebral blood flow reduction occurs in the early stages of diabetes, followed by no significant deterioration. Cerebral blood flow may not be related to the changes of NO and ET-1, but the trend of cerebral blood flow may be related to the change of the two.
diabetes mellitus; brain frontal cortex; CBF; dual-channel laser doppler flowmeter; NOS; ET-1
A
1001-1978(2017)11-1517-07
R-332;R322.81;R331.37;R338.64;R587.1
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.018.html
10.3969/j.issn.1001-1978.2017.11.009
2017-08-15,
2017-09-10
国家自然科学基金资助项目(No 81673871)
杨明艳(1992-),女,硕士生,研究方向:中药防治重大疾病,E-mail:664296882@qq.com; 赵 瑛(1960-),女,博士,教授,博士生导师,研究方向:中药防治重大疾病,通讯作者,E-mail:zhaoy219@163.com