两种阿尔茨海默病树模型的探究
陈 奔,覃梅春,黄金兰,吴登攀,郭尔楚,许哲郝,刘志萍,钟振国
(1.广西中医药大学广西中医药科学实验中心,广西 南宁 530200;2.徐州医科大学药学院药理学教研室,江苏 徐州 221004)
◇实验方法学◇
陈 奔1,覃梅春1,黄金兰2,吴登攀2,郭尔楚1,许哲郝1,刘志萍1,钟振国1
(1.广西中医药大学广西中医药科学实验中心,广西 南宁 530200;2.徐州医科大学药学院药理学教研室,江苏 徐州 221004)
目的比较两种不同的阿尔茨海默病(Alzheimer’s disease, AD)树鼩模型大脑神经病理改变,探索优化的AD树鼩模型。方法50只树鼩随机分为5组:D-半乳糖复合鹅膏蕈氨酸(IBO)高、低剂量组(腹腔注射D-半乳糖复合双侧大脑基底注射IBO),Aβ25-35复合IBO高、低剂量组(双侧基底前脑注射)及对照组,10只/组。HE染色法观察各组树鼩大脑神经细胞形态;免疫组化法检测各组树鼩大脑胆碱乙酰基转移酶(ChAT)和突触素(SYP)的表达;免疫印迹法检测β淀粉样蛋白1-42(Aβ1-42)、淀粉样蛋白前体蛋白(APP)和磷酸化tau蛋白(p-tau)的表达。结果HE染色显示,造模树鼩大脑神经细胞均出现程度不同的形态损伤改变 ,以D-半乳糖复合IBO高剂量组和Aβ25-35复合IBO高剂量组改变明显;免疫组化染色结果显示,造模组的ChAT和SYP的表达均明显下降(P<0.01),其中以Aβ25-35复合IBO高剂量组下降明显。免疫印迹检测结果显示,造模组的Aβ1-42、APP和p-tau的表达均明显升高(P<0.05或P<0.01),其中以
Aβ25-35复合IBO高剂量组升高明显。结论Aβ25-35合并IBO注射Meynert核损毁造模方法更适合构建AD树鼩模型。
阿尔茨海默病;树鼩;胆碱乙酰基转移酶;突触素;β淀粉样蛋白;淀粉样蛋白前体蛋白;磷酸化tau蛋白
目前,阿尔茨海默病(Alzheimer’s disease, AD)缺乏特效的治疗方法,一方面是由于与人类AD类似的动物模型未能真正建立,鉴于灵长类动物的昂贵价格以及实验动物的3R原则,现有AD模型的实验动物多为啮齿类,其与人类的大脑结构多有不同;另一方面,由于AD发病因素多样、病理过程错综复杂,难将其兼顾模拟。因此,探索新型的AD动物模型一直是研究热点。树鼩与人类某些基因具有较高的相似性[1],与灵长类有较高的亲缘关系,且在生理解剖上与人类具有极高相似度,因此,以树鼩为对象构建的AD模型更能模拟人类AD发病。D-半乳糖复合鹅膏蕈氨酸(ibotenic acid,IBO)的造模方法是本课题组之前研究的一种成熟的造模方法[2],β淀粉样蛋白25-35(amyloid beta 25-35,Aβ25-35)合并IBO致老年痴呆的方法,孔明望等[3]均采用过,但二者均用大鼠造模。本实验尝试以树鼩为受试动物,以上述两种AD造模方法进行比较,大脑病理学检查研究此两种AD造模方法效果的优劣,以期找到以树鼩为研究对象的新型AD动物模型。
1 材料
1.1实验动物12月龄中缅树鼩滇西亚种50 只,♂,体质量(130±10)g,由昆明医科大学实验动物学部提供,许可证号:SCXK(滇)K2013-0002。引进后,饲养于广西中医药大学清洁级动物实验中心。
1.2药物与试剂D-半乳糖(Sigma公司,批号:G0625);鹅膏蕈氨酸(IBO,Sigma公司,批号:BGBC2055VF);Aβ25-35(Sigma公司,批号:053M4804V);广谱二抗(上海长岛生物技术有限公司,批号:D-3004);DAB浓缩型试剂盒(上海长岛生物技术有限公司,批号:FL-6001);抗乙酰胆碱转移酶(choline acetyltransterase,ChAT)抗体(种属山羊,Abcam公司,货号:ab18736);抗突触素(synaptophysin,SYP)抗体(种属兔,Abcam公司,货号:ab14692);抗β样淀粉蛋白1-42(beta amyloid 1-42,Aβ1-42)抗体(种属兔,Abcam公司,货号:ab39377);抗淀粉样蛋白前体蛋白(amyloidogenic property,APP)抗体(种属兔,Sigma公司,货号:SAB5200113);抗磷酸化tau蛋白抗体(种属羊,Santa Cruz公司,货号:sc-23468);抗甘油醛-3-磷酸脱氢酶(GAPDH)抗体(CST公司,货号:#5174);羊抗兔HRP标记二抗(碧云天,货号:A0208);驴抗山羊HRP标记二抗(碧云天,货号:A0181);羊抗鼠HRP标记二抗(碧云天,A0216)。
1.3仪器正置显微镜CX41(OLYMPUS公司);恒温烘箱DHG-9023A(上海恒一科学仪器有限公司);石蜡切片机SQ2125(徕克公司);摊片机PPTHK-21B(徕克公司);IMS图像分析系统(基尔顿生物科技上海有限公司);D5100数码相机(NIKON公司);酶标仪MK3(芬兰雷勃);Mini protean 3 cel电泳仪(Bio-Rad 公司);电转仪PS-9(大连竞迈科技有限公司);成像系统(Tanon-5200)。
2 方法
2.1动物分组与溶液配制50只12月龄♂滇西亚种树鼩随机分为D-半乳糖复合IBO高剂量组(1.92% D-半乳糖,IBO 5 g·L-1)、D-半乳糖复合IBO低剂量组(0.96% D-半乳糖,IBO 5 g·L-1)、Aβ25-35复合IBO高剂量组(Aβ25-3510 g·L-1,IBO 5 g·L-1)、Aβ25-35复合IBO低剂量组(Aβ25-355 g·L-1,IBO 5 g·L-1)和对照组,10只/组。Aβ25-35用灭菌生理盐水分别配制成浓度为5、10 g·L-1Aβ25-35溶液,置37℃培养箱孵育4 d,使其成聚集态,分装,-20℃保存备用。D-半乳糖用灭菌生理盐水配制成浓度为0.96%、1.92%的D-半乳糖溶液。IBO用灭菌生理盐水配制成5 g·L-1IBO溶液,-20℃保存。
2.2模型制备D-半乳糖复合IBO造模组:高、低剂量组按5 mL·kg-1的体积体重比分别腹腔注射1.92%、0.96%的D-半乳糖溶液,每天1次,连续6周,第7周两组动物均颅内双侧大脑Meynert基底核注射IBO 1 μL。Aβ25-35复合IBO造模组:动物正常饲养6周,在第7周,颅内双侧大脑Meynert基底核注射Aβ25-35与IBO混合液,即Aβ25-35复合IBO高剂量组注射浓度为10 g·L-1Aβ25-351 μL和IBO 1 μL,Aβ25-35复合IBO低剂量组注射浓度为5 g·L-1Aβ25-351 μL和IBO 1 μL。对照组:每日腹腔注射等体积的生理盐水,第7周颅内双侧大脑Meynert基底核注射生理盐水2 μL。具体操作方法如下:10%的水合氯醛(350 mg·kg-1)腹腔注射麻醉树鼩,将其固定于脑立体定位仪,头部皮肤备毛,75%乙醇消毒树鼩备毛的皮肤,在其两耳连线中央向鼻尖方向开一长约0.8 cm的切口,钝性分离筋膜,暴露出颅骨,参照中缅树鼩脑立体定位图谱[4],于耳间线和矢状逢交叉点向矢状缝前8.7 mm,中线旁开3 mm处以三棱针钻孔,颅骨下10 mm缓慢注射(5 min)各组动物相应药物(参照前述),注入完成后,针头再在原位保留5 min后缓慢拔针,伤口处用生理盐水清理后缝合,碘酒擦拭,1周后进行指标检测。
2.3标本制备各组树鼩随机选取5只,水合氯醛腹腔注射麻醉,快速剥离胸腔,左心室主动脉插管,先后以预冷生理盐水和4%多聚甲醛溶液冲洗血液,并进行心脏灌流,以准确快速固定脑组织,除颅盖,取出完整大脑,置于4%多聚甲醛固定液中,用于病理切片待测。各组树鼩再随机选取5只,水合氯醛腹腔注射麻醉,快速剥离胸腔,左心室主动脉插管,以预冷生理盐水快速冲洗血液,取出完整大脑,用于免疫印迹实验。
2.4大脑HE染色取上述大脑组织,流水冲洗,去除残留的固定液和杂质。常规脱水、透明、浸蜡、包埋、切片后,进行烤片和脱蜡、水化、苏木精染色、伊红染色,二甲苯透明后,中性树胶封片。
2.5免疫组织化学染色法检测ChAT与SYP的表达上述大脑组织脱蜡、水化后,PBS冲洗5 min×3次,置0.01 mol·L-1柠檬酸钠缓冲溶液中高压修复,滴加3%双氧水,湿盒孵育10 min,以消除内源性过氧化物酶的活性。PBS冲洗3 min×3次。8%山羊血清封闭10 min后滴加一抗(ChAT 1 ∶1 000,SYP 1 ∶500),湿盒4℃孵育过夜。PBS冲洗3 min×3次。滴加HRP标记广谱二抗,室温湿盒孵育20 min。PBS冲洗3 min×3次。新鲜DAB染色,待切片颜色改变时,立即用自来水洗去染色液。切片苏木精复染,盐酸乙醇分化,常规脱水、透明,中性树胶封片。选取每片镜头下上、下、左、右、中5个视野拍照,采集分析样本相关部位,利用IMS图像分析系统计算ChAT和SYP阳性面积。
2.6免疫印迹法检测APP、Aβ1-42、p-tau表达水平将树鼩脑组织剪成细小的碎片,按每20 mg组织加入150 μL裂解液的比例加入裂解液,匀浆器匀浆至完全裂解。裂解后的样品4℃ 12 000×g离心15 min,取上清,进行蛋白质定量后,贮存于-80℃冰箱。制备10%分离胶,半干式转至PVDF膜上,用5%脱脂奶粉室温封闭1 h后,4 ℃孵育一抗(Aβ1-421 ∶1 000,APP 1 ∶500,p-tau 1 ∶1 000,GAPDH 1 ∶1 000)过夜。次日,按照1 ∶1 000稀释加入相应HRP标记二抗,与膜37℃孵育1 h。用TBST洗涤3次后,ECL化学发光检测蛋白条带。
2.7统计学分析实验数据以SPSS19.0软件进行统计学分析,单因素方差分析组间差异。
3 结果
3.1HE染色HE染色镜下观察到对照组树鼩大脑组织神经元细胞轮廓清晰,排列整齐,核仁明显,结构完整,细胞核呈圆形,胞质丰富,锥体细胞结构连接紧密,细胞未见变形、固缩等改变;D-半乳糖复合IBO低剂量组神经元细胞形态稍显变化,排列稍稀疏,细胞核变形,少量突起,细胞数量变少;D-半乳糖复合IBO高剂量组形态改变明显,多个神经元变性坏死,排列稀疏、紊乱,严重脱失,胞质、胞核界限不明显,细胞周围间隙过大,神经纤维排列杂乱,锥体细胞变小、缺失,有少量神经元;Aβ25-35复合IBO低剂量组神经元细胞形态发生改变,核固缩严重、胞质、胞核界限不明显,细胞变得稀疏,锥体细胞变小、缺失;Aβ25-35复合IBO高剂量组无完整神经元细胞形态,锥体细胞变薄,残留的锥体细胞变浅,基质疏松及微空泡形成(Fig 1)。
3.2免疫组化染色
3.2.1ChAT阳性神经元细胞免疫组化染色 Fig 2显示,对照组存在大量的ChAT阳性神经元,其阳性物质主要存在于胞质与胞膜内,显黄色,细胞排列紧密、整齐;D-半乳糖复合IBO组的ChAT阳性神经元数量明显减少,胞体破裂缩小,出现核固缩,排列较松散。Aβ25-35复合IBO组的ChAT阳性神经元数量明显减少,无完整结构,胞体缩小,出现核固缩、染色加深、排列较松散、阳性物质较少。Tab 1结果显示,与对照组比较,各造模组的ChAT阳性细胞阳性反应面积/OD值均有明显降低(P<0.01)。相同造模组内比较:与D-半乳糖复合IBO低剂量组比较,D-半乳糖复合IBO高剂量组的ChAT阳性细胞阳性反应面积/OD值明显降低(P<0.01);与Aβ25-35复合IBO低剂量组相比,Aβ25-35复合IBO高剂量组的ChAT阳性细胞阳性反应面积/OD值亦明显降低(P<0.01)。不同造模组间比较:与D-半乳糖复合IBO高剂量组相比,Aβ25-35复合IBO高剂量组的ChAT阳性细胞阳性反应面积/OD值明显减少(P<0.01)。
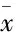
Tab 1 Comparison of choline acetyltransferase(ChAT) positive reaction positive cell area/OD in each group(±s, n=5)
**P<0.01vscontrol group;##P<0.01vsD-galactose compound IBO low-dose group;△△P<0.01vsAβ25-35compound IBO low-dose group;▲▲P<0.01vsD-galactose compound IBO high-dose group
3.2.2突触素免疫组化染色 Fig 3显示,对照组存在大量的突触素,大多集中在胞质与胞膜内,显黄色,细胞结构完整,排列紧密;D-半乳糖复合IBO组突触素反应产物的量明显减少,细胞固缩,排列紊乱。Aβ25-35复合IBO组神经元细胞数量和突触素反应产物明显减少,核破裂,核仁染色加深。Tab 2结果显示,与对照组比较,造模组的突触素阳性细胞阳性反应面积/OD值均有明显降低(P<0.01);与低剂量组比
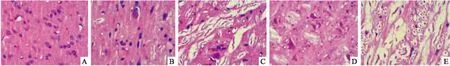
Fig 1 The pathological changes of brain tissues in tree shrews of each group(×40)
A:Control group;B:D-galactose compound IBO low-dose group;C:D-galactose compound IBO high-dose group; D: Aβ25-35compound IBO low-dose group; E: Aβ25-35compound IBO high-dose group
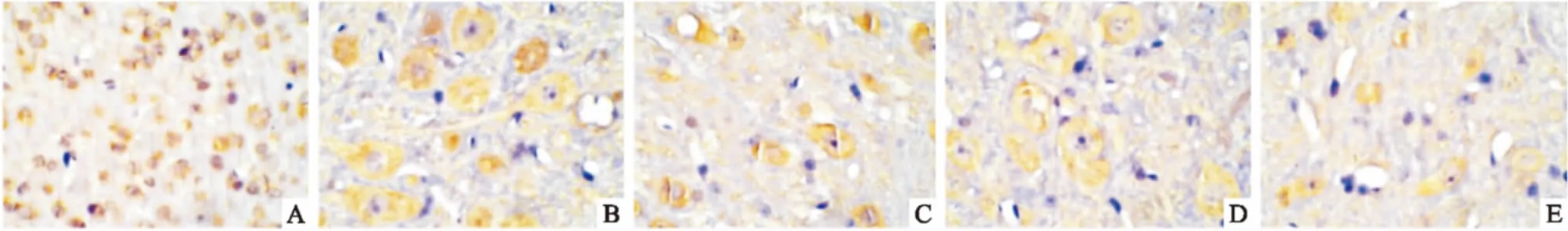
Fig 2 Comparison of choline acetyltransferase positive neurons in each group(×40)
A:Control group;B:D-galactose compound IBO low-dose group;C:D-galactose compound IBO high-dose group; D: Aβ25-35compound IBO low-dose group; E:Aβ25-35compound IBO high-dose group
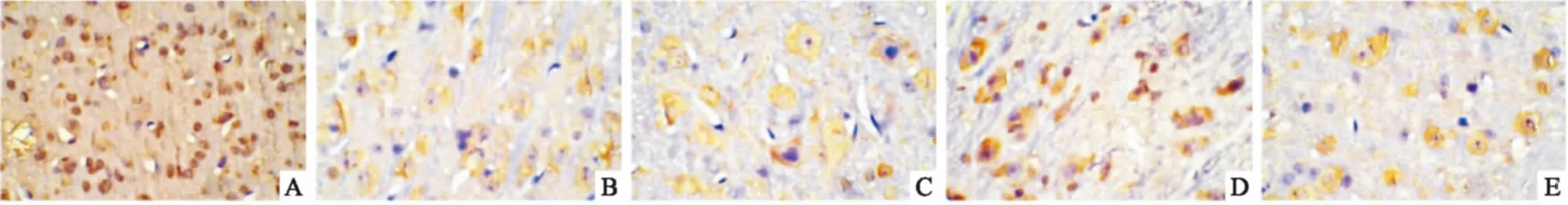
Fig 3 Changes of synaptophysin immunoreactivity in each group(×40)
A:Control group; B: D-galactose compound IBO low-dose group; C: D-galactose compound IBO high-dose group; D: Aβ25-35compound IBO low-dose group; E: Aβ25-35compound IBO high-dose group
较,两种造模模式的高剂量组的突触素阳性细胞阳性反应面积/OD值均明显降低(P<0.01);与D-半乳糖复合IBO高剂量组相比,Aβ25-35复合IBO高剂量组的突触素阳性细胞阳性反应面积/OD值明显减少(P<0.01)。
Tab 2 Comparison of synaptophysin(SYP) immunoreactivepositive reaction cell area/OD in each group(±s,n=5)
**P<0.01vscontrol group;##P<0.01vsD-galactose compound IBO low-dose group;△△P<0.01vsAβ25-35compound IBO low-dose group;▲▲P<0.01vsD-galactose compound IBO high-dose group
3.3APP、Aβ1-42、p-tau灰度值的变化各组树鼩脑组织中APP、Aβ1-42、p-tau蛋白印迹的定量分析见Fig 4。① 与空白组比较,0.96%组Aβ1-42、APP、p-tau的灰度值明显增加(P<0.05);与0.96%组比较,1.92%组APP、Aβ1-42、p-tau灰度值明显增多(P<0.05);② 与空白组比较,5、10 μg组的Aβ1-42、APP、p-tau的灰度值有明显增加(P<0.01);与5 μg组比较,
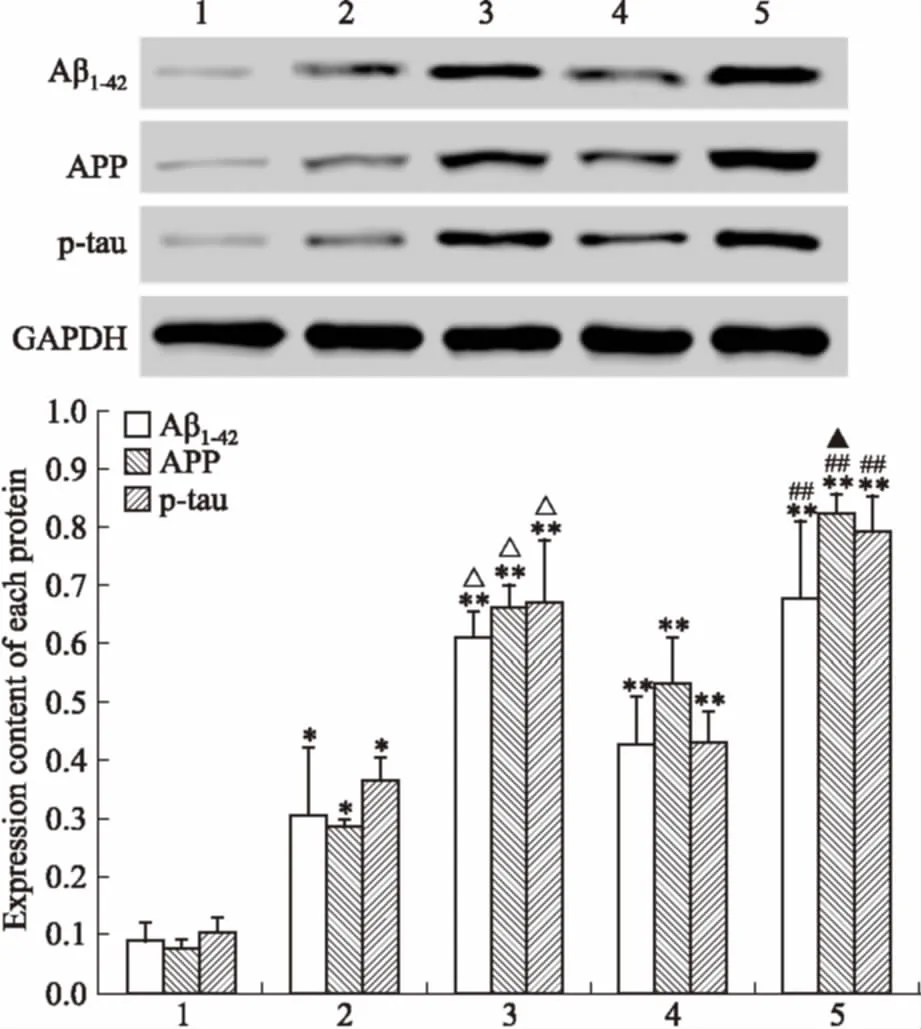
Fig 4 Changes of Aβ1-42,APP and p-tau in each group(±s,n=5)
1:Control group;2:D-galactose compound IBO low-dose group;3:D-galactose compound IBO high-dose group; 4: Aβ25-35compound IBO low-dose group; 5: Aβ25-35compound IBO high-dose group.*P<0.05,**P<0.01vscontrol group;△P<0.05vsD-galactose compound IBO low-dose group;##P<0.01vsAβ25-35compound IBO low-dose group;▲P<0.05vsD-galactose compound IBO high-dose group
10 μg组Aβ1-42、APP、p-tau的灰度值有明显增加(P<0.01);③ 与1.92%组比较,10 μg组的APP灰度值明显增加(P<0.05)。提示短期造模方法中的高剂量比长期造模法中的高剂量方法AD相关蛋白含量更高。
4 讨论
树鼩(tree shrew,Tupaiabelangeri)是一类外形酷似松鼠的小型哺乳动物,1986年Zeller等[5]根据树鼩的头骨形态将其建立为一个独立目级—攀鼩目(Scandentia)。树鼩在神经发育、生理解剖、心理应激等方面与灵长类甚至人类有很强的相似性[6],同时其拥有哺乳动物里最大脑-体重比,是研究脑功能相关疾病的理想模型[7],因此,树鼩也是研究AD的理想模型动物。李麟仙等[8]就以树鼩为模型动物,探究了三七总皂苷单体Rb1对树鼩局部脑缺血的保护作用。
D-半乳糖复合IBO的造模方法是本课题组之前研究的一种成熟的造模方法[2],联合建立AD模型,在脑组织形态、生化及临床检测指标方面呈现老化特征,从而使模型在神经递质变化和脑病理改变等方面更类似于AD患者的表现。此外,Aβ25-35脑室注射致痴呆小鼠模型是国内外公认的抗老年痴呆模型,但因体内存在Aβ自身清除机制,Aβ在大脑中的沉积达不到理想效果,应用IBO基底前脑注射可破坏模型动物脑内胆碱能神经系统,造成胆碱能神经元丢失,模拟老年性痴呆[9]。但该模型仅模拟了与学习记忆有关的胆碱能神经系统损害有关的信息,且此种损害可逆,不表现 AD患者的典型的如神经元纤维缠结、老年斑等病理学改变。因此,为互补不足,本研究将Aβ25-35合并IBO共同构建树鼩AD 模型,同时,采用D-半乳糖复合IBO的造模方法,比较两种以树鼩为动物载体的AD动物模型的最佳造模方式。
实验证明[10],脑组织中由APP水解生成的Aβ1-42水平与空间学习障碍和长时程记忆障碍具有明显相关性,为老年痴呆患者认知障碍的决定性因素,在认知障碍病理过程中起着关键作用。当各种因素导致Aβ空间构象发生错误折叠,转变成以β折叠为主时,就会导致蛋白质聚集,难以被蛋白酶水解,从而在组织内沉积,并诱导神经元凋亡甚至坏死[11-12]。tau蛋白是神经元中主要微管相关蛋白,正常tau蛋白被磷酸化往往导致始于神经元突起末端的神经元退行性病变, 最终导致神经元死亡和痴呆神经元细胞外Aβ的沉积。本研究Western blot结果显示,造模后动物脑组织内的Aβ1-42、APP、p-tau含量均明显升高,提示造模组开始出现AD的病理过程。在同种造模方式下,高剂量组脑组织内Aβ1-42、APP、p-tau含量较低剂量组明显升高,说明两种不同造模方法下,均以高剂量组的造模效果更好。同时,比较D-半乳糖复合IBO高剂量组和Aβ25-35复合IBO高剂量组的Western blot结果,Aβ25-35复合IBO高剂量组有更高的Aβ1-42、APP、p-tau含量。提示Aβ25-35复合IBO方法的效果优于D-半乳糖致亚急性损伤合并IBO核损毁的造模方法。
ChAT的含量和活性与中枢胆碱能系统密切相关[13],是大脑胆碱能系统功能的标志,而AD患者脑中胆碱能活性降低对记忆与认知障碍的发生起着重要的作用。ChAT是在胆碱能神经元胞体内合成的,其标志着胆碱能神经元的功能强弱;也是催化乙酰胆碱生物合成的限速酶,能间接估计乙酰胆碱的释放量[14],因此,ChAT是反映大脑胆碱能系统功能的重要标志酶。突触素是突触囊泡膜上的特异性蛋白质,参与突触囊泡的导入、转运,神经递质的释放、突触囊泡再循环以及突触发生[15]。突触素的减少意味着突触囊泡转运能力下降,突触传递功能受阻,老年学习记忆减退与海马结构突触素的变化密切相关。本研究HE染色结果显示,造模后动物大脑组织神经元形态发生明显改变,呈排列稀疏、数量减少、细胞核变形、胞核界限不明显等现象,结合免疫组化和Western blot结果,与对照组相比,各模型组树鼩脑组织的ChAT和SYP免疫阳性细胞阳性反应面积/OD值明显降低,此在一定程度上反映了AD树鼩动物模型的形成。在同种造模方式下,高剂量组形态改变明显,与相应低剂量组相比,高剂量组的ChAT和SYP阳性细胞阳性反应面积/OD值明显下降,说明两种不同造模方法下,均以高剂量组的造模效果更好。同时,比较D-半乳糖复合IBO高剂量组和Aβ25-35复合IBO高剂量组的形态特征与免疫组化结果,Aβ25-35复合IBO高剂量组表现出更为典型的凋亡染色特征和胆碱能系统功能及突触素损害,提示Aβ25-35复合IBO方法的效果优于D-半乳糖致亚急性损伤合并IBO核损毁的造模方法。
综上实验结果,Aβ25-35复合IBO注射大脑Meynert基底核造模与D-半乳糖复合IBO造模相比,动物脑组织产生了更高的Aβ1-42、APP、p-tau含量,同时表现出更为典型的凋亡染色特征和胆碱能系统功能及突触素损害。除此之外,兼考虑Aβ25-35复合IBO的造模周期短(约1周),D-半乳糖复合IBO造模周期长(7周),树鼩应激性强[16],对生存环境要求苛刻,长期的外部环境变化与人为干预会增加动物死亡率等因素,可以认为Aβ25-35复合IBO注射大脑Meynert基底核的方法更适合AD树鼩模型。
(致谢:本实验于广西中医药科学实验中心完成,感谢各位老师和同学的大力帮助。)
[1] 王绘山, 陈贵元, 蒋宗敏, 等. 树鼩VEGF全长编码序列的克隆及分子特征分析[J].云南大学学报(自然科学版), 2014,36(5): 781-7.
[1] Wang H S, Chen G Y, Jiang Z M, et al. Cloning and characterization of full-length VEGF encoding sequence of tree shrew[J].JYunnanUniv(NatSciEd), 2014,36(5): 781-7.
[2] 钟振国, 屈泽强, 王乃平, 等. 三七总皂苷对Alzheimer′s病大鼠模型大脑胆碱能神经病理损害的保护作用[J]. 中药材, 2005,28(2): 119-22.
[2] Zhong Z G, Qu Z Q, Wang N P, et al. Protective effect of Panax notoginseng saponins on cerebral cholinergic nerve pathological damage in rats with Alzheimer’s disease[J].ChinMedMater, 2005,28(2): 119-22.
[3] 孔明望, 王 平, 田代志, 等. Aβ25~35合并鹅膏蕈氨酸诱导老年痴呆大鼠模型的建立及评价[J]. 中国老年学杂志, 2008,28(10): 945-7.
[3] Kong M W, Wang P, Tian D Z, et al. Establishment and evaluation of rat model of Alzheimer′s disease induced by Aβ25~35combined with lysine[J].ChinJGerontol, 2008,28(10): 945-7.
[4] 杨文光. 中缅树鼩广西猕猴脑立体定位图谱[M]. 南宁: 广西科学技术出版社, 1990.
[4] Yang W G.Guangximacaquebrainstereotaxicatlasoftreeshrew[M].Nanning: Guangxi Science and Technology Press, 1990.
[5] Zeller U A. Ontogeny and cranial morphology of the tympanic region of the Tupaiidae, with special reference to Ptilocercus[J].FoliaPrimatol(Basel), 1986,47(2-3): 61-80.
[6] 徐 林, 张 云, 梁 斌, 等. 树鼩实验动物和人类疾病的树鼩模型研究概述[J]. 动物学研究, 2013,34(2): 59-69.
[6] Xu L, Zhang Y, Liang B, et al. Tree shrew animal and human disease model of tree shrew[J].ZoologRes, 2013,34(2): 59-69.
[7] 彭燕章, 叶智章, 邹如金, 等. 树鼩生物学[M]. 昆明: 云南科技出版社, 1991.
[7] Peng Y Z, Ye Z Z, Zou R J, et al.Treeshrewbiology[M]. Kunming: Yunnan Science and Technology Press,1991.
[8] 李麟仙,王子灿,黄志宏, 等. 三七皂甙对急性脑缺血的保护作用[J]. 中国药理学通报,1991,7(1):56-9.
[8] Li L X, Wang Z C, Huang Z H, et al. Effects of Panax Notoginseng Saponins on acute cerebral ischemia[J].ChinPharmacolBull, 1991,7(1):56-9.
[9] Ji C, Li Q, Aisa H, et al. Gossypium herbaceam extracts attenuate ibotenic acid-induced excitotoxicity in rat hippocampus[J].JAlzheimersDis, 2009,16(2):331-9.
[10] 郝 键.不同类型β-淀粉样蛋白与APPswe/PS1dE9 小鼠认知功能障碍的相关性研究[D]. 西安:中国人民解放军第四军医大学, 2011.
[10] Hao J. Correlations between different forms of Aβ and cognitive deficits in APPswe/PS1dE9 mice[D]. Xian: the Fourth Military Medical University, 2011.
[11] Ivihns K J, Ivind J K, Sharp J P. Multiple pathways of apoptosis in PC12 cells[J].JBoilChem, 1999,274(4): 2107-12.
[12] Kanai M, Matsubara E, Isoe K,et al. Longitudinal study of cerebrospinal fluid levels of tau, Aβ1-40, and Aβ1-42(43)in Alzheimer′s disease: a study in Japan[J].AnnNeurol, 1998,44(1): 17-26.
[13] 钟振国, 屈泽强, 王乃平,等. 三七总皂苷对阿尔茨海默病大鼠脑胆碱能神经的保护作用[J]. 中国临床康复, 2006,10(19): 174-6.
[13] Zhong Z G, Qu Z Q, Wang N P, et al. Protective effect of Panax notoginseng saponins on cholinergic neurons in rats with Alzheimer′s disease[J].ChinJClinRehabil, 2006,10(19): 174-6.
[14] Oda Y. Choline acetyltransferase distribution and pathologic changes in the central nervous system[J].PatholInt, 1999,49(11): 921.
[15] 杨 春. 突触素的若干研究[J]. 河南医学研究, 2004,13(1): 85.
[15] Yang C. Study on synaptophysin[J].HenanMedRes, 2004,13(1): 85.
[16] 陈丽玲, 李玛琳, 刘汝文, 等.树鼩驯化中应激综合征的防治[J]. 野生动物, 2009,30(4): 177-9.
[16] Chen L L, Li M L, Liu R W, et al. Tree shrews domestication in prevention of stress syndrome[J].WildAnim, 2009,30(4): 177-9.
StudyoftwokindsofAlzheimer’sdiseasetreeshrewmodels
CHEN Ben1, QIN Mei-chun1, HUANG Jin-lan2, WU Deng-pan2, GUO Er-chu1, XU Zhe-hao1, LIU Zhi-ping1,ZHONG Zhen-guo1
(1.ScienceExperimentCenter,GuangxiUniversityofChineseMedicine,Nanning530200,China; 2.DeptofPharmacology,XuzhouMedicalUniversity,XuzhouJiangsu221004,China)
AimTo explore the optimized tree shrews model of Alzheimer′s disease through comparison of the pathology changes of brain neurons between the two kinds of tree shrew models.MethodsFifty tree shrews were randomly divided into five groups with 10 in each group: control group, high dose D-galactose combined with ibotenic acid(IBO) group, low dose D-galactose combined with IBO group [intraperitoneal injection D-galactose combined with IBO injection into bilateral basal nucleus of Meynert(BNM)], high dose Aβ25-35combined with IBO group, and low dose Aβ25-35combined with IBO group(injection into bilateral BNM). Hematoxylin and eosin(HE) staining was used to observe the morphological changes of brain neurons. The expressions of choline acetyltransterase(ChAT) and synaptophysin(SYP) in the brains were detected by immunohistochemical staining. Western blot was used to detect the expression of amyloid beta 1-42(Aβ1-42), amyloid precursor protein(APP) and phosphorylated tau protein(p-tau).ResultsThe HE staining showed there were different degrees of morphological changes in the brains of model groups. The changes in the high dose D-galactose and high dose Aβ25-35combined with IBO group were more obvious than those in low dose D-galactose and Aβ25-35combined with IBO group. Immunohistochemical staining revealed that the levels of ChAT and SYP in the model groups decreased compared with control group, and the decline in high dose Aβ25-35combined with IBO group was more marked than that in low dose Aβ25-35combined with IBO group(P<0.01). Western blot revealed that the levels of Aβ1-42, APP, p-tau in the model groups increased compared with control group, and the rise in high dose Aβ25-35combined with IBO group was more apparent than that in low dose Aβ25-35combined with IBO group(P<0.05 orP<0.01).ConclusionThe method of modeling by Aβ25-35combined with IBO injection into bilateral BNM is more suitable for the establishment of Alzheimer’s disease model.
Alzheimer’s disease; tree shrew; ChAT; SYP; Aβ; APP; p-tau
A
1001-1978(2017)11-1617-06
R-332;R363-332;R322.81;R745.702.2;R977.3;R977.6
时间:2017-10-10 10:05 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20171010.1005.054.html
10.3969/j.issn.1001-1978.2017.11.027
2017-07-19,
2017-08-18
广西科学研究与技术开发计划项目(No 桂科攻1347003-1)
陈 奔(1990-),男,硕士,助教,研究方向;新药研究与开发,E-mail: 935527242@qq.com; 钟振国(1956-),男,博士,教授,研究方向:新药研究与开发,通讯作者,E-mail: gxtcmuzzg@163.com

