RAS突变和微卫星不稳定与Ⅲ期结直肠癌患者临床病理特征及预后的相关性分析*
刘建化, 黄成智, 曾卫强, 黎 莹, 杨冬阳, 马 冬△
(广东省人民医院, 广东省医学科学院 1胃肠肿瘤内科, 2胃肠外科, 3药学部, 广东 广州 510180)
RAS突变和微卫星不稳定与Ⅲ期结直肠癌患者临床病理特征及预后的相关性分析*
刘建化1, 黄成智2, 曾卫强3, 黎 莹1, 杨冬阳1, 马 冬1△
(广东省人民医院, 广东省医学科学院1胃肠肿瘤内科,2胃肠外科,3药学部, 广东 广州 510180)
目的检测Ⅲ期结直肠癌患者中RAS和BRAF基因突变以及微卫星不稳定(microsatellite instability,MSI)状态,并分析其临床病理关系及预后。方法收集2010~2015年广东省人民医院共281例经病理学证实的Ⅲ期结直肠癌组织标本,采用PCR-Sanger测序法和免疫组织化学法对石蜡切片进行分析,检测RAS/BRAF基因突变和MSI状态,并探讨其与结直肠癌临床病理特征和预后的关系。结果281例患者中,RAS/BRAF突变率为48.4%(136/281),其中KRAS突变率最高(116/281,41.3%)。RAS/BRAF基因突变与癌胚抗原水平密切相关(P<0.05)。免疫组织化学法检测到高度MSI(MSI-H)患者18例(6.4%),MSI-H状态在淋巴结转移N2b期患者中更为常见(P<0.05)。BRAF基因在MSI-H肿瘤中的突变率较高(P<0.01)。RAS/BRAF野生型或者MSI-H患者的总生存期和无进展生存期均明显高于突变型或低度MSI/微卫星稳定患者。结论RAS/BRAF突变和MSI检测有助于结直肠癌生物学行为分析和患者预后判断。
结直肠癌;RAS基因;BRAF基因; 微卫星不稳定
结直肠癌(colorectal cancer,CRC)是全世界范围内最常见的恶性肿瘤之一,其发病率和死亡率分别位居第3位和第5位[1],严重威胁人类健康。在我国,CRC发病例数逐年上升。除了手术切除,化疗是最常用的治疗手段,但由于个体基因表型差异,CRC对化疗药物耐药的发生率较高。近年来随着对肿瘤发病机制和生物学行为深入研究,特异性高且不良反应轻的分子靶向药物日益成为研究焦点,为CRC进入精准医学指导下的个体化治疗提供了新思路。
研究证实,CRC发生、发展涉及多基因、多步骤、多途径,其中微卫星不稳定(microsatellite instability,MSI)途径和染色体不稳定途径最为重要[2]。MSI是由错配修复基因突变或启动子甲基化造成的细胞DNA复制错误,在肿瘤基因调控中发挥重要作用[3],参与多种人类肿瘤发生过程。CRC是MSI发生率较高的恶性肿瘤,90%的遗传性非息肉病性CRC和约10%散发性CRC存在高度MSI(MSI-H)现象[4]。特别值得注意的是,染色体不稳定途径涉及表皮生长因子受体(epithelial growth factor receptor,EGFR)介导的信号传导通路,其与配体结合后可活化下游RAS/RAF/MAPK和PI3K/AKT/mTOR通路从而启动信号转导,诱导肿瘤细胞增殖、分化和侵袭[5]。目前针对EGFR的靶向药物(如西妥昔单抗、帕尼单抗等)已经被广泛用于晚期CRC治疗,其较高的有效率更是开创了靶向治疗里程碑。然而突变型RAS(包括KRAS、NRAS和HRAS)基因可导致 EGFR 信号通路异常激活,不受上游蛋白调控[6-7],患者不能从抗EGFR治疗中获益。有研究显示,BRAF突变的CRC患者肿瘤进展更快,对抗EGFR药物敏感性更低,生存期更短[8]。故RAS/BRAF基因状态检测对指导临床治疗具有重大意义。
迄今为止,已有针对EGFR信号通路上的RAS/BRAF基因突变和MSI状态与CRC发展转移相关性研究探索[3, 8-9],但对其临床意义的认识尚不充分,且多为小样本,缺乏系统性报道。本研究基于Sanger测序和免疫组化方法,以确诊为Ⅲ期CRC患者的石蜡包埋组织为研究对象,检测肿瘤中RAS/BRAF基因突变状况和MSI状态,并评价其临床病理特征及预后价值,为CRC风险评估和治疗提供理论依据。
材 料 和 方 法
1病例和材料
回顾性分析2010年1月~2015年10月广东省人民医院共281例经病理学证实的Ⅲ期CRC病例,所有病理标本均经10%甲醛固定,石蜡包埋。每个病例均有明确的起始时间(手术时期)、终点时间及终点状态(生存/死亡),死亡患者有明确的死亡时间和死因记录。其中男性153例(54.4%),女性128例(45.6%),年龄22~84岁,平均59.0岁。存活组121例(43.0%),中位生存期45.6月;死亡组146例(52.0%),中位生存期24.2月;14例(5.0%)患者失访。研究对象纳入标准包括:(1)入组前患者均接受手术治疗,病理学诊断为Ⅲ期CRC;(2)病理学标本充足,临床资料齐备;(3)每个患者已签知情同意书。合并炎症性肠病或者机体其它部位原发性肿瘤的患者被排除。总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS)分别定义为随机化开始至死亡/随访结束以及至局部复发/远处转移/随访结束。肿瘤的临床分期和病理分级依据2010年国际抗癌联盟(The Union for International Cancer Control,UICC)所定的结直肠癌分期法。
2实验方法
2.1标本处理和基因突变检测 采用DNA FFPE Tissue Kit (Qiagen)提取石蜡包埋肿瘤组织的DNA,用NanoDrop 2000分光光度仪检测提取DNA浓度和A260/A280比值。采用PCR方法进行基因扩增,利用Ion AmpliSeqTMDesigner 1.2.6 软件包(Life Technologies)设计基因引物序列,见表1。扩增条件为:95 ℃预变性5 min; 95 ℃变性30 s, 56 ℃退火45 s, 72 ℃延伸20 s,共45个循环;最后72 ℃延伸5 min。PCR产物纯化后,用ABI 3730XL测序仪(Invitrogen Life Technologies)对KRAS(外显子2、3、4)、NRAS(外显子2、3、4)、HRAS(外显子2)和BRAF(外显子15)基因进行Sanger测序,测序结果采用 Chromas和DNAMAN软件读取,并与NCBI基因库序列对比分析。
2.2免疫组化实验 每个蜡块取4 μm厚连续切片,免疫组化方法检测CRC中错配修复蛋白MLH1、MSH2、MSH6和PMS2的表达。SP免疫组化试剂盒购自北京中杉公司,鼠抗人单克隆抗体购自Cell Signaling Technology。检测时切片常规脱蜡,抗原修复,分别滴加鼠抗人MLH1(1∶150)、MSH2(1∶100)、MSH6(1∶150)及PMS2(1∶150),4 ℃孵育过夜,次日加入 II 抗,DAB显色,苏木素复染,中性树胶封片。实验中以正常细胞染色作为对照,肿瘤细胞核内出现棕黄色颗粒为阳性表达。MSI结果判定:4个蛋白均呈阳性表达即为微卫星稳定(mircosatellite stability,MSS);出现1个阴性表达为低度MSI(MSI-L);出现2个或2个以上阴性表达为MSI-H。

表1 RAS和BRAF基因扩增的引物序列和片段长度
3统计学处理
结 果
1RAS/BRAF基因突变频率及类型
在281例Ⅲ期CRC组织标本中,RAS/BRAF突变率为48.4%(136/281),其中KRAS突变率最高(116/281,41.3%)。在KRAS突变的患者中,第2、3、4外显子突变例数分别为99例(85.3%)、4例(3.5%)和13例(11.2%),其中第2外显子第12密码子的p.G12D突变最常见(41/116,35.3%)。图1为检测到的代表性突变型KRAS测序图谱。与KRAS基因相比,NRAS(包括第2、3、4外显子)和BRAF(包括第15外显子)突变率较低:NRAS基因突变患者6例(2.1%),以p.G12D突变最常见(3/6,50%),未检测到第4外显子突变;BRAF基因突变患者19例,均为p.V600E突变,见表2。本研究未检测到HRAS突变。

Figure 1. The representative sequencing chromatograph demonstratingKRASmutations in exon 2 (A) and exon 4 (B).
图1结直肠癌患者突变型KRAS基因测序图谱
在突变患者中,2例患者同时携带KRAS(p.G12D)和BRAF(p.V600E)突变,3例患者同时携带KRAS(p.G12D/p.A146T)和NRAS(p.G12D/p.A18T/ p.Q61L)突变,而本研究未检测到BRAF和NRAS基因突变共存。
2免疫组织化学法检测Ⅲ期CRC患者中MSI状态
免疫组织化学染色证实:MSI-H患者18例(6.4%),MSI-L患者38例(13.5%),MSS患者225例(80.1%),其中MSI-H/KRAS(p.G12D/p.G13D)7例,MSI-H/BRAF患者4例,而在MSI-H和MSI-L患者中,MLH1表达缺失最为常见(31/56,55.4%)。图2为1例代表性的MSS病例。
表2KRAS、NRAS和BRAF基因各个外显子不同突变亚型的发生率
Table 2. Mutation subtype frequency distribution ofKRAS,NRASandBRAFgenes

Genemutationsn(%)KRAS p.G12D41(35.3) p.G12V25(21.6) p.G12C10(8.6) p.G12A6(5.2) p.G12R3(2.6) p.G12S1(0.9) p.G13D13(11.2) p.A59T3(2.6) p.Q61H1(0.9) p.A146T7(6.0) p.A146V2(1.7) Others4(3.4)NRAS p.G12D3(50.0) p.A18T1(16.7) p.Q61L1(16.7) p.Q61R1(16.7)BRAF p.V600E19(100)
3RAS/BRAF基因突变和MSI状态与Ⅲ期CRC临床病理特征的相关性
本研究探讨了RAS/BRAF基因突变和MSI状态与Ⅲ期CRC患者的临床病理联系,卡方检验分析可见KRAS基因在癌胚抗原(carcino-embryonic antigen,CEA)≥20 μg/L患者中突变率高于CEA<20 μg/L患者(P<0.05);NRAS基因在c-MET阴性/弱阳性表达患者中突变率为12.5%,明显高于c-MET中/强阳性患者(P<0.01);而BRAF基因突变与肿瘤部位密切相关,右半结肠癌明显高于左半结肠癌及直肠癌患者(P<0.01)。但是RAS/BRAF基因突变与肿瘤分化程度、浸润深度及区域淋巴结转移无关,见表3。
MSI状态与Ⅲ期CRC区域淋巴结转移显著相关,在N1、N2a和N2b患者中MSI-H所占比例分别为7.3%、0.0%和13.3%,即≥7个区域淋巴结转移的患者更多呈MSI-H状态(P<0.05),而与患者的肿瘤部位、分化程度、浸润深度、c-MET表达和CEA水平无关,见表4。

Figure 2. Immunohistochemical staining pattern of a microsatellite stability (MSS) in colorectal carcinoma (original magnification, ×100; magnification at the top right corner, ×400). A: negative control; B: MLH1 positive expression; C: MSH2 positive expression; D: MSH6 positive expression; E: PMS2 positive expression.
图2免疫组化检测的MSS结直肠癌患者
此外,本研究检测发现BRAF基因在MSI-H肿瘤中的突变率(22.2%,4/18)高于MSI-L/MSS肿瘤(5.7%,15/263)(P<0.01),而KRAS和NRAS基因突变与MSI状态无关,见表5。

表3 RAS/BRAF基因突变与281例Ⅲ期结直肠癌患者的临床病理关系
CEA: carcino-embryonic antigen.
4生存分析
截止到2016年12月1日随访结束,56.9%(160/281)的Ⅲ期CRC患者死亡,均死于肿瘤复发或转移,中位随访时间36.0月(0.2~73月),21例(7.5%)患者失访。本研究进一步评估了RAS/BRAF基因突变和MSI状态对Ⅲ期CRC患者预后生存的影响。结果显示RAS/BRAF野生型患者OS和PFS均明显高于突变患者(2=17.787,P<0.01和2=15.662,P<0.01);同样,MSI-H患者的预后优于MSI-L/MSS患者(OS:2=5.963,P<0.05; PFS:2=3.971,P<0.05),见图3。
讨 论
CRC是临床病理异质性较高的恶性肿瘤,其起病隐匿,侵袭性高。近年来EGFR作为CRC治疗的一个重要靶点已经引起广泛关注[5],特别是EGFR信号通路中起关键作用的RAS/BRAF基因异常更与人类肿瘤恶性转化密切相关。同时,作为CRC另一发病机制,MSI检测成为CRC高危人群筛选和治疗选择的一种新手段,美国食品药品监督管理局(Food and Drug Administration,FDA)已批准程序性细胞死亡蛋白1(programmed cell death protein 1,PD-1)抑制剂用于治疗具有MSI-H的晚期实体瘤患者,这是FDA首次批准不按肿瘤来源,而直接按照生物标志物使用的抗癌药物,是肿瘤治疗史上一个重大突破[4]。目前,靶向药物联合免疫治疗已成为CRC研究热点。我们希望在此基础上,进一步探讨RAS/BRAF突变和MSI的相关性及其与CRC发生发展关系,从而找出新的分子诊断、治疗和预后判定方法,在基因水平实现CRC个体化治疗,使病人生存获益。
本研究对281例Ⅲ期CRC组织标本进行检测,结果显示RAS/BRAF突变率为48.4%(136/281),6.4%(18/281)患者为MSI-H;其中KRAS基因第2外显子突变率最高,而RAS家族其它成员比如NRAS和HRAS的突变则较为罕见。值得一提的是,不同于RAS基因突变的异质性,BRAF突变具有同质性,均为V600E突变。上述结果与国外的研究类似[9-10]。有研究显示[11],BRAF基因突变率在CRC患者里为4%~10%,同样的结论在我们的研究中也得到证实(6.8%,19/281)。此外,本研究也观察到突变的KRAS、NRAS和BRAF基因之间以及突变基因和MSI-H状态之间并不具有排他性,1.8%(5/281)患者同时存在2种基因突变,KRAS与BRAF突变、KRAS与NRAS突变相互重叠,而NRAS与BRAF突变却是相互独立的;遗憾的是我们未检测到同一基因不同外显子的突变共存,这些结果与近年来报道[12]部分不符,可能原因是所选样本来源不同(中国人对比欧美人)以及样本量存在差异。最近,一项回顾性研究也提出,MSI-H与RAS/BRAF突变之间并不排斥[13],同样我们的实验检测到11例MSI-H患者同时具有KRAS或BRAF突变。RAS/BRAF基因突变在CRC肿瘤发生早期即出现,肿瘤进程中癌细胞的MSI状态始终不变。令人鼓舞的是,随着基因谱数据不断积累,基因之间的相关性将被进一步阐明。
表4MSI状态与281例Ⅲ期结直肠癌患者的临床病理关系
Table 4. The correlation between the microsatellite instability (MSI) status and clinicopathological features in 281 patients with stage Ⅲ colorectal cancer

ClinicopathologicalfeaturenMSI⁃H(%)MSI⁃L/MSS(%)PTumorlocation Leftcolon1226(4.9)116(95.1)0.646 Rightcolon353(8.6)32(91.4) Rectum1249(7.3)115(92.7)Differentiation Well/moderate16912(7.1)157(92.9)0.559 Poor1126(5.4)106(94.6)Depthofinvasion T110(0.0) 1(100.0)0.622 T2220(0.0)22(100.0) T321015(7.1)195(92.9) T4483(6.2)45(93.8)Nodalstage N119214(7.3)178(92.7)0.035 N2a590(0.0)59(100.0) N2b304(13.3)26(86.7)c⁃METexpression Negative/weak243(12.5)21(87.5)0.358 Moderate514(7.8)47(92.2) Strong20611(5.3)195(94.7)InitialCEA(μg/L) <20424(9.5)38(90.5)0.371 ≥2023914(5.9)225(94.1)
MSI-H: MSI-high; MSI-L: MSI-low; MSS: microsatellite stability.

表5 MSI状态与基因突变的相关性
我们进一步探讨了RAS/BRAF基因突变与Ⅲ期CRC临床病理参数之间的关系,研究表明突变型RAS/BRAF基因在促进CRC发展、侵袭中具有重要临床意义。具体说,KRAS基因在CEA≥20 μg/L的患者中突变率较高,而与其它临床病理学特征无关。国内外有文献报道,KRAS突变多预示患者老龄、肿瘤分化程度低、临床分期晚[11-12]。不同研究结果的差异,可能源于研究人群遗传背景不同。迄今为止,NRAS突变由于检测率低,其临床意义具有一定争议性。在恶性黑色素瘤和白血病里,NRAS突变更多出现在老年患者,一项最近研究表明,右半结肠癌易发生NRAS突变[13]。在本研究中,NRAS突变与c-MET低表达密切相关,提示NRAS突变较其它RAS突变肿瘤恶性度较低。此外,CRC中HRAS突变更为罕见,突变率<0.5%,目前国内尚无有关HRAS突变临床价值的报道。本实验亦未检测到HRAS突变肿瘤。我们的研究同时表明BRAF在女性、右半结肠癌突变率高,这与Martinetti等[11]研究结果基本一致。总之,RAS/BRAF突变的CRC具有更强的侵袭性,最终导致器官浸润、肿瘤扩散。
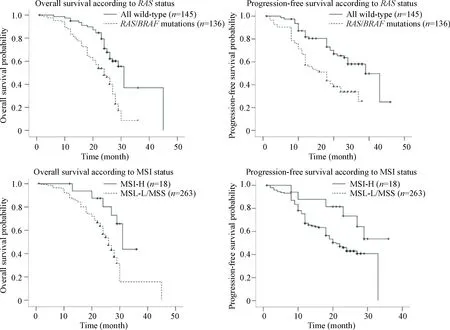
Figure 3. Kaplan-Meier survival curves of stage Ⅲ colorectal carcinoma samples.
图3Ⅲ期结直肠癌患者的OS和PFS生存曲线
近年来,多个数据显示MSI-H的CRC患者具有明显且独立的临床特征:MSI-H较之MSI-L/MSS患者,多表现为低分化、组织异质性明显、克罗恩样病表现以及淋巴细胞浸润[6, 13]。孟文建等[14]对128例Ⅱ~Ⅲ期直肠癌患者进行分析,得出与上述相同结果,更进一步提出MSI-H好发于右半结肠、女性多见。我们的数据也证实MSI-H患者淋巴结转移更明显。在MSI与RAS/BRAF基因突变相关性研究中,统计显示MSI-H与BRAF突变密切相关,而MSI状态与其它基因突变无关。一项最近的研究也注意到BRAF突变的CRC中MSI-H占40%,结果有统计学意义[6]。然而Ogura等[13]分析表明MSI-L肿瘤更易出现NRAS突变,与其它基因突变无关。这种差异可能原因是入组患者种族不同以及研究方法有异。由此可见,MSI参与CRC发生发展,其状态检测有助于预测CRC生物学行为。
早在上个世纪90年代,KRAS突变作为实体瘤预后不良的因素已被报道,但是直到近些年,RAS/BRAF突变对CRC预后的预测价值才引起广泛关注。同既往研究一样,本实验发现在Ⅲ期CRC中,RAS/BRAF基因突变组,特别是BRAF突变组,其OS和PFS明显低于野生型组;而NRAS突变组的预后较其它突变组好。总之,RAS/BRAF基因突变是CRC预后不良的预测因子。此外,尽管多项国内外研究对MSI状态与各临床分期CRC的预后关系进行了探索,但结论尚未统一。就目前而言,比较一致的是在Ⅱ、Ⅲ期CRC患者中,MSI-H对生存有积极意义[15],我们的研究结果也支持上述观点。但是MSI状态作为CRC患者生存的预测指标仍需大样本前瞻性临床试验进一步证实。
综上所述,由于本研究的回顾性本质,结果不可避免存在选择性偏倚。研究过程中部分患者临床资料失访,特别是术后未再入院治疗的病人。因此我们需要更多的体内外实验证实上述观点。总之,RAS/BRAF基因突变和MSI-L/MSS状态不仅是Ⅲ期CRC致病机制,也是CRC侵袭力和预后不良的一个新的预测因子,其检测对于判断新发病例预后及制定个体化治疗策略具有重要意义。
[1] 周静怡, 钟 冰, 刘 丽, 等. miR-496过表达抑制结肠癌细胞生长和转移[J]. 中国病理生理杂志, 2016, 32(10):1815-1823.
[2] Wicha MS. Targeting self-renewal, an Achilles’ heel of cancer stem cells[J]. Nat Med, 2014, 20(1):14-15.
[3] 石雪迎, 郑 杰. 系统筛查微卫星不稳定性结直肠癌的意义和策略[J]. 中华病理学杂志, 2015, 44(1):9-14.
[4] 李异玲, 田 忠, 傅宝玉. 胃癌及癌前病变中PTEN及微卫星不稳定的变化及二者的关系[J]. 世界华人消化杂志, 2008, 16(22):2470-2475.
[5] 唐夏莉, 焦德敏, 陈 君, 等. miRNA-126对肺癌A549细胞的增殖、迁移、侵袭及EGFR/AKT/mTOR信号通路的影响[J]. 中国病理生理杂志, 2016, 32(3):458-463.
[6] 宗星月, 李进伟. 针对 EGFR 和 VEGF/VEGFR 靶点的肿瘤分子靶向药物研究进展[J]. 中国实用内科杂志, 2014, 34(Suppl 2):62-64.
[7] 巩 波, 李东风, 谢子钧, 等. 上/下调miR-21对结肠癌细胞的生物学作用及对西妥昔单抗药物敏感性的影响[J]. 中国病理生理杂志, 2014, 30(4):609-614.
[8] Di Nicolantonio F, Martini M, Molinari F, et al. Wild-typeBRAFis required for response to panitumumab or cetuximab in metastatic colorectal cancer[J]. J Clin Oncol, 2008, 26(35):5705-5712.
[9] Zeinalian M, Emami MH, Naimi A, et al. Immunohistochemical analysis of mismatch repair proteins in Iranian colorectal cancer patients at risk for lynch syndrome[J]. Iran J Cancer Prev, 2015, 8(1):11-17.
[10] Ogino S, Nosho K, Kirkner GJ, et al. CpG island methy-lator phenotype, microsatellite instability, BRAF mutation and clinical outcome in colon cancer[J]. Gut, 2009, 58(1):90-96.
[11] Martinetti D, Costanzo R, Kadare S, et al.KRASandBRAFmutational status in colon cancer from Albanian patients[J]. Diagn Pathol, 2014, 9:187.
[12] Kawazoe A, Shitara K, Fukuoka S, et al. A retrospective observational study of clinicopathological features ofKRAS,NRAS,BRAFandPIK3CAmutations in Japanese patients with metastatic colorectal cancer[J]. BMC Cancer, 2015, 15:258.
[13] Ogura T, Kakuta M, Yatsuoka T, et al. Clinicopathological characteristics and prognostic impact of colorectal can-cers with NRAS mutations[J]. Oncol Rep, 2014, 32 (1):50-56.
[14] 孟文建, 王 玲, 于永扬, 等. 微卫星不稳定在散发性Ⅱ、Ⅲ期直肠癌中的意义[J]. 重庆医学, 2010, 39 (18):2420-2422, 2426.
[15] 李新霞, 胡晓杰, 吴 涛, 等. 散发性结直肠癌组织病理学特征及微卫星不稳定状态分析400例[J]. 世界华人消化杂志, 2013, 21(12):1080-1089.
(责任编辑: 卢 萍, 罗 森)
CorrelationofRASmutationsandmicrosatelliteinstabilitywithclinicopathologicalfeaturesandprognosisofpatientswithstageⅢcolorectalcancer
LIU Jian-hua1, HUANG Cheng-zhi2, ZENG Wei-qiang3, LI Ying1, YANG Dong-yang1, MA Dong1
(1DepartmentofGastrointestinalOncology,CancerCenter,2DepartmentofGastrointestinalSurgery,3DepartmentofPharmacy,GuangdongGeneralHospital,GuangdongAcademyofMedicalSciences,Guangzhou510180,China.E-mail:madong8005@126.com)
AIM: To investigate the status ofRAS/BRAFmutations and microsatellite instability (MSI) and their associations with clinicopathological features and prognosis of the patients with stage Ⅲ colorectal cancer (CRC).METHODSThe surgical patients with stage Ⅲ CRC (n=281) were followed up. The mutations ofRAS/BRAFwere examined by PCR amplification-Sanger sequencing, and MSI status was detected using immunohistochemistry (IHC) in their archival paraffin-embedded tissue specimens. The relationships of the status with the clinicopathological features and prognosis of the patients were statistically analyzed.RESULTSAmong 281 patients, the mutations ofRAS/BRAFwere observed in 136 cases (48.4%), including 116 cases (41.3%) ofKRASmutations.RAS/BRAFmutations were highly correlated with the level of carcino-embryonic antigen (P<0.05). Moreover, 18 cases (6.4%) of MSI-high (MSI-H) patients were determined by IHC, and MSI-H status was more common in N2b patients (P<0.05). Correlation study found that the mutation rate ofBRAFwas higher in MSI-H tumors than that in MSI-low (MSI-L)/microsatellite stability (MSS) counterparts (P<0.01), although no association betweenKRAS/NRASmutations and the MSI status was observed. The prognosis in the patients with wild-typeRAS/BRAFor MSI-H was better than the patients with any mutation or MSI-L/MSS (P<0.01).CONCLUSIONMutantRAS/BRAFand MSI may serve as fairly good indicators for prognosis of the patients with stage Ⅲ CRC.
Colorectal cancer;RASgene;BRAFgene; Microsatellite instability
R363; R735.3
A
10.3969/j.issn.1000- 4718.2017.10.017
1000- 4718(2017)10- 1837- 08
2017- 07- 04
2017- 07- 25
广东省医学科研基金资助项目(No. A2017418)
△通讯作者 Tel: 020-81884713-80521; E-mall: madong8005@126.com
杂志网址: http://www.cjpp.net

