右美托咪定减轻酒精诱导的小鼠急性肝损伤*
黄 强, 夏明珠, 阳文杰, 戴中亮, 姜远旭△
(1深圳市人民医院麻醉科, 深圳市麻醉医学工程研究中心, 2深圳市罗湖医院集团湖贝社区健康服务中心, 广东 深圳 518020)
右美托咪定减轻酒精诱导的小鼠急性肝损伤*
黄 强1, 夏明珠2, 阳文杰1, 戴中亮1, 姜远旭1△
(1深圳市人民医院麻醉科, 深圳市麻醉医学工程研究中心,2深圳市罗湖医院集团湖贝社区健康服务中心, 广东 深圳 518020)
目的探讨右美托咪定(DEX)对酒精诱导的小鼠急性肝损伤的作用及机制。方法50只昆明小鼠随机分为5组(n=10):生理盐水对照(NS)组、酒精性肝损伤模型(E)组、DEX低剂量(10 μg/kg)治疗(E+L)组、DEX中剂量(50 μg/kg)治疗(E+M)组和DEX高剂量(100 μg/kg)治疗(E+H)组。各组动物乙醇灌胃后6 h处死,采集血和肝组织标本。测定各组血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)水平以及甘油三酯(TG)浓度;测定各组肝组织丙二醛(MDA)、还原型谷胱甘肽(GSH)的含量及超氧化物歧化酶(SOD)活性;ELISA测定小鼠肝组织肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β)的浓度;Western blot检测肝组织细胞色素 P450 2E1(CYP2E1)和核因子κB (NF-κB)的表达;HE染色观察肝组织病理学改变并进行肝损伤评分。结果与NS组比较,E组血清的AST、ALT水平及TG含量升高,与E组比较,E+M组和E+H组血清AST、ALT水平及TG含量降低;与NS组比较,E组肝组织MDA含量升高,GSH含量和SOD活性降低,与E组比较,E+M组和E+H组肝组织MDA含量降低,GSH含量及SOD活性升高;与NS组比较,E组肝组织TNF-α和IL-1β含量升高,与E组比较,E+M组和E+H组肝组织TNF-α和IL-1β含量降低;与NS组比较,E组肝组织CYP2E1和NF-κB表达升高,与E组比较,E+M组和E+H组肝组织CYP2E1和NF-κB表达降低;肝组织病理学检查可见,DEX中、高剂量可明显减轻肝细胞变性和坏死及炎性细胞浸润程度。结论右美托咪定通过抗炎及抗氧化作用对急性酒精性损伤的肝脏具有一定的保护作用,其作用机制可能与抑制CYP2E1和NF-κB的表达有关。
右美托咪定; 酒精性肝损伤; 细胞色素 P450 2E1; 核因子κB
酒精性肝损伤常发生于过度饮酒者,严重者发展为酒精性肝硬化,5年生存率约为23%~50%[1]。酒精性肝损伤发病机制复杂,研究表明,氧化应激反应及其诱导的肝脏炎性反应在酒精性肝损伤中扮演重要角色[2-3]。因此,减轻肝脏炎症和氧化应激是治疗酒精性肝损伤的重要手段。
右美托咪定(dexmedetomidine,DEX)是一种高选择性α2-肾上腺素能受体激动剂,由于具有良好的镇静和镇痛作用,近年来用于危重病人的镇静及术后需要机械通气的病人[4-5]。目前的研究表明,DEX具有抗炎和抗氧化作用,且对内毒素、肝缺血再灌注和急性肺损伤诱导的肝损伤有保护作用[5-9]。然而,DEX对酒精性肝损伤的保护作用及机制未见报道。本研究制备小鼠急性酒精性肝损伤模型, 以探讨DEX对酒精性肝损伤的保护作用及其可能的作用机制。
材 料 和 方 法
1药物和试剂
盐酸右美托咪定注射液(江苏恒瑞医药公司);天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)和还原型谷胱甘肽(glutathione,GSH)测定试剂盒(南京建成生物工程研究所);TNF-α和IL-1β ELISA试剂盒(RayBiotech);抗细胞色素P450 2E1(cytochrome P450 2E1,CYP2E1) 抗体(Abcam);抗NF-κB和β-actin抗体(CST)。
2方法
2.1模型制作和分组 清洁级昆明种小鼠50只,4~5周龄,体重(20.0±2.0)g,雄性(购于广东省医学实验动物中心)。 实验前适应性喂养2 d,造模前禁食12 h,自由饮水。实验按体重随机分为5组,每组10只:生理盐水对照(NS)组(腹腔注射等体积生理盐水25 mL/kg,0.5 h后给予等热量、等体积糖水12 mL/kg灌胃)、酒精性肝损伤模型(E)组(腹腔注射等体积生理盐水25 mL/kg,0.5 h后给予50%乙醇12 mL/kg灌胃)、DEX低剂量治疗(E+L)组(腹腔注射DEX 10 μg/kg,0.5 h后给予50%乙醇12 mL/kg灌胃)、DEX中等剂量治疗(E+M)组(腹腔注射Dex 50 μg/kg,0.5 h后给予50%乙醇12 mL/kg灌胃)和DEX高剂量治疗(E+H)组(腹腔注射DEX 100 μg/kg,0.5 h后给予50%乙醇12 mL/kg灌胃)。末次给药6 h后,腹腔注射3%戊巴比妥钠50 mg/kg麻醉小鼠,麻醉后开腹,暴露下腔静脉,采集血标本,室温静置30 min,4 ℃、2 500×g离心10 min,取上清备用。放血处死动物,完整取出肝脏并称重。冰面上取部分肝右叶用10%中性多聚甲醛固定24 h后,用于病理学检查,取部分肝左叶液氮速冻后,-70 ℃冰箱冻存备用。
2.2血清AST、ALT和甘油三酯(triglyceride,TG)水平的检测 取上述血清,严格按照试剂盒操作方法检测AST、ALT及TG水平。
2.3肝组织TNF-α和IL-1β含量的检测 取冰冻肝组织解冻,ELISA检测TNF-α和IL-1β含量,严格按说明书操作。
2.4肝组织MDA、GSH含量及SOD活性的检测 取肝组织100 mg解冻,制备肝匀浆用于测定肝组织中MDA、GSH含量和SOD活性。
2.5肝组织CYP2E1和NF-κB蛋白表达的检测 取适量肝组织,用组织蛋白裂解液提取组织总蛋白,经过10% SDS-PAGE 分离后,电转移至硝酸纤维素膜上。室温下用含10%脱脂奶粉的TBST溶液对膜封闭2 h或过夜;封闭完毕后用PBST洗膜5次,每次间隔5分钟,洗膜后加入CYP2E1或NF-κB p65的 I 抗(1∶500),4 ℃孵育过夜;洗膜3次后,加入 II 抗(辣根过氧化物酶标记的羊抗兔),室温下孵育1 h,洗膜5次,每次间隔5 min,最后加入化学发光增强剂,自显影。采用图像分析处理系统对蛋白条带扫描分析,记录吸光度。结果表示为与对照组的相对吸光度。
2.6肝脏病理学的观察 取上述10%中性甲醛固定的肝组织,常规石蜡包埋,切片,经HE染色后观察肝组织病理学改变并进行病理学评分。肝组织评分标准如下:肝窦充血;门管区水肿;炎性细胞浸润;肝细胞坏死。分别依病情轻重评分(0分:无病变或非常轻微;1分:轻度病变;2分:中度病变;3分:重度病变;4分:极重度病变)。各项评定分数相加为肝损伤总评分。
3统计学处理
采用SPSS 13.0软件行统计分析。计量资料以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA),Student-Newman-Keulq检验进行多重比较。组间比较采用Kruskal-Wallis 秩和检验。以P<0.05为差异有统计学意义。
结 果
1血清ALT、AST和TG水平的变化
与NS组比较,E组的ALT、AST及TG水平升高(P<0.01);与E组比较,E+M组和E+H组的ALT、AST及TG水平下降(P<0.05);与E+M组比较, E+H组的ALT、AST及TG水平下降(P<0.01),见表1。
表1右美托咪定对急性酒精性肝损伤小鼠血清ALT、AST及TG水平的影响
Table 1. The effects of dexmedetomidine on the serum levels of ALT, AST and TG in the mice with acute liver injury induced by alcohol (Mean±SD.n=10)
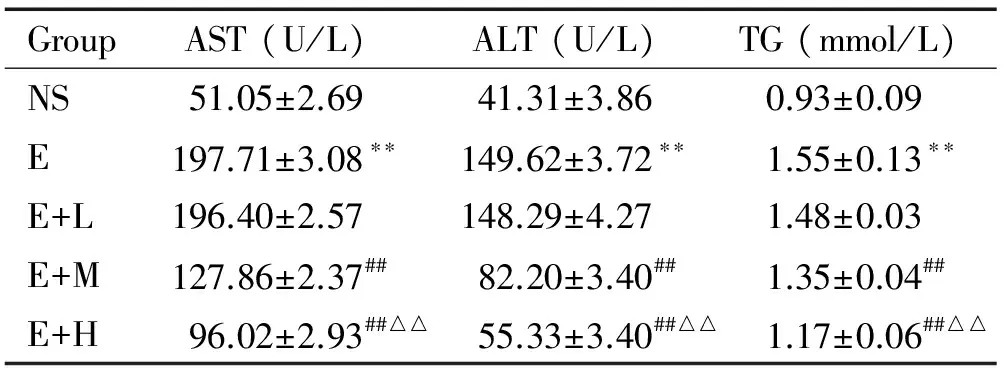
GroupAST(U/L)ALT(U/L)TG(mmol/L)NS51.05±2.6941.31±3.860.93±0.09E197.71±3.08∗∗149.62±3.72∗∗1.55±0.13∗∗E+L196.40±2.57148.29±4.271.48±0.03E+M127.86±2.37##82.20±3.40##1.35±0.04##E+H96.02±2.93##△△55.33±3.40##△△1.17±0.06##△△
**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
2肝组织MDA、GSH含量和SOD活性的变化
与NS组比较,E组的MDA含量增加(P<0.01),SOD活性及GSH含量降低(P<0.01);与E组比较,E+M组和E+H组的MDA含量降低(P<0.01),SOD活性及GSH含量升高(P<0.01);与E+M组比较, E+H组MDA含量降低(P<0.01),SOD活性及GSH含量升高(P<0.01),见表2。
表2右美托咪定对急性酒精性肝损伤小鼠肝组织MDA、SOD及GSH水平的影响
Table 2. The effects of dexmedetomidine on the levels of MDA, SOD and GSH in the liver of the mice with acute liver injury induced by alcohol (Mean±SD.n=10)
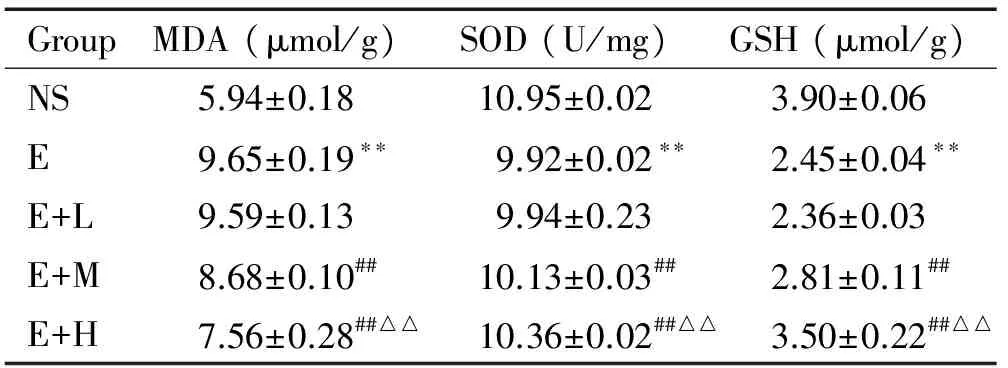
GroupMDA(μmol/g)SOD(U/mg)GSH(μmol/g)NS5.94±0.1810.95±0.023.90±0.06E9.65±0.19∗∗9.92±0.02∗∗2.45±0.04∗∗E+L9.59±0.139.94±0.232.36±0.03E+M8.68±0.10##10.13±0.03##2.81±0.11##E+H7.56±0.28##△△10.36±0.02##△△3.50±0.22##△△
**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
3肝组织TNF-α和IL-1β含量的变化
与NS组比较,E组TNF-α和IL-1β含量增加(P<0.01);与E组比较,E+M组和E+H组TNF-α和IL-1β含量降低(P<0.01);与E+M组比较,E+H组TNF-α和IL-1β含量降低(P<0.01),见图1、2。
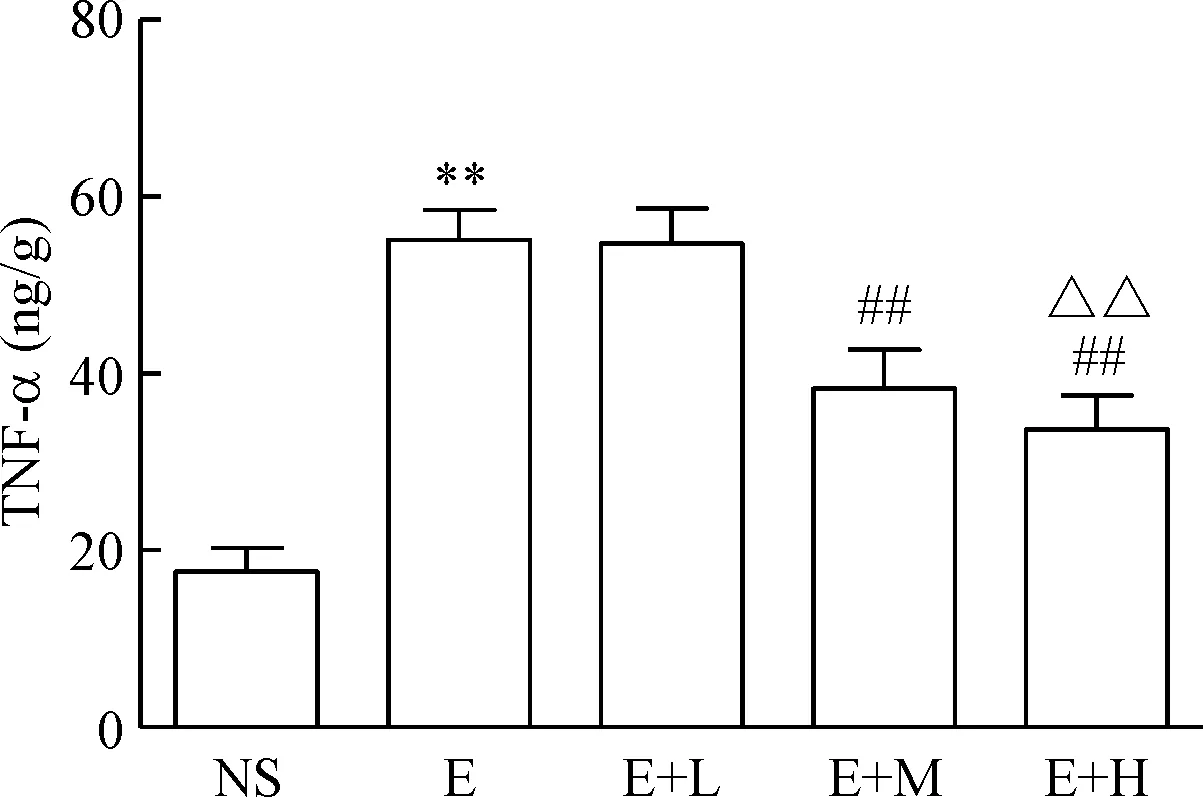
Figure 1. The effect of dexmedetomidine on TNF-α expression in the liver of the mice induced by alcohol. Mean±SD.n=10.**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
图1右美托咪定对各组肝组织TNF-α的影响
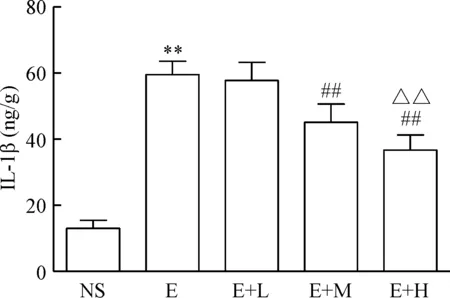
Figure 2. The effect of dexmedetomidine on IL-1β expression in the liver of the mice induced by alcohol. Mean±SD.n=10.**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
图2右美托咪定对各组肝组织IL-1β的影响
4肝组织病理学改变及肝损伤评分
NS组为正常的肝脏组织学结构,E组可见大量的炎性细胞及脂肪变性,与E组相比,E+H组炎性细胞及脂肪变性减少。与NS组比较,E组肝损伤评分增高(P<0.01);与E组比较,E+M组和E+H组肝损伤评分降低(P<0.01);与E+M组比较,E+H组肝损伤评分降低(P<0.01),见图3。
5肝组织CYP2E1和NF-κB的表达
与NS组比较,E组CYP2E1表达增加(P<0.01);与E组比较,E+M组和E+H组的CYP2E1表达降低(P<0.01);与E+M组比较, E+H组的CYP2E1表达降低(P<0.01),见图4。
与NS组比较,E组的NF-κB表达增加(P<0.01);与E组比较,E+M组和E+H组的NF-κB表达降低(P<0.01);与E+M组比较, E+H组NF-κB表达降低(P<0.01),见图5。
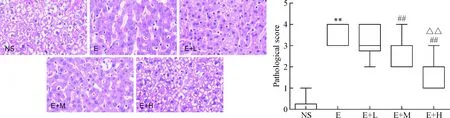
Figure 3. The histopathological changes and injury scores of the liver in the mice after treated with dexmedetomidine (HE staining, ×400). Median (minimum~maximum).n=10.**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
图3HE染色观察右美托咪定对各组肝组织病理学改变及肝损伤评分的影响

Figure 4. The effect of dexmedetomidine on CYP2E1 expression in the liver of the mice induced by alcohol. Mean±SD.n=10.**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
图4右美托咪定对各组肝组织CYP2E1表达的影响

Figure 5. The effect of dexmedetomidine on the expression of NF-κB in the liver of the mice induced by alcohol. Mean±SD.n=10.**P<0.01vsNS group;##P<0.01vsE or E+L group;△△P<0.01vsE+M group.
图5右美托咪定对各组肝组织NF-κB表达的影响
讨 论
一次性暴饮建立的急性酒精性肝损伤模型由于造模周期短、易复制, 且与人类豪饮造成的肝损害一致, 是研究急性酒精性肝损伤发病机制的理想模型。本实验参照以往的研究复制急性肝损伤模型[10]。我们的研究发现,给予50%乙醇(4.8 g/kg)灌胃,可导致血液中ALT、AST和TG明显升高;病理学显示炎性细胞浸润,产生严重组织损伤,表明50%乙醇灌胃成功诱导急性肝损伤。本实验中,给予DEX 中、高剂量治疗后,ALT、AST和TG降低,病理学改变减轻,表明DEX剂量依赖性减轻酒精诱导的急性肝损伤。
氧化应激在酒精性肝损伤中扮演重要角色。酒精刺激后,活性氧簇(reactive oxygen species,ROS)的产生是引起肝损害的重要因素[11]。过多的ROS通过损害DNA、蛋白变性等作用损害肝细胞。酒精诱导的ROS与多不饱和脂肪酸产生反应从而破坏细胞膜。在人体,ROS主要由SOD、GSH等酶类和非酶类抗氧化物质清除,以保持ROS浓度的平衡。MDA是机体脂质过氧化的终末产物,间接反映出细胞损伤的程度[12]。我们的研究发现,与对照组相比,酒精导致肝组织SOD活性及GSH含量降低,MDA含量增加,而DEX治疗能够增加SOD活性及GSH含量,降低MDA含量,表明抗氧化及减轻脂质过氧化反应是DEX减轻酒精导致肝损伤的机制之一。在肝脏,CYP2E1可被乙醇诱导并参与乙醇代谢,CYP2E1是一种有效的活性氧产生酶,产生超氧阴离子自由基和过氧化氢,是酒精导致的肝氧化应激的主要因素[13]。为了进一步探讨DEX抗氧化机制,我们观察了Dex对CYP2E1表达的影响。我们的研究发现,DEX治疗抑制酒精诱导的CYP2E1表达,提示DEX的抗氧化作用可能与抑制肝细胞CYP2E1表达有关。
目前研究表明,乙醇诱导的氧化应激反应能增加肠黏膜的通透性及破坏肠上皮细胞的完整性,导致肠源性内毒素进入血液循环,激活肝细胞释放TNF-α、IL-1β等炎症因子,诱导肝炎性反应,进一步加重肝组织损伤,这也是酒精性肝损伤的重要发病机制[14]。TNF-α是炎性反应的促发因子,TNF-α激活后,其它炎性细胞因子相继激活。研究表明,TNF-α、IL-1β在肝损伤中发挥重要作用[15-16]。临床研究结果表明,血清TNF-α、IL-1β水平与酒精性肝疾病的肝功能和预后有关[17]。我们的研究发现,模型组小鼠肝脏炎症因子TNF-α和IL-1β明显升高,而Dex治疗能降低肝组织TNF-α和IL-1β的浓度,表明抑制肝脏炎性反应是DEX减轻酒精诱导的肝损伤机制之一。NF-κB是调控包括TNF-α在内的诸多促炎分子基因表达的重要转录因子[18]。以往的研究表明,NF-κB活化在酒精灌胃加高脂饮食诱导的肝损害中可能起重要作用[19]。最近研究发现,NF-κB在酒精诱导的肝损伤中起重要作用[20]。我们的研究发现,酒精诱导肝组织NF-κB表达增加,而DEX治疗抑制NF-κB的表达,提示DEX抑制炎性反应与抑制NF-κB的表达有关,因而抑制NF-κB的活性对酒精诱导的肝损伤也是有益的。
总之,DEX通过抗炎和抗氧化作用减轻酒精诱导的小鼠急性肝损伤,且呈剂量依赖性,其机制可能与抑制CYP2E1和NF-κB的表达有关。
[1] 于晨辉, 杜仲燕, 高 佳, 等. 4-HNE通过抑制TNF-α介导的NF-κB活化诱导酒精性肝损伤[J]. 中国病理生理杂志, 2013, 29(6):1046-1052.
[2] Liu Y, Wang J, Li L, et al. Hepatoprotective effects ofAntrodiacinnamomea: the modulation of oxidative stress signaling in a mouse model of alcohol-induced acute liver injury[J]. Oxid Med Cell Longev, 2017, 2017:7841823.
[3] Cai X, Yan A, Fu N, et al.Invitroantioxidant activities of enzymatic hydrolysate fromSchizochytriumsp. and its hepatoprotective effects on acute alcohol-induced liver injuryinvivo[J]. Mar Drugs, 2017, 15(4):E115.
[4] Chen C, Qian Y. Protective role of dexmedetomidine in unmethylated CpG-induced inflammation responses in BV2 microglia cells[J]. Folia Neuropathol, 2016, 54(4):382-391.
[5] 万林骏, 黄青青, 岳锦熙, 等.右美托咪啶与咪达唑仑用于外科重症监护病房术后机械通气患者镇静的比较研究[J]. 中国危重病急救医学, 2011, 23(9):543-546.
[6] Peng M, Wang YL, Wang CY, et al. Dexmedetomidine attenuates lipopolysaccharide-induced proinflammatory response in primary microglia[J]. J Surg Res, 2013, 179(1):e219-e225.
[7] Sezer A, Memis D, Usta U, et al. The effect of dexmedetomidine on liver histopathology in a rat sepsis model: an experimental pilot study[J]. Ulus Travma Acil Cerrahi Derg, 2010, 16(2):108-112.
[8] Sen V, Güzel A,en HS, et al. Preventive effects of dexmedetomidine on the liver in a rat model of acid-induced acute lung injury[J]. Biomed Res Int, 2014:621827.
[9] Tüfek A, Tokgöz O, Aliosmanoglu I, et al. The protective effects of dexmedetomidine on the liver and remote organs against hepatic ischemia reperfusion injury in rats[J]. Int J Surg, 2013, 11(1):96-100.
[10] 齐慧慧, 宋 佳, 陈岳祥. 小鼠急性酒精性肝损伤模型的建立[J]. 世界华人消化杂志, 2012, 20(9):759-763.
[11] Das SK, Vasudevan DM. Alcohol-induced oxidative stress[J]. Life Sci, 2007, 81(3):177-187.
[12] Li G, Ye Y, Kang J, et al. L-Theanine prevents alcoholic liver injury through enhancing the antioxidant capability of hepatocytes[J]. Food Chem Toxicol, 2012, 50(2):363-372.
[13] Butura A, Nilsson K, Morgan K, et al. The impact of CYP2E1 on the development of alcoholic liver disease as studied in a transgenic mouse model[J]. J Hepatol, 2009, 50(3):572-583.
[14] Mandrekar P, Szabo G. Signalling pathways in alcohol induced liver inflammation[J]. J Hepatol, 2009, 50(6):1258-1266.
[15] Candel S, de Oliveira S, López-Muoz A, et al. TNFα signaling through TNFR2 protects skin against oxidative stress-induced inflammation[J]. PLoS Biol, 2014, 12(5):e1001855.
[16] 张海云, 常香荣. 黄芪甲苷通过抑制JAK2/STAT3信号通路减轻重症急性胰腺炎大鼠肝损伤[J]. 中国病理生理杂志, 2016, 32(6):984-989.
[17] Chen YL, Peng HC, Hsieh YC, et al. Epidermal growth factor improved alcohol-induced inflammation in rats[J]. Alcohol, 2014, 48(7):701-706.
[18] Nie Y, Lu YX, Lv LH. Effect of propofol on generation of inflammatory mediator of monocytes[J]. Asian Pac J Trop Med, 2015, 8(11):964-970.
[19] 马晓燕, 司英奎, 韩雪霖. 脂肪性肝病中NF-κB活性变化及其意义[J]. 中国病理生理杂志, 2007, 23(11):2276-2271.
[20] da Silva BS, Rodrigues GB, Rocha SW, et al. Inhibition of NF-κB activation by diethylcarbamazine prevents alcohol-induced liver injury in C57BL/6 mice[J]. Tissue Cell, 2014, 46(5):363-371.
(责任编辑: 林白霜, 罗 森)
Dexmedetomidineattenuatesacutealcoholichepaticinjuryinmice
HUANG Qiang1, XIA Ming-zhu2,YANG Wen-jie1, DAI Zhong-liang1, JIANG Yuan-xu1
(1DepartmentofAnesthesiology,ShenzhenPeople’sHospital,ShenzhenAnesthesiologyEngineeringCenter,2HubeiCommunityHealthServiceCenter,LuohuHospitalgroup,Shenzhen518020,China.E-mail: 13613051840@163.com)
AIM: To investigate the effects of dexmedetomidine (DEX) on acute alcoholic hepatic injury in mice and to explore the possible mechanisms.METHODSKunming mice (n=50) were randomly divided into 5 groups (n=10): normal saline control (NS) group, acute alcoholic hepatic injury model (E) group, low-dose (10 μg/kg) DEX (E+L) group, medium-dose (50 μg/kg) DEX (E+M) group and high-dose (100 μg/kg) DEX (E+H) group. The animals were sacrificed at 6 h after gavage of alcohol or normal saline. The levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), triglyceride (TG), malondialdehyde (MDA), glutathione (GSH) and superoxide dismutase (SOD) were measured. The livers were removed for evaluation of histological characteristics and determining the content of tumor necrosis factor-α (TNF-α) amd interleukin-1β (IL-1β) in the liver tissues by ELISA. The expression levels of cytochrome P450 2E1 (CYP2E1) and nuclear factor -κB (NF-κB) in the liver tissues were evaluated by Western blot.RESULTSCompared with NS group, the levels of ALT, AST and TG were obviously increased in E group, which were obviously decreased in E+M and E+H groups. Compared with NS group, the levels of TNF-α, IL-1β and MDA were obviously increase in E group, which were obviously decreased in E+M and E+H groups. Compared with NS group, the activity of SOD and the content of GSH were obviously decreased in E group, which were obviously increased in E+M and E+H groups. Compared with NS group, the expression of CYP2E1 and NF-κB was obviously increase in E group, which was obviously decreased in E+M and E+H groups. Compared with NS group, ethanol induced marked liver histological injury, which was less pronounced in E+M and E+H groups.CONCLUSIONDEX has a protective effect on mouse liver with acute alcoholic injury by the involvement in the processes of antioxidation and antiinflammation, and its mechanism may be associated with the inhibition of CYP2E1 and NF-κB expression.
Dexmedetomidine; Alcoholic hepatic injury; Cytochrome P450 2E1; Nucler factor-κB
R575.1; R965
A
10.3969/j.issn.1000- 4718.2017.10.026
1000- 4718(2017)10- 1891- 05
2017- 03- 13
2017- 07- 06
深圳市科技研发基金资助项目(No. JCYJ20160422142317026)
△通讯作者 Tel: 0755-22948275; E-mail: 13613051840@163.com
杂志网址: http://www.cjpp.net

