三阴性乳腺癌模型裸鼠血管正常化后对紫杉醇的反应*
吕荣钊, 赵璐瑜, 史长征, 李 伟, 翁泽平, 黄 信, 王宁霞△, 潘运龙△
(暨南大学附属第一医院 1乳腺外科, 2影像学科, 3胃肠外科, 4病理科, 广东 广州 510632)
三阴性乳腺癌模型裸鼠血管正常化后对紫杉醇的反应*
吕荣钊1, 赵璐瑜2▲, 史长征2, 李 伟3, 翁泽平4, 黄 信1, 王宁霞1△, 潘运龙3△
(暨南大学附属第一医院1乳腺外科,2影像学科,3胃肠外科,4病理科, 广东 广州 510632)
目的通过观察人三阴性乳腺癌(triple-negative breast cancer,TNBC)模型裸鼠血管正常化后对紫杉醇的反应,探讨重组人内皮抑素与紫杉醇在血管正常化时间窗内联用是否优于紫杉醇单用并分析磁共振成像(magnetic resonance imaging,MRI)在早期评估化疗的作用。方法将人TNBC细胞株MDA-MB-231种植于36只BALB/c-nu雌性裸小鼠的右下腹部皮下,随机分成4组(模型组、重组人内皮抑素治疗组、紫杉醇治疗组及人内皮抑素联用紫杉醇治疗组),每组有7只完成实验。重组人内皮抑素于实验开始时给药,连续使用17 d,紫杉醇于实验第6天和第12天分别给药,所有用药均为腹腔注射,用量均为10 mg·kg-1·d-1。治疗前1 d及注射实验试剂后5、11、17 d进行MRI扫描,所有荷瘤鼠均在最后一次MRI扫描后颈椎脱位处死,切下瘤体,进行病理学及免疫组化检测,测定肿瘤微血管密度(microvessel density,MVD)及Ki67表达。结果第17天,联用组移植瘤体积小于模型组及重组人内皮抑素治疗组(P<0.05),但与紫杉醇治疗组比较无显著差异。第11天,紫杉醇治疗组的慢弥散系数大于模型组,联用组慢弥散系数大于重组人内皮抑素治疗组(P<0.05)。解剖各组荷瘤鼠未见远处转移病灶。HE染色显示4组肿瘤外周均有明显坏死,且药物治疗组坏死程度均高于模型组。药物治疗组的MVD均小于模型组,且药物联用组均小于药物单用组(P<0.05)。药物联用组Ki67表达较重组人内皮抑素组明显降低,但与紫杉醇治疗组相比无显著差异。结论在血管正常化时间窗内,重组人内皮抑素联合紫杉醇化疗对TNBC移植瘤虽有明显的抑瘤作用,但疗效未优于紫杉醇;慢弥散系数可以早期预测治疗效果。
三阴性乳腺癌; 血管正常化; 内皮抑素; 紫杉醇; 化疗; 磁共振成像
三阴性乳腺癌(triple-negative breast cancer,TNBC)是指癌组织免疫组化结果显示雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER-2)均为阴性的一个特殊亚型乳腺癌,约占所有浸润性乳腺癌的10%~20%。其特点是发病年龄较早(多为绝经前患者),侵袭性强。其复发的高峰风险期为术后3年,其后复发风险迅速下降。与其它乳腺癌亚型相比,TNBC远处转移后患者生存期较短,全身治疗主要是化疗,但化疗效果并不理想。探索更有效的TNBC治疗方法是目前临床医学的一个热点[1-2]。目前抗血管生成药和化疗药的序贯治疗模式在某些实体恶性肿瘤中有一定的进展,但在TNBC方面证据尚不足,现对TNBC使用重组人内皮抑素(recombinant human endostatin,rh-endostatin)联合紫杉醇化疗进行动物实验研究,以探讨联合用药对TNBC的效果。
材 料 和 方 法
1材料
实验细胞为人TNBC细胞株MDA-MB-231,购自中国科学院典型培养物保藏委员会细胞库。实验动物为4周龄BALB/c-nu雌性裸小鼠,购自北京华阜康生物科技股份有限公司。重组人内皮抑素购自山东先声麦得津生物制药有限公司;紫杉醇注射液购自百时美施贵宝(上海)贸易有限公司。
2方法
本动物实验设计方案通过暨南大学实验动物伦理委员会的伦理审查(编号为2016062201)。本实验过程中严格遵循动物伦理学原则。裸鼠在暨南大学实验动物管理中心正常自由饲养。MDA-MB-231细胞经过复苏、培养,最后于裸鼠右侧下腹部皮下注射接种单细胞悬液,每只注射0.1 mL,瘤细胞总数约1×107。纳入标准:体重20 g±3 g;肿瘤长径、短径9 mm±3 mm。将36只裸鼠随机分成4组:A(模型)组;B(重组人内皮抑素)组;C(紫杉醇)组;D(重组人内皮抑素联合紫杉醇)组。按照纳入标准,剔除使用试剂前移植瘤过小及实验过程中致死的荷瘤鼠共8只,最后每组7只荷瘤鼠完成实验。A组与C组使用生理盐水,B组与D组使用重组人内皮抑素,每组均连续使用17 d;C组和D组第6天和第12天使用紫杉醇。所有用药均为腹腔注射,用量均为10 mg·kg-1·d-1。在给药前1 d及给药后5、11、17 d,麻醉后使用超导型磁共振成像(magnetic resonance imaging,MRI)系统和八通道腕关节线圈扫描移植瘤,在最大截面测量肿瘤长短径。体积计算公式:体积(mm3)=0.5×长径(mm)×短径2(mm2)。 抑瘤率计算公式:抑瘤率(%)=(对照组当天平均肿瘤体积-给药组当天平均肿瘤体积)/对照组当天平均肿瘤体积×100%。采用GE AW4.5工作站,多b值弥散加权成像采用体素内不相干运动成像模型,将b值≤200 s/mm2设为低b值,b值>200 s/mm2设为高b值,避开坏死组织与囊变区分别选取正常与病变感兴趣区(region of interest,ROI)各一处,ROI面积包括病灶1/3以上,测得表观扩散系数(apparent diffusion coefficient, ADC),不同时点ROI的选择层面及位置尽量保持相同。处理后得到慢弥散系数值。所有荷瘤鼠均在第17天用颈椎脱位法处死,剥离肿瘤后常规固定,石蜡包埋、切片、染色和免疫组化染色,测定Ki67与微血管密度(microvessel density,MVD)。为减少Ki67误差,由同一个医生(盲法)进行人工检测,取10个计数区域的平均值。用CD31显示病变内微血管数,以血管内皮细胞胞质内出现棕黄色颗粒为阳性判定标准。参照Weidner计数法,将切片置于40倍显微镜下确定染色最高血管密度区域,然后置于200倍显微镜下,取3个最高血管密度区计算MVD的平均值。
3统计学处理
采用SPSS 21.0软件进行统计学分析,计量资料用均数±标准差(mean±SD)表示,组间两两比较使用Bonferroni法检验,组内两两比较使用配对t检验,抑瘤率的比较使用Mann-WhitneyU检验,以P<0.05为差异有统计学意义。
结 果
1各组移植瘤不同时期的体积
MRI下取移植瘤的最大截面,测得长径与短径,计算平均值。结果显示第11天,D组移植瘤体积小于A组(P<0.05), C组与A组移植瘤体积无显著差别;第17天,C组与D组移植瘤体积均小于A组和B组(P<0.05);D组移植瘤体积与C组无显著差异,见表1。
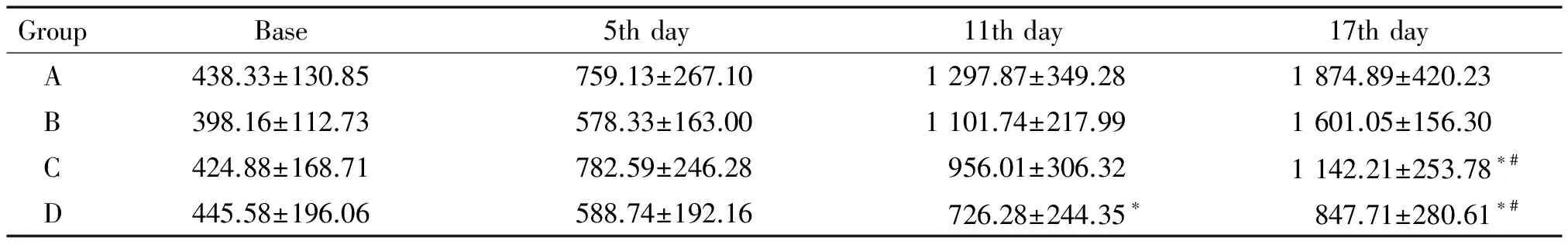
表1 移植瘤体积
A: model group; B: rh-endostatin treatment group; C: paclitaxel treatment group; D: rh-endostatin+paclitaxel treatment group.*P<0.05vsgroup A;#P<0.05vsgroup B.
2抑瘤率
按公式计算得到各组不同时点的抑瘤率。结果显示在第17天,B组抑瘤率小于C组和D组(P<0.05),D组与C组的抑瘤率无显著差异,见表2。
表2各组不同时点的抑瘤率
Table 2. Tumor inhibitory rate of every group at different time points (%.n=7)
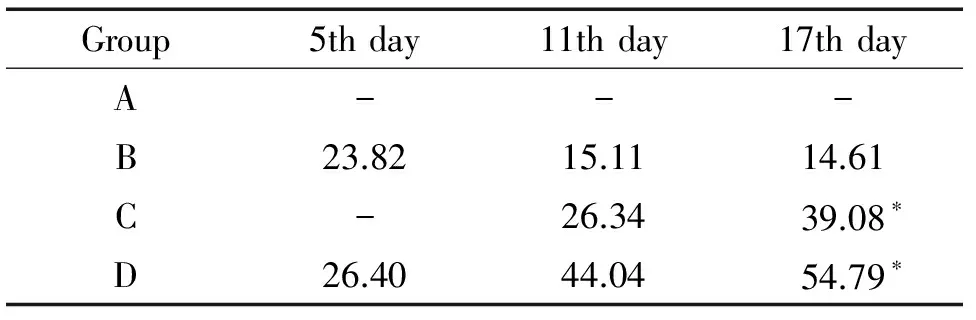
Group5thday11thday17thdayA---B23.8215.1114.61C-26.3439.08∗D26.4044.0454.79∗
A: model group; B: rh-endostatin treatment group; C: paclitaxel treatment group; D: rh-endostatin+paclitaxel treatment group.*P<0.05vsgroup B.
3MRI扫描
3.1常规平扫 常规扫描裸鼠皮下移植瘤,结果显示T1加权成像(T1-weight image, T1WI)呈等信号,T2WI呈稍高信号,在第11天及17天,各组T2WI出现不同程度的高信号坏死区,A组移植瘤普遍出现中心坏死区,见图1。
3.2慢弥散系数的结果 使用GE AW4.5工作站处理得到各组不同时点的平均慢弥散系数。组间比较显示:第11天,C、D组慢弥散系数均较A组升高,D组慢弥散系数较B组升高(P<0.05);第17天,D组慢弥散系数明显较其它3组升高(P<0.05)。组

Figure 1. The imaging of transplanted tumors in T2WI at different time points. A: model group; B: rh-endostatin treatment group; C: paclitaxel treatment group; D: rh-endostatin+paclitaxel treatment group.
图1各组移植瘤在不同时点T2WI下的表现
内比较显示:C组与D组在第5天后慢弥散系数逐渐升高(P<0.05),见表3。
4病理学检查
荷瘤鼠移植瘤的病理证实为浸润性导管癌,免疫组化为ER、PR和HER-2阴性,解剖各组荷瘤鼠,均未发现远处转移。

表3 各组的慢弥散系数的变化
A: model group; B: rh-endostatin treatment group; C: paclitaxel treatment group; D: rh-endostatin+paclitaxel treatment group.*P<0.05vsgroup A;#P<0.05vsgroup B;▲P<0.05vsgroup C.
4.1HE染色 通过HE染色显示各组坏死的变化。结果显示各组有不同程度的坏死,A组、B组、C组、D组在肿瘤外周坏死程度依次增多,见图2。
4.2各组MVD的变化 按Weidner计数法,计算得各组的MVD平均值:A组为22.05±1.21,B组为16.95±0.68,C组为18.24±1.03,D组为14.12±1.02,给药物各组MVD均小于A组,D组MVD小于B、C组(P<0.05),B组和C组无显著差异,见图3。
4.3各组Ki67的变化 结果显示各组的Ki67指数:A组为49.29%±3.64%, B组为44.88%±3.39%,C组为20.14%±4.60%,D组为16.29%±5.38%。D组Ki67指数小于B组,但与C组无显著差异,见图4。

Figure 2. Morphology of transplanted tumor in various groups (HE staining,×200). Arrows indicate the necrosis. A: model group; B: rh-endostatin treatment group; C: paclitaxel treatment group; D: rh-endostatin+paclitaxel treatment group.
图2各组移植瘤形态的变化

Figure 3. MVD changes in various groups (×200). A: model group; B: rh-endostatin treatment group; C: paclitaxel treatment group; D: rh-endostatin+paclitaxel treatment group.
图3各组MVD的改变
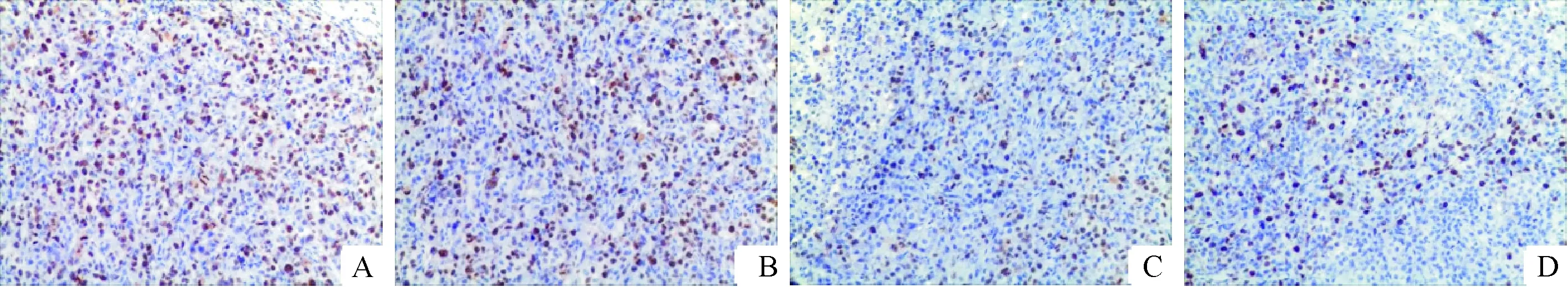
Figure 4. Ki67 expression changes in various groups (×100). A: model group; B: rh-endostatin treatment group; C: paclitaxel treatment group; D: rh-endostatin+paclitaxel treatment group.
图4各组Ki67表达的变化
讨 论
TNBC对内分泌治疗和针对HER-2的靶向治疗无效,其全身治疗主要是化疗,目前一般认为化疗药物中较为有效的是蒽环类和紫杉醇类的药物,有报道显示,TNBC如伴有BRCA1突变,铂类药物获益更好[3],但证据尚不足。由于化疗效果并不令人满意,因此如何提高TNBC化疗效果是目前的热点。理论上,最有效的化疗是使得每一个肿瘤细胞都能充分接触化疗药物并且到达细胞内部发挥作用,从而产生最大的细胞毒效应,实现这一目标,可通过改善肿瘤血管血供、改变细胞毒性药物的剂型、或者通过不同的载体传输化疗药。过去使用抗肿瘤血管生成药物,试图通过抑制肿瘤内部血管生成,以减少对肿瘤输送营养和氧气,从而达到所谓“饿死”肿瘤的目的,但抗血管生成药物致使肿瘤内部血管严重退化,肿瘤整体供血不足,导致其细胞处于乏氧状态。乏氧会刺激诱导促血管生成因子如血管内皮生长因子的表达,从而促使肿瘤内部生成更多的异常血管。肿瘤内部血管与正常组织血管的结构和功能不同,其形态上表现为迂曲无序,粗细不一,部分呈囊状,且空间分布不均匀,血管网多分叉且不规则,血管壁薄且裂隙增宽,裂口增多,基底膜厚薄不均,血管周细胞形态异常,肿瘤细胞过度增殖导致内部密度增高,内压力增大,致使肿瘤内的血管及淋巴管受到压迫,管腔变细变扁,这些血管结构的异常造成渗漏、血流紊乱不均、无效灌注增加、乏氧加重和代谢产物酸性物质增加。血管与淋巴管的渗出增加,导致肿瘤内部及其毗邻组织间隙液压升高,形成恶性循环,阻碍了药物在肿瘤内部的运输和扩散,药物难以发挥有效作用。Jain等[4]于2001年提出了肿瘤血管“正常化”理论: 某些抗血管生成药物也可以暂时“正常化”肿瘤脉管系统的异常结构和功能,使其对氧气和药物递送更有效,从而减轻缺氧,减少促血管生成因子的表达,并增加化疗药物的与肿瘤细胞的接触而更有效发挥其细胞毒作用。虽然这一理论明显有悖于既往的认识,但目前许多研究证实适当使用某些抗血管靶向药物可以产生肿瘤血管“正常化”[5-6]。抗血管生成药物的破坏血管作用与促肿瘤血管生成的相互作用达到一种临时的平衡,使得肿瘤内部血管的结构和功能趋于正常,但这一平衡通常是短暂且可逆的,这一短暂的时期称为肿瘤血管“正常化”的时间窗。在时间窗内合理使用化疗药,理论上可以有助于提高抗瘤效果并抑制肿瘤转移。
目前已经证实能产生血管正常化的药物有贝伐珠单抗(bevacizumab,BEV)[7]、重组人内皮抑素[8-9]等。由于后来Meta分析发现BEV未能改善乳腺癌的总生存期,且3~4度严重不良反应(如蛋白尿、心血管事件等)较常见[10],2011年10月美国FDA撤消了其治疗乳腺癌适应证的许可。重组人内皮抑素的作用机制是通过提高外源性血管生成因子的作用恢复促血管生成因子和血管生成抑制因子的平衡,使肿瘤内部血管和微环境的结构和功能趋于正常化。重组人内皮抑素联合化疗药物治疗晚期非小细胞肺癌的III期临床试验中证实了其增效化疗的作用。重组人内皮抑素在研究小细胞肺癌方面,已经有较多的研究数据[8-9],但是在乳腺癌方面,证据尚充分。不同的抗血管靶向药物的时间窗是不同的,重组人内皮抑素使用在裸鼠移植瘤上,多数文献报道的时间窗是4~10 d[8,11]。
本研究显示,重组人内皮抑素组的抑瘤率随使用时间的推移,有下降趋势,显示重组人内皮抑素的抑瘤作用随使用时间延长,其作用并没有逐渐增强,此可能与重组人内皮抑素本身无明显直接抗肿瘤细胞生长作用有关,且其仅能抑制肿瘤新生血管的形成,对于原来的血管没有抑制作用,原来的已经分化成熟的血管依然持续发挥作用。联合用药组的抑瘤率逐渐升高,均高于相应时点的药物单用组,但从移植瘤体积比较,明显小于重组人内皮抑素组,未见明显小于紫杉醇组,表明联合用药组的疗效优于重组人内皮抑素组,但未优于紫杉醇组。有报道显示重组人内皮抑素和紫杉醇适当联合作用在小细胞肺癌上出现协同作用[12],也有报道未发现协同作用[13],本研究观察重组人内皮抑素与紫杉醇在血管正常化时间窗内联合治疗TNBC,有明显的抑瘤作用,但没有明显提高紫杉醇的疗效,由于本次研究的样本相对较少、研究时间较短,需要更多的研究进一步探讨。
Ki67是一种存在于增殖细胞的抗原,其功能与有丝分裂密切相关,Ki67阳性率越高,提示肿瘤内部增殖细胞比例越高,肿瘤生长越快,组织分化越差,复发风险越高,对化疗往往也越敏感,但预后较差,因此, Ki67高值是一个预后不良的指标[14]。本次研究显示治疗结束时,联合用药组与紫杉醇组的Ki67的最低,移植瘤外周细胞的坏死程度最为明显,同期此2组的移植瘤体积的最小,抑瘤率也最高,表明Ki67下降与瘤周的肿瘤细胞及治疗效果有密切相关性,Ki67下降越明显,治疗效果越佳,Ki67有预测治疗效果作用。肿瘤MVD是指肿瘤组织中单位密度的微血管数量,包括细动脉、细静脉和毛细血管,MVD是新血管生长的度量标准,未治疗的肿瘤内部MVD是较高的,在血管正常化时MVD是明显减少的。本次研究重组人内皮抑素组的MVD明显少于模型组,间接显示此时是血管正常化时间窗,联合用药组MVD最少,表明在时间窗内联用紫杉醇化疗药,其对血管的抑制作用最明显。
既往使用ADC预测肿瘤治疗效果,但在单指数模型弥散加权成像(diffusion weighted imaging,DWI)中,ADC受到微循环灌注干扰,扫描技术条件及个体间的差异对结果影响较大,稳定性及重复性不理想,近年来发现双指数DWI衰减模式不仅图像质量优于单指数模式,并且更能准确地反映水分子信号的衰减,慢弥散系数不受微循环灌注影响,较ADC更能代表水分子的真性弥散[15]。本次研究组内比较显示,紫杉醇组和联合用药组的慢弥散系数进行性升高,其体积增大放缓也逐步明显,结合最后的病理细胞坏死比例、Ki67的变化以及肿瘤体积的变化,显示慢弥散系数与肿瘤的转归呈密切正相关,慢弥散系数增高是肿瘤治疗效果好的信号。另外一方面,组间比较,第11天,紫杉醇组慢弥散系数高于模型组,联合用药组慢弥散系数高于B组,此时组间的移植瘤体积无差异,至第17天出现差异,此时紫杉醇组与A组,D组与B组的慢弥散系数进一步拉大,表明慢弥散系数改变先于体积改变。因此,慢弥散系数不仅可以反映治疗效果,并可在肿瘤大小、形态改变前出现变化,可早期预测疗效,慢弥散系数为无创性早期预估肿瘤治疗的效果提供一个新的手段。
[1] Kumar P, Aggarwal R. An overview of triple-negative breast cancer[J]. Arch Gynecol Obstet, 2016, 293(2):247-269.
[2] 邱万寿, 唐 勇, 刘 威, 等. 甲基硒酸对人三阴性乳腺癌细胞化疗增敏作用的机制探讨[J]. 中国病理生理杂志, 2013, 29(11):1990-1993.
[3] Petrelli F, Coinu A, Borgonovo K, et al. The value of platinum agents as neoadjuvant chemotherapy in triple- negative breast cancers: a systematic review and meta-analysis[J]. Breast Cancer Res Treat, 2014,144(2):223-232.
[4] Jain RK. Normalizing tumor vasculature with antiangioge-nic therapy: a new paradigm for combination therapy[J]. Nat Med, 2001, 7(9):987-989.
[5] 傅岳武, 潘运龙, 覃 莉, 等. 纳米金抑制Ang-2和RGS-5表达导致裸鼠肝癌血管正常化[J]. 中国病理生理杂志, 2011, 27(12):2247-2252.
[6] Fukumura D, Jain RK. Tumor microvasculature and microenvironment: targets for anti-angiogenesis and normalization[J]. Microvasc Res, 2007, 74(2-3):72-84.
[7] Tolaney SM, Boucher Y, Duda DG, et al. Role of vascular density and normalization in response to neoadjuvant bevacizumab and chemotherapy in breast cancer patients[J]. Proc Natl Acad Sci U S A, 2015, 112(46):14325-14330.
[8] Li N, Zheng D, Wei X, et al. Effects of recombinant human endostatin and its synergy with cisplatin on circulating endothelial cells and tumor vascular normalization in A549 xenograft murine model[J]. J Cancer Res Clin Oncol, 2012, 138(7):1131-1144.
[9] Li W, Zhao X, Du B, et al. Gold nanoparticle-mediated targeted delivery of recombinant human endostatin normalizes tumour vasculature and improves cancer therapy[J]. Sci Rep, 2016, 6:30619.
[10] Hamilton EP, Blackwell KL. Safety of bevacizumab in patients with metastatic breast cancer[J]. Oncology, 2011,80(5-6):314-325.
[11] Jiang XD, Dai P, Qiao Y, et al. Clinical study on the recombinant human endostatin regarding improving the blood perfusion and hypoxia of non-small-cell lung cancer[J]. Clin Transl Oncol, 2012, 14(6):437-443.
[12] 李 娜, 金子良, 刘竹君, 等. 重组人血管内皮抑制素注射液联合化疗多周期治疗晚期非小细胞肺癌的疗效[J]. 中华肿瘤杂志, 2011, 33(12):937-942.
[13] Sun XJ, Deng QH, Yu XM, et al. A phase II study of Endostatin in combination with paclitaxel, carboplatin, and radiotherapy in patients with unresectable locally advanced non-small cell lung cancer[J]. BMC Cancer,2016, 16:266.
[14] 许林锋, 倪嘉延, 陈耀庭, 等.HIF-1α基因沉默对大鼠肝癌CBRH-7919细胞p27和Ki67表达的影响[J]. 中国病理生理杂志, 2012, 28(10):1825-1829.
[15] Oto A, Yang C, Kayhan A, et al. Diffusion-weighted and dynamic contrast-enhanced MRI of prostate cancer: correlation of quantitative MR parameters with Gleason score and tumor angiogenesis[J]. Am J Roentgenol, 2011,197(6):1382-1390.
(责任编辑: 林白霜, 余小慧)
Responseofhumantriple-negativebreastcancertopaclitaxelaftervascularnormalizationinnudemice
LÜ Rong-zhao1, ZHAO Lu-yu2, SHI Chang-zheng2, LI Wei3, WENG Ze-ping4, HUANG Xin1, WANG Ning-xia1, PAN Yun-long3
(1DepartmentofBreastSurgery,2DepartmentofImage,3DepartmentofGastrointestinalSurgery,4DepartmentofPathology,TheFirstAffiliatedHospitalofJinanUniversity,Guangzhou510632,China.E-mail:tpanyl@jnu.edu.cn; 13316268808@163.com)
AIM: To explore whether there is synergistic effect of recombinant human endostatin (rh-Endo) and paclitaxel (Pac) in the time window of vascular normalization and the role of magnetic resonance imaging (MRI) in early assessment of chemotherapy by observing the response of human triple-negative breast cancer (TNBC) to Pac after vascular normalization in nude mice.METHODSThe human TNBC MDA-MB-231 cells were planted in the subcutaneous region of right lower abdomen of BALB/c-nu female nude mice. These nude mice were randomly divided into 4 groups (n=7). rh-Endo was given for 17 consecutive days in rh-Endo group and rh-Endo+Pac group. Pac was given on the 6th and 12th days in Pac group and rh-Endo+Pac group. The dosage of both drugs was 10 mg·kg-1·d-1(ip). On the day before the treatment and the 5th, 11th and 17th days after treatment, all the transplanted tumors were examined by MRI. All the mice were killed by cervical dislocation and their transplanted tumors were taken down for examinations after the last MRI on the 17th day. The changes of pathology, immunohistochemisty, microvessel density (MVD) and Ki67 expression were measured.RESULTSOn the 17th day, the volume of transplanted tumor in rh-Endo+Pac group was smaller than that in model group and rh-Endo group (P<0.05), and no difference between rh-Endo+Pac group and Pac group was found. On the 17th day, the tumor inhibitory rates in rh-Endo group, Pac group and rh-Endo+Pac group were 14.61%, 39.08% and 54.79%, respectively. The slow diffusion coefficient in Pac group was increased compared with model group, while it was decreased compared with rh-Endo+Pac group (P<0.05). No distant metastatic lesion in the tumor-bearing mice was observed. The necrotic rates in rh-Endo+Pac group and Pac group were higher than those in model group and rh-Endo group. The MVD in model group was higher than that in the other 3 groups. The MVD in rh-Endo+Pac group was decreased compared with Pac group and rh-Endo group. The Ki67 level in rh-Endo+Pac group was decreased compared with rh-Endo group, and no difference between rh-Endo+Pac group and Pac group was detected.CONCLUSIONIn the time window of vascular normalization, the combination of Pac and rh-Endo has a significant antitumor effect on TNBC, but this study did not observe a significant synergistic effect of the 2 drugs. The change of slow diffusion coefficient can predict the therapeutic effect in advance.
Triple-negative breast cancer; Vascular normalization; Endostatin; Paclitaxel; Chemotherapy; Magnetic resonance imaging
R737.9; R363
A
10.3969/j.issn.1000- 4718.2017.10.014
1000- 4718(2017)10- 1819- 06
2017- 05- 08
2017- 08- 07
国家自然科学基金资助项目(No.81472849)
△通讯作者 潘运龙 Tel: 020-38688358; E-mail: tpanyl@jnu.edu.cn; 王宁霞 Tel: 020-38688613; E-mail: 13316268808@163.com
▲并列第1作者
杂志网址: http://www.cjpp.net

