酪酸梭菌代谢产物丁酸和氢气对急性胃黏膜损伤的作用*
王金丹, 乔莞宁, 朱 静, 付瑶阳, 胡万里, 董人杰, 洪凯睿, 张佳丽, 王方岩△
(温州医科大学 1检验医学院、生命科学学院, 2基础医学院病理生理学教研室, 浙江 温州 325035)
酪酸梭菌代谢产物丁酸和氢气对急性胃黏膜损伤的作用*
王金丹1, 乔莞宁2▲, 朱 静2, 付瑶阳2, 胡万里1, 董人杰2, 洪凯睿2, 张佳丽2, 王方岩2△
(温州医科大学1检验医学院、生命科学学院,2基础医学院病理生理学教研室, 浙江 温州 325035)
目的前期研究表明酪酸梭菌对损伤的胃黏膜具有保护作用,但具体效应物质不明。本文通过检测酪酸梭菌的主要代谢产物氢气和丁酸对损伤胃黏膜的效应,探究黏膜保护作用的具体机制。方法将雄性ICR小鼠通过乙醇灌胃诱导胃黏膜损伤,并以氢气和丁酸分别进行处理,观测胃组织的大体变化和组织结构损伤情况,通过RT-qPCR检测炎症因子白细胞介素12(IL-12)、Ras相关核蛋白1(RAN1)和单核细胞趋化蛋白1(MCP-1)的含量,采用免疫组化法观测Bcl-2和Bax蛋白表达量变化。结果胃组织大体观测发现丁酸能够保护胃黏膜,而氢气不具有此作用;HE染色也提示丁酸能够显著改善乙醇造成的胃黏膜病理损伤。RT-qPCR则显示所检测炎症因子IL-12、RAN1和MCP-1的表达量较模型对照组有显著降低(P<0.01)。在丁酸组,Bax的表达量较模型组显著减低(P<0.01),而Bcl-2的含量却明显提高(P<0.01)。结论酪酸梭菌胃黏膜保护效应的主要产物可能是丁酸而不是氢气。丁酸能够通过抑制炎症反应,下调Bax/Bcl-2表达比例,从而实现对胃黏膜的保护作用。
丁酸; 氢气; 急性胃黏膜损伤; 炎症; 细胞凋亡
胃黏膜损伤是临床上常见的消化系统疾病。幽门螺旋杆菌感染,使用非甾体抗炎药物以及过量饮酒是其最为主要的致病原因。胃黏膜损伤不仅降低了患者的生活质量并且容易癌变。现有的治疗手段虽能够取得较好的短期疗效[1],但长期来看,却存在复发率高的严重不足。
本课题组之前的研究显示酪酸梭菌对由阿司匹林[2]、应激、幽门结扎以及乙醇[3-4]诱导的小鼠胃黏膜损伤均具有显著的保护效果,本文则在以往研究基础上进一步研究其具体作用机制。酪酸梭菌能够产生多种代谢产物,但其中最为主要是丁酸和氢气。现有研究已证明丁酸和氢气对炎症及氧化相关的疾病均具有较为突出的治疗或者预防效果。为了证实丁酸和氢气是否为酪酸梭菌胃黏膜保护作用的具体效应物质,我们利用乙醇诱导的小鼠急性胃黏膜损伤模型,通过丁酸和氢气分别进行干预,对胃组织的大体损伤和病理变化进行分析,判断其作用,并检测炎症因子及凋亡相关蛋白Bcl-2和Bax的表达水平,对内在的具体机制进行探索。
材 料 和 方 法
1实验动物
健康雄性ICR小鼠,体重25~30 g,由温州医科大学动物实验中心提供,合格证号为SCXK(浙)2010-0150。
2实验方法
2.1动物分组 将小鼠40只随机分成4组,每组10只,分别为正常对照组、模型组、丁酸组和氢气组。
2.2给药情况及动物模型制备 丁酸组小鼠在造模前30 min以2 g/kg丁酸钠的剂量进行灌胃;氢气组小鼠在造模前30 min以0.6 mL的饱和氢水灌胃;模型组则灌予相同体积的生理盐水。禁食24 h后,以剂量为10 mL/kg的无水乙醇灌胃,1 h后即建立起乙醇灼烧性胃损伤模型[5]。
2.3标本采集 在造模结束后,取胃组织,做大体观察胃部黏膜面溃疡状况,一部分(n=4)用10%福尔马林固定,用于HE染色,其余小鼠胃组织(n=6)冻存,用于后续指标测定。
2.4病理指标的检测及方法 (1) 溃疡面积:将胃组织展开平置后,进行扫描,获得的图像再用软件Image-Pro Plus (IPP)6.0测量胃组织的总面积及出血溃疡面积,并计算两者的相对面积比例。(2)溃疡抑制百分率:根据IPP软件计算所得的溃疡面积比值,依照以下公式进行溃疡抑制率百分率计算:溃疡抑制率百分率(%)=(对照组溃疡面积比例-给药组溃疡面积比例)/对照组溃疡面积比例×100%。(3)胃组织病理检测:将10% 甲醛固定的各组胃组织标本,进行常规脱水石蜡包埋,然后制成病理切片,切片厚度约为4~5 μm,HE染色在光镜下观察胃黏膜的组织学变化。
2.5RT-qPCR 取50~100 mg小鼠胃组织于离心管中,加入1 mL TRIzol试剂后充分匀浆,常规操作提取总RNA。使用核酸蛋白分析检测RNA浓度及纯度。按照逆转录试剂盒(TIANGEN,货号KT201)说明书合成样品cDNA。以合成的cDNA为模板,按荧光定量PCR试剂盒(TaKaRa,货号RR820A)说明书,在25 μL体系内进行PCR扩增。引物序列如表1。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s后采集荧光信号,重复40个循环。以GAPDH为内参照,用2-ΔΔCt计算出其相对表达量。
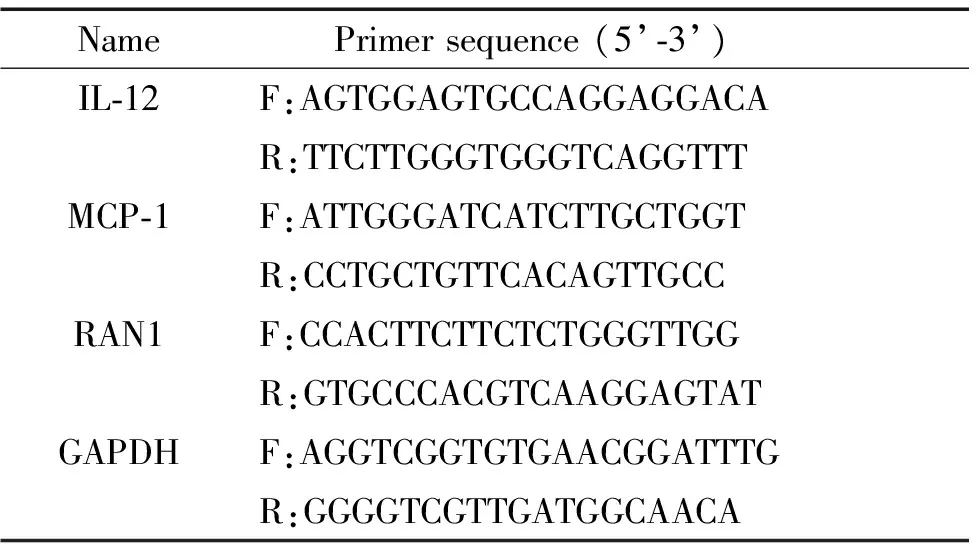
表1 引物序列
2.6免疫组化实验 对Bcl-2和Bax进行免疫组化检测, I 抗浓度通过预实验确定。在常规抗体孵育清洗后,进行DAB复染。用IPP 6.0软件进行图像半定量分析,每张切片选取5个高倍镜视野(×400),测定各组小鼠胃黏膜Bax和Bcl-2阳性目标积分吸光度(A)值。
3统计学处理
采用SigmaPlot作图分析,SPSS 17.0统计软件进行数据分析。实验数据用均数±标准差(mean±SD)表示,多组数据的比较采用单因素方差分析,方差齐性则采用Bonferroni法,方差不齐者用Dunnett’s T3法,以P<0.05表示差异有统计学意义。
结 果
1丁酸和氢气对乙醇灼烧型胃溃疡的胃黏膜大体形态的影响
为分析丁酸和氢气的效果,我们观察胃黏膜出血损伤程度,并通过IPP 6.0软件计算溃疡抑制率。乙醇造模后,小鼠胃黏膜呈现大面积的出血,并以沿血管分布为特征。有些胃壁有皱缩,出现条索状变化,严重的出血位置甚至呈现黑色或暗红色。丁酸明显减轻了溃疡出血损伤,溃疡抑制率也显著的提高,但是氢气并未减轻胃黏膜的损伤,见图1。
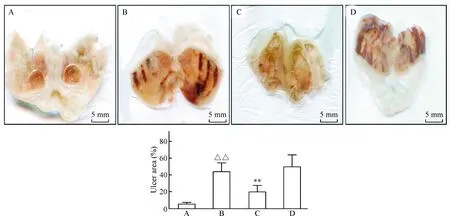
Figure 1. Macroscopic appearance of the gastric mucosa. A: normal group; B: model group; C: butyrate group; D: hydrogen group. Mean±SD.n=4.△△P<0.01vsnormal group;**P<0.01vsmodel group.
图1各组小鼠胃黏膜扫描图片
2丁酸对胃溃疡病理变化的影响
从HE染色结果可以看出正常组的胃壁结构清晰完整,细胞形态正常;而模型组则出现了明显的胃黏膜病理损伤,坏死的黏膜大量脱落,部分胃黏膜上皮出现缺损,腺体被破坏,腺腔内出现了脱落的上皮细胞碎片,还出现了炎细胞浸润的现象;在使用丁酸后,胃黏膜损伤程度较模型组明显缩小,黏膜上皮较完整连续,腺体的排列较整齐,未见明显损伤,见图2。
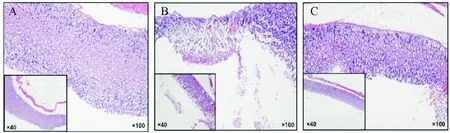
Figure 2. Histological assessment of acute gastric mucosal injury induced by ethanol (HE staining). A: normal group; B: model group; C: butyrate group.
图2各组小鼠胃黏膜病理图片
3丁酸对胃黏膜组织内炎症因子的影响
对胃黏膜组织进行Rt-q RCR检测炎症因子表达水平。结果发现,与正常对照组比较,模型组的白细胞介素12(interleukin 12,IL-12)、Ras相关核蛋白1(Ras-related nuclear protein 1, RAN1)和单核细胞趋化蛋白1(monocyte chemotactic protein-1,MCP-1)等多种炎症细胞因子的相对表达量均有显著提高。而丁酸处理组的各炎症细胞因子与模型组相比,其相对表达量则均有显著降低(P<0.01),见图3。
4丁酸对胃组织Bcl-2和Bax表达的影响
免疫组化结果显示,正常组 Bax 表达为弱阳性,定位在胞浆,主要集中分布在黏膜层;模型组Bax的表达量为强阳性,积分吸光度明显高于正常组,差异具有统计学意义(P<0.01)。而丁酸组Bax的表达量明显低于模型组,其Bax的积分吸光度值显著低于模型组,差异有统计学意义(P<0.01)。并且我们发现丁酸能够显著上调Bcl-2的表达(P<0.01),见图4。
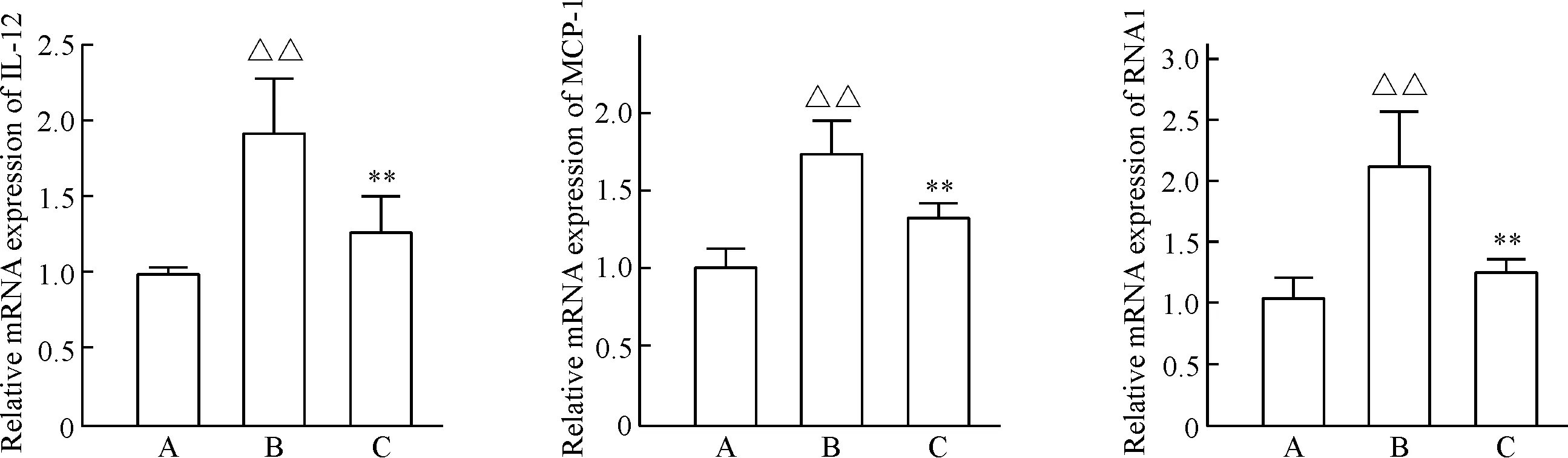
Figure 3. The relative mRNA expression of inflammatory factors in different groups. A: normal group; B: model group; C: butyrate group. Mean±SD.n=6.△△P<0.01vsnormal group;**P<0.01vsmodel group.
图3各组小鼠胃组织IL-12、RAN1和MCP-1的mRNA相对表达量
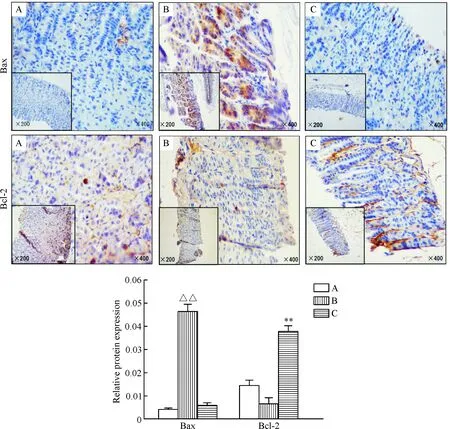
Figure 4. The expression of Bax and Bcl-2 in different groups. A: normal group; B: model group; C: butyrate group. Mean±SD.n=4.△△P<0.01vsnormal group;**P<0.01vsmodel group.
图4各组小鼠胃黏膜组织Bax和Bcl-2的表达情况
讨 论
乙醇诱导的胃黏膜损伤,能够复制较为典型的人类胃黏膜损伤的临床表现,如胃黏膜的出血糜烂等,并且饮酒过多也是造成胃黏膜损伤的重要原因。因此,该模型常用于筛选胃黏膜保护作用物质。我们前期的工作已证实酪酸梭菌对胃黏膜的保护作用,本研究则进一步探索该菌的具体效应物质。酪酸梭菌是益生菌,能够产生氢气、丁酸、维生素B、乳酸等多种对人体有益物质,而其中产量最多生物效应最为突出的是氢气[6]和丁酸[7]。本文对氢气和丁酸的胃黏膜保护作用进行评价。
但我们发现氢气组的胃组织损伤程度与模型组并无明显差异,而丁酸组保护效应却非常显著。因此,判断酪酸梭菌的主要效应产物可能不是氢气而是丁酸。值得注意的是,有研究发现氢气在大鼠应激型胃溃疡中对胃黏膜有明显的效应[8],而且他们的给氢途径是采用静脉注射。我们认为结果的差异可能与给氢的剂量、途径、所采用的动物种属以及溃疡模型不同等因素有关。关于氢气对胃黏膜损伤的效应仍有待进一步深入研究。
丁酸对机体的影响可分为对肠内的作用和对肠外的作用。对肠内的作用包括:调节跨膜运输、改善炎症和氧化状态的肠黏膜、增强黏膜屏障、调节内脏敏感性和蠕动,以及预防和抑制结肠癌[9]。肠外效果包括减轻血红蛋白病[10-12]、高胆固醇血症[13-14]、胰岛素抵抗[15-16]及脓毒症[17-18]等。而本研究中,我们发现丁酸能够显著减轻乙醇造成的胃黏膜损伤。
IL-12促进细胞介导的免疫应答能力,具有免疫刺激作用,可调节自然杀伤细胞的天然免疫和辅助型T细胞、细胞毒性T淋巴细胞介导的获得性免疫应答[19-20],是重要的细胞因子。众多研究表明,IL-12与RAN1参与炎症反应,可引起胃黏膜大量炎症细胞浸润及免疫反应,同时通过正反馈使炎症反应不断增强,干扰胃黏膜生理功能,造成局部损伤,引发后继慢性炎症与免疫相关疾病等。有研究证实,在急性胃黏膜损伤中,IL-12及RAN1表达显著增加[21],本实验也证实了这一点。MCP-1属趋化因子CC亚家族中一员,可由多种细胞分泌,募集单核细胞、嗜碱性粒细胞和T细胞至炎症部位,经历级联反应,在炎症过程中起促进作用[22]。已有大量相关研究表明,在相关急慢性胃炎及胃癌中,MCP-1表达水平也显著提升[23]。在使用丁酸处理后,上述炎症介子则有显著下降,这提示丁酸具有抗炎作用,与其它研究的结论相一致[17]。以往研究已证实丁酸能够抑制NF-κB,从而降低TNFα、IL-1β、IL-2、IL-6、IL-8、IL-12等多种炎症细胞因子表达,发挥抗炎作用[24]。丁酸作为组蛋白去乙酰化酶抑制剂,能够调控基因的表达,也是其发挥抗炎作用的关键[25]。新近的研究认为丁酸可以通过其特异性受体GPR109a介导生物学效应[26]。丁酸在乙醇诱导的胃黏膜炎症中通过何种机制发挥抗炎作用是我们下一步的需要探讨的关键。
为评价丁酸对胃黏膜损伤的保护作用,我们测定了凋亡调控相关蛋白Bax和Bcl-2。这2个蛋白在凋亡过程中至关重要。当Bax表达量增加时,促进凋亡的发生,Bcl-2表达量增加时则具有抗凋亡作用。本研究发现,在乙醇模型组Bax的表达明显上调,而Bcl-2的表达量基本不变。丁酸组Bax的表达量较模型组明显减少,而Bcl-2的表达量显著增加,这些数据提示丁酸可通过下调Bax的表达,上调Bcl-2的表达,抗凋亡实现对胃黏膜上皮的保护作用。但丁酸如何调控这2种蛋白,尚需深入研究。
总之,本文已证实丁酸是酪酸梭菌的胃黏膜保护效应的主要代谢产物,能够减轻胃部炎症反应,下调Bax/Bcl-2的表达比例,防止乙醇介导的胃黏膜的损伤,为更为深入的机制研究和临床应用提供理论依据。
[1] 许 华, 俞励平, 文 洁, 等. 兰索拉唑抗实验性胃溃疡作用的研究[J]. 中国病理生理杂志, 2002, 18(6):698-700.
[2] 沈淑蓉, 朱 静, 张 浩, 等. 酪酸梭菌抗阿司匹林致小鼠胃溃疡作用的初步研究[J]. 浙江医学, 2015, 37(12):1037-1040, 1045.
[3] 林刻智, 赵 娜, 孔咪咪, 等. 酪酸梭菌预防小鼠幽门结扎型胃溃疡的机制研究[J]. 中国病理生理杂志, 2015, 31(7):1309-1314.
[4] Wang FY, Liu JM, Luo HH, et al. Potential protective effects ofClostridiumbutyricumon experimental gastric ulcers in mice[J]. World J Gastroenterol, 2015, 21(27): 8340-8351.
[5] 徐静华, 陈雪梅, 赵余庆, 等. 姜辣素对动物实验性胃溃疡的影响[J]. 沈阳药科大学学报, 2011, 28(3):221-225.
[6] Ohsawa I, Ishikawa M, Takahashi K, et al. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals[J]. Nat Med, 2007, 13(6):688-694.
[7] Gao Z, Yin J, Zhang J, et al. Butyrate improves insulin sensitivity and increases energy expenditure in mice[J]. Diabetes, 2009, 58(7):1509-1517.
[8] Liu X, Chen Z, Mao N, et al. The protective of hydrogen on stress-induced gastric ulceration[J]. Int Immuno-pharmacol, 2012, 13(2):197-203.
[9] Rivera-Ingraham GA, Espinosa F, Garcia-Gómez JC. Effect of γ-amino butyric acid on limpet populations: towards the future management and conservation of endangered patellid species[J]. J Chem Ecol, 2011, 37(1):1-9.
[10] Tognetti VB, Van Aken O, Morreel K, et al. Perturbation of indole-3-butyric acid homeostasis by the UDP-glucosyltransferase UGT74E2 modulatesArabidopsisarchitecture and water stress tolerance[J]. Plant Cell, 2010, 22(8):2660-2679.
[11] Leljak-LevaniD, JeiM, Cesar V, et al. Biochemical and epigenetic changes in phytoplasma-recovered periwinkle after indole-3-butyric acid treatment[J]. J Appl Microbiol, 2010, 109(6): 2069-2078.
[12] Yang L, Li Z, Li X, et al. Butyric acid stimulates bone sialoprotein gene transcription[J]. J Oral Sci, 2010, 52(2):231-237.
[13] Strader LC, Culler AH, Cohen JD, et al. Conversion of endogenous indole-3-butyric acid to indole-3-acetic acid drives cell expansion inArabidopsisseedlings[J]. Plant Physiol, 2010, 153(4):1577-1586.
[14] Ruzicka K, Strader LC, Bailly A, et al.ArabidopsisPIS1 encodes the ABCG37 transporter of auxinic compounds including the auxin precursor indole-3-butyric acid[J]. Proc Natl Acad Sci U S A, 2010, 107(23):10749-10753.
[15] Zhu H, Li T, Zhang Y, et al. High-performance organic nanoscale photoswitches based on nanogap electrodes coated with a blend of poly(3-hexylthiophene) and[6,6]-phenyl-C61-butyric acid methyl ester (P3HT:PCBM)[J]. Adv Mater, 2010, 22(14):1645-1648.
[16] Montero B, Garcia-Morales JL, Sales D, et al. Evolution of butyric acid and the methanogenic microbial population in a thermophilic dry anaerobic reactor[J]. Waste Manag, 2010, 30(10):1790-1797.
[17] Wang F, Liu J, Weng T, et al. The inflammation induced by lipopolysaccharide can be mitigated by short chain fatty acid, butyrate, through up-regulation of IL-10 in septic shock[J]. Scand J Immunol, 2017, 85(4):258-263.
[18] Wang F, Jin Z, Shen K, et al. Butyrate pretreatment attenuates heart depression in a mice model of endotoxin-induced sepsis via anti-inflammation and anti-oxidation[J]. Am J Emerg Med, 2017, 35(3):402-409.
[19] Lesinki GB, Badgwell B, Zimmerer J, et al. IL-12 pretreatments enhance IFN-α-induced Janus kinase-STAT signaling and potentiate the antitumor effectes of IFN-α in a murine model of malignant melanoma[J]. J Immunol, 2004, 172(12):7368 -7376.
[20] Knutson KL, Disis ML. IL-12 enhances the generation of tumour antigen-specific Th1 CD4+T cells duringexvivoexpansion[J]. Clin Exp Immunol, 2004, 135(2):322-329.
[21] 林 谦, 王大为, 唐英姿, 等. 幽门螺杆菌相关性胃炎患儿胃黏膜白细胞介素-12、白细胞介素-12信使核糖核酸的变化[J]. 实用儿科临床杂志, 2005, 20(9):849-850.
[22] Hojo Y, Ikeda U, Takahashi M, et al. lncreased levels of monocyte-related cytokines in patients with unstable angina[J]. Atherosclerosis, 2002, 161(2):403-408.
[23] 陈海涛, 张文俊. 单核细胞趋化蛋白-1与胃癌关系的研究进展[J]. 国际消化病杂志, 2014, 34(3):198-200.
[24] Ustün GE, Solmaz SK, Morsunbul T, et al. Advanced oxidation and mineralization of 3-indole butyric acid (IBA) by Fenton and Fenton-like processes[J]. J Hazard Mater, 2010, 180(1-3):508-513.
[25] Mishiro T, Kusunoki R, Otani A, et al. Butyric acid attenuates intestinal inflammation in murine DSS-induced colitis model via milk fat globule-EGF factor 8[J]. Lab Invest, 2013, 93(7):834-843.
[26] Singh N, Gurav A, Sivaprakasam S, et al. Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis[J]. Immunity, 2014, 40(1):128-139.
(责任编辑: 林白霜, 罗 森)
EffectofmetabolitesofClostridiumbutyricum,butyricacidandhydrogen,onacutegastricmucosallesion
WANG Jin-dan1, QIAO Wan-ning2, ZHU Jing2, FU Yao-yang2, HU Wan-li1, DONG Ren-jie2, HONG Kai-rui2, ZHANG Jia-li2, WANG Fang-yan2
(1SchoolofMedicalLaboratoryScienceandLifeScience,2DepartmentofPathophysiology,SchoolofBasicMedicineScience,WenzhouMedicalUniversity,Wenzhou325035,China.E-mail:wzyxywfy@126.com)
AIM: To observe the antiulcer effect of butyric acid and hydrogen, the main metabolites ofClostridiumbutyricum(C.butyricum), and to explore the underlying mechanism.METHODSThe mouse model of acute gastric mucosal lesion was prepared by gavage with ethanol. The mice were randomly divided into 4 groups: normal group, model group, butyric acid group and hydrogen group. The mice in butyric acid group and hydrogen group were given butyrate and hydrogen prior to model establishment, respectively. Macroscopic observation of the pathological changes in gastric tissues was performed to evaluate the effect of the 2 metabolites ofC.butyricum. Meanwhile, the mRNA expression levels of inflammatory factors, such as IL-12, RAN1 and MCP-1, were determined by RT-qPCR. The expression levels of apoptosis-related proteins Bcl-2 and Bax were detected by immunohistochemical staining.RESULTSThe macroscopic observation found that butyrate, not hydrogen, protected gastric mucosa. HE staining also showed that butyrate significantly attenuated the pathological damage of the gastric mucosa induced by ethanol. Compared with model group, the mRNA levels of inflammatory factors IL-12, RAN1 and MCP-1 in butyrate group significantly decreased (P<0.01). In butyrate group, the protein level of Bax was obviously decreased compared with model group (P<0.01), while the protein level of Bcl-2 was significantly increased (P<0.01).CONCLUSIONThe gastric mucosa protective metabolite ofC.butyricummay be butyric acid, not hydrogen. Butyric acid protects the gastric mucosa against ethanol-induced lesion by inhibiting the inflammation and reducing the expression ratio of Bax/Bcl-2.
Butyric acid; Hydrogen; Acute gastric mucosal lesion; Inflammation; Apoptosis
R573.3; R363
A
10.3969/j.issn.1000- 4718.2017.10.029
1000- 4718(2017)10- 1906- 06
2017- 04- 05
2017- 05- 31
浙江省科技厅项目(No. 2017C33068);浙江省新苗人才计划(No. 2017R413042);温州市科技局项目(No. y20150009)
△通讯作者 Tel: 0577-86689817; E-mail: wzyxywfy@126.com
杂志网址: http://www.cjpp.net
▲ 并列第1作者

