中性粒细胞/淋巴细胞比率及血小板平均体积对慢阻肺发作风险和严重程度预测价值
吴春明 陈兴无
中性粒细胞/淋巴细胞比率及血小板平均体积对慢阻肺发作风险和严重程度预测价值
吴春明 陈兴无
目的探讨中性粒细胞/淋巴细胞比率(NLR)及血小板平均体积(MPV)对慢性阻塞性肺疾病患者发作风险及严重程度的预测价值。方法选择2014年6月至2015年5月收入我院呼吸内科,明确诊断为慢性阻塞性肺疾病急性加重期患者96例,年龄40-70岁,性别不限,按照两种方法分组:(1)根据发作频率分为频繁发作组67例,非频繁发作组29例;(2)按肺功能气流受限的程度分为3组,其中中度组(50%≤FEV1占预计值%<79%)42例,重度组(30%≤FEV1占预计值<49%)39例,极重度组(FEV1占预计值%<30%)15例。诊断及严重度分组依据2013年修订版《慢性阻塞性肺疾病诊治指南》,同时均排除30天内全身使用糖皮质激素、合并其它器官炎性疾病、自身免疫系统疾病、血液病的患者。收集所有患者治疗前及治疗后外周血常规、CRP、动脉血气、肺功能检查结果,并对所有患者完成CAT评分,按照上述分组方法比较各组患者治疗前、治疗后中性粒细胞/淋巴细胞比率(NLR)、血小板平均体积(MPV)的变化,及其治疗前NLR、MPV与动脉血气、CRP、肺功能、CAT评分之间的相关性。结果(1) 频繁发作组患者NLR明显高于非频繁发作组(t=3.442,P=0.031<0.05);而两组患者MPV比较差异无显著意义(t=1.264,P=0.209>0.05)。(2) 在不同严重程度的慢阻肺分组中对患者NLR、MPV进行比较,NLR在不同的严重程度中存在显著的差异(F=5.592,P=0.017<0.05);MPV在严重程度方面无差异(F=0.179,P=0.910>0.05)。(3) NLR与CRP正相关(r=0.26,P<0.05),与FEV1负相关(r=-0.39,P<0.05),与发作频率正相关;MPV与CRP、FEV1、发作频率无明显相关性。(4) NLR、MPV治疗后跟治疗前相比,均下降,说明通过治疗,慢阻肺患者全身性炎症反应减轻。结论(1) 中性粒细胞/淋巴细胞比率(NLR)对慢阻肺发作风险有正向预测价值,即中性粒细胞/淋巴细胞比率高,慢阻肺发作风险越大,中性粒细胞/淋巴细胞比率低,慢阻肺 发作风险越小;中性粒细胞/淋巴细胞比率(NLR)对慢阻肺严重程度也有正向预测价值,即比率高,慢阻肺严重程度越严重,比率低时,慢阻肺严重程度越低。(2) 血小板平均体积(MPV)对慢阻肺发作风险和严重程度没有预测价值。
慢性阻塞性肺疾病;中性粒细胞/淋巴细胞比率;血小板平均体积;发作风险;严重程度
慢性阻塞性肺疾病(慢阻肺)是一种渐进、退行性和多发性疾病,特征为进行性气流受限。反复急性发作(AECOPD)是其病情进行性发展的重要原因之一,部分患者特别易于发作,称之为“频繁发作型”,ECLIPSE队列研究数据(慢阻肺纵向评价识别预测性替代终点)表明,即使根据慢阻肺全球倡议(GOLD)定义为2级的患者(FEV150%-80%预计值),其中有22%属于频繁发作型[1]。AECOPD及长时间持续发作导致肺功能、生活质量加速下降、医疗费用、死亡率增加。因此,预测和预防AECOPD是慢阻肺管理的主要目标之一。最近,中性粒细胞-淋巴细胞比率(NLR)作为炎性生物标志物已引起重视,因其快速、廉价、容易测量被认为是一个新的炎症标记物评估慢性炎症。已证明NLR是多种炎性疾病如心脑血管疾病、癌症[2]、牛皮癣预后的生物标志物。慢阻肺患者NLR升高[3],而且NLR值也与 血清CRP水平正相关。但持续增高的全身炎症反应是否影响AECOPD复发仍不清楚。血小板与炎症标记物密切相关,在炎性疾病引发和蔓延起到关键作用。在一定范围内,血小板体积越大其作用越强,为此血小板平均体积(MPV)成为血小板功能和活化的指标。先前研究表明,心肌梗塞、心脑血管病、阿尔茨海默氏病、高血压和乳糜泻MPV增加;与此相反,在活动性炎性疾病如溃疡性结肠炎、类风湿性关节炎和强直性脊柱炎降低。MPV的双重作用很大程度上受炎症强度的影响[4]。研究发现,慢阻肺患者相比健康人,无论急性发作还是稳定期,MPV降低;而疾病恢复期,MPV增加[5],慢阻肺特别是III和IV期患者MPV和WBC相关,表明MPV可能反映AECOPD患者全身炎症状况。最近的研究表明,MPV 和MPV/血小板计数比值可以预测缺血性心血管疾病长期死亡率。本研究探讨NLR、MPV与慢阻肺发作风险、严重程度的关系,以下是此研究结果。
资料与方法
一、一般资料
选择2014年6月至2015年5月收入黄山市人民医院呼吸内科,明确诊断为慢性阻塞性肺疾病急性加重期患者96例,年龄40-70岁,性别不限,按照两种方法分组:① 根据发作频率分为频繁发作组67例,非频繁发作组29例;② 按肺功能气流受限的程度分为3组,其中中度组(50%≤FEV1占预计值%<79%)42例,重度组(30%≤FEV1占预计值<49%)39例,极重度组(FEV1占预计值%<30%)15例。收集相关指标及一般资料情况:中性粒细胞数值、淋巴细胞数值、红细胞分布宽度(RDW)、平均血小板体积(MPV),并计算出NLR;动脉血气、CRP、肺功能、CAT等。
二、诊断标准
① 慢阻肺 诊断标准符合《慢性阻塞性肺疾病诊治指南(2015年修订版)》的诊断与分级。② 急性加重频率及肺功能受限程度按GOLD标准分组(2015年版)。排除标准 排除30天内全身使用糖皮质激素、合并其他器官炎性疾病、自身免疫系统疾病、血液系统疾病的患者。
三、方法及相关指标检测
抽取所有患者治疗前及治疗后静脉血,采用全自动血细胞分析仪-BC-5390CRP检测治疗前及治疗后全血细胞计数及分类检测,采用免疫比浊法测定,使用美国贝克曼-库尔特AU5800全自动生化分析仪检测治疗前后的CRP。并抽取动脉血,行血气分析检查;对所有受试者采用慢性阻塞性肺疾病评估测试(CAT)问卷进行评估,填写评分表,了解急性发作次数。并对所有患者使用我院肺功能仪进行治疗前、治疗后肺功能检测。
四、统计学方法
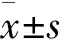
结 果
一、患者一般资料的比较
1 不同发作频率患者一般资料比较:按发作频率分组时,非频繁发作组和频繁发作组的慢阻肺患者,性别、年龄、吸烟史等一般情况的比较没有统计学差异(P>0.05),而发作频率(1.421±0.421)、(5.248±2.261)和住院次数(0.717±0.287)、(3.404±1.875)的比较有显著的差异,P<0.05。(见表1)。
2 不同严重程度患者一般资料比较:按不同严重程度分组时,中度组、重度组、极重度组的慢阻肺患者,性别、年龄、吸烟史等一般情况的比较没有统计学差异,而发作频率(2.105±1.36)、(4.685±1.834)、(8.113±0.961)和住院次数(1.019±0.628)、(3.077±1.395)、(5.74±1.432)的比较有显著的差异,P<0.05。(见表2)
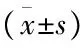
表1 不同发作频率患者一般资料的比较
(续表1)

组别n发作频率住院次数非频繁发作组291.421±0.4210.717±0.287频繁发作组675.248±2.2613.404±1.875t,P-9.023,P<005-7.656,P<005
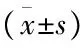
表2 不同严重程度患者一般资料的比较
(续表2)

组别n发作频率住院次数中度组422.105±1.361.019±0.628重度组394.685±1.8343.077±1.395极重度组158.113±0.9615.74±1.432F,P90.636,P<005102.421,P<005
二、患者治疗前后部分实验室指标的比较
各项指标在进行治疗前后对比时,治疗后跟治疗前相比,NLR、MPV、RDW、CRP、PCO2、CAT的均值都呈下降趋势,PO2、FEV1的均值呈上升趋势。
其中NLR、CRP、PO2、PCO2、FEV1、CAT这6项指标在治疗前后存在差异,具有显着的统计学意义(P<0.05)。说明通过治疗,慢阻肺患者体内的中性粒细胞/淋巴细胞比值降低、C-反应蛋白降低、动脉血二氧化碳分压减少、自我评估测试评分降低;通过治疗,患者体内的动脉血氧分压值增大,肺功能(FEV1%)明显改善,而MPV、RDW治疗后变化不明显,P>0.05。(见表3)。
三、治疗前不同分组患者部分实验室指标及临床参数的比较
1 不同发作频率患者部分实验室指标及临床参数的比较:频繁发作组患者NLR比率明显高于非频繁发作患者(P<0.05),而且PO2、PCO2、FEV1、CAT也与非频繁发作组存在显著差异(P<0.05);两组患者MPV、RDW、CRP差异不明显,P>0.05。(见表4)
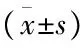
表3 治疗前、后部分实验室指标的比较
续表3
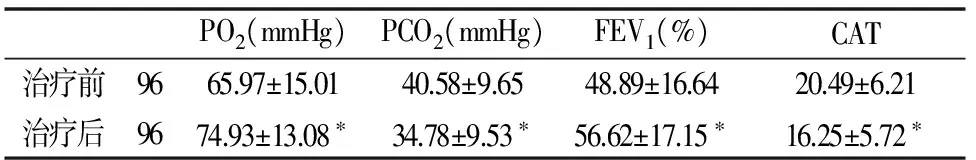
PO2(mmHg)PCO2(mmHg)FEV1(%)CAT治疗前9665.97±15.0140.58±9.6548.89±16.6420.49±6.21治疗后9674.93±13.08∗34.78±9.53∗56.62±17.15∗16.25±5.72∗
注:与治疗前相比,*P<0.05
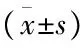
表4 不同发作频率患者部分实验室指标及临床参数的比较
(续表4)

组别nPO2(mmHg)PCO2(mmHg)FEV1(%)CAT非频繁发作组2973.48±13.2536.76±6.3469.1±7.3113.28±2.37频繁发作组6762.7±14.77∗42.2±10.38∗40.14±10.9∗23.61±4.52∗
注:与非频繁发作组比,*P<0.05
2 不同严重程度患者部分实验室指标及临床参数的比较:各项指标在进行严重程度的对比时,中度组、重度组、极重度组的组内两两比较中(F检验),NLR在不同严重度患者中存在显着差异(P<0.05),而PO2、PCO2、FEV1、CAT也在不同严重度患者中存在显着差异(P<0.05);而血小板平均体积(MPV)、红细胞分布宽度(RDW)、 C-反应蛋白(CRP)这几项指标在各组中差异不明显,P>0.05。(见表5)
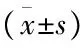
表5 不同严重程度患者部分实验室指标及临床参数的比较
续表5

组别nPO2(mmHg)PCO2(mmHg)FEV1(%)CAT中度4271.21±13.2436.93±5.6064.84±8.9915.07±3.54重度3963.15±16.2241.18±9.8540.82±5.6523.05±3.74极重度1558.67±12.56∗49.27±12.43∗25.22±3.37∗29.00±1.81∗
注:与严重程度组内相比,*P<0.05
四、所有患者治疗前部分指标间的相关关系
治疗前,NLR与CRP、发作频率正相关(相关系数分别为r=0.260,0.215,P<0.05);NLR与FEV1负相关(相关系数为r=-0.19,P=0.044<0.05,因FEV1数值越小,严重程度越重;数值越大,严重程度越轻);FEV1与CAT、发作频率、住院次数负相关(相关系数分别为r=-0.935,-0.854,-0.85,P<0.05或0.01),即第一秒用力呼气容积越大,肺功能指标越好,则患者的自我评估分数越低、病情发作频率越低、住院次数越少;CAT与发作频率和住院次数也分别显示正相关(相关系数r=0.866,0.806,P<0.01),即患者自我评估分数越高,则发作频率和住院次数随之也高;同时发作频率与住院次数(相关系数r=0.914)正相关。即发作频率越高,住院次数越多。而MPV与CRP、FEV1、CAT、发作频率、住院次数未显示相关性,P>0.05。(见表6)
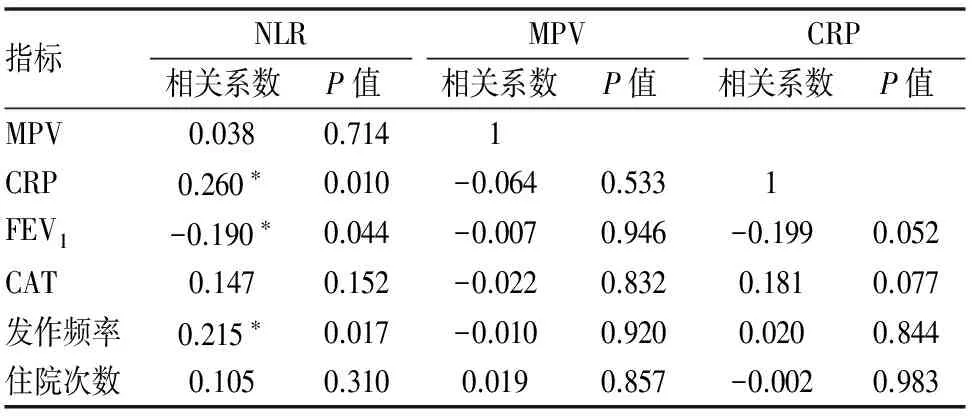
表6 治疗前部分指标间的相关关系
(续表6)
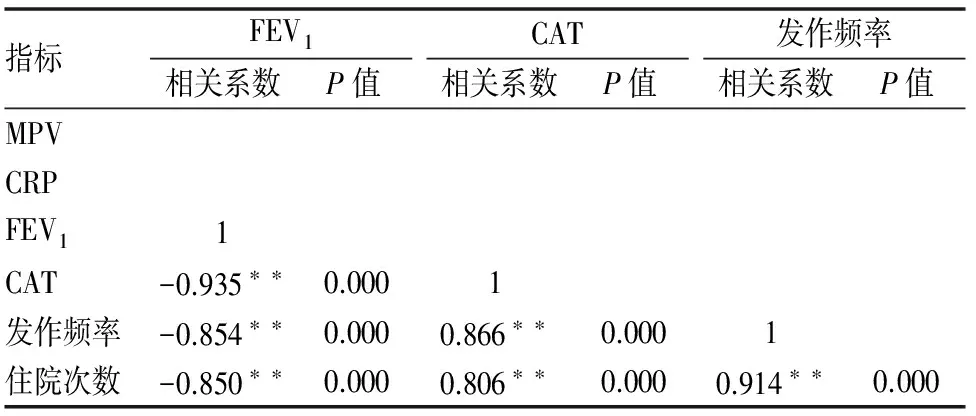
指标FEV1相关系数P值CAT相关系数P值发作频率相关系数P值MPVCRPFEV11CAT-0.935∗∗0.0001发作频率-0.854∗∗0.0000.866∗∗0.0001住院次数-0.850∗∗0.0000.806∗∗0.0000.914∗∗0.000
*在 0.05 水平(双侧)上显着相关。**在 0.01 水平(双侧)上显着相关。
讨 论
慢性阻塞性肺疾病临床特征之一在于反复急性发作,后者与肺功能加速恶化[6]、疾病负担和死亡率增加强烈相关;一些患者更易发生急性发作,故在慢阻肺预防策略中,预测发作风险、发作严重程度的重要性逐渐得到重视。迄今为止,预测未来恶化的最佳因子是先前发作史和FEV1下降[7]以及肺动脉高压的直接或间接指标。其他预测因子包括抑郁、胃食管反流病(GERD)和生活质量。然而这些指标不能反映慢阻肺的整体全貌尤其无法反映机体的病理生理状况,其中FEV1在一些重症患者难以检测。而可以预测慢阻肺急性加重的生物标记物包括易使用的血清生物标志物以支持慢阻肺患者分层或作为疾病进展和合并症的预测指标非常有限。因此,寻找具有识别发作预测潜力的“标志物”就必然重要,可以客观预测AECOPD的发作风险,也可预测病情的严重性。
炎症是慢阻肺的一个突出特征,慢阻肺患者疾病进展过程异质性明显[8],这可能是由于炎症水平的差异。肺部炎症反应伴随慢性低级别全身性炎症反应[9]。越来越多的证据表明,慢阻肺患者外周血全身炎症介质如C-反应蛋白(CRP)、肿瘤坏死因子α(TNF-α)、白介素(IL-) 8和IL-6升高[10]。目前尚不清楚全身炎症反应代表炎症介质从肺溢出或作为疾病的一个独立的系统组成部分。AECOPD通常被认为是这些潜在炎症过程的加剧,大量研究描述了AECOPD肺部炎症反应伴随全身性炎症反应增強[9];而频繁发作患者与非频繁发作患者比较全身炎症上升更急剧[11]。炎症标志物可能有助于确定高水平基础炎症和疾病快速进展的亚组患者[12],成为表征慢阻肺气道和全身性炎症程度的有用手段[13]。监测血循环炎症生物标志物水平可提供慢阻肺患者危险分层,反映疾病严重程度和对治疗的反应[14]。全身性炎症由生物标志物测定:C-反应蛋白(CRP)、白细胞和血纤维蛋白原,与合并症包括心血管疾病和肺癌风险增加2-4倍相关[15]。而CRP是其中最为广泛研究的一种标志物,既往研究显示,CRP与疾病严重程度、预后、急性加重及共患疾病风险相关[11,16]。然而应用CRP于慢阻肺的风险管理因其结果不一致和高度可变性极大降低了其临床应用价值[17-18]。最近,两种新的炎性标志物已引起重视,一种是中性粒细胞-淋巴细胞比率(NLR),另一种是血小板平均体积(MPV),因它们快速、廉价、容易测量的特点被认为是新的炎症标记物评估慢性炎症。
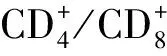
血小板是由骨髓巨核细胞产生的,是血液中体积最小的细胞,主要功能是凝血和止血作用,修补破损的血管。MPV是血小板平均体积的大小,是血小板的一个重要功能指标,由于血小板无细胞核,故其功能取决于骨髓巨核细胞内 DNA的含量,大体积的血小板含有更多的活性物质,其功能明显增强,故血小板体积的大小可反映骨髓巨核细胞增生能力。如果由于骨髓增生低下造成血小板减少,MPV可不变或减小,如果由于破坏增多而引起血小板减少,MPV可增大。MPV是一个广泛应用的反映血小板功能的标志物,可以反应不同慢性病的炎症程度[24-25]。有文献报道,MPV水平降低为慢阻肺炎症反应的标志物之一。国内有人[26]研究慢阻肺加重期患者MPV下降,而白细胞计数和中性粒细胞百分比增加,更重要的是加重期MPV与中性粒细胞百分比呈显着负相关,因此预测MPV下降提示患者炎症程度加重。
本研究结果我们观察到,急性加重期慢阻肺患者治疗前NLR明显升高,治疗后明显下降;而急性加重期慢阻肺患者治疗后MPV也明显下降,两者与CRP的变化一致。CRP主要反应组织损伤和炎症的敏感指标,当机体发生炎症、组织损伤、感染时CRP水平明显升高。它反应个体总的炎症程度,在慢阻肺稳定期和加重期升高[27]。慢阻肺患者急性加重期时,体内炎症反应激烈,中性粒细胞参与炎症反应,数量增多及凋亡减少,而淋巴细胞过度凋亡,导致两者出现不平衡,从而中性粒细胞-淋巴细胞比值(NLR)升高。因此NLR升高水平可以反应体内炎症反应程度,即NLR值越高,则体内炎症反应越强烈。而由于体内炎症反应干扰了骨髓巨核细胞并抑制血小板的释放,导致血小板减少,进而MPV减小或不变,因此MPV的降低提示患者炎症程度加重。本研究还发现,在急性加重期慢阻肺患者中,通过治疗,患者CRP明显下降,说明患者体内炎症水平下降,故NLR的下降与炎症程度一致,而既往研究认为, MPV水平与慢阻肺患者炎症程度呈负相关,本研究未能证明MPV能够反映慢阻肺的炎症程度,不能除外偏倚或样本量小可能。
本研究的另一发现是NLR对慢阻肺的发作风险具有预测价值,即在不同发作频率的患者中,NLR的比值越高,慢阻肺的发作风险越大,比值越低,发作风险越小。且NLR与患者严重程度呈正相关,即NLR比值越高,患者病情越严重,NLR越低,患者病情相对越轻。同时通过MPV的研究,发现MPV的变化对慢阻肺的发作风险和严重性没有预测价值。同样需要说明的是,由于缺少肺功能气流受限为轻度患者的临床资料及本研究为单中心资料,故本研究有关NLR、MPV在慢阻肺的发作风险、严重性预测过程中的作用,也需要更大样本、更加合理的研究方案进一步明确。
综上研究结果,我们认为 NLR 可作为评估 AECOPD 病情严重程度及预测急性发作风险的标志物,NLR 是一项操作简单、廉价及易于推广的指标,而MPV在AECOPD中的价值仍需进一步的探讨研究。
[1] Hurst JR.Evaluation of COPD Longitudinally to Identify Predictive Surrogate Endpoints (ECLIPSE) Investigators. Susceptibility to exacerbation in chronic obstructive pulmonary disease[J].N Eng J Med,2010,363(12):1128-1138.
[2] Cedrés S,Torrejon D,Martínez A,et al.Neutrophil to lymphocyte ratio (NLR) as an indicator of poor prognosis in stage IV non-small cell lung cancer[J].Clin Transl Oncol,2012,14(11):864-869.
[3] Günay E,Sarinc Ulasli S,Akar O,et al. Neutrophil-to-lymphocyte ratio in chronic obstructive pulmonary disease: a retrospective study[J].Inflammation,2014,37(2):374-380.
[4] Gasparyan AY,Sandoo A,Stavropoulos-Kalinoglou A,et al.Mean platelet volume in patients with rheumatoid arthritis : the effect of anti-TNF-alpha therapy[J].Rheumatol Int,2010,30(8):1125-1129.
[5] Wang RT,Li JY,Cao ZG,et al.Mean platelet volume is decreased during an acute exacerbation of chronic obstructive pulmonary disease[J].Respirology,2013,18(8):1244-1248.
[6] Halpin DM,Decramer M,Celli B,et al.Exacerbation frequency and course of COPD[J].Int J Chron Obstruct Pulmon Dis,2012,7:653-661.
[7] Bowler RP,Kim V,Regan E,et al.Prediction of acute respiratory disease in current and former smokers with and without COPD[J].Chest,2014,146(4):941-950.
[8] Casanova C,de Torres JP,Aguirre-Jaíme A,et al.The progression of chronic obstructive pulmonary disease is heterogeneous: the experience of the BODE cohort[J].Am J Respir Crit Care Med,2011,184(9):1015-1021.
[9] Sinden NJ,Stockley RA.Systemic inflammation and comorbidity in COPD: a result of 'overspill' of inflammatory mediators from the lungs? Review of the evidence[J].Thorax,2010,65(10):930-936.
[10] Tanni SE,Pelegrino NR,Angeleli AY,et al.Smoking status and tumor necrosis factor-alpha mediated systemic inflammation in COPD patients[J].J Inflamm(Lond),2010,7:29.
[11] Donaldson GC,Seemungal TA,Patel IS,et al.Airway and systemic inflammation and decline in lung function in patients with COPD[J].Chest,2005,128(4):1995-2004.
[12] Agustí A,Edwards LD,Rennard SI,et al.Persistent systemic inflammation is associated with poor clinical outcomes in COPD: a novel phenotype[J].PLoS One,2012,7(5):e37483.
[13] Suissa S,Dell’Aniello S,Ernst P.Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality[J].Thorax,2012,67(11):957-963.
[14] Vestbo J,Rennard S.Chronic obstructive pulmonary disease biomarkers for disease activity needed-urgently[J].Am J Respir Crit Care Med,2010,182(7):863-864.
[15] Shaw JG,Vaughan A,Dent AG,et al.Biomarkers of progression of chronic obstructive pulmonary disease(COPD)[J].J Thorac Dis,2014,6(11):1532-1547.
[16] Nural S,Günay E,Halici B,et al.Inflammatory processes and effects of continuous positive airway pressure (CPAP)in overlap syndrome[J].Inflammation,2013,36(1):66-74.
[17] de Torres JP,Pinto-Plata V,Casanova C,et al.C-reactive protein levels and survival in patients with moderate to very severe COPD[J].Chest,2008,133(6):1336-1343.
[18] Dickens JA,Miller BE,Edwards LD,et al.COPD association and repeatability of blood biomarkers in the ECLIPSE cohort[J].Respir Res,2011,12:146.
[19] Thomsen M,Ingebrigtsen TS,Marott JL,et al.Inflammatory biomarkers and exacerbations in chronic obstructive pulmonary disease[J].JAMA,2013,309(22):2353-2361.
[20] Tuder RM,Petrache I.Pathogenesis of chronic obstructive pulmonary disease[J].J Clin Invest,2012,122(11):4300.
[21] Okyay GU,?nal S,?ne? K,et al.Neutrophil to lymphocyte ratio in evaluation of inflammation in patients with chronic kidney disease[J].Ren Fail,2013,35(1):29-36.
[22] Caramori G,Pandit A,Papi A.Is there a difference between chronic airway inflammation in chronic severe asthma and chronic obstructive pulmonary disease?[J].Curr Opin Allergy Clin Immunol,2005,5(1):77-83.
[23] Williams TJ,Jose PJ.Neutrophils in chronic obstructive pulmonary disease[J].Novartis Found Symp,2001,234:136-141.
[24] Yazici S,Yazici M,Erer B,et al.The platelet indices in patients with rheumatoid arthitis:mean platelet volume reflects disease activity[J].Platelets,2010,21(2):122-125.
[25] Kisacik B,Tufan A,Kalyoncu U,et al.Mean platelet volume(MPV) as an inflammatory marker in ankylosing spondyitis and rheumatoid arthritis[J].Joint Bone Spine,2008,75(3):291-294.
[26] 李洪.平均血小板体积与慢性阻塞性肺疾病加重期的关系[J].成都医学院学报,2012,7(2):300-302,317.
[27] Kaczmarek P,Sladet K,Skucha W,et al.The influence of simvastatin on seleceted inflammatory markers in patients with chronic obstructive pulmonary disease[J].Pol Arch Med Wewn,2010,120(1-2):11-17.
Predictivevalueofneutrophil/lymphocyteratioandmeanplateletvolumeinCOPDexacerbationriskandseverity
WUChun-ming,CHENXing-wu.
DepartmentofRespiratoryMedicine,HuangshangPeople’sHospital,Huangshan,Anhui245000,China
ObjectiveTo explore the predictive value of NLR(neutrophil/ lymphocyte ratio) and MPV(mean platelet volume) in exacerbation risk and disease severity in chronic obstructive pulmonary disease (COPD) patients.Methods96 COPD patients with acute exacerbation were selected, aging from 40 to 70. They were divided into two groups according to exacerbation frequency (67 cases in the frequent group, and 29 cases in the non-frequent group) or into three groups according to the degree of lung function (42 cases in the moderate group, 39 cases in the severe group, and 15 cases in the very severe group). Patients were excluded if they used systemic corticosteroids within 30 days or had underlying other organ inflammatory diseases, autoimmune disease, blood disease. Blood routine, C-reactive protein, arterial blood gas, pulmonary function testing and CAT scores were performed and evaluated before and after treatment. Changes of NLR and MPV in each group were examined and compared. The relationship between retreatment NLR, MPV and arterial blood gas, CRP, pulmonary function and CAT scores was evaluated.Results1. NLR was significantly higher in the frequent group than in the non-frequent group (t=3.442,P=0.031<0.05), and there was no significant difference in MPV between the two groups (t=1.264,P=0.209>0.05). 2. There was significant difference in NLR between the moderate group and the very severe group (F=5.592,P=0.017<0.05), while MPV did not show any significant difference among the three groups (F=0.179,P=0.910>0.05). 3. NLR was positively correlated with CRP (r=0.26,P<0.05) and exacerbation frequency, while negatively correlated with FEV1(r=-0.39,P<0.05). There was no significant correlation of MPV with CRP, FEV1, and exacerbation frequency. 4. NLR and MPV were declined after the end of treatment, which indicated that systemic inflammatory response mitigated in COPD patients.Conclusion1. NLR has a positive predictive value for the onset of COPD exacerbation risk and severity. 2. There is no predictive value for MPV in the onset of COPD and disease?severity.
chronic obstructive pulmonary disease; neutrophil/ lymphocyte ratio; mean platelet volume; exacerbation risk; severity
10.3969/j.issn.1009-6663.2017.010.022
245000 安徽 黄山,黄山市人民医院呼吸内科
陈新无,E-mail:cxw0028@126.com
2017-02-15]

