酿酒酵母低渗敏感性突变株的选育
叶 菁 岳希洁 蒋雪薇, 罗晓明 陈代文 吴 健 李赤翎
(1. 长沙理工大学化学与生物工程学院,湖南 长沙 410004;2. 益阳职业技术学院生物与信息工程系,湖南 益阳 410600;3. 广东益鲜美生物科技有限公司,广东 清远 513300)
酿酒酵母低渗敏感性突变株的选育
叶 菁1岳希洁2蒋雪薇1,3罗晓明1陈代文3吴 健1李赤翎1
(1. 长沙理工大学化学与生物工程学院,湖南 长沙 410004;2. 益阳职业技术学院生物与信息工程系,湖南 益阳 410600;3. 广东益鲜美生物科技有限公司,广东 清远 513300)
为促进酿酒酵母胞内产物的有效释放,以其野生型二倍体(2n)菌株Y1为出发菌株,经紫外诱变处理,通过测定其胞外FDP浓度及核酸、蛋白质渗透率,对比各突变株在低渗条件下的自溶程度。结果表明:突变株Hs5*(n)低渗培养时,条件性自溶程度最高,其胞外FDP浓度达25.82 μg/mL,低渗培养6 h时,其核酸、蛋白质渗透率高达1.86,2.07。此外突变株Hs2*(n)、Hs1(2n)也具有较好的条件性自溶能力。试验共筛选获得3株低渗敏感性突变株,与野生型菌株相比,条件性自溶的低渗敏感性突变株能有效促进胞内大分子物质的外泌。
酿酒酵母;紫外诱变;低渗敏感性突变株;条件性自溶
Abstract: In order to improve the efficient secretion of intracellular product inSaccharomycescerevisiae, wild diploid Y1(2n) were mutagenized with UV treatment as original strain. To further identify, the degree of autolysis of each mutant strain was contrasted in low permeability condition by the test of its content of FDP, extra-cellular nucleic acids and proteins. The results showed: Hs5*(n)showed the highest degree of conditional autolysis in low permeability condition, the concentration of FDP in extracellular environment was 25.81 μg/mL. At the sixth hour in low permeability, its penetration rate of nucleic acid and protein in extracellular environment were 1.86 and 2.07, respectively. In addition, mutant strain Hs2*(n), Hs1(2n)also had a great extent of conditional autolysis capacity. These three low-permeability mutant strains obtained in this study possessed greater efficiency of intracellular product secretion contrast with wild strain.
Keywords:Saccharomycescerevisiae; UV mutagenesis; low-permeability mutant; conditional autolysis
酿酒酵母(Saccharomycescerevisiae)是生物技术领域最常用的真核外源基因表达系统[1],但其坚硬的细胞壁及细胞膜是阻碍胞内产物释放的主要屏障[2],因此如何促进胞内物质及外源蛋白的高效分泌成为研究热点。目前提高胞内物质释放的方法主要有物理法、化学法和生物法,其中物理法和化学法是目前最常采用的手段,这2种方法虽然效果明显但也存在着不足[3-5]。物理法以脉冲电场、超声波等方法为主,对仪器设备要求较高;化学法主要采用溶剂破碎,易导致蛋白质等大分子物质发生改变。此外,采用基因工程手段改造外源基因中的信号肽,增强外源蛋白的分泌能力也是研究的主流方向[6-7],但此法技术难度高、处理步骤复杂。
相比之下,采用传统的遗传育种方式筛选条件致死突变株显得更为安全、简便。条件致死突变株的突变位点经常发生在细胞壁(膜)的相关基因上,导致其在相应的条件下细胞通透性增大,从而促进细胞发生自溶,使细胞内物质释放到胞外[8]。目前,常见的条件致死酵母菌株主要有三类:温度敏感突变株[8]、高渗胁迫突变株[9]以及低渗敏感突变株[10]。课题组[11]前期研究过程中以酿酒酵母Y1为出发菌株,诱变选育出一株温度敏感突变酵母菌Ts4,37 ℃培养时其胞内大分子物质分泌能力明显提升,证明了条件致死突变株能有效释放胞内产物。基于此,本研究拟继续对酿酒酵母Y1进行诱变处理,采用等渗、低渗培养基对比培养进行初筛,再以胞外1、6-二磷酸果糖(Fructose-1, 6-diphosphate, FDP)浓度及胞内蛋白质、核酸渗透率为复筛指标,筛选出具有高蛋白外泌水平的低渗敏感性突变株(Hypotonic-sensitive mutant, Hs),旨在丰富酿酒酵母条件致死菌株类型,并为快速构建有效释放胞内产物的宿主系统提供更为简单有效的方法。
1 材料与方法
1.1 材料
1.1.1 菌种
酿酒酵母菌(Saccharomycescerevisiae)Y1:长沙理工大学食品与发酵研究所分离并保藏。
1.1.2 培养基
活化斜面培养基:麦芽汁培养基[12]242;
生孢子培养基:Meclary培养基[12]244;
种子培养基:YEPD培养液[13];
YEPDK培养基:YEPD培养基中添加4.5% KCl;
YEPDS+K培养基:YEPD培养基中添加4.5% KCl和0.004%十二烷基磺酸钠(SDS);
YEPS培养基:用蔗糖代替YEPD培养基中的葡萄糖;
YEPDS培养基:YEPD培养基中添加0.004%十二烷基磺酸钠(SDS);
发酵培养基:在YEPDS培养液中添加0.2% MgCl2。
1.1.3 仪器
显微成像系统:Eclipse E200型,尼康仪器(上海)有限公司;
紫外分光光度计:UV1800型,日本岛津公司;
恒温振荡培养箱:ZWY-2102C型,上海智城分析仪器制造有限公司;
高速离心机:台式TGL-16G型,常州诺基仪器有限公司。
1.2 方法
1.2.1 菌悬液的制备 菌株Y1在28 ℃、160 r/min下培养12 h,无菌生理盐水离心洗涤3次,制成108CFU/mL的菌悬液备用。
1.2.2 紫外诱变及突变株的筛选 根据文献[11],对Y1菌的二倍体(2n)及单倍体(n)菌悬液进行紫外诱变,将诱变后的酵母菌悬液梯度稀释,影印接种于YEPDK、YEPDS平板上,28 ℃、培养48 h。挑选在YEPDK上正常生长,而在YEPDS上微生长或不生长的突变株进入复筛;取初筛挑选的菌株依次接种于YEPD、YEPDK、YEPDS、YEPS、YEPDS+K平板上,再次筛选低渗透压时微生长或不长的菌株[2]。
1.2.3 FDP含量的测定 参考文献[14],并采用血球计数板计算发酵液菌体浓度,以每毫升发酵液中107个细胞计算FDP含量。
1.2.4 酵母核酸、蛋白质渗透率的测定 取筛选获得的突变株依次进行活化、种子培养基培养、发酵培养基培养(培养3 h时添加SDS 0.04 g/L)。取两份发酵液,其中一份采用紫外分光光度法直接测定菌体密度(OD600),另一份先80 ℃水浴 5 min,再10 000 r/min离心20 min,取上清液,分别测定OD260、OD280,按式(1)、(2)计算胞外核酸渗透率(LD260)、蛋白质渗透率(LD280)。
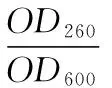
(1)

(2)
2 结果与讨论
2.1 酵母子囊孢子的制备
通常条件下酵母细胞以二倍体的形式存在,进行出芽生殖,但在特殊条件诱导下(以醋酸钠为唯一碳源,缺乏氮源),可以进行有性繁殖,产生2~4个单倍体有性孢子[15],即子囊孢子,酿酒酵母产生的子囊孢子是人工选育优良杂交酵母菌株的重要基因纯核系来源[16]。将酿酒酵母Y1二倍体(2n)接种于麦氏培养基上培养一周,筛选获得其单倍体(n),并通过显微镜下观察,检验其二倍体生孢子情况,孔雀绿—番红染色后见图1。可以看出,在麦氏培养基上培养时,Y1二倍体(2n)营养细胞易转变生成子囊,这时细胞核进行减数分裂,形成子囊孢子。

图1 酿酒酵母Y1子囊孢子染色图(100×)
2.2 低渗敏感性突变株的筛选及生长特征鉴定
酿酒酵母的营养体多以二倍体(2n)的形式存在,但其单倍体(n)的突变率相对较髙,且单倍体(n)突变株经重新结合形成二倍体(2n)后,诱变所获得的性状才能较稳定地遗传下去[17]。因此,同时以酵母二倍体(2n)、单倍体(n)为出发菌株,采用紫外线对菌株Y1的二倍体(2n)及单倍体(n)菌株分别照射30 s,4.5 min,利用影印培养法对等渗及低渗条件下菌株的生长状况进行对比初筛,获得低渗敏感性突变株,结果见图2及表1、2。由图2可知,圆圈标出的突变株在等渗培养条件下(YEPDK培养)生长正常,但在低渗培养条件下(YEPDS培养)生长微弱甚至无法生长;表1、2显示,根据等渗平板与低渗透平板菌落生长对照情况,筛选出8株二倍体(2n)、7株单倍体(n)低渗敏感性突变株。

表1 酿酒酵母二倍体(2n)突变菌株生长谱†
† Y1为出发菌株;“-”为不生长;“+/-”为生长微弱;“+”为正常生长;“++”为生长旺盛。

表2 酿酒酵母单倍体(n)突变菌株生长谱†
† Y1为出发菌株;“-”为不生长;“+/-”为生长微弱;“+”为正常生长;“++”为生长旺盛。
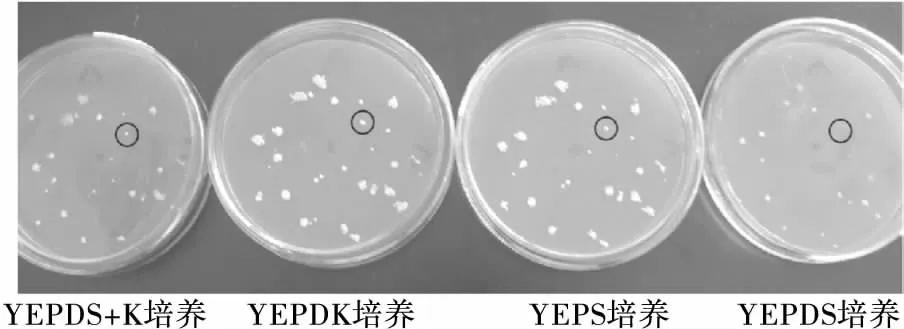
图2 影印培养筛选低渗敏感性突变株
低渗培养基(YEPDS)中添加了表面活性剂十二烷基硫酸钠(SDS),SDS能形成低渗环境,并作用于细胞膜上的脂类和蛋白质,促进胞内物质释放到胞外,进而引起酵母细胞的自溶[18]。由表1、2可知,出发菌株Y1(2n,n)在等渗培养基(YEPDK)、等渗保护培养基(YEPDS+K)、低渗培养基1(YEPS)及低渗培养基2(YEPDS)中均能生长,说明其不具有低渗敏感性。而Hs1、Hs2*、Hs5* 3株突变株在YEPDK上均生长旺盛,在低渗培养基(YEPDS)上则生长被抑制,且当在低渗培养基中添加4.5%氯化钾(YEPDS+K)后3株突变株的生长均得到部分恢复,因此选择突变株Hs1、Hs2*、Hs5*作进一步分析。对比发现,Hs1、Hs2*、Hs5*存在一些特性差异,在酵母菌常规培养基(YEPD)上,Hs1、Hs2*生长状况一般,而Hs5*生长茂盛,说明常规条件下Hs5* 更易繁殖;在低渗条件相对较弱的培养基(YEPS)上Hs1、Hs5*生长微弱,而Hs2*则正常生长,说明Hs1、Hs5*的渗透压敏感性强于Hs2*,因此,初步推测Hs1、Hs2*、Hs5*为低渗敏感性突变株,且Hs5*在低渗时更易发生自溶。
2.3 低渗敏感性突变株自溶程度考察
2.3.1 低渗敏感性突变株胞外FDP测定 FDP是酵母细胞内糖酵解途径中的中间产物,由于其不断参与代谢反应所以存在时间非常短。正常情况下,未经处理的细胞其通透性较差,FDP在胞外很难得到积累[19],而低渗敏感性突变株在低渗条件下细胞的通透性发生改变,培养液中 FDP 的浓度升高,因此FDP是衡量酵母细胞低渗敏感程度的重要指标。测定酿酒酵母及其突变株在低渗条件下培养2 h时的菌体浓度及其胞外FDP浓度,菌体浓度以数量级107个为单位,计算出FDP在发酵液中的浓度,结果见图3、4。由图3可知,在酿酒酵母二倍体突变株中,Hs1胞外FDP含量最高,为出发菌株的1.55倍,说明二倍体突变株中Hs1的渗透压敏感性最强。由图4可知,在酿酒酵母单倍体突变株中,Hs2*、Hs5*的胞外FDP浓度明显高于其它菌株,分别为出发菌株的1.94、2.37倍。由图3、4可以确定Hs1、Hs2*、Hs5* 3株突变株为低渗敏感性突变株,其中Hs5*低渗敏感性最强,其细胞外FDP浓度达25.82 μg/mL。
2.3.2 低渗敏感性突变株核酸、蛋白质胞外渗透率测定 正常情况下难以分泌到胞外的大分子物质核酸、蛋白质渗透率也是可以衡量酵母细胞自溶程度的重要指标。对比分析添加SDS前后突变株Hs1、Hs2*、Hs5* 以及发菌株Y1的核酸、蛋白质渗透率,结果见图5、6。由图5、6可知,突变株Hs1、Hs2*、Hs5* 核酸、蛋白质渗透率均明显大于出发菌株,说明紫外诱变导致突变株的细胞壁/膜结构发生改变,当其处于低渗环境时会出现适度自溶,因此胞外大分子物质含量增大。此外从图5、6还可以看出,出发菌株Y1在添加SDS前后的核酸、蛋白质渗透率变化很小,而突变株核酸、蛋白质的渗透率随着添加SDS发酵时间的延长而越来越高,其原因是突变株在低渗环境中生长微弱,同时细胞溶胀作用引起了膜不可逆的破坏,促进核酸、蛋白质等物质的外泌[20]。其中Hs5* 大分子渗透率最大,发酵6 h时,其胞外核酸、蛋白质渗透率分别达2.07,1.86,为出发菌株的3.22倍及3.64倍。由此证明突变株Hs1、Hs2*、Hs5*属于具有大分子外泌能力的低渗敏感性突变株,且Hs5*在低渗条件下展现出最强的外泌特性。

图3 二倍体突变株胞外FDP浓度
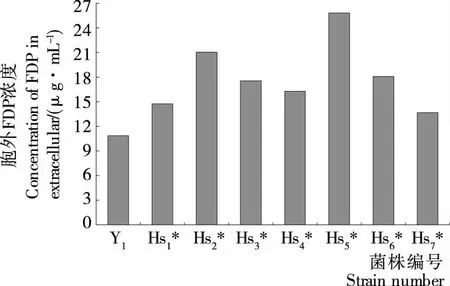
图4 单倍体突变株胞外FDP浓度

图5 突变株核酸渗透率

图6 突变株蛋白质渗透率
3 结论
酿酒酵母作为外源基因最理想的真核生物表达系统,其细胞通透性对胞内产物的有效释放具有重要意义。通过简单的诱变处理,利用低渗培养基定向筛选出3株低渗敏感性自溶突变株,即Hs1、Hs2*、Hs5*。对比其低渗条件下自溶程度可以发现:Hs5*突变株自溶程度最高,其胞外FDP浓度达25.82 μg/mL,为出发菌株的2.37倍,核酸及蛋白质渗透率分别为2.07,1.86,为出发菌株的3.22倍及3.64倍,可以较大程度地提高酿酒酵母对外源蛋白的分泌能力。将低渗敏感突变株Hs5*与前期筛选的温度敏感突变株Ts4对比分析发现Hs5*具有更强的胞内物质释放能力。
温度和渗透压在微生物培养中都是易于控制的条件,筛选对渗透压、温度敏感性强的目标菌株,有利于简化胞内产物的提取工艺,为其工业化应用奠定基础。
[1] 何秀萍. 国内酿酒酵母分子遗传与育种研究40年[J]. 微生物学通报, 2014, 41(3): 450-458.
[2] 何秀萍, 刘增然, 刘春秀, 等. 酵母菌细胞自溶突变株的研究[J]. 微生物学报, 2003, 43(2): 283-287.
[3] GANEVA V, GALUTOV B, TEISSIE J. High yield electroextraction of proteins from yeast by a flow process[J]. Analytical Biochemistry, 2003, 315(1): 77-84.
[4] FONSECA R A S, RAFAEL R S, KALIL S J, et al. Different cell disruption methods for astaxanthin recovery byPhaffiarhodozyma[J]. African Journal of Biotechnology, 2011, 10(7): 1 165-1 171.
[5] ROLLINI M, MUSATTI A, MANZONI M. Production of glutathione in extracellular form bySaccharomycescerevisiae[J]. Process Biochemistry, 2010, 45(4): 441-445.
[6] 暴立娟, 宋庆凤, 李杰. 重组木聚糖酶的安全高效表达与应用研究[J]. 食品工业科技, 2011(1): 156-158.
[7] SUDA Y, RODRIGUEZ R K, COLUCCIO A E, et al. A screen for spore wall permeability mutants identifies a secreted protease required for proper spore wall assembly[J]. PLoS One, 2009, 4(9): e7 184.
[8] 郭科, 周兵. 酵母Ndilp突变表达文库的建立和温度敏感株的筛选[J]. 中国生物化学与分子生物学报, 2012, 28(10): 966-970.
[9] 彭郦, 曾新安. 高糖胁迫对生长期酿酒酵母生理代谢的影响[J]. 现代食品科技, 2011, 27(4): 397-399.
[10] SHIMIZU J, YODA K, YAMASAKI M. The hypo-osmolarity-sensitive phenotype of theSaccharomycescerevisiaehpo2 mutant is due to a mutation inPKC1, Which regulates expression ofβ-glucanase[J]. Mol Gen Genet, 1994, 242: 641-648.
[11] 岳希洁, 蒋雪薇, 罗晓明, 等. 酿酒酵母温度敏感性突变株的选育[J]. 食品与机械, 2016, 32(8): 9-12.
[12] 沈萍, 陈向东. 微生物学实验[M]. 4版. 北京: 高等教育出版社, 2007: 242-244.
[13] 杜连祥, 路福平. 微生物学实验技术[M]. 北京: 中国轻工出版社, 2006: 355.
[14] 王迎辉, 卢晓霆, 常启龙. 啤酒废酵母制备1,6-二磷酸果糖的研究[J]. 食品科技, 2008, 33(11): 231-233.
[15] STRATHEN J N, JONES E W, BROACH J R. The molecular biology of the yeastSaccharomyces: Life cycle and inheritance[M]. New York: Cold Spring Harbor Laboratory Press, 1981: 43-48.
[16] 严小琼, 黄思思, 覃香香, 等. 热带假丝酵母产生子囊孢子的条件及单倍体分离的研究[J]. 基因组学与应用生物学, 2013, 32(2): 201-206.
[17] 龚熠, 伍时华, 易弋, 等. 酿酒酵母子囊孢子单倍体形成和制备的研究[J]. 中国酿造, 2011(9): 80-84.
[18] 李祥, 彭莉, 王毅, 等. 酵母自溶研究[J]. 中国酿造, 2001(5): 17-19.
[19] 王镜岩, 朱圣更, 徐长法. 生物化学[M]. 北京: 高等教育出版社, 2002: 63-65.
[20] 冀照君, 孙波, 迟玉杰, 等. 方波脉冲电穿孔法提高酵母菌细胞通透性的条件优化[J]. 食品科学, 2010, 31(15): 50-54.
Breeding of low-permeability sensitive mutant from Saccharomyces cerevisiae
YE Jing1YUEXi-jie2JIANGXue-wei1,3LUOXiao-ming1CHENDai-wen3WUJian1LIChi-ling1
(1.SchoolofChemical&BiologicalEngineering,ChangshaUniversityofScience&Technology,Changsha,Hunan410004,China; 2.CollegeofBiological&InformationEngineering,YiyangVocationa&TechnicallCollege,Yiyang,Hunan410600,China; 3.GuangdongYixianmeiBIO-SCICo.,Ltd,Qingyuan,Guangdong513300,China)
10.13652/j.issn.1003-5788.2017.08.006
长沙市科技计划重点项目 (编号:K1403029-11);清远市科技计划项目(编号:2013A024,2014A023);湖南省水生资源食品加工工程技术研究中心开放基金项目(编号:2015GCZX07)
叶菁,女,长沙理工大学在读硕士研究生。
蒋雪薇(1972—),女,长沙理工大学副教授,硕士生导师,博士。E-mail:jxw_72@sina.com 李赤翎(1966—),女,长沙理工大学教授,硕士生导师,博士。E-mail:baiweili2005@163.com
2017—05—24

