β -环糊精衍生物/Cu2O毛细管电色谱整体 柱的制备及其应用
李英杰, 尹丽娟, 高立娣, 吕仁江, 刘树仁, 王 宁, 崔丽燕
(齐齐哈尔大学化学与化学工程学院,黑龙江齐齐哈尔 161006)
毛细管电色谱(CEC)是一种高效、快速的微分离技术,该方法结合高效液相色谱(HPLC)的高选择性和毛细管电泳(CE)的高效性,近几年得到了广泛的关注[1 - 2]。CEC中使用最广泛的手性固定相为β-环糊精(β-CD)及其衍生物[3]。由于天然β-CD受到键合能力和水溶性等物理化学性能的限制,使其在手性分离上有一定的局限性。然而,对β-CD进行化学修饰,通过在其原有结构上引入新的基团,可以改善其水溶性并增强对手性化合物的拆分能力[4]。因此,β-CD及其衍生物被广泛应用于分离领域[5 - 7]。近年来,改性β-CD电色谱整体柱成为研究热点,其优点在于制备方法简单、柱效高、柱子牢固稳定,结合CEC的高分离效率、分析速度快、检测灵敏度高和应用范围广泛等特点,特别适合于高沸点、大分子、强极性和热稳定性差的化合物的分离分析[8 - 9]。
纳米金属氧化物具备比表面积大、易于改性、生物相容性好等特点,在制备色谱分离介质方面已经显出强大的优势[10 - 12]。其中,Cu2O不仅具有纳米材料的优点,而且其结构内部还有用来容纳一定尺寸大小分子的空间[13],这种特有的内部空间会协同β-环糊精改善分离性质。本文制备了烯丙胺-β-环糊精/Cu2O(Ally-β-CD/Cu2O)毛细管电色谱整体柱,其机械强度高,通透性好,骨架分布均匀,柱效高,是一种性能较好的杂化整体柱。毛细管电色谱中有机-无机杂化整体柱比无机硅胶整体柱和有机聚合物整体柱更优越,更具发展前景。
1 实验部分
1.1 仪器与试剂
HP3DCE型毛细管电泳仪(美国,安捷伦公司);P200Ⅱ型高压恒流泵(大连依利特分析仪器公司);D8型X-射线衍射仪(XRD)(德国,Bruker-axs公司);250X型X-射线光电子谱仪(XPS)(美国,Thermo公司);S-4300型扫描电子显微镜(SEM)(日本,日立公司);Nicolet 380型傅立叶红外光谱仪(美国,热电公司)。
甲基丙烯酸-三甲基硅烷丙酯(γ-MAPS)、乙二醇二甲基丙烯酸酯(EDMA)、甲基丙烯酸缩水甘油酯(GMA)(上海阿拉丁试剂公司);偶氮二异丁腈(AIBN)和2-丙烯酰胺基-2-甲基-1-丙磺酸(AMPS)(美国Flake公司);二甲基亚砜(DMSO)、正十二醇(分析纯,天津科密欧试剂公司);对甲苯磺酰氯、烯丙胺(分析纯,上海阿拉丁试剂公司);3-(异丁烯酰氧)丙基三甲基硅烷(KH570)(分析纯,上海阿拉丁试剂公司);D,L-组氨酸(生化试剂,上海阿拉丁试剂公司);盐酸克伦特罗标准品(中国药品生物制品检定所)。实验用水均为超纯水。
1.2 实验方法
1.2.1环糊精衍生物的制备两步合成烯丙胺-β-环糊精(Ally-β-CD)。首先,制备磺酰化-β-环糊精(6-OTs-β-CD)[14]:β-CD 5.13 g溶于3.05 g NaOH溶液中,加入对甲苯磺酰氯1.68 g,冷水浴搅拌5 h。反应结束后过滤,滤液调节pH至6~7,得到白色沉淀。50 ℃真空干燥8 h,得到6-OTs-β-CD。Ally-β-CD[15]合成:称取1.97 g 6-OTs-β-CD与50 mL烯丙胺混合溶液在70 ℃水浴中反应8 h。产生的黄色溶液冷却至室温,加入30 mL甲醇稀释,加入沉淀剂乙腈得到白色沉淀。50 ℃真空干燥12 h,得到Ally-β-CD。
合成Ally-β-CD/Cu2O[16]过程如下:0.1 mol/L 50 mL CuSO4·5H2O与0.1 mol/L 100 mL NaOH溶液混合,机械搅拌,剧烈搅拌的情况下加入1.97 g Ally-β-CD/(100 mL)丙酮溶液以及3 mL N2H4溶液,搅拌2 h,待反应结束后离心15 min,得到红棕色沉淀,50 ℃真空干燥24 h,获得Ally-β-CD/Cu2O。
1.2.2整体柱的制备将35 cm的毛细管分别用1 mol/L HCl冲洗30 min、水冲洗30 min、1 mol/L NaOH溶液冲洗1 h,两端封口反应6 h,水冲洗30 min,甲醇冲洗20 min,再用N2吹干。将VKH570∶V丙酮=1∶1注入毛细管中两端封口,室温反应24 h。甲醇冲洗,氮气吹干,备用。
称取GMA 0.1500 g,EDMA 0.1000 g,环己醇0.1000 g, 正十二醇0.2200 g,AIBN 0.0018 g,AMPS 0.0016 g和Ally-β-CD/Cu2O 0.0500 g,以及2 mL DMSO,超声混匀。将混合物填充入预处理过的毛细管中,填料部分26.0 cm。两端封口,50 ℃水浴反应14 h后,依次用甲醇和超纯水冲洗。
1.3 色谱条件
流动相:5 mmol/L NaH2PO4(pH=8.50),柱温:20 ℃,工作电压:10 kV,正极进样:10 kV×5 s,检测波长:200 nm
2 结果与讨论
2.1 合成衍生物红外光谱分析
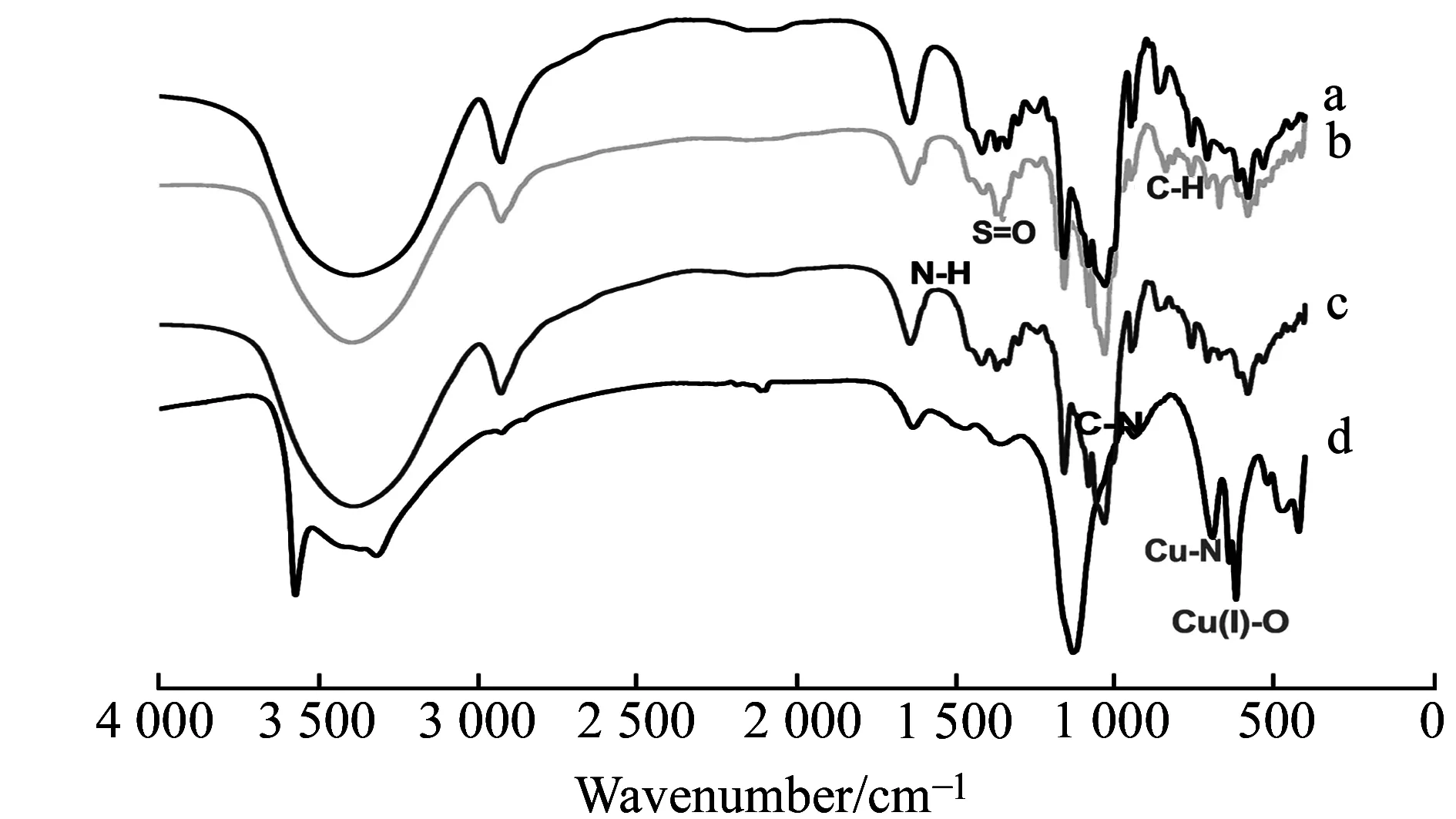
图1 环糊精衍生的红外光谱图Fig.1 Infrared spectra of cyclodextrin derivatives a.β -CD;b.6-OTs-β -CD;c.Ally-β -CD;d.Ally-β -CD/Cu2O.
为了确定β-CD衍生物合成是否成功,采用红外光谱进行分析,其结果如图1。图中曲线(b)与(a)相比,保持了β-CD的特征吸收,又引入了1 365 cm-1处的S=O 双键伸缩振动吸收峰,以及845 cm-1处的 C-H 伸缩振动吸收峰。存在S=O双键伸缩振动吸收峰,确定衍生物为6-OTs-β-CD;曲线(b)与(c)相比,引入了1 080 cm-1C-N键伸缩振动吸收峰及1 571 cm-1处的N-H伸缩振动吸收峰,确定合成的衍生物为Ally-β-CD。曲线(c)与(d)相比,引入了691 cm-1的Cu-N 键的伸缩振动吸收峰及638 cm-1的Cu(Ⅰ)-O伸缩振动吸收峰,确定合成的衍生物为Ally-β-CD/Cu2O。
2.2 整体柱制备条件优化
2.2.1功能单体比例的优化以Ally-β-CD/Cu2O和GMA作为功能单体,当m(Ally-β-CD/Cu2O)∶m(GMA)=0.0500 g∶0.0900 g时,所得的整体柱在高压恒流泵压力为 20 MPa 时,用甲醇冲洗整体柱,流速为20 μL/min(未键合的空毛细管柱同压下流速为35 μL/min),柱子通透性较好,柱内固定相的机械强度达到最佳。
2.2.2聚合温度的优化依据原位聚合反应机理的阐述[16],温度影响引发剂在聚合反应中的分解速度,从而影响固定相的孔径大小及机械强度。考察了反应温度为20、30、40、50、60 ℃的整体柱内键合的不同情况。在高压恒流泵压力为 20 MPa 时,20 ℃ 条件下,甲醇流速为 30 μL/min 近似空柱,表明柱内孔径过大,聚合物脱离柱壁;而 60 ℃时,流速仅为10 μL/min,柱内聚合物质地致密。聚合反应温度在 50 ℃时,甲醇流速为 20 μL/min,柱内孔径大小适中、通透性好。因此确定制备整体柱的聚合温度为50 ℃。
2.2.3聚合时间的优化聚合时间对整体柱内固定相的键合情况有重要的影响。聚合时间少,固定相键合情况不佳,溶质的保留较小;聚合时间过长时,溶质的保留较大,柱内固定相过于致密,柱子的通透性下降,考察了8、10、12、13、14、15、16 h不同聚合时间。实验表明,聚合时间在8 h,甲醇流速为30 μL/min,近似空柱,显微镜下观察没有聚合;聚合时间在 14 h时,甲醇流速为 20 μL/min左右,柱子的通透性好,固定相键合情况良好。因此确定制备整体柱的聚合时间为14 h。
2.3 毛细管电色谱整体柱柱内固定相的表征
2.3.1整体柱的扫描电镜表征运用扫描电镜(SEM)观察了整体柱固定相的形貌,如图2所示。图2a为整体柱柱内固定相的截面图,从图中可以看出整体柱内部颗粒键合紧密,分布均匀,互穿成网络结构,有较大的孔径,使毛细管整体柱具有良好的通透性。图2b为整体柱柱内固定相的局部截面图,从图中可以看出整体柱内固定相与毛细管内壁键合紧密,增加了整体柱的机械强度,使之能够承受较大的柱压。

图2 整体柱固定相扫描电镜(SEM)图 Fig.2 SEM images of stationary phase in monolithic column a.cross-section,b.a part of cross-section.
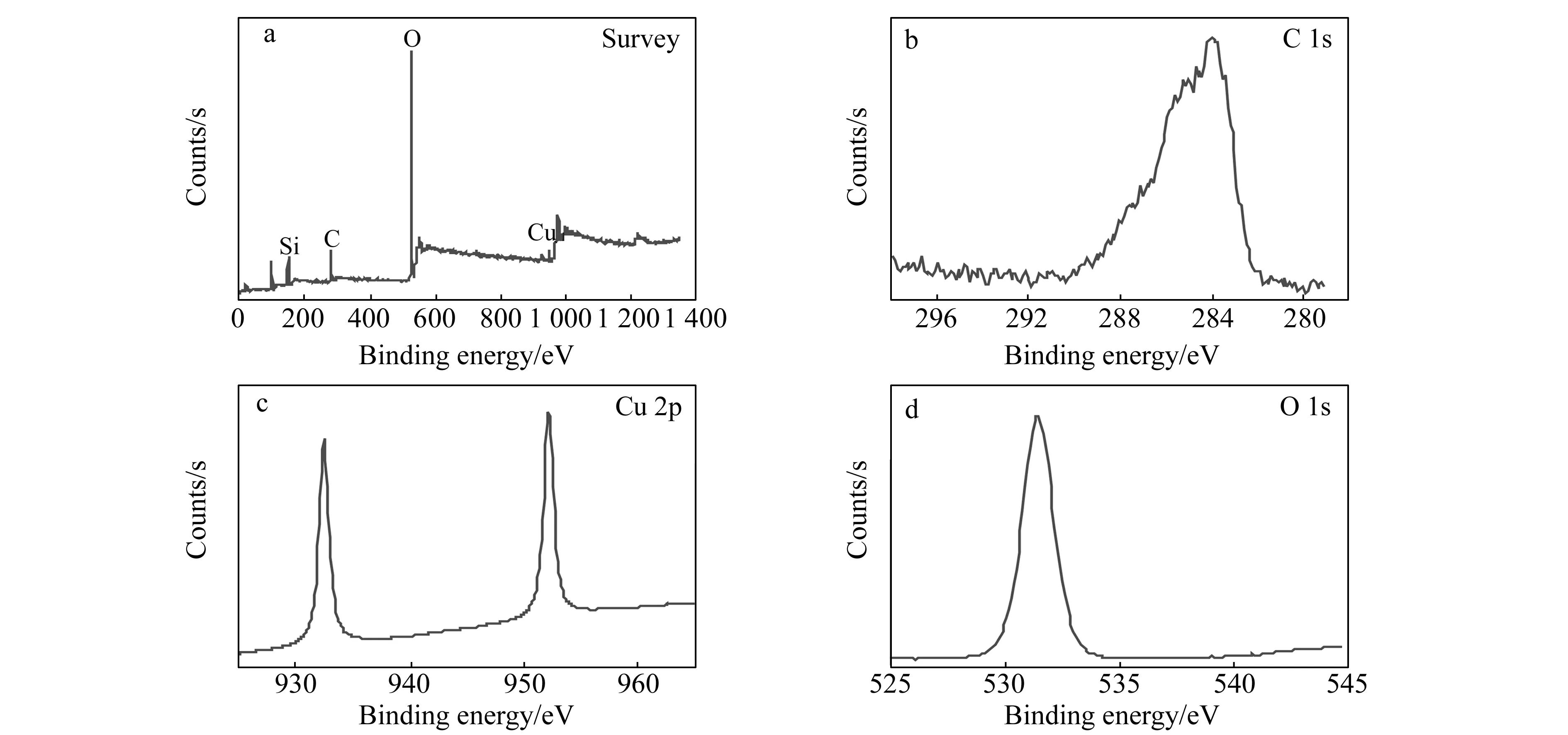
图3 柱内固定相 X-射线光电子能谱(XPS)Fig.3 X-ray photoelectron spectroscopy(XPS)
2.3.2X-射线光电子能谱表征图3为制备的整体柱固定相的X-射线光电子能谱(XPS)表征,图3a为整体柱内固定相的全谱表征,通过XPS全谱可以表明整体柱柱内固定相中含有C、O、Si、Cu 4 种元素。图3b为C1s X-射线能谱表征图,以C1s能谱为标准,图3c为Cu的2p X-射线能谱表征图,图中表明Cu信号在932.6和952.2 eV,分别为Cu的2p3和铜的2p1X-射线能谱峰,通过与XPS标准谱图对比与Cu2O中Cu的2p轨道能谱峰相符。图3d为O1s X-射线能谱表征图,与Cu2O中的O的结合能相符,因此可以证明制备的整体柱内存在Cu2O。
2.3.3X-射线衍射表征通过对整体柱内固定相的XPS表征图3C中可以看出在932.6 eV处有Cu信号出现,表明存在Cu 或Cu2O物质[17]。因为Cu 2p3/2 XPS不能分出Cu和Cu2O之间区别。使用X-射线衍射(XRD)来确认Cu(Ⅰ)的存在。对整体柱内固定相进行XRD表征,从图4中可以看出没有出现Cu的特征衍射峰,Cu(Ⅰ)出现衍射峰值同国际标准卡片(05-0667)衍射特征峰值相同,证明整体柱内固定相中含有Cu2O。
2.4 整体柱的性能研究
以5 mmol/L NaH2PO4溶液(pH=8.50)为缓冲溶液,在分离电压为10 kV,柱温为20 ℃,检测波长为200 nm的毛细管电色谱条件下,以硫脲为中性标记物连续5次重复进样测定,计算其保留时间的相对标准偏差(RSD)为2.7%,柱效达到47 658N/m。同时应用于分离组氨酸(D,L构型通过单独分析L型氨基酸进行定性),由图5可以看出组氨酸的分离度Rs达到3.82,组氨酸的单一对映体保留时间(ta,tb)的RSD分别为1.31%,0.79%。说明该整体柱具有手性分离能力。该柱在连续使用 72 h 或间歇使用2个月后仍具有良好的分离能力,表明该整体柱具有较好的重现性和稳定性。
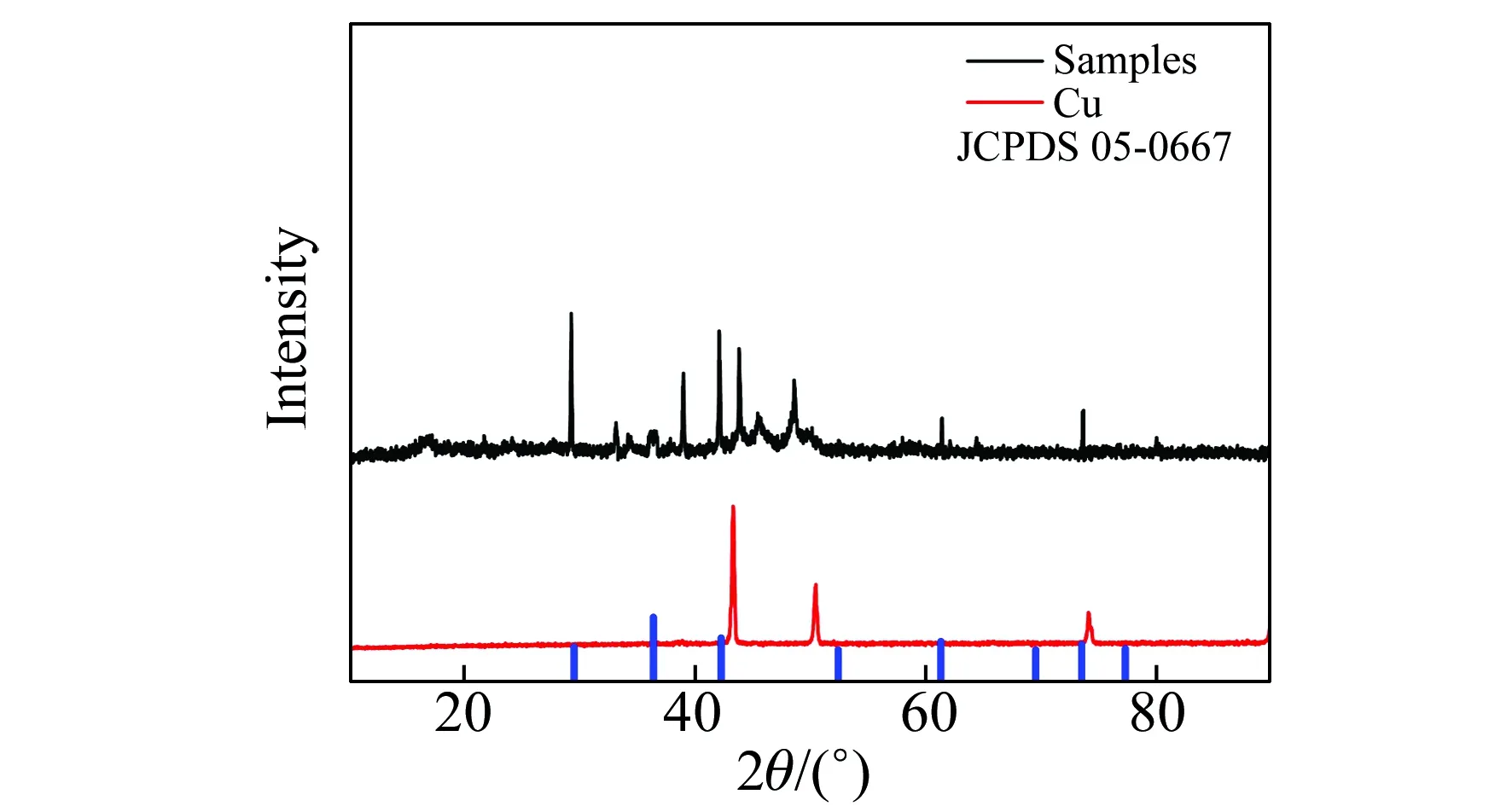
图4 柱内固定相X-射线衍射(XRD)图Fig.4 XRD of Tungesten oxide
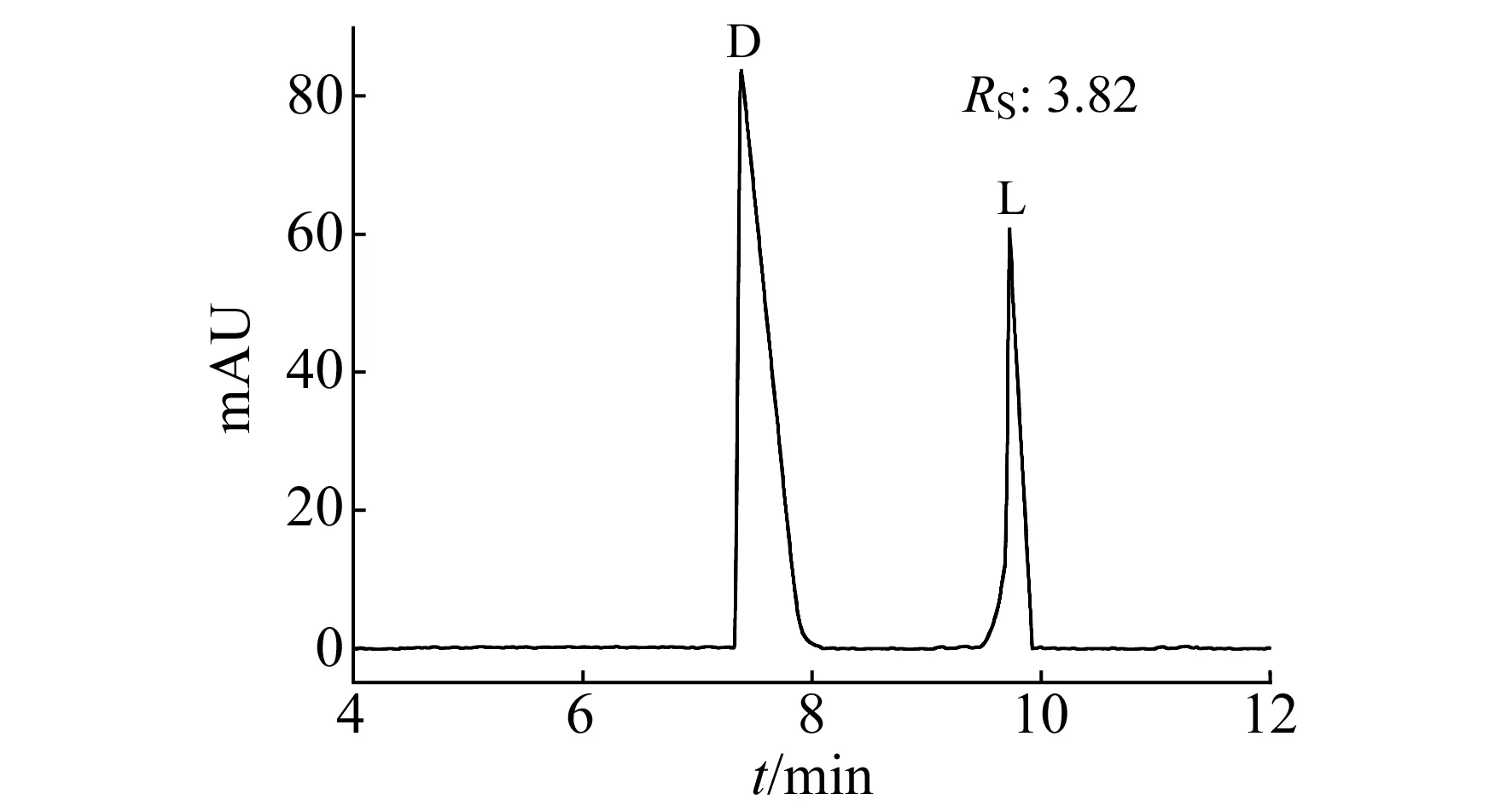
图5 D,L-组氨酸电色谱分离图Fig.5 Electrochromatographic spectrum of D,L-histidine
2.5 整体柱的应用
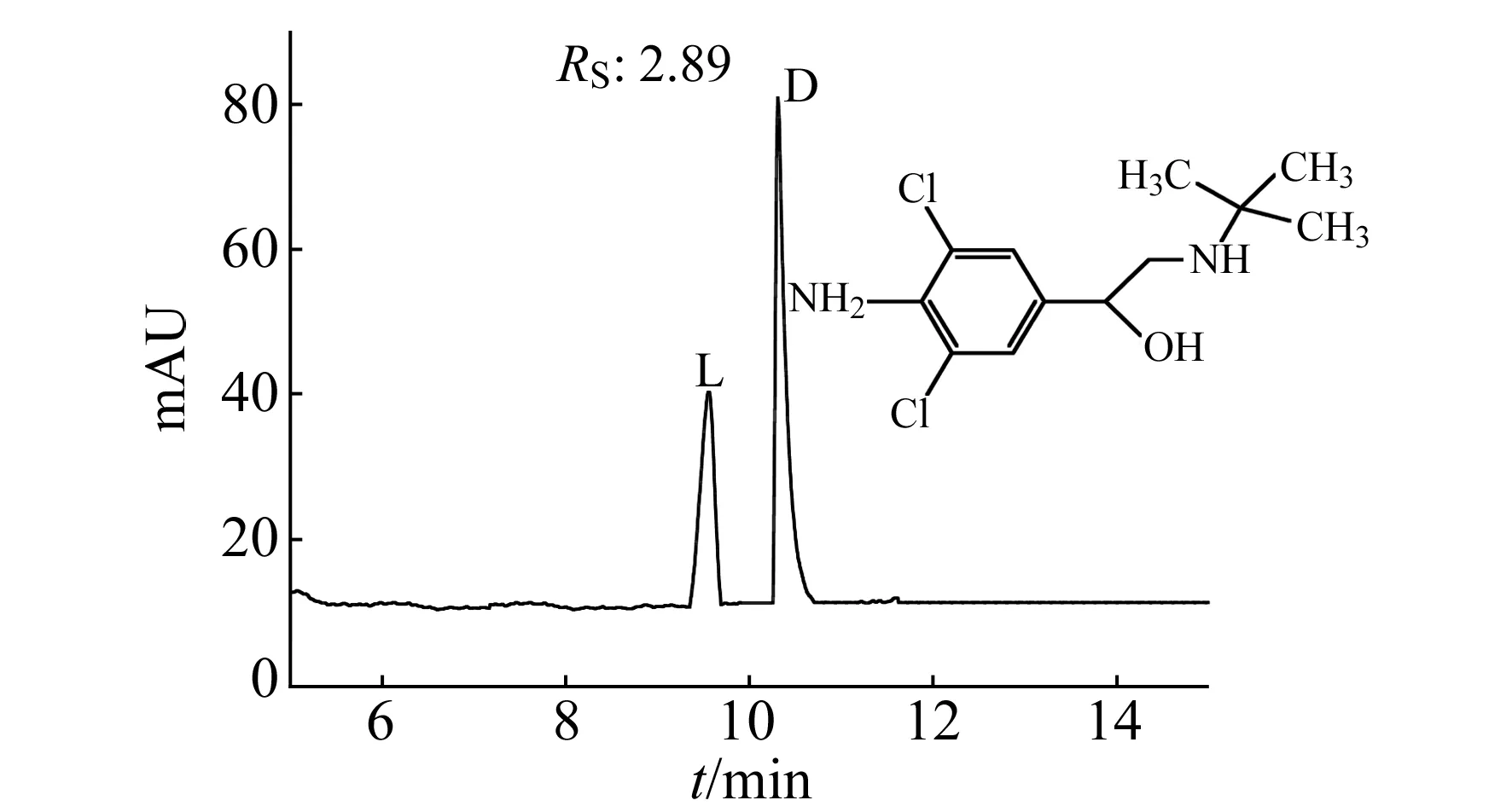
图6 盐酸克伦特罗电色谱分离图Fig.6 Electrochromatographic spectrum of Clenbuterol
盐酸克伦特罗属于β-肾上腺素类兴奋剂,在临床上用于治疗慢性阻塞性肺疾和支气管哮喘等疾病[18]。β-肾上腺素类兴奋剂大多数为手性对映体,研究表明具有药效的一般为左旋体,右旋体活性较低甚至有毒性,为了能够安全准确用药,快速高效地拆分药物对映体的要求日益变得迫切。利用制备的Ally-β-CD/Cu2O毛细管电色谱整体柱,对盐酸克伦特罗对映体进行手性分离,其电色谱图如图6。在最佳电色谱条件下,盐酸克伦特罗对映体达到了基线分离。
3 结论
本文制备了以β-CDs复合材料为固定相的新型毛细管电色谱整体柱,并确定了最佳制柱条件:功能单体Ally-β-CD/Cu2O与GMA物质的质量之比为0.05 g∶0.09 g,水浴温度50 ℃,聚合时间14 h。通过扫描电镜可以看出整体柱内固定相颗粒键合紧密,分布均匀,有较大孔径,互穿成网状结构,与柱壁键合紧密。测定该整体柱的理论塔板数达47 658N/m,对D,L-组氨酸对映体的分离度达RS到3.82。并对盐酸克伦特罗对映体进行了拆分,达到基线分离,分离度Rs为2.89。

