两种同步放化疗方案对放疗后复发Ⅲ~Ⅳ期食管癌患者近期疗效、生存时间及不良反应的影响
丁仁平 魏洁 王军 姚春飞 徐元肃
·论著·
两种同步放化疗方案对放疗后复发Ⅲ~Ⅳ期食管癌患者近期疗效、生存时间及不良反应的影响
丁仁平 魏洁 王军 姚春飞 徐元肃
目的探讨顺铂与奈达铂分别联合多西他赛+IMRT对放疗后复发Ⅲ~Ⅳ期食管癌患者近期疗效、生存时间及不良反应的影响。方法放疗后复发Ⅲ~Ⅳ期食管癌患者共130例,以随机数字表法分为对照组和观察组,每组65例,在IMRT+多西他赛基础上分别给予顺铂和奈达铂辅助治疗;比较2组患者近期疗效,随访生存率、随访复发转移、EORTC QLQ-C30症状领域评分及不良反应发生率等。结果观察组患者近期疗效显著优于对照组,差异有统计学意义(P<0.05);观察组患者随生存率显著高于对照组,差异有统计学意义(P<0.05);观察组患者随访复发转移率显著低于对照组,差异有统计学意义(P<0.05);观察组患者EORTC QLQ-C30症状领域评分显著低于对照组,差异有统计学意义(P<0.05);同时观察组患者不良反应率显著低于对照组,差异有统计学意义(P<0.05)。结论相较于顺铂,奈达铂联合多西他赛同步IMRT治疗放疗后复发Ⅲ~Ⅳ期食管癌可有效控制肿瘤进展,提高生存率,降低远期复发转移风险,改善日常生活质量,且有助于避免不良反应发生。
顺铂;奈达铂;同步放化疗;复发;食管癌
目前放疗是食管鳞癌主要治疗方法之一,但流行病学报道显示,患者放疗后局部复发率可达70%~85%,复发后5年生存率可下降20%~30%[1]。食管癌放疗复发后挽救治疗已成为医学界关注的热点和难点之一;食管癌放疗后诱发局部纤维化使得再次手术治疗难度较大,同时亦可明显影响化疗方案敏感性,完全缓解率较低[2,3];近年来在调强放疗基础上给予联合化疗药物同步应用逐渐成为放疗后复发食管癌患者临床治疗首选[4],但在具体化疗方案选择方面尚无统一标准。本次研究以我院收治放疗后复发Ⅲ~Ⅳ期食管癌患者共130例作为研究对象,在IMRT+多西他赛基础上分别给予顺铂和奈达铂辅助治疗,探讨两种同步放化疗方案对放疗后复发Ⅲ~Ⅳ期食管癌患者近期疗效、生存时间及不良反应的影响,报道如下。
1 资料与方法
1.1 一般资料 研究对象选取我院2011年6月至2013年6月收治放疗后复发Ⅲ~Ⅳ期食管癌患者共130例,以随机数字表法分为对照组和观察组,每组65例。对照组中,男45例,女20例;平均年龄(63.96±5.30)岁;平均BMI值(20.75±2.42)kg/m2;放疗至复发平均时间为(11.72±2.40)个月;平均肿瘤直径(4.15±1.33)cm;上次放疗平均剂量(53.69±4.22)Gy;根据肿瘤位置划分,食管上1/3段19例,食管中1/3段35例,食管下1/3段11例,根据临床分期划分,Ⅲ期41例,Ⅳ期24例。观察组中,男47例,女18例;平均年龄(63.80±5.26)岁;平均BMI值(20.82±2.46)kg/m2;放疗至复发平均时间(11.79±2.44)个月;平均肿瘤直径(4.08±1.31)cm;上次放疗平均剂量(53.58±4.17)Gy;根据肿瘤位置划分,食管上1/3段17例,食管中1/3段38例,食管下1/3段10例,根据临床分期划分,Ⅲ期43例, Ⅳ期22例。2组患者一般资料比较差异无统计学意义(P>0.05)。
1.2 纳入与排除标准
1.2.1 纳入标准:①经内镜病理活检确诊食管鳞癌;②符合TNM分期Ⅲ~Ⅳ期[5];③首次放疗后复发;④Karnofsky评分>60分;⑤预计生存时间≥3个月;⑥年龄18~75岁;⑦研究方案经医院伦理委员会批准;⑧患者及家属签署知情同意书。
1.2.2 排除标准:①发生远处转移;②放化疗禁忌;③合并其他系统恶性肿瘤;④食管穿孔或上消化道活动性出血;⑤肝肾功能不全;⑥血液系统疾病;⑦精神系统疾病;⑧研究药物过敏;⑨免疫系统疾病;⑩临床资料不全。
1.3 治疗方法 2组患者均采用IMRT治疗,治疗仪器采用德国西门子Primus V7医用直线加速器行6 MV照射,剂量分配为:95%PTV为46~64 Gy/2 Gy/23~32 f,双肺V20和心脏V30分别<20%、30%,而脊髓 PRV Dmax<10 Gy;CT模拟增强扫描确定病灶位置,扫描层厚设定为5 mm,扫描范围为下颌至肝下缘;勾画肿瘤体积,GTV外放1 cm作为CTV,CTV外放0.5 cm作为PTV;对照组患者给予顺铂(南京制药厂有限公司,规格20 ml∶20 mg)+多西他赛同步化疗,其中顺铂75 mg/m2静脉滴注,第1~3天;多西他赛(深圳万乐药业有限公司,规格1 ml∶40 mg)60 mg/m2静脉滴注,第1天;观察组患者给予奈达铂+多西他赛同步化疗,其中奈达铂(齐鲁制药有限公司,规格20 ml∶20 mg)40 mg/m2静脉滴注,第1天,多西他赛用法用量同对照组;每3周为1个周期,共行2个周期。
1.4 观察指标 (1)随访3年,记录患者治疗后1年、2年及3年生存例数,计算百分比;(2)随访3年,记录患者再次复发和远处转移例数,计算百分比;其中远处转移包括腹腔淋巴结转移;(3)生活质量评价采用EORTC QLQ-C30症状领域评分[5],包括疲劳、疼痛及恶心呕吐,分值越低提示生活质量越佳;(4)不良反应判定参照WHO抗癌药物常见不良反应分度标准(CTCAE4.03版)[5],包括骨髓抑制、消化道反应、放射性食管炎及放射性肺炎。
1.5 疗效判定标准 根据WHO实体瘤反应评价标准(RECIST1.1版)[5]进行判定,包括完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD);RR%=[(CR例数+PR例数)/总例数]×100%。
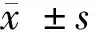
2 结果
2.1 2组患者近期疗效比较 观察组患者近期疗效显著优于对照组,差异有统计学意义(P<0.05)。见表1。

表1 2组患者近期疗效比较 n=65,例(%)
注:与对照组比较,*P<0.05
2.2 2组患者随访生存率比较 观察组患者随生存率显著高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 2组患者随访生存率比较 n=65,例(%)
注:与对照组比较,*P<0.05
2.3 2组患者随访复发转移率比较 观察组患者随访复发转移率显著低于对照组,差异有统计学意义(P<0.05)。见表3。

表3 2组患者随访1年和2年生存率比较 n=65,例(%)
注:与对照组比较,*P<0.05
2.4 2组患者EORTC QLQ-C30症状领域评分比较 观察组患者EORTC QLQ-C30症状领域评分显著低于对照组,差异有统计学意义(P<0.05)。见表4。

表4 2组患者EORTC QLQ-C30症状领域评分比较 n=65,分
注:与对照组比较,*P<0.05
2.5 2组患者不良反应发生率比较 观察组患者不良反应率显著低于对照组,差异有统计学意义(P<0.05)。见表5。

表5 2组患者不良反应发生率比较 n=65,例(%)
注:与对照组比较,*P<0.05
3 讨论
食管癌是我国最为常见消化系统恶性肿瘤之一,其总发病率和病死率高居恶性肿瘤第4位[6]。
作为临床主要治疗手段之一,食管癌患者行放射治疗后极易发生局部复发,以往对于复发食患者多采用挽救性手术治疗,但因低蛋白血症影响,手术相关病死率极高,且5年生存率不足25%[7];而单纯化疗方案应用则受限于病灶纤维化、中心区域乏氧等问题,患者对于药物敏感性下降明显,难以获得满意缓解效果[8]。近年来临床报道证实,同步放化疗方案用于局部复发食管癌患者较单纯放疗或化疗在提高肿瘤缓解效果,延长生存时间方面优势明显,并已成为该类患者临床治疗首选方案之一[9]。
调强放疗是一种新型放射治疗技术,可通过最大限度提高肿瘤局部辐射剂量和降低周围正常组织器官受量,在提高肿瘤细胞抑杀效果的同时,减轻放射相关毒副作用;多项临床报道显示,挽救性放疗剂量大于50 Gy食管癌患者远期预后较小于50 Gy者更佳,但增加放射剂量可能导致相关不良反应显著增加,且二次放疗后脊髓量耐受剂量进一步降低[10],故大部分学者推荐处方剂量应在48~50 Gy。
解剖学证实食管外膜属于疏松结缔组织,且与周围组织相连紧密,在患者病灶侵犯外膜时极易累及周围器官;而在放疗同时给予化疗药物辅助应用一方面能够有效促进原发病灶缩小甚至消失,另一方面亦可提高微小侵犯或转移灶清除效果[11]。多西他赛是一类半合成紫杉烷类化合物,可通过促进细胞凋亡、抑制微管蛋白解聚而发挥抗肿瘤作用;同时其还是公认细胞周期特异性放射增敏剂,可随药物作用时间增加而提高放射增敏效应[12]。而顺铂和奈达铂分别属于第一代、第二代铂类抗肿瘤药物,主要作用机制为干扰DNA复制进程,抑制肿瘤细胞分裂增殖;其对于乏氧肿瘤细胞抑杀作用有效,可阻断肿瘤细胞亚致死性和潜在致死性损伤修复进程,两者在局部复发食管癌患者病情控制方面效果均较为确切[13];但已有研究显示,奈达铂与肿瘤细胞核苷反应形成复合物速率更快,有助于在短时间内达到良好肿瘤抑杀作用;同时奈达铂静脉注射过程中无需水化,药物不良反应较顺铂明显减轻,更有助于改善生活质量[14,15]。
本次研究结果中,观察组患者近期疗效显著优于对照组,差异有统计学意义(P<0.05);观察组患者随生存率显著高于对照组,差异有统计学意义(P<0.05);观察组患者随访复发转移率显著低于对照组,差异有统计学意义(P<0.05),证实奈达铂辅助用于放疗后复发Ⅲ~Ⅳ期食管癌患者治疗在控制肿瘤病灶,延长生存时间及降低复发转移风险方面优势明显;部分学者报道证实,奈达铂在降低消化道肿瘤患者复发转移风险方面优于顺铂[16];而观察组患者EORTC QLQ-C30症状领域评分显著低于对照组,差异有统计学意义(P<0.05);同时观察组患者不良反应率显著低于对照组,差异有统计学意义(P<0.05),则说明与顺铂相比,放疗后复发Ⅲ~Ⅳ期食管癌行奈达铂辅助化疗有助于降低毒副作用发生几率,改善日常生活质量,与以往研究[15]基本一致。
综上所述,相较于顺铂,奈达铂联合多西他赛同步IMRT治疗放疗后复发Ⅲ~Ⅳ期食管癌可有效控制肿瘤进展,提高生存率,降低远期复发转移风险,改善日常生活质量,且有助于避免不良反应发生。
1 Montgomery EA.Oesophageal cancer //Stewart BW,Wild CP.World Cancer Report 2014.Lyon:International Agency for Research on Cancer,2014.374-382.
2 Yamashita H,Okuma K,Wakui R,et al.Details of recurrence sites after elective nodal irradiation (ENI) using 3D-conformal radiotherapy (3D-CRT) combined with chemotherapy for thoracic esophageal squamous cell carcinoma-a retrospective analysis.Radiother Oncol,2011,98:255-260.
3 Higuchi K,Komori S,Tanabe S,et al.Definitive chemoradiation therapy with docetaxel,cisplatin,and 5-fluorouracil (DCF-R) in advanced esophageal cancer:a phase 2 trial ( KDOG0501-P2).Int J Radiat Oncol Biol Phys,2014,89:872-879.
4 Kato K,Muro K,Minashi K,et al.Phase Ⅱ study of chemoradiotherapy with 5-fluorouracil and cisplatin for StageⅡ-Ⅲ esophageal squamous cell carcinoma:JCOG trial (JCOG 9906).Int J Radiat Oncol Biol Phys,2011,81:684-690.
5 孙燕,石远凯主编.临床肿瘤内科手册.第5版.北京:人民卫生出版社,2013.152-153.
6 Fakhrian K,Gamisch N,Schuster T,et al.Salvage radiotherapy in patients with recurrent esophageal carcinoma.Strahlenther Onkolog,2012,188:136-142.
7 Lee SJ,Kim S,Kim M,et al.Capecitabine in combination with either cisplatin or weekly paclitaxel as a first-line treatment for metastatic esophageal squamous cell carcinoma:a randomized phaseⅡstudy.BMC Cancer,2015,15:1-7.
8 Ohnuma H,Sato Y,Hirakawa M,et al.A Phase 1/2 study of definitive chemoradiation therapy using docetaxel,nedaplatin,and 5-fluorouracil (DNF-R) for esophageal cancer.Int J Radiat Oncol Biol Phys,2015,93:382-390.
9 Zanoni A,Verlato G,Giacopuzzi S,et al.Neoadjuvant concurrent chemoradiotherapy for locally advanced esophageal cancer in a single high-volume center.Ann Surg Oncol,2013,20:1993-1999.
10 Castilla L,Rovirosa A,Ginés A,et al.Endoluminal brachytherapy in the treatment of oesophageal cancer.Technique description,case report and review of the literature.Rev Esp Enferm Dig,2015,107:449-453.
11 Schull B,Kornek GV,Schmid K,et al.Effective combination chemotherapy with bimonthly docetaxel and cisplatin with or without hematopoietic growth factor support in patients with advanced gastroesophageal cancer.Oncology,2011,65:211-217.
12 Pasini F,de Manzoni G,Zanoni A,et al.Neoadjuvant therapy with weekly docetaxel and cisplatin,5-fluorouracil continuous infusion,and concurrent radiotherapy in patients with locally advanced esophageal cancer produced a high percentage of long-lasting pathological complete response:a phase 2 study.Cancer,2013,119:939-945.
13 Ninomiya I,Okamoto K,Tsukada T,et al.Recurrence patterns and risk factors following thoracoscopic esophagectomy with radical lymph node dissection for thoracic esophageal squamous cell carcinoma.Mol Clin Oncol,2016,4:278-284.
14 Miyanaga S,Ninomiya I,Tsukada T,et al.Concentration-dependent radiosensitizing effect of docetaxel in esophageal squamous cell carcinoma cells.Int J Oncol,2016,48:517-524.
15 Yamashita H,Takenaka R,Omori M,et al.Involved-field radiotherapy (IFRT) versus elective nodal irradiation (ENI) in combination with concurrent chemotherapy for 239 esophageal cancers:a single institutional retrospective study.Radiat Oncol,2015,14:171-172.
16 Zhou Z,Zhen C,Bai W,et al.Salvage radiotherapy in patients with local recurrent esophageal cancer after radical radiochemotherapy.Radiat Oncol,2015,10:1-7.
10.3969/j.issn.1002-7386.2017.20.025
魏洁,239001 安徽省滁州市第一人民医院放疗科;
E-mail:dingrenping0709@163.com
R 735.1
A
1002-7386(2017)20-3130-03
2017-03-13)
239001 安徽省滁州市第一人民医院放疗科

