大鼠实验性高三酰甘油血症氧化损伤标志物研究
王锦淳 陈朱井 嵇月娥 周杰 张景正 韩蕾 周晓霞
·论著·
大鼠实验性高三酰甘油血症氧化损伤标志物研究
王锦淳 陈朱井 嵇月娥 周杰 张景正 韩蕾 周晓霞
目的建立大鼠高三酰甘油血症模型并观察模型鼠氧化损伤标志物及NADPH氧化酶的变化。方法60只雄性SD大鼠随机分为正常对照组、高三酰甘油血症模型组及阳性药物组,每组20只,模型组和阳性药物组采用高脂饲料喂养4周。测定基线及建模4周末的血清三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)及肝脏的TG、TC。以RT-PCR法检测建模6周末鼠肝NOX1-mRNA与NOX4-mRNA表达。阳性药物组4周末后以非诺贝特灌胃,剂量为100 mg·kg-1·d-1,持续2周后检测血清TG、HDL-C、LDL-C及 TC。结果造模4周末,模型与阳性药物组血清TG、LDL-C、TC、肝脏TG、TC水平均较基线时明显升高(P<0.05);模型组与阳性药物组血清HDL-C明显低于其基线时水平(P<0.05)。同时,模型组与阳性药物组血清MDA水平较基线时明显升高(P<0.05); SOD和GSH-PX较基线时明显降低(P<0.05)。6周末模型组肝NOX1-mRNA与NOX4-mRNA表达均高于对照组与阳性药物组(P<0.05)。阳性药物组经非诺贝特灌胃治疗2周后,血清TG、TC、LDL-C均明显下降(P<0.05),HDL-C明显上升(P<0.05)。结论成功建立大鼠高三酰甘油血症模型,高三酰甘油血症大鼠GSH-PX和SOD明显降低,MDA明显上升,并通过激活体内NADPH氧化酶而诱导机体出现氧化损伤。
高三酰甘油血症; 氧化损伤;大鼠
高脂血症(hyperlipidemia,HLP)作为一种代谢性疾病,以体内脂类代谢失调导致的血浆中脂类含量异常为主要特征[1],是动脉粥样硬化(atherosclerosis,AS)、冠心病及脑卒中等心脑血管疾病的确认危险因素之一[2,3],及时有效地调节血脂异常是防治心脑血管疾病的重要措施。研究表明,高三酰甘油血症(hypertriglyceridemia,HTG)也是引致AS的独立危险因素[4],其中氧化应激(oxidative stress,OS)所致的血管内皮细胞损伤在AS的发病中可能发挥了重要的作用,OS是机体内抗氧化防御与自由基的产生出现的一种严重失衡的病理状态,导致活性氧(reactive oxygen species,ROS)蓄积在细胞内而产生的氧化损伤过程。尼克酰胺腺嘌呤二核苷酸磷酸盐氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NADPH)是内皮细胞生成ROS的主要酶体[5],通过促进机体的氧化损伤参与了AS的发生发展,是机体内一种主要的氧化损伤标志物。本研究通过建立实验性高三酰甘油血症大鼠模型,观察其氧化损伤标志物及NADPH氧化酶的变化,旨在为抗HTG新药开发提供实验依据。
1 材料与方法
1.1 实验动物 健康SPF 级SD大鼠60只,均为雄性,体重(200±10)g,南京医科大学实验动物中心提供。实验期内饲养室温度(20±1)℃。
1.2 药品与试剂 三酰甘油测定试剂盒(TG)、高密度脂蛋白胆固醇测定试剂盒(HDL-C)、低密度脂蛋白胆固醇测定试剂盒(LDL-C)、总胆固醇测定试剂盒(TC)、丙二醛(MDA)测定试剂盒、超氧化物歧化酶(SOD)测定试剂盒及谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒均由南京建成生物工程研究所提供, NOX1-mRNA与NOX4-mRNA 的RT-PCR试剂盒由Fermentas公司(美国)提供,引物由上海生工技术服务有限公司提供。非诺贝特由安徽先锋制药有限公司提供。其他试剂均为国产分析纯。
1.3 主要仪器 医用解剖器械(苏州医疗器械厂)、TL-16G型高速冷冻离心机(上海实验仪器厂)、AirTech超净工作台(苏净集团安泰有限公司)、BP110S电子秤(德国SARTORIUS公司)、AU600全自动生化分析仪(日本OLYMPUS公司)、UV-1240型紫外分光光度计(日本岛津公司)、PCR系统(澳大利亚Rotor-gene公司)。
1.4 方法
1.4.1 高三酰甘油血症大鼠模型制备:60只雄性SD大鼠随机分为正常对照组、高三酰甘油血症模型组及阳性药物组,每组20只。适应性饲养1周,禁食12 h(不禁水)后采眼眶静脉血,离心分离血清,使用全自动生化分析仪检测血清TC、TG、HDL-C及LDL-C,同时采用比色法检测MDA、SOD及GSH-PX。3组各处死动物3只,取肝脏组织0.5 g剪碎,加提取液后制成匀浆,以5 000 r/min离心20 min后取上清液,采用全自动生化分析仪测定肝脏中TG和TC的水平。正常对照组自由食用常规基础饲料,高脂模型组以自配的高脂饲料[6]喂养6周,主要成份为: 74.8%基础饲料、0.2%胆固醇、10%蛋黄粉及15%纯猪油。阳性药物组先以高脂饲料喂养4周,4周末后以非诺贝特灌胃,剂量为100 mg·kg-1·d-1,持续2周。于造模的第4周末,禁食12 h(不禁水)后采眼眶静脉血,分离血清后检测TG、HDL-C、LDL-C及 TC,以评价造模是否成功。随即将3组动物各处死3只,取肝脏组织制成匀浆,全自动生化分析仪测定肝脏中TG和TC的水平。阳性药物组于6周末同法检测血清TG、HDL-C、LDL-C及 TC。
1.4.2 大鼠模型氧化损伤标志物测定:造模第4周末于SD大鼠眼眶静脉丛取血,分离血清后采用比色法检测MDA、SOD及GSH-PX。
1.5 RT-PCR法检测NOX1-mRNA与NOX4-mRNA表达:于造模第6周末处死大鼠,剖取大鼠肝脏组织,按RT-PCR试剂盒操作说明进行PCR检测。大鼠肝脏组织采用总RNA提取试剂盒根据说明提取肝脏组织总RNA后进行逆转录,Nox1引物序列为sense:5’-CACAAGAAAAATCCTTGGGTCAA-3’,antisense:5’-GACAGCAGATTGCGACACACA-3’;Nox4引物序列为sense:5’-TGGCTGCCCATCTGGTGAATG-3’,antisense:5’-CAGCAGCCCTCCTGAAACATGC-3’。内参选择β-action作为参照,引物序列为sense:5’-TAAAGACCTCTATGCCAACACAGT-3’。antisense:5’-CACGATGGAGGGGCCGGACTCATC-3’。取2 μg总RNA行逆转录成cDNA,取20 μl作为反应体系。PCR反应由逆转录产物2 μl以及β-action和NOX1与NOX4的引物共同组成。反应过程按照标准的RT-PCR步骤进行:首先预变性的反应条件为95℃、5 s,接着进行梯度变性反应,94℃、30 s,60℃、30 s,72℃、60 s,72℃、7 s递减,共进行30次的循环。取5 μl反应产物于1%琼脂糖凝胶电泳后经凝胶成像系统分析处理,以目的基因表达量与β-action表达量比值作为Nox1 和Nox4 mRNA 的相对表达量。
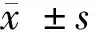
2 结果
2.1 造模前后大鼠血清及肝脏血脂指标 适应性饲养1周后(即造模前基线时),3组大鼠血清的TG、HDL-C、LDL-C、TC,以及肝脏的TG、TC的水平均位于正常水平,3组间各指标差异均无统计学意义(P>0.05)。造模4周末,模型组和阳性对照组血清TG、LDL-C、TC水平,以及肝脏TG、TC水平均明显上升,高于其基线时水平和对照组4周末水平,差异均有统计学意义(P<0.05)。造模4周末,模型组血清HDL-C明显下降,低于其基线时水平和对照组4周末的水平,差异有统计学意义(P<0.05),提示模型组和阳性对照组大鼠血脂代谢出现紊乱,说明造模成功。见表1。

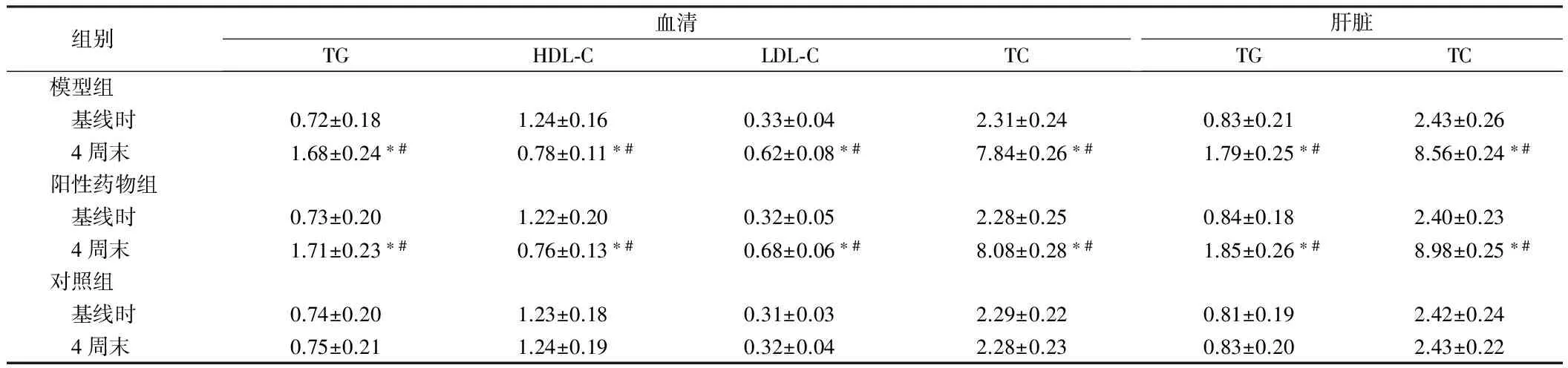
组别血清TGHDL⁃CLDL⁃CTC肝脏TGTC模型组 基线时0.72±0.181.24±0.160.33±0.042.31±0.240.83±0.212.43±0.26 4周末1.68±0.24∗#0.78±0.11∗#0.62±0.08∗#7.84±0.26∗#1.79±0.25∗#8.56±0.24∗#阳性药物组 基线时0.73±0.201.22±0.200.32±0.052.28±0.250.84±0.182.40±0.23 4周末1.71±0.23∗#0.76±0.13∗#0.68±0.06∗#8.08±0.28∗#1.85±0.26∗#8.98±0.25∗#对照组 基线时0.74±0.201.23±0.180.31±0.032.29±0.220.81±0.192.42±0.24 4周末0.75±0.211.24±0.190.32±0.042.28±0.230.83±0.202.43±0.22
注:与基线时比较,*P<0.05;与对照组造模4周末比较,#P<0.05
2.2 3组大鼠血清氧化损伤标志物比较 基线时,3组大鼠血清的MDA、SOD和GSH-PX的差异均无统计学意义(P>0.05)。造模4周末,模型组和阳性药物组血清MDA水平明显升高,高于其基线时水平和对照组4周末水平,差异均有统计学意义(P<0.05)。造模4周末,模型组和阳性药物组血清SOD和GSH-PX明显下降,低于其基线时水平和对照组4周末水平,差异均有统计学意义(P<0.05)。见表2。

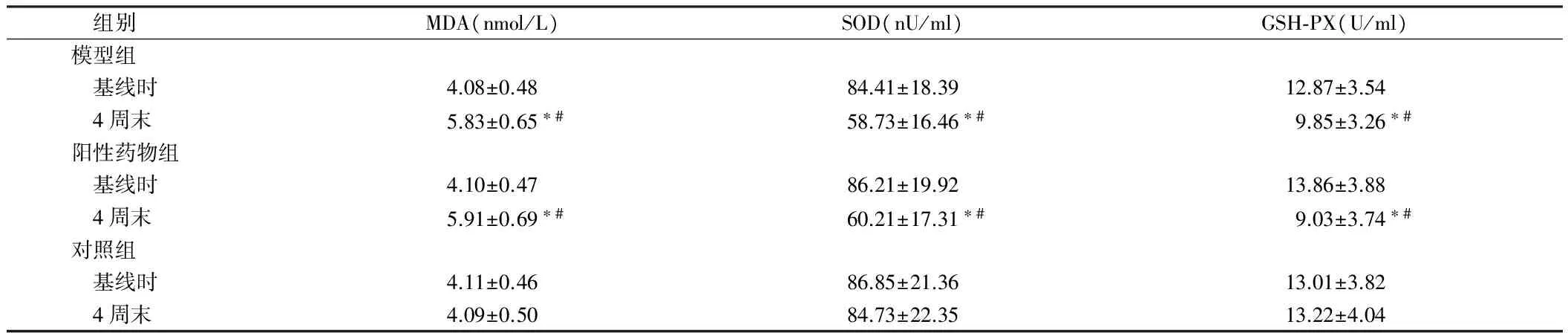
组别MDA(nmol/L)SOD(nU/ml)GSH⁃PX(U/ml)模型组 基线时4.08±0.4884.41±18.3912.87±3.54 4周末5.83±0.65∗#58.73±16.46∗#9.85±3.26∗#阳性药物组 基线时4.10±0.4786.21±19.9213.86±3.88 4周末5.91±0.69∗#60.21±17.31∗#9.03±3.74∗#对照组 基线时4.11±0.4686.85±21.3613.01±3.82 4周末4.09±0.5084.73±22.3513.22±4.04
注:与基线时比较,*P<0.05;与对照组比较,#P<0.05
2.3 造模后3组大鼠肝脏NOX1-mRNA与NOX4-mRNA表达 造模6周后模型组NOX1-mRNA与NOX4-mRNA表达均高于对照组与阳性药物组,差异均有统计学意义(P<0.05)。见表3,图1。
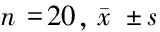
组别NOX1⁃mRNANOX4⁃mRNA模型组 0.72±0.060.69±0.06阳性药物组0.45±0.060.44±0.06对照组 0.46±0.050.45±0.05F值12.5810.14P值<0.01<0.01

图1 NOX1 mRNA与NOX4 mRNA表达的电泳图
1与4、2与5、3与6组分别代表阳性药物组、对照组与模型组的NOX1 mRNA与NOX4 mRNA
2.4 非诺贝特对大鼠高三酰甘油血症模型血脂的影响 阳性药物组基线、4周末及6周末3个时点的TG、TC、LDL-C、HDL-C的总体差异均有统计学意义(P<0.05)。治疗2周后,血清TG、TC、LDL-C均明显下降,HDL-C明显上升,各指标与4周末比较,差异均有统计学意义(F值分别为9.82、11.24、17.54、16.83,P<0.05)。与基线时比较,6周末HDL-C高于基线水平,差异有统计学意义(F=7.58,P<0.05),而血清TG、TC、LDL-C的差异均无统计学意义(F值分别为1.46、1.77、1.25,P>0.05)。见表4。
3 讨论
现已明确脂代谢紊乱或高脂血症是心脑血管疾病的重要危险因素之一[7,8],血清中高TG、TC及LDL-C作为高脂血症的重要指标,其水平的上升能促进AS的产生,因此控制血清TG、TC的含量对于心脑血管疾病的预防和治疗具有十分重要的意义。HDL-C作为拮抗AS的保护性预防因子,研究表明其与冠心病和AS的发生呈负相关[9],它可与LDL-C竞争脂蛋白受体,能防止LDL-C运送的的胆固醇沉积在动脉壁,还可从周围血管壁摄取胆固醇并逆向转运至肝内降解。TG代谢紊乱在AS的发生发展中也发挥着重要的作用。目前认为高TG血症可通过损伤血管内皮细胞、引起脂质过氧化、促进血管平滑肌细胞增殖、促进血栓形成等启动AS。而在高TG血症导致AS的过程中,氧化应激所致的血管内皮细胞损伤对于AS的发生意义较大,可使脂质过氧化反应增强、抗氧化酶活性降低[10]。本研究采用高脂饲料制HTG血症大鼠模型,实验结果显示,模型组和阳性药物组建模4周后血清TG、LDL-C、TC水平,以及肝脏TG、TC水平均明显上升,血清HDL-C明显下降,提示模型组大鼠血脂代谢出现紊乱,与同类研究结果[3,7]一致,说明造模成功。非诺贝特是过氧化酶体增殖物激活受体-α的特异性激活剂,研究表明可明显降低血脂并升高HDL-C, 本研究中阳性药物组在接受非诺贝特灌胃2周后,血清TG、TC、LDL-C均明显下降,低于4周末建模结束时水平(P<0.05);HDL-C明显上升,高于4周末建模结束时水平(P<0.05)。与基线时比较,6周末血清TG、TC、LDL-C的差异均无统计学意义(P>0.05),而HDL-C甚至高于基线水平(P<0.05),说明非诺贝特可明显改善血脂水平。

时间点TGHDL⁃CLDL⁃CTC基线时0.73±0.201.22±0.200.32±0.052.28±0.254周末1.71±0.230.76±0.130.68±0.068.08±0.286周末0.71±0.141.36±0.130.29±0.062.23±0.16F值24.6321.0817.2233.57P值<0.01<0.01<0.01<0.01
由于机体细胞内氧自由基的产生与消除失衡,导致氧化应激,致使超氧阴离子(O2-)、过氧化氢(H2O2)以及羟自由基(-OH)等活性氧在体内蓄积而出现氧化损伤过程。活性氧主要参与引起脂质过氧化、诱发内皮细胞与平滑肌细胞增殖、调节血管张力、促进炎性反应等病理生理效应[11,12]。机体细胞对氧自由基损伤的耐受决定于细胞内关键性抗氧化酶SOD、CAT和GSH的含量,机体内正常情况下SOD、CAT和GSH-PX协同作用可清除ROS,使细胞的氧化还原维持自稳态,防止脂质过氧化及其中间代谢产物对机体的损害。MDA是机体内脂质过氧化反应的重要代谢产物,对细胞具有严重的毒性,血清中MDA的含量一定程度上反映了机体内自由基产生和消除的情况。但当稳态由于某些因素影响而失衡时,ROS产生大于消除的速率时,ROS就会出现大量蓄积,可出现脂质氧化、内皮细胞功能失调或凋亡以及血管收缩性改变,促进AS的发生发展。本研究发现,HTG血症大鼠模型制备成功后,其血清中SOD和GSH-PX明显下降,而MDA明显上升,与周亮等[8]研究结果一致,说明高TG血症大鼠体内的氧化应激导致氧化损伤。
研究表明,NADPH氧化酶是体内ROS生成的主要酶体之一[13],NADPH氧化酶包括NOX1-5和DUOX1-2,NADPH氧化酶过度活化会促进细胞内ROS高表达。血管平滑肌主要表达NOX1与NOX4,可能是激活NADPH氧化酶的关键亚基,会促使机体产生氧化应激[14]。NADPH 氧化酶在动脉血管上的表达升高,能诱使大量的ROS产生,ROS氧化LDL 生成ox-LDL,泡沫细胞吞噬的ox-LDL即主要来源于此,泡沫细胞是AS斑块中最早出现的细胞成分,泡沫细胞逐渐堆积形成早期的AS 病变脂质条纹[15]。Thum 等[16]研究显示ox-LDL可通过激活人冠状动脉内皮细胞中的NOX4 而促进活性氧的生成。NADPH 氧化酶的活性增高能使依赖NO 的内皮舒张功能失调,并增加AS的危险性。Wingler等[17]研究发现,在肾素-血管紧张素系统活性高表达的雄性大鼠主动脉和肾脏中,NOX1mRNA和NOX4 mRNA表达较野生大鼠明显增高,由NOX1 和NOX4 介导的O2-生成明显上升,从而灭活NO 使内皮功能失调,导致心血管病的发展。本研究发现大鼠造模成功后,肝脏NOX1-mRNA与NOX4-mRNA的表达均明显上升,提示大鼠体内NADPH氧化酶系统得到激活而导致氧化损伤。
综上所述,HTG血症大鼠GSH-PX和SOD活性明显降低,MDA含量明显上升,同时通过激活体内NADPH氧化酶而诱导机体出现氧化损伤,提示对于NADPH氧化酶的抑制对于抵抗氧化损伤、改变脂类代谢紊乱有较为重要的意义,为进一步探讨抗高TG血症的新药开发及其作用靶点提供了实验依据。
1 阿荣,乔延江,博·格日勒图,等.荜茇宁衍生物对高脂血症大鼠调脂作用及其机制的研究.安徽医药,2015,19:1446-1449.
2 吴小明.大黄素对大鼠混合型高脂血症的影响.安徽医药,2008,12:1026-1028.
3 王冬艳,华欣,叶记林,等.江苏地产白首乌C21甾体苷对高血脂大鼠血脂调节和肝脏保护作用研究.安徽医药,2015,19:1454-1457.
4 Austin MA,Hokanson J E,Edwards KL.Hypertriglyceridemia as a cardiovascular risk factor.AmJ Cardiol,1998,81:7-12.
5 Keaney JF Jr.Oxidative stess and the vascular wall:NADPH oxidases take center stage.Circulation,2005,112:2585-2588.
6 郝光荣主编.实验动物学.第2版.上海:第二军医大学出版社,2005.204.
7 王毓炜,谢承佳.毛冬青苷对高脂血症大鼠血脂的影响及其作用机制.安徽医药,2015,19:242-245.
8 周亮,许玉萍,魏源,等.绞股蓝总皂甙对实验性高脂血症大鼠血脂和脂质过氧化水平的影响.中国应用生理学杂志,2008,24:205-207.
9 黄震华.升高高密度脂蛋白胆固醇和载脂蛋白A-Ⅰ的治疗和进展.中国新药与临床杂志,2013,32:869-875.
10 王锦淳,苏佩清,孙丹丹,等.黄芩茎叶总黄酮对高甘油三酯血清致人脐静脉内皮细胞氧化损伤的保护作用及机制研究.中国药理学通报,2012,28:397-402.
11 Rupin A,Paysant J,Sansilvestri P,et al.Role of NADP Hoxidase-mediated superoxidep reduction in the regulation of Eselectin expression by endothelial cells subjected to anoxia/reoxygenation.Cardiovasc Res,2004,63:323-330.
12 Guzik TJ,West NE,Black E,et al.Vascular superoxidep roductionby NAD (P) Hoxidase:association with endothelial dysfunction andclinical risk factors.Circ Res,2000,86:E85-90.
13 Keaney JF Jr.Oxidative stess and the vascular wall:NADPH oxidases take center stage.Circulation,2005,112:2585-2588.
14 周俊英,周东方,王玮.缺氧诱导因子1及下游NADPH氧化酶在酒精性肝病大鼠肝组织中的表达及意义.中国组织化学与细胞化学杂志,2018,19:263-265.
15 Jamie WM,Mark ES.A central role for the endothelial NADPH oxidase inatherosclerosis.FEBS,2000,472:1-4.
16 Thum T,Borlak J.Mechanistic role of cytochrome P450 monooxygenases in oxidized lox-density lipoprotein-induced vascular injury:therapy through LOX-1 receptor antagonism.Circ Res,2004,94:e1-13.
17 Wingler K,Wünsch S,Kreutz R,et al.Upregulation of the vascular NAD(P)H-oxidase isoforms Nox1 and Nox4 by the renin-angiotensin system in vitro and in vivo.Free Radic Biol Med,2001,31:1456-1464.
Studyonoxidativedamagemarkersinexperimentalratswithhypertriglyceridemia
WANGJinchun*,CHENZhujing,JIYue’e*,etal.
*JiangsuHealthVocationalCollege,Nanjing211800,China
ObjectiveTo establish rat model with hypertriglyceridemia in order to observe the changes of oxidative damage markers and NADPH oxidase in experimental rats with hypertriglyceridemia.MethodsSixty male SD rats were randomly divided into control group (n=20),model group (n=20) and positive drug group (n=20).The rats in model group and positive drug group were feed with high fat diet for 4 weeks.The serum levels of TG,HDL-C,LDL-C,TC,MDA,SOD,GSH-PX and TG,TC in liver at baseline and on 4 weeks after modeling were detected. The expression levels of of NOX1-mRNA and NOX4-mRNA in liver were measured by RT-PCR at the end of 6 weeks after modeling.The rats in positive drug group were given fenofibrate by gavage,100 mg·kg-1·d-1for 2 weeks, and then the levels of TG,HDL-C,LDL-C and TC were detected.ResultsAt the end of 6 weeks after modeling,the levels of TG,LDL-C,TC and TG,TC in model group and positive drug group were significantly increased,as compared with those at baseline (P<0.05),however,the serum levels of HDL-C were obviously decreased,as compared with those at baseline (P<0.05). Meanwhile,the serum levels of MDA in model group and positive drug group were significantly higher than those at baseline (P<0.05),but the levels of SOD and GSH-PX were significantly lower than those at baseline(P<0.05).The expression levels of liver NOX1-mRNA and NOX4-mRNA at the end of 6 weeks after modeling in model group were significantly higher than those in control group and positive drug group (P<0.05). On 2 weeks after treatment with fenofibrate,the serum levels of TG,TC and LDL-C in positive drug group were obviously decreased, however,the serum levels of HDL-C were significantly increased (P<0.05).ConclusionThe rat models with hypertriglyceridemia are successfully established. The levels of GSH-PX and SOD in rats with hypertriglyceridemia are obviously decreased and the levels of MDA were significantly increased,and then NADPH oxidase is activated to induce oxidative damage in vivo.
hypertriglyceridemia; oxidative damage; rats
10.3969/j.issn.1002-7386.2017.20.003
周晓霞,225009 江苏省扬州市,扬州大学医学院基础部生化教研室;
E-mail:wangjingchuncyn@163.com
R 589.21
A
1002-7386(2017)20-3055-05
2017-06-19)
项目来源:江苏省卫生职业技术教育研究立项课题(编号:J201509)
211800 江苏建康职业学院(王锦淳、嵇月娥、周杰、张景正、韩蕾);江苏大学附属句容医院(陈朱井);扬州大学医学院基础部生化教研室(周晓霞)

