LncRNA RSU1P2在宫颈癌肿瘤细胞中作为ceRNA拮抗let-7a促进肿瘤发生的影响研究
蒋琼
·论著·
LncRNA RSU1P2在宫颈癌肿瘤细胞中作为ceRNA拮抗let-7a促进肿瘤发生的影响研究
蒋琼
目的观察lncRNA RSU1P2对宫颈癌肿瘤细胞的影响。方法在Caski、HeLa和C33A细胞中通过转染质粒使RSU1P2过表达,通过MTT试验和集落形成测定法检测RSU1P2对细胞活力的影响,用Transwell测定RSU1P2对细胞的转移和侵袭能力的影响,通过流式细胞仪测定RSU1P2对细胞周期和细胞凋亡的影响通过蛋白(质)印迹法(Western blot)检测EMT相关蛋白的变化,通过动物实验测定RSU1P2在体内对宫颈癌组织的影响等。结果在Hela和C33A等细胞中RSU1P2过表达后,细胞增殖能力、转移侵袭能力和VM均增强(P<0.05),细胞G1期与S期比例和细胞凋亡数减少(P<0.05)。与对照组相比,RSU1P2-A组裸鼠的平均体重和肿瘤体积的中分别提高了约110%(P<0.05)。结论lncRNA RSU1P2在宫颈癌组织中通过调节let-7A与其靶基因的分配从而促进癌细胞的发生发展。
长链非编码RNA;宫颈癌;ceRNA;Let-7a
长链非编码RNA(long non-coding RNA,lncRNA)是一类内生的长度大于200nt的非编RNA,lncRNA自身并不转录编码功能性蛋白质,但参与调控基因在不同水平的表达[1]。LncRNA广泛参与各种生理过程,如核转运、选择性剪接以及表观遗传学等。此外,lncRNA也可以作一种结构组件,调控mRNA的稳定以及衰减,甚至可以作为小非编码RNA(small non-coding RNA,sncRNA)的前体[2]。越来越多的研究发现,许多癌症细胞中lncRNA的表达异常,如H19是一个长度为2.3 kb的lncRNA,在多种癌症,包括肝癌、膀胱癌和乳腺癌中异常表达,参与调节肿瘤的增殖与转移侵袭,这表明lncRNA的异常表达对肿瘤发生有着至关重要的影响[3]。微RNA(microRNAs,miRNAs)是一类长度约为22nt的内源性sncRNA,其主要作用是通过结合mRNA选择性调控基因的表达,在大多数生物过程中起着显著作用[4]。成熟的miRNA和与其部分互补的靶RNA结合形成miRNA反应元件(miRNA response elements,MREs)。一个miRNA可以结合多个靶RNA分子,单个靶RNA分子上也可以与多个miRNA分子结合,因此靶RNA分子的表达受到多种miRNA的抑制。在此基础上,竞争性内源RNA(competing endogenous RNAs,ceRNA)假说,即ceRNA可以通过MREs竞争性结合miRNA从而影响miRNA的功能,抑制miRNA导致的基因沉默[5]。目前,对于在肿瘤中发挥ceRNA功能的lncRNA的了解甚少。在本研究中,我们发现一个lncRNA,RSU1P2(Ras suppressor protein 1 pseudogene 2)。为了探讨其在细胞癌变的作用,我们首先证明了与相邻的非肿瘤组织相比RSU1P2在宫颈癌组织中表达上调,并在宫颈癌细胞作为一种原癌基因。此外,我们发现RSU1P2与miRNA let-7a的结合解除let-7a对其靶基因IGF1R,N--myc和EphA4的抑制,从而发现RSU1P2在宫颈癌肿瘤发生中的作用。
1 材料与方法
1.1 临床样本、细胞培养和转染 从14例宫颈癌患者取其宫颈癌组织样本和邻近正常宫颈组织样本,并提取各个样本RNA。人宫颈癌细胞株HeLa和C33A由本实验室既往保存,在RPMI1640培养基(Invitrogen)中培养,该培养基含有10%胎牛血清(FBS),100 μg/ml链霉素和100 U/ml青霉素,置于37℃、CO2体积分数为5%的温箱内培养。使用脂质体2000试剂(Invitrogen)进行细胞转染,根据其说明书进行相关操作。本研究已告知患者及其家属,并签署知情同意书,并在伦理委员会的指导下开展研究。
1.2 qRT-PCR分析 qRT-PCR分析用于检测RSU1P2的相对转录物水平,let-7a和其靶基因。使用有SYBR 混合液的Taq试剂盒(TaKaRa公司)并根据该试剂盒的说明书进行qRT-PCR扩增及分析。
1.3 miRNA靶标预测 使用RegRNA,TargetScan和PicTar等最常用的预测方法找到let-7a的下游mRNA靶基因。
1.4 Western blot分析 收集细胞,加入适量RIPA裂解液裂解细胞收集细胞蛋白液,加入适量的上样缓冲液,并在100℃水浴后进行聚丙烯胺凝胶电泳。PVDF膜转膜后用脱脂奶粉进行封闭,然后用特定的一抗及二抗进行温育,用化学发光法探测三类细胞中IGF1R,N-myc,EphA4,GAPDH的表达。兔抗人GAPDH,NMYC,IGF1R,EphA4的一抗来自Saierbio(天津,中国),兔抗人BAK来自Santa Cruz Biotechnology公司(加利福尼亚州,美国)。使用LABWORKS 4.0软件所得Western印迹条带进行定量。
1.5 细胞活性和增殖能力的检测 3-(4,5-二甲基吡啶-2-基)-2,5-二苯基四唑鎓溴化物进行(MTT)法和细胞增殖法来测定评估宫颈癌细胞系的活性和增殖能力。MTT测定中,细胞转染后20~24 h将8000 C33A细胞或5000 HeLa细胞接种到96孔板。在集落形成测定中,如上述操作将300 C33A细胞或250 HeLa细胞接种到12孔板。所有实验进行3次以上。
1.6 流式细胞仪检测细胞周期 2组C33A或HeLa细胞在6孔板中在培养液中培养24 h。其中一组在收集前24 h改用不含血清的培养液培养,而另一组细胞在收集前均在含血清培养液中培养。将细胞通过离心收集,用95%(V/V)乙醇固定,并储存于-20℃过夜。用磷酸盐缓冲盐水(PBS)洗涤后,将细胞重悬于碘化丙锭(PI)染色缓冲液(PBS,0.1%的Triton X-100,50 μg/ml的PI,0.1 mg/ml的无DNase的RNA酶和0.1%柠檬酸三钠)放在冰上30 min。用FACS Calibur的流式细胞仪(BD Biosciences公司)和细胞Quest软件(BD Biosciences公司)检测分析DNA含量。
1.7 TUNEL法 在HeLa细胞用pcDNA3/RSU1P2或空载转染后48 h,将经PBS洗涤的细胞并固定在含4%多聚甲醛的PBS,置于室温下30 min。在PBS中温育5 min后,在冰上用0.1%(V/V)的Triton X-100对细胞进行透化处理2 min。将样品用PBS洗涤2次,每次5 min,温育在混合溶液1 h(酶溶液∶标记溶液= 1∶9,罗氏)并避光。用DAPI(4,6-二脒基-2-苯基,300 nmol/L, Invitrogen)染色之前,将细胞在PBS中洗涤3次,每次5 min。最后一次洗涤后,将样品与成像系统(NIS Elements F 2.20成像软件,尼康,东京,日本)可成像检测。
1.8 EGFP报告基因分析 转染了pcDNA3/PRI-let- 7aHeLa、对照空质粒、let-7a反义寡核苷酸(ASO)、ASO对照(ASO序列在补充表S1中列出)和上述空载的Hela细胞中在48孔板中培养。表达红色荧光蛋白(RFP)的表达载体pDsRedz-N1(Clontech)用于归一化。将细胞用RIPA裂解缓冲液48 h后裂解,并且收集蛋白质。使用荧光分光光度计F-4500(Hitachi)检测EGFP表达和RFP的表达。所有测定进行3次以上。
1.9 细胞迁移和侵袭实验 收集转染后的2组A549细胞,用无血清RPMI-1640培养基重悬,以每孔5×104个的细胞密度加入到预铺好Matrigel基质胶的Transwell小室的上室内,下室加入600 ml完全培养液,培养箱中常规培养24 h取出上室,用4%多聚甲醛处理后用0.01%结晶紫染色,于200倍光学显微镜下计数穿膜细胞数,随即取5个视野,取平均值。每组实验设3个复孔,实验重复3次。
1.10 质粒构建 将含有PRI-let-7a的DNApianduan 导入至BamHI和EcoRI限制性位点之间的pcDNA3载体DNA片段中,得到含pcDNA3/PRI-let-7α(PRI-let-7a)的质粒。用两条单链进行退火反应。将野生型或突变型的mRNA 3’非编码区插入到pcDNA3/EGFP载体的下游区域的BamHI和EcoRI位点之间。含pUC57-RSU1P2(GENEWIZ)的质粒,含有全部长度的RSU1P2,然后将重建的片段插入BamHI和EcoRI位点之间的pcDNA3载体中,并且所有的构建体通过DNA测序确认。
1.11 在裸鼠肿瘤异种移植模型 共有3×106转染了pcDNA3/RSU1P2和对照载体的HeLa细胞悬浮于100 μl无血清RPMI 1640培养基中并皮下注入到腋下6周大的雌性裸鼠中。注射7 d后每2天测定小鼠重量和肿瘤大小。肿瘤体积计算如下:肿瘤体积=长度×宽度2×1/2。所有小鼠在注射后20 d处死,将肿瘤从小鼠中分离并储存在-80℃。
2 结果
2.1 RSU1P2在人宫颈癌组织中表达上调及在体内和体外的致瘤功能 采用qRT-PCR检测14对宫颈癌组织和邻近的正常组织RSU1P2的表达水平。结果表明,与相应的非肿瘤组织相比RSU1P2表达水平在宫颈癌组织显著增加,差异有统计学意义(P<0.05)。同时对比RSU1P2在三种宫颈癌细胞:Caski,HeLa和C33A细胞中的表达水平, CaSki细胞的RSU1P2水平最低。另外,由于Hela是HPV阳性细胞系和C33A是HPV阴性细胞系,是代表性的宫颈癌细胞系,故选择了HeLa和C33A细胞系做今后的研究。用MTT试验和集落形成测定法检测细胞活力发现,转染了RSU1P2-full和shR-RSU1P2的HeLa和C33A细胞系48 h - 96 h 间RSU1P2的显著表达造成细胞活力增加
和集落形成的能力,而敲除RSU1P2的细胞中这些表型均减少。用Transwell测定细胞的转移侵袭能力发现,RSU1P2过表达可约2.1倍增加细胞迁移能力和侵袭能力,但sRSU1P2约35%降低这些能力。此外,血管生成拟态(VM)分析显示为RSU1P2对肿瘤生长起促进作用。结果表明,RSU1P2-full约1.8倍增加的HeLa或C33A细胞的VM,但与对照组比较SHR-RSU1P2则为呈现约40%抑制。为了进一步检查RSU1P2对体外肿瘤生长的影响,将相应细胞注射入7只裸鼠侧腹,20 d后处死裸鼠。与对照组相比,RSU1P2-full组的平均体重和肿瘤的体积增加。见表1、2。

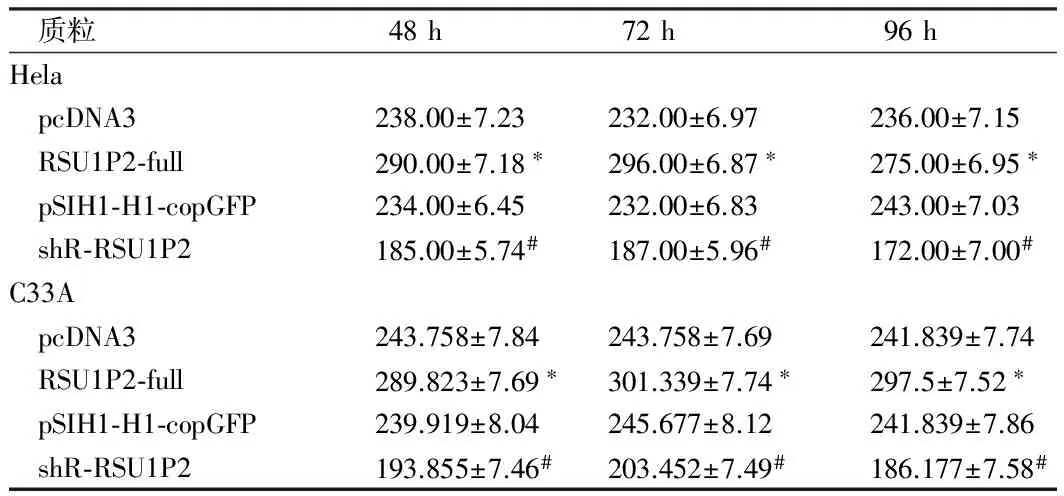
质粒48h72h96hHela pcDNA3238.00±7.23232.00±6.97236.00±7.15 RSU1P2⁃full290.00±7.18∗296.00±6.87∗275.00±6.95∗ pSIH1⁃H1⁃copGFP234.00±6.45232.00±6.83243.00±7.03 shR⁃RSU1P2185.00±5.74#187.00±5.96#172.00±7.00#C33A pcDNA3243.758±7.84243.758±7.69241.839±7.74 RSU1P2⁃full289.823±7.69∗301.339±7.74∗297.5±7.52∗ pSIH1⁃H1⁃copGFP239.919±8.04245.677±8.12241.839±7.86 shR⁃RSU1P2193.855±7.46#203.452±7.49#186.177±7.58#
注:与pcDNA3比较,*P<0.05;与pSIH1-H1-copGFP比较,#P<0.05


质粒增殖细胞数迁移细胞数穿膜细胞数VMHela pcDNA3144.593±5.64150.619±6.87144.862±4.68210.198±7.94 RSU1P2⁃full299.697±4.57∗299.543±5.63∗221.862±4.51∗390.397±6.43∗ pSIH1⁃H1⁃copGFP141.867±5.36145.809±6.35143.465±4.72210.232±7.38 shR⁃RSU1P243.178±5.39#56.071±7.58#40.045±5.32#142.568±7.84#C33A pcDNA3141.121±5.25144.597±6.24140.399±4.37182.083±7.16 RSU1P2⁃full219.733±4.36∗194.929±6.31∗312.112±5.07∗340.309±8.10∗ pSIH1⁃H1⁃copGFP141.907±5.18146.693±6.35142.587±4.68183.16±7.57 shR⁃RSU1P260.5805±4.67#65.6141±6.47#62.3919±4.28#118.042±6.73#
注:与pcDNA3比较,*P<0.05;与pSIH1-H1-copGFP比较,#P<0.05
2.2 RSU1P2的let-7的结合区域促进宫颈癌发生 为避免其他的miRNA干扰,本研究选择RSU1P2的一个21bp的片段,其包含let-7a中结合位点,构建含pcDNA3/RSU1P2-fragment A(pRSU1P2-A)的载体。RSU1P2-A促进了HeLa和C33A细胞的细胞活力、增殖能力、迁移和侵袭能力,与对照相比pRSU1P2-A增强了Hela和C33A中VM的形成。在裸鼠实验中与对照载体组相比较,RSU1P2-A组的平均体重和肿瘤体积的中分别提高了约110%。见表3、4。
2.3 RSU1P2促进细胞周期进程和EMT并减少细胞凋亡 RSU1P2-A过表达造成HeLa细胞中G1期细胞比例减少(从57.5%到48.9%),S期细胞增加(从22.1%到30.5%),与之相反,在敲除RSU1P2的HeLa细胞中G1期细胞的积累和S期细胞减少。RSU1P2-A处理的Hela细胞的增殖指数明显高于阴性对照,并且SHR-RSU1P2处理的Hela细胞增殖指数降低。在用pcDNA3/RSU1P2或SHR-RSU1P2处理的C33A细胞中亦观察到同样的现象。用TUNEL可视化测定凋亡细胞,结果表明与对照组相比pRSU1P2-A转染的细胞表现出凋亡减弱。在Western Blot实验中RSU1P2-A表达导致E-cadherin的减少以及Vimentin和ICAM-1的增加,在表达shR-RSU1P2的HeLa细胞则有完全相反的结果。见表5、6,图1。


质粒48h72h96hHela pcDNA3130.023±6.34136.157±6.75138.627±6.29 pRSU1P2⁃A203.406±6.39∗193.066±5.93∗186.417±6.08∗C33A pcDNA3203.333±6.96200.709±7.35196.602±7.10 pRSU1P2⁃A284.093±6.82∗293.743±7.26∗308.003±7.08∗
注:与pcDNA3比较,*P<0.05


质粒增殖细胞数迁移细胞数穿膜细胞数VMHela pcDNA3205.473±5.83183.293±5.7378.9028±6.01190.286±6.12 pRSU1P2⁃A476.924±5.74∗478.926±5.82∗350.005±6.14∗408.321±6.08∗C33A pcDNA3194.502±5.89171.467±6.3284.972±6.89194.25±7.23 pRSU1P2⁃A299.957±5.94∗248.332±6.29∗169.944±6.73∗327.054±7.35∗
注:与pcDNA3比较,*P<0.05


质粒细胞增殖数Hela pcDNA3258.351±5.35 pRSU1P2⁃A388.908±6.20∗ pSIH1⁃H1⁃copGFP259.395±5.71 shR⁃RSU1P2147.585±6.18∗C33A pcDNA3243.852±5.47 pRSU1P2⁃A337.031±6.16# pSIH1⁃H1⁃copGFP241.869±5.38 shR⁃RSU1P2124.9±6.05#
注:与pcDNA3比较,*P<0.05;与pSIH1-H1-copGFP比较,#P<0.05


质粒E⁃cadherinVimentinICAM⁃1pcDNA3258.24±3.42262.461±3.56263.509±3.58pRSU1P2⁃A213.038±3.45∗360.395±3.62∗339.4±3.29∗pSIH1⁃H1⁃-copGFP276.193±2.87278.325±2.47275.702±32.68shR⁃RSU1P2374.763±2.92#172.246±2.41#214.048±2.74#
注:与pcDNA3比较,*P<0.05;与pSIH1-H1-copGFP比较,#P<0.05
2.4 RSU1P2是let-7A的靶基因 通过碱基互补配对发现RSU1P2序列含有let-7a的结合区。将let-7a序列中含6个碱基突变的野生或突变片段连接在EGFP报告基因的下游进行克隆扩增,并与PRI-LET-7A或ASO-LET-7A一起分别转染HeLa细胞,与对照组相比let-7a的表达导致EGFP强度均减少了近31%,而ASO-let-7a细胞中EGFP强度则增加了2.2倍。qRT-PCR检测表明,let-7a的过度表达可约78%抑制RSU1P2的水平,而ASO-let-7A则可诱导RSU1P2,5倍增强其表达水平。见图2。
2.5 RSU1P2作为为let-7a的ceRNA调控相关基因 在HeLa细胞RSU1P2-A的表达阻遏了let-7a的抑制作用,但SHR-RSU1P2抑制两种转录产物和let-7A的靶基因IGF1R,N--MYC和EphA4表达的蛋白质水平。此外,let-7A表达水平与RSU1P2表达水平呈负相关,转染pRSU1P2-AHeLa细胞中let-7a的表达水平降低了50%,但转染SHR-RSU1P2的Hela细胞中let-7a表达水平显着增加约15倍。RSU1P2-A的表达显著增强IGF1R,N-myc和EphA4中EGFP强度;相反SHR-RSU1P2则显著减少了其EGFP强度。但let-7a水平的改变对含有3'UTR突变载体的let-7A靶细胞中的EGFP强度没有影响。 qRT-PCR反映,与对照相比转染pRSU1P2-A的小鼠这三个靶基因的表达均增加。qRT-PCR分析表明,患者样本中let-7a的表达下降,但在宫颈癌组织与相邻非肿瘤组织相比较,其靶基因RSU1P2表达增加。此外,在14对临床宫颈癌组织样本中IGF1R、N-myc和EphA4普遍有高水平的表达。为了证明RSU1P2 CERNA的作用是通过let-7a中的结合位点驱动的,我们仅表达野生型或转染含let-7A突变片段的RSU1P2的HeLa细胞并检测其细胞增殖。MTT、集落形成实验、透孔迁移和侵袭实验、VM和western blot分析表明,RSU1P2能抑制let-7A对恶性表型和其靶基因的作用。见表7~13。

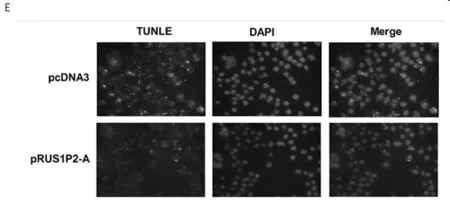
图1 RSU1P2加速细胞周期进程,抑制细胞凋亡并促进体外EMT过程。 在HeLa(A)和C33A(B)细胞中通过流式细胞仪分析转染细胞的细胞周期进程(逐级)。 HeLa细胞中的TUNEL检测 通过TUNEL(绿色荧光)显示凋亡小体,细胞核被DAPI染色(蓝色荧光)(C)

图2 RSU1P2作为let-7a的直接目标的验证。显示了预测的let-7a结合位点和含有野生型或突变体结合位点的RSU1P2区段的序列。 将RSU1P2(RSU1P2 WT)和缺失let-7a结合位点的突变体衍生物克隆到EGFP编码区的下游


质粒RNA表达水平IGF1RN⁃MYCEphA4蛋白质表达水平IGF1RN⁃MYCEphA4pcDNA3119.32±3.45121.84±4.12120.57±4.20277.69±3.51126.05±3.48171.93±3.65pRSU1P2⁃A244.35±3.52∗313.08±4.08∗374.26±4.26∗∗434.93±3.62∗341.55±3.50∗128.43±3.56∗pSIH1⁃H1⁃copGFP121.47±3.46118.32±4.15118.96±4.15276.63±3.16130.12±3.21169.86±3.68shR⁃RSU1P242.15±3.41#56.01±4.11#33.95±4.17#185.46±3.12#63.02±3.19#455.71±3.72#
注:与pcDNA3比较,*P<0.05,与pSIH1-H1-copGFP比较,#P<0.05


质粒IGF1RN⁃MYCEphA4pcDNA3343.24±6.46345.12±5.73352.67±6.47pRSU1P2⁃A290.43±5.89∗371.53±5.85∗337.58±5.42∗pSIH1⁃H1⁃copGFP345.13±5.82343.24±6.12339.47±6.25shR⁃RSU1P2286.66±6.04#356.44±6.32#320.61±5.97#
注:与pcDNA3比较,*P<0.05,与pSIH1-H1-copGFP比较,#P<0.05


质粒let⁃7a的表达水平pcDNA3153.56±3.67pRSU1P2⁃A72.50±3.12∗pSIH1⁃H1⁃copGFP156.57±3.27shR⁃RSU1P2398.05±3.69∗
注:与pcDNA3比较,*P<0.05


质粒IGF1RN⁃MYCEphA4pcDNA30.21±4.250.21±9.820.20±9.07pRSU1P2⁃A0.70±5.42∗0.82±6.53∗0.62±6.77∗
注:与pcDNA3比较,*P<0.05


质粒48h72h96hpcDNA3+pri⁃let⁃7a0.52±6.730.50±7.410.53±6.92pcDNA30.70±6.95∗0.70±7.11∗0.69±8.73∗pri⁃let⁃7a+pRSU1P2⁃A0.90±6.99#0.92±4.57#0.84±6.37#
注:与pcDNA3+pri-let-7a比较,*P<0.05;与pcDNA3比较,#P<0.05


质粒增殖细胞数迁移细胞数穿膜细胞数VMpcDNA3+pri⁃let⁃7a0.39±6.380.54±6.250.56±5.830.31±5.89pcDNA30.67±6.15∗0.69±6.20∗0.71±5.39∗0.69±4.78∗∗pri⁃let⁃7a+pRSU1P2⁃A0.72±6.27#0.76±6.14#0.77±5.72#0.81±5.78#
注:与pcDNA3+pri-let-7a比较,*P<0.05;与pcDNA3比较,#P<0.05


质粒IGF1RN⁃MYCEphA4pcDNA3+pri⁃let⁃7a0.78±4.030.44±7.350.47±6.98pcDNA31.04±7.24∗1.04±5.33∗1.03±6.67∗pri⁃let⁃7a+pRSU1P2⁃A0.96±6.08#1.134±5.47#1.00±6.26#
注:与pcDNA3+pri-let-7a比较,*P<0.05;与pcDNA3比较,#P<0.05
3 讨论
哺乳动物基因组的高通量研究已经揭示,哺乳动物基因组可被转录成数万种lncRNAs[1]。虽然一小部分lncRNAs已经发现其功能特征,但大部分的lncRNA的功能是未知的。最近,出现的报告表明,lncRNAs是在各种癌症中起着重要的作用,存在致癌和抑癌两种潜在作用[6-8]。在回顾lncRNA数据库及相关文献中发现RSU1P2是Ras抑制蛋白的伪基因,在最近的研究中RSU1P2已经显示出与RSU1不同的功能[9]。 RSU1(约33 kD)能抑制Ras依赖的原癌基因的转化,从而促进细胞粘附和侵入,且降低细胞增殖[28]。 RSU1的沉默导致乳腺癌细胞增殖及抑制其细胞凋亡[10]。但是目前对RSU1P2的功能还不清楚。了解lncRNAs对生理和病理条件的影响对说明lncRNAs的功能和调节机制是至关重要的。
通过本研究中的实验可以的出一些重要的结论。首先,RSU1P2在Hela和C33A细胞中表达显著增加,表明RSU1P2在宫颈癌组织中高表达,并能提高增殖、血管生成、侵袭和迁移能力,促进EMT和HeLa和C33A细胞的G1/S转变,从而充当癌基因的角色。此外,动物实验证明RSU1P2可促进宫颈癌肿瘤的发生,故RSU1P2在体内和体外均可以发挥致瘤的功能。第二, RSU1P2螯合let-7a可以有效地扰动let-7a与其靶基因IGF1R,N-myc和EphA4的之间的相互作用。大量的研究已经证明,IGF1R和N-myc基因是let-7家族的靶基因[10,11],也有研究报道EphA4的是let-7a的靶基因[12]。 IGF1R在各种癌症细胞中显著表达,通过激活细胞内的PI3K和MAPK途径致癌,而且促进细胞增殖和转移[13,14]。 N-myc基因是Myc家族原癌基因中的一种,在神经母细胞瘤细胞中高表达,可作为治疗失败的遗传标记。有研究报道N-myc基因也可促进神经细胞瘤细胞的迁移[15]。 EphA4基因属于Eph受体酪氨酸激酶家族,并已被证明在不同类型的人类癌症中发挥作用[6,17]。 EphA4在人脑胶质瘤U251细胞系中通过EphA4-FGFR1途径促进细胞的增殖和迁移[18], 结直肠癌发生肝转移和EphA4基因的高度表达与EphB2基因的低表达相关[19]。本研究结果表明RSU1P2在宫颈癌肿瘤细胞中作为ceRNA促进癌细胞的发生发展,而且在体外的人临床样本中得到了同样的结果:与相应的邻近正常组织相比,宫颈癌组织样本中let-7A表达下降而RSU1P2表达增加。此外,生物信息学分析发现RSU1P2含有其他的miRNA,如miR-122、 miR-143和miR-9的多个结合位点,因此RSU1P2可调节miRNA分子及其靶基因的分布,形成了RNA-RNA调节通路。
综上所述,通过调节let-7A与其靶基因的分配RSU1P2可以促进癌细胞的发生发展。了解RSU1P2对恶性肿瘤细胞的影响有助于阐明宫颈癌的发病机制,为宫颈癌的靶向治疗提供新依据。
1 Cech TR,Steitz JA.The noncoding RNA revolution-trashing old rules to forge new ones.Cell,2014,157:77-94.
2 Yang L,Duff MO,Graveley BR,et al.Genomewide characterization of non-polyadenylated RNAs.Genome biology,2011,12:R16.
3 Gibb EA,Brown CJ,Lam WL.The functional role of long non-coding RNA in human carcinomas.Molecular cancer,2011,10:38.
4 Lee DF,Su J,Kim HS,et al.Modiling familial cancer with induced pluripotent stem cells.Cell,2015,161:240-254.
5 Tay Y,Rinn J,Pandolfi PP.The multilayered complexity of ceRNA crosstalk and competition.Nature,2014,505:344-352.
6 徐丹,李军川.肺腺癌组织和血清中lncRNA-ATB表达及临床意义分析.临床肿瘤学杂志,2016,21:218-222.
7 Karreth FA,Tay Y,Perna D,et al.In vivo identification of tumor-suppressive PTEN ceRNAs in an oncogenic BRAF-induced mouse model of melanoma.Cell,2011,147:382-395.
8 季青,李琦.长链非编码RNA在肿瘤发生、发展中的作用研究现状.中国癌症杂志,2011,21:232-235.
9 Vasiliki G,Dimitrios PB.Elimination of Ras Suppressor-1 from hepatocellular carcinoma cells hinders their in vitro metastatic properties.Anticancer research,2015,35:1509-1512.
10 Gao L,Wang X,Wang X,et al.IGF-1R,a target of let-7b,mediates crosstalk beween IRS-2/Akt and MAPK pathways to pormote proliferation of oral squamous cell carcinoma.Oncotarget,2014,5:2562-2574.
11 潘延凤,冯磊,魏凌雁,等.长链非编码RNA在肝癌中表达谱的变化.中华实验外科杂志,2011,28:406-407.
12 朱竹先,余晨,邱忠民,等.LncRNA PCGEM1和雄激素受体在前列腺癌中的共定位表达及临床意义.中国癌症杂志,2016,26:320-325.
13 Deyell RJ,Attiyeh EF.Advances in the understanding of constitutional and somatic genomic alterations in neuroblastoma.Cancer genetics,2011,204:113-121.
14 Sureban SM,May R,Weygant N,et al.XMD8-92 inhibits pancreatic tumor xenograft growth via a DCLK1-dependent mechanism.Cancer Letters,2014,531:151-161.
15 黄时军,杨军,孙辉,等.长链非编码RNA-H19促小细胞肺癌细胞株A549上皮-间质转化及侵袭.中国癌症杂志,2015,25:940-944.
16 夏天.长链非编码RNA以竞争性内源RNA角色调控胃癌发生的机制研究.宁波大学,2014.
17 Geisler S,Coller J.RNA in unexpected places:long non-coding RNA functions in diverse cellular contexts.Nat Rev Mol Cell Biol,2013,14:699-712.
18 Ingo L,Dana-Lynn TK.MycN promotes TRPM7 expression and cell migration in neruoblastoma through a process that involves polyamines.FEBS OPen Bio,2014,24:966-975.
19 徐小雯,袁捷,左志贵,等.与放疗抵抗相关的长链非编码RNA在不同放疗敏感性结直肠癌细胞株中的表达.中华胃肠外科杂志,2014,17:1096-1100.
EffectsofLncRNARSU1P2oncervicalcancercellsinvitro
JIANGQiong.
DepartmentofGynecology,TCMHospitalofShiyanCity,Hubei,Shiyan442012,China
ObjectiveTo observe the effects of LncRNA RSU1P2 on cervical cancer cells in vitro.MethodsThe overexpression of RSU1P2 was performed by transfection plasmid in Caski,HeLa and C33A cells,then the effects of RSU1P2 on cell vitality were detected by MTT test and colony formation assay.Moreover the effects of RSU1P2 on cell metastasis and invasion ability were measured by Transwell,and its effects on cell cycle and cell apoptosis were determined by flow cytometry. The changes of EMT related protein were detected by Western Blot.Besides the effects of RSU1P2 on cervical cancer tissues of nude mice were detected in vivo.ResultsAfter overexpression of RSU1P2 in Hela and C33A cells,the cell abilities of proliferation,metastasis,invasion and VM were significantly increased (P<0.05),and the cell proportion at phase G1,phase S and the number of apoptotic cells were significantly decreased (P<0.05).As compared with those in control group,the average weight and tumor volume in nude mice with RSU1P2-A were increased by approximately 110% (P<0.05).ConclusionThe lncRNA RSU1P2 can promote the pathogenesis and development of cervical cancer by regulating the distribution of let-7A and its target genes.
long chain non-coding RNA; cervical cancer; ceRNA; Let-7A
10.3969/j.issn.1002-7386.2017.20.001
R 711.74
A
1002-7386(2017)20-3045-06
2017-04-16)
442012 湖北省十堰市中医医院妇科

