COPD大鼠原代肺动脉平滑肌细胞中MCP-1、TGF-β1和TLR4蛋白的检测*
蒋 明 ,王昌明,韩旭惠,杨 丹,马礼兵,陈 峰,吕 倩
桂林医学院附属医院呼吸内科 广西桂林 541001
COPD大鼠原代肺动脉平滑肌细胞中MCP-1、TGF-β1和TLR4蛋白的检测*
蒋 明 ,王昌明#,韩旭惠,杨 丹,马礼兵,陈 峰,吕 倩
桂林医学院附属医院呼吸内科 广西桂林 541001
慢性阻塞性肺疾病;Toll样受体4;单核细胞趋化蛋白-1;转化生长因子-β1;大鼠
目的:探讨慢性阻塞性肺疾病(COPD)大鼠远端原代肺动脉平滑肌细胞(PASMCs)中单核细胞趋化蛋白-1(MCP-1)、转化生长因子-β1(TGF-β1)的分泌情况及其与Toll样受体4 (TLR4)信号通路的相关性。方法通过脂多糖(LPS)诱导建立大鼠COPD模型,分离培养、鉴定原代大鼠PASMCs,以LPS诱导PASMCs,然后分组(对照组、LPS组、TAK-242组,LPS+TAK-242组)培养细胞,用Western blot法检测各组PASMCs中TLR4的表达,ELISA法检测细胞培养上清液MCP-1、TGF-β1的浓度,并进行相关性分析。结果LPS组较对照组PASMCs中TLR4的表达水平上调(P<0.05),细胞培养上清液中MCP-1、TGF-β1的含量升高(P<0.05);TAK-242组PASMCs中TLR4的表达水平下调(P<0.05),上清液中MCP-1、TGF-β1与TLR4无相关性。结论LPS可诱导大鼠原代PASMCs合成分泌MCP-1、TGF-β1,同时上调TLR4表达水平。
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)主要的病理特征为血管炎症反应和血管重塑。肺动脉平滑肌细胞(pulmonary artery smooth muscle cells,PASMCs)是肺血管重塑的主要效应细胞。研究[1-3]表明,当受到有害因素刺激时,PASMCs表型发生转化,合成、分泌炎症因子及基质蛋白的活性增加,募集炎症细胞聚集和炎症级联放大,并促进PASMCs的增殖和迁移,促进肺血管重塑。单核细胞趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1)是一种趋化性细胞因子,可趋化激活巨噬细胞,参与介导继发性炎症反应[4]。转化生长因子-β1(transforming growth factor-β1,TGF-β1)属于TGF-β家族,是近年来新发现的调节细胞生长、分化的活性多肽类物质,对细胞的生长和分化等多种病理、生理过程有重要调节作用[5]。有研究[6]报道,与正常人比较,急性加重期和缓解期COPD患者血清MCP-1、TGF-β1的水平明显升高。Toll样受体4 (Toll-like receptor 4,TLR4)是第一个被发现的哺乳动物TLR,可被肽聚糖及脂多糖(lipopolysaccharides,LPS)等激活来调节炎症反应[7]。作者通过建立COPD大鼠模型,分离培养大鼠原代PASMCs,探究COPD大鼠PASMCs合成、分泌MCP-1、TGF-β1的水平同TLR4信号通路的关系。
1 材料与方法
1.1实验动物、主要试剂和仪器SPF级Wistar大鼠24只,雌雄各半,体重(200±20)g,6~8周龄,购自桂林医学院动物实验中心,大鼠在室温、安静和避强光环境中自由饮水和进食。实验动物合格证号:SCXKG 2014-0001。LPS(美国 Sigma 公司),翻盖红色金牌黄果树香烟(贵阳卷烟厂出品,焦油量15 mg,烟气烟碱量1.2 mg),DMEM培养基、胎牛血清(美国Gibco公司),TLR4鼠单克隆抗体(美国Abcam公司),辣根过氧化物酶标记的羊抗鼠二抗、β-actin小鼠单克隆抗体(北京中杉金桥生物技术有限公司),总蛋白提取试剂盒(上海碧云天生物技术有限公司),DAB显色试剂盒(武汉博士德生物工程有限公司),ELISA 试剂盒(美国 BENDER 公司),自制91 cm×42 cm×62 cm有机玻璃舱,倒置相差显微镜(日本 Olympus),美国Bio-Rad公司蛋白电泳及转膜仪、450型全自动酶标仪。
1.2动物模型的建立Wistar大鼠适应环境1周后,模型组于实验第1、14天经气道内注入LPS,每次200 μg/只,予自制有机玻璃舱内烟熏1 h/d,共8周,舱内有小孔可与外界空气相通,保持舱内气压与外界相等,舱内放置适量无水氯化钙吸收水分、保持干燥。对照组于实验第1、14天经气道注入等量生理盐水,其他不做任何处理,与模型组大鼠在同等条件下饲养8周。
1.3大鼠远端原代PASMCs分离、培养及鉴定采用酶消化法结合组织块贴壁法。Wistar 大鼠腹腔注射100 g/L水合氯醛麻醉,体积分数75%乙醇浸泡大鼠5 min,开胸取心肺,取肺动脉3级以下分支,分离血管中膜,Ⅰ型胶原酶37 ℃水浴消化15~20 min,离心、吸出消化酶,加入含体积分数25%胎牛血清的DMEM高糖培养液,置 37℃、体积分数5%CO2培养箱内培养,4 d左右可见细胞从组织块周围萌出,10 d左右细胞生长融合达培养瓶的90%以上时即消化传代,选用第3~6代(达对数生长期)细胞用于该实验。PASMCs细胞爬片行免疫细胞化学染色鉴定。
1.4PASMCs中TLR4蛋白含量的Westernblot检测用LPS、TAK-242干预细胞后按如下方法进行分组(每组均设6个复孔):对照组不做任何处理;LPS组加入LPS(终质量浓度为1 mg/L),TAK-242组(终浓度为1 μmol/L)、LPS+TAK-242组(LPS终质量浓度为1 mg/L,TAK-242终浓度为1 μmol/L)培养24 h。提取PASMCs总蛋白,测定总蛋白浓度,计算上样量后上样,使每孔蛋白总量一致,然后进行SDS-PAGE凝胶电泳约120 min;转膜,将PVDF膜用封闭液封闭2 h,加入TLR4单抗(按11 000稀释)4 ℃过夜,TBST漂洗膜3次, 10 min/次;二抗山羊抗鼠IgG(按15 000稀释)室温孵育2 h,最后发光,所得图像用Imag J软件进行灰度值分析。
1.5各组细胞培养上清液中MCP-1、TGF-β1水平的ELISA法检测细胞培养、分组和样本量同1.4。采用450型 ELISA 酶标仪,于波长595 nm处测定光密度值,利用 Revelation Spectra MR软件绘制标准曲线,通过标本的光密度值在标准曲线上得到标本的MCP-1、TGF-β1浓度。具体操作步骤按照试剂盒说明。
1.6统计学处理采用SPSS 18.0统计软件分析数据,应用2×2析因设计的方差分析比较各组PASMCs中TLR4蛋白含量和细胞培养上清液中MCP-1、TGF-β1水平的差异,检验水准α=0.05。
2 结果
2.1大鼠COPD建模的HE染色判断及PASMCs免疫细胞化学染色法鉴定见图1(箭头所标处为肺动脉)。对照组肺组织(图1A)肺泡结构完整,无炎细胞浸润;模型组肺组织(图1B)肺泡壁断裂、肺泡融合肺大泡形成,肺动脉平滑肌层明显增厚,大量炎细胞浸润,符合COPD大鼠肺组织病理改变。Α-SM-actin 免疫组织化学染色,光镜下见胞质内大部分肌动蛋白染成棕黄色,呈现与细胞长轴平行的丝状物,证实为 PASMCs(图1C)。
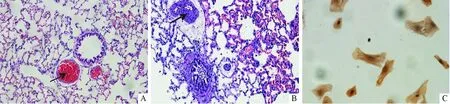
A:对照组;B:模型组;C:肌动蛋白免疫细胞化学染色。 图1 大鼠COPD建模的HE染色判断及PASMCs免疫细胞化学染色法鉴定(×200)
2.2各组PASMCs中TLR4蛋白含量的比较见图2及表1。LPS组细胞TLR4表达较对照组明显升高(P<0.05);TAK-242组细胞TLR4的表达较对照组降低(P<0.05);TAK-242组细胞较LPS组中TLR4的表达明显降低(P<0.01)。
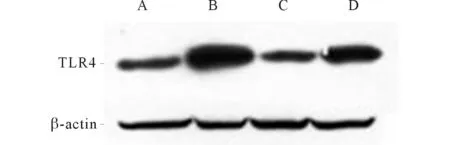
A:对照组;B:LPS组;C:TAK-242组;D:LPS+TAK-242组。 图2 各组PASMCs中TLR4的表达

组别TLR4对照组0.917±0.019LPS组2.912±0.079TAK-242组0.623±0.006LPS+TAK-242组1.899±0.003
FLPS=43 461.403,FTAK-242=19 213.336,F交互=16 174.815;P均<0.001。
2.3各组细胞培养上清液中MCP-1、TGF-β1水平的比较见表2。

表2 各组细胞培养上清液中MCP-1、TGF-β1水平变化比较(n=6)
2.4MCP-1、TGF-β1表达水平与TLR4含量相关性分析COPD大鼠PASMCs上清液中MCP-1、TGF-β1表达水平与TLR4含量无关(rP=0.471和0.352,P>0.05)。
3 讨论
COPD是一种以气流受限为特征的肺部疾病,主要表现为加速下降的肺功能,严重影响患者生活质量,并带来沉重经济负担的疾病[8-9]。血管炎症反应和肺血管重塑是其主要病理特征。
TLRs是一类天然的免疫受体,促进细胞因子的合成与释放,引发炎症反应。TLR4是第一个被发现的哺乳动物TLR,属于Ⅰ型跨膜蛋白受体,可被病原微生物、肽聚糖(PGN)、LPS等激活,产生趋化因子、黏附分子、急性期蛋白及细胞因子来调节炎症反应。气道注入LPS和被动吸烟可能通过NF-κB信号通路引起肺损伤继而引发COPD,而TLR4在这一过程中起到重要作用[10]。该实验采用气道内注入LPS及香烟烟雾暴露方法建立COPD大鼠模型。COPD患者气道炎性细胞的浸润主要为淋巴细胞和巨噬细胞[11]。MCP-1是一种重要的趋化因子,与巨噬细胞的激活和趋化明显相关[12]。TGF-β1能够刺激成纤维细胞合成细胞外基质并抑制其降解,致使气道管壁增厚进而引发气道重塑,导致肺功能的进行性损害[13]。MCP-1和TGF-β1在COPD的发生、发展中起重要作用,与正常人比较,COPD患者急性加重期和缓解期MCP-1、TGF-β1的水平明显升高[6]。有研究[14]证实,在血管平滑肌细胞中TLR4/NF-κB信号通路可介导MCP-1的表达。该实验通过分离培养原代PASMCs,LPS诱导体外培养的细胞,发现TLR4的表达明显升高,细胞上清液中合成分泌MCP-1、TGF-β1的水平也明显升高用。为进一步探究PASMCs合成分泌MCP-1、TGF-β1的水平与TLR4之间的关系,以TLR4特异性抑制剂TAK-242干预细胞,发现可明显下调TLR4的表达,但细胞培养上清液中MCP-1、TGF-β1的水平并不随之降低。有研究[15]报道,COPD患者急性加重期组织因子(tissue factor,TF)和MCP-1、TGF-β1的水平明显高于正常人,且TF与MCP-1、TGF-β1之间有明显正相关性。由此推测大鼠原代PASMCs合成分泌MCP-1、TGF-β1的水平除了受TLR4的影响外可能还有其他信号途径的参与,但其具体机制目前仍不十分清楚,作者将在接下来的研究中做进一步的探讨。
[1] NAZARI-JAHANTIGH M,WEI Y,SCHOBER A.The role of microRNAs in arterial remodelling[J].Thromb Haemost,2012,107(4):611
[2] 李满祥,卢家美.肺动脉平滑肌细胞增殖的分子机制及干预的研究进展[J].西安交通大学学报(医学版),2014,35(3):285
[3] YI B,CUI J,NING JN,et al.Over-expression of PKGIα inhibits hypoxia-induced proliferation, Akt activation, and phenotype modulation of human PASMCs: the role of phenotype modulation of PASMCs in pulmonary vascular remodeling[J].Gene,2012,492(2):354
[4] 张群,王竞秋.大鼠急性炎髓损伤后MCP-1及BDNF表达变化的实验研究[J].甘肃医药,2013,32(3):184
[5] 袁晟.转化生长因子-β 对牙种植体骨结合的影响[J].医学研究生学报,2012,25(2):212
[6] 黄爱霞.单核细胞趋化蛋白MCP-1、组织因子和转化生长因子β1在慢性阻塞性肺疾病中的意义[J].热带医学杂志,2015,15(1):70
[7] PACE E,GIARRATANO A,FERRARO M,et al. TLR4 upregulation underpins airway neutrophilia in smokers with chronic obstructive pulmonary disease and acute respiratory failure[J].Hum Immunol,2011,72(1):54
[8] ZHONG N,WANG C,YAO W,et al.Prevalence of chronic obstructive pulmonary disease in China: a large, population-based survey[J].Am J Respir Crit Care Med,2007,176(8):753
[9] FANG X,WANG X,BAI C.COPD in China: the burden and importance of proper management[J].Chest,2011,139(4):920
[10] MENG Y, YU CH, LI T, et al.Expression and significance of Toll-like receptor-4 in rats lung established by passive smoking or associated with intratracheal instillation of lipopolysaccharide[J]. Zhonghua Yi Xue Za Zhi,2013,93(28):2230
[11]VALIPOUR A,SCHREDER M,WOLZT M,et al.Circulating vascular endothelial growth factor and systemic inflammatory markers in patients with stable and exacerbated chronic obstructive pulmonary disease[J].Clin Sci (Lond),2008,115(7):225
[12]KO FW,LAU CY,LEUNG TF,et al.Exhaled breath condensate levels of 8-isoprostane, growth related oncogene alpha and monocyte chemoattractant protein-1 in patients with chronic obstructive pulmonary disease[J].Respir Med,2006,100(4):630
[13] WU L,CHAU J,YOUNG RP,et al.Transforming growth factor-beta1 genotype and susceptibility to chronic obstructive pulmonary disease[J].Thorax,2004,59(2):126
[14]徐斌,张延斌,张春华,等.TLR4/NF-κB信号通路ox-LDL诱导的血管平滑肌细胞分泌MCP-1中的作用[J].心血管康复医学杂志,2013,22(3):215
[15] WANG Y, ZHENG Y, ZHAI YL, et al. Comparative analysis of MCP-1 and TF in elderly patients with acute exacerbations of COPD and its clinical significance[J]. Eur Rev Med Pharmacol Sci,2015,19(2):215
(2016-11-27收稿 责任编辑赵秋民)
Detection of MCP-1,TGF-β1 and TLR4 protein in primary pulmonary artery smooth muscle cells of COPD rats
JIANGMing,WANGChangming,HANXuhui,YANGDan,MALibing,CHENFeng,LYUQian
DepartmentofRespiratoryMedicine,GuilinMedicalUniversityAffiliatedHospital,Guilin,Guangxi541001
chronic obstructive pulmonary disease;Toll like receptor-4;monocyte chemoattractant protein 1;transforming growth factor β1;rat
Aim: To probe into the secretion of monocyte chemoattractant protein 1(MCP-1),transforming growth factor β1(TGF-β1) in primary pulmonary artery smooth muscle cells(PASMCs) of chronic obstructive pulmonary disease(COPD) rats and the correlation with toll-like receptor 4(TLR4) signaling pathways. Methods: The COPD rat model was established, and the PASMCs were separated, induced by LPS, and then divided into control group,LPS group,TAK-242 group,and LPS+TAK-242 group. The expression of TLR4 in PASMCs of each group was detected by Western blot, and the concentrations of MCP-1 and TGF-β1 in cell culture fluid were determined by ELISA, and at last a correlation analysis was conducted.Results: In contrast with the control group, the expression of TLR4 in PASMCs of the LPS group was inecreased(P<0.05) and the concentrations of MCP-1 and TGF-β1 in cell culture fluid were increased(P<0.05). The expression of TLR4 in PASMCs of the TAK-242 group was down-regulated(P<0.05) and the concentrations of MCP-1 and TGF-β1 in cell culture fluid showed no correlation with the expression of TLR4.Conclusion: LPS can induce PASMCs of rats to synthesize and secrete MCP-1 and TGF-β1, and the TLR4 is up-expressed at the same time.
10.13705/j.issn.1671-6825.2017.05.031
R563.3
*国家自然科学基金资助项目 81360010;广西省卫生厅自然科学基金资助项目 S201603
#通信作者,男,1963年11月生,博士,教授,主任医师,研究方向:慢性阻塞性肺疾病,E-mail:wcm@glmc.edu.cn

