猪细小病毒感染PK-15细胞后TLRs转录时相的变化
周 雍, 靳晓慧, 李炳晓, 景亚星, 韩 丽, 张利卫,2, 魏战勇
(1.河南农业大学牧医工程学院,河南 郑州 450002; 2.河南省动物性食品安全重点实验室,河南 郑州 450002)
猪细小病毒感染PK-15细胞后TLRs转录时相的变化
周 雍1,2, 靳晓慧1,2, 李炳晓1,2, 景亚星1, 韩 丽1, 张利卫1,2, 魏战勇1,2
(1.河南农业大学牧医工程学院,河南 郑州 450002; 2.河南省动物性食品安全重点实验室,河南 郑州 450002)
研究猪细小病毒(Porcine Parvovirus,PPV)感染猪肾传代细胞(PK-15 cells)后Toll样受体(Toll-like receptors,TLRs)表达水平变化情况,为探明PPV感染机制提供理论基础。试验利用荧光定量PCR方法检测PPV感染PK-15细胞后TLR1-10的转录时相变化。结果显示,PPV感染PK-15细胞后,TLR1在PPV感染后3h表达上调,约为对照组细胞的3.1倍,其他时段均低于正常水平;TLR3和TLR7 mRNA表达水平在病毒感染早期均低于正常水平;TLR4和TLR8的mRNA含量均在感染后3、12、36 h表达上调,TLR10分别在在3h和36 h表达上调,其他时段均不同程度的降低;而TLR2和TLR9 mRNA表达水平在感染后24 h开始升高,并于48 h达到峰值,分别为对照水平的10.1倍和26.7倍。研究表明,PPV感染PK-15细胞后能够诱导细胞上TLR2和TLR9 在mRNA水平显著上调,PPV感染可能通过TLR2和TLR9受体介导感染。
猪细小病毒;Toll样受体;PK-15细胞;转录时相
猪细小病毒(Porcine Parvovirus,PPV)是引起母猪繁殖障碍为主要特征的重要病原体之一,与其他病原混合感染率极高,增强其他病原的感染性,给养猪业造成了严重的经济损失[1-2]。目前,该病在欧洲、美洲、亚洲的多个国家均有流行,中国已先后在北京、上海、吉林、黑龙江、四川和浙江等地分离到该病毒,血清学调查阳性率为80%[3]。目前对于其感染致病机制了解甚少,特别是通过何种受体介导感染更是不甚了解。Toll样受体 ( Toll-like receptor, TLR )是TLRs家族的重要成员之一,可以通过识别病毒的单链RNA(ssRNA)诱导机体表达干扰素α(IFN-α)和白细胞介素12(IL-12)等细胞因子,对病毒做出相应的免疫应答。其中,TLR2识别范围较广, 可识别大部分现已发现的病原体相关分子模式 (Pathogen-Associated Molecular Pattem, PAMP)结构,TLR1和TLR6作为辅助受体同TLR2组成异二聚体发挥作用[4]。TLR3参与对病毒感染细胞后复制产生dsRNA的识别[5]。TLR4 可识别病毒的包膜蛋白,促进释放β干扰素( interferon β,IFN-β) 及多种细胞因子和炎性介质,介导抗病毒免疫反应,并参与致病[6]。TLR5主要识别大多数杆菌都具有的一个可溶性因子鞭毛蛋白。TLR7、TLR8主要识别多种小分子抗病毒化合物以及病毒的ssRNA[7]。TLR9介导对细菌DNA CpG序列的识别[8]。到目前为止,已有13种TLR被发现。猪体内存在10种TLR,即TLR1~TLRl0,除TLR8外,其余猪TLRs的完整编码序列都已清晰[9]。Toll样受体是一个庞大的I型跨膜受体蛋白家族,TLR3、TLR7、TLR8、TLR9都是介导病毒免疫的重要受体。LUND等[10]用基因敲除技术研究TLR9是否介导了HSV-2诱导IFN-II分泌,结果显示这个过程需要TLR9介导。KURT-JONES等[11]发现呼吸道合胞病毒(RSV)的一些融合蛋白能诱生促炎症细胞因子,与正常对照小鼠比较,RSV在TLR4缺陷小鼠中的复制量更多且持续时间更长,提示TLR4能促进机体对病毒的清除。因此,对动物体内的TLRs进行准确定量,可更好地了解动物机体通过免疫应答抵抗病毒感染的致病机制[12]。本试验利用SYBR Green I实时定量PCR 检测方法,分不同时间点定量检测PPV感染PK-15细胞后Toll-like受体1~10的mRNA的水平变化[13],为研究猪细小病毒的感染机制提供基础数据和依据,并为预防和控制猪细小病毒的感染奠定基础。
1 材料与方法
1.1材料
1.1.1 细胞和病毒 猪肾细胞PK-15(Porcine Kindney-15 cells)细胞购买自中国兽药监察所,并由河南省动物性食品安全重点实验室传代保存;猪细小病毒李氏毒株,病毒滴度为10-6.5·(0.1 mL)-1,由河南省动物性食品安全重点实验室传代保存。
1.1.2 主要仪器 台式离心机(Sigma, Germany); PCR 仪(Thermo, America);CFX96 Real-Time PCR 仪(Roche, Switzerland);紫外凝胶成像系统(SIM, America); LEICA DMIL 倒置显微镜(Leica, Germany);CO2培养箱(Thermo, America)。
1.1.3 主要试剂 E.Z.N.A Total RNA KitⅠ(OMEGA);HiFiScript 1st Strand cDNA Synthesis Kit(康为世纪公司);RPMI Medium 1640(Solarbio);胰蛋白酶-EDTA消化液(Solarbio);DEPC水(Sigma, America);SYBR®Premix Ex Taq TMII(TaKaRa, Japan);胎牛血清(Hyclone, America);琼脂糖(Promega, America);其他试剂均为国产或进口分析纯。
1.1.4 工作液配制 10%细胞培养液:450 mL的RPMI-1640培养液中加入50 mL的胎牛血清,混匀后4 ℃保存备用。
2%细胞维持液:196 mL的RPMI-1640培养液中加入4 mL的胎牛血清,混匀后4 ℃保存备用。
D-Hank’s液:NaCl 8 g,葡萄糖1 g,KClO34 g,NaHCO30.35 g,Na2HPO4·12H2O 0.152 g,KH2PO40.06 g,溶于900 mL ddH2O中,定容至1 000 mL,高压灭菌20~30 min,4 ℃保存备用。
1.2方法
1.2.1 PK-15细胞的培养和PPV病毒的增殖 按常规细胞培养方法[14],用1640培养液加10%胎牛血清作为PK-15细胞的培养液,置37 ℃、5%CO2培养箱中培养,直至PK-15细胞生长状态稳定方可进行后续试验。
传代培养细胞,待PK-15细胞培养至80%时,加入适量PPV病毒后继续置于5% CO2培养箱中吸附,吸附1~3 h后,加2%的细胞维持液继续培养24~48 h,待贴壁细胞80%发生病变时,将细胞瓶置于-20 ℃冰箱冷冻,再于室温下融化,如此反复冻融3次细胞全部脱落,吸至离心管中,离心除去细胞碎片后于-80 ℃保存备用。
1.2.2 病毒半数细胞感染量(TCID50)的测定 用2%的RPMI-1640培养液在1.5 mL离心管中10倍倍比稀释PPV病毒液(稀释度为10-1~10-7),将稀释好的病毒接种于96孔细胞培养板,每个稀释度各作8个重复孔,每孔100 μL,设一列正常细胞对照。逐日观察细胞病变并记录结果,按照Karber法计算TCID50。
1.2.3 病毒感染和样品收集 将PK-15细胞用胰酶消化后,接种于于6孔细胞培养板,待细胞贴壁面积达到80%以上时,用D-hank’s洗2次,将PPV接种于PK-15细胞30 μL(MOI=1),每孔做2个重复,另设2孔作对照。将6孔板置于5% CO2培养箱中吸附2 h后,弃液体,添加1.5 mL 2%的细胞维持液,继续培养。分别于感染后0、1、3、6、12、24、36、48、72 h用显微镜观察并记录细胞状态,之后对样品进行收集。收集样品时吸取上清于EP管;再次加1.5mL 2%细胞培养液,反复冻融2次,吹打均匀,吸入EP管中,于-80 ℃冰箱保存备用。
1.2.4 RNA提取和反转录 参照 E.Z.N.A Total RNA KitⅠ说明书提取细胞总RNA,具体方法和步骤参照文献[15]进行 ,以提取的总RNA为模板进行反转录,反转录合成的cDNA作为荧光定量PCR模板。
1.2.5 荧光定量PCR 参照GenBank公布的猪TLR1~TLR10序列,使用Primer Premier 5.0软件设计引物(如表1),并由上海生工生物工程技术服务有限公司合成。以β-actin基因为内参基因,进行相对荧光定量PCR,反应体系为20 μL,其中SYBR Premix Ex Taq 10 μL,上、下游引物(25 pmol·L-1)各0.35 μL,cDNA (1 000 ng· μL-1) 2 μL,RNsae Free ddH2O 7.3 μL。反应条件为:95 ℃,30 s;95 ℃,5 s;55 ℃,30 s;72 ℃,30 s;共进行45个循环;循环结束后升温至95 ℃,10 s,再降至65 ℃持续60 s,递增至95 ℃, 1 s,采集荧光信号得出扩增产物的溶解曲线,于37 ℃,30 s后结束反应。
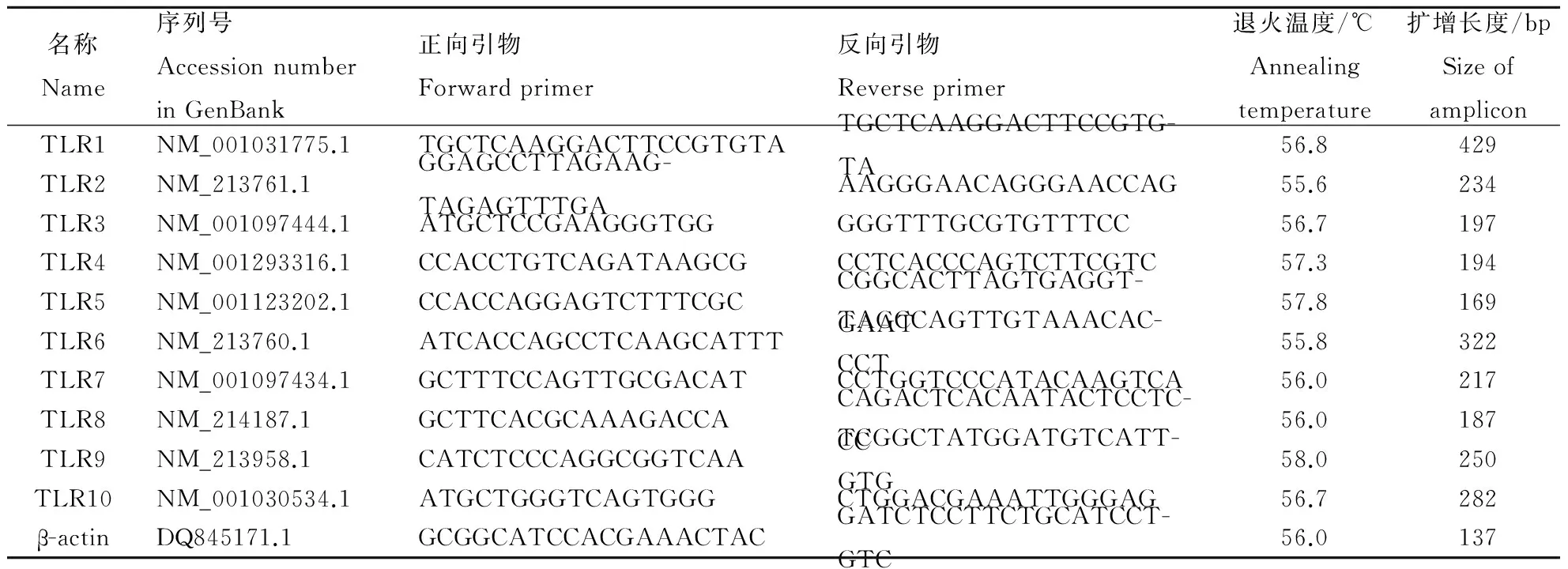
表1 Real-time PCR引物及其反应条件Table 1 Primers and conditions used for Real-time PCR assays
1.2.6 数据分析 在荧光定量PCR中,循环阈值(Ct)是反映模板中目标基因含量的重要指标,通过比较目标基因和内参基因β-actin,消除样品收集和加样操作过程中的误差。采用 2-△△Ct法分析数据。试验数据用SPSS软件进行处理分析,采用Duncan法进行检验差异性。
2 结果与分析
2.1PPV感染PK-15后对细胞形态的影响
根据试验结果计算TCID50,PPV病毒滴度为10-5.5·mL-1,待细胞生长至80%时用PPV感染PK-15细胞(MOI=1),37 ℃吸附后换维持液,并设未接毒细胞对照。于显微镜下记录细胞生长形态(图1),发现当感染PPV后6 h,显微镜下未见明显形态学变化;感染24 h后,可以看到明显的病变;48 h后随着细胞的增殖,对照组细胞密度增加,逐渐开始变圆,感染组细胞病变达到60%以上,病变细胞聚缩成团状,并伴有明显的多层重叠状态,细胞脱落呈空斑状;到60 h时,对照组细胞几乎铺满底部,接毒组出现明显的聚集、裂解等病变现象,细胞病变区域达到100%,并且大面积脱落。
2.2PPV感染PK-15细胞后TLR1~TLR10的mRNA转录情况
PPV感染PK-15细胞后,在0、1、3、6、12、24、36、48、72 h收集细胞,提取细胞RNA,进行荧光定量PCR,与β-actin进行比较分析,得出不同时段细胞内TLR1~TLR10的表达量(图2)。通过荧光定量PCR,发现在各时段感染组和未感染组均有TLR1~TLR10的转录。其中,TLR1 mRNA水平在PPV感染后3 h约为正常水平的3.1倍,其他时段均低于正常水平。在病毒感染后12 h时,TLR2 mRNA表达量开始升高,约为对照组1.8倍,48 h差异达到峰值,约为对照组的10.1倍。TLR3和TLR7 mRNA表达水平在病毒感染早期均低于正常水平,TLR3在60 h和72 h高于正常水平,TLR7在36 h和72 h高于正常水平。TLR4和TLR8均在3、12、36 h较正常水平发生上调,其他时段mRNA表达水平低于正常水平。TLR5在感染后1、3、36 h较正常水平上调,TLR6在病毒感染后3 h达到峰值,约为正常水平的3.8倍。PPV病毒感染后TLR9 mRNA表达量在24 h开始高于对照组,于48 h相对表达量达到峰值,约为对照组的26.7倍,持续到72 h均发生显著上调。其中60 h和72 h分别为正常水平的13.4倍、1.25倍。TLR10 mRNA转录水平在感染后3 h和36 h发生上调,其他时段较正常水平均发生下调。
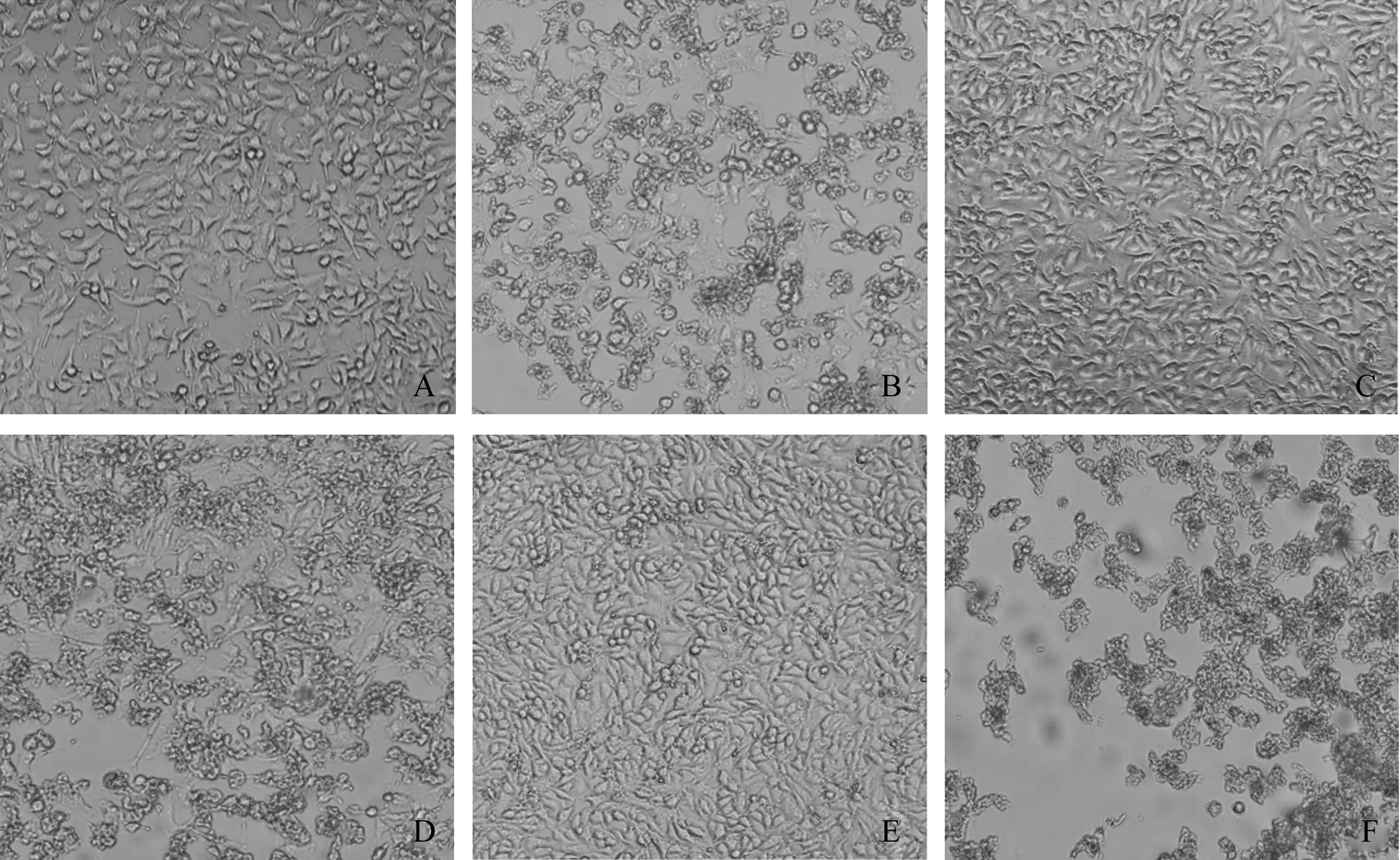
注:A、C和E分别为24、48和60 h的对照细胞;B.、D、F分别为PPV感染后24、48和60 h 细胞。
Note: A, C and E were untreated cell in the post 24, 48 and 60 h, respectively ; B, D and F were PK-15 cells infected with PPV at 24, 48 and 60 h post-infection, respectively.
图1PPV感染PK-15细胞后细胞形态(×100)
Fig.1CellmorphologyofPK-15cellsinfectedwithPPV(×100)
3 结论与讨论
随着分子生物学与病毒学研究的发展,人们对病原微生物的作用机制有了更深入的了解和认识。TLRs和其他分子识别受体能够识别病原微生物的多种PAMPs,这种识别机制使TLRs在先天性免疫和固有免疫中发挥重要作用,然而由于免疫机制的复杂性,人们至今仍然无法系统揭示天然免疫是如何识别微生物病原体的,人们也无法了解天然免疫系统是如何精细调控和诱导获得性免疫的。
近几年研究发现,TLRs在病毒感染中发挥重要作用。徐春利等[16]研究发现,HBV感染中能够激活TLRs,并调节天然免疫应答及获得性免疫应答。XU等[17]研究发现,慢性乙型肝炎(Chronic Hepatitis B, CHB)患者外周血单核细胞(Peripheral blood mononuclear cell, PBMC)和浆样树突细胞(plasmacytoid dendritic cell, pDCs)上TLR7和TLR9 mRNA表达量和TLR7蛋白表达量低于正常人群,而TLR9蛋白表达量高于正常人群;TLR9蛋白表达与HBV病毒DNA呈负相关,TLR9蛋白表达与HBV呈正相关,结果也表明HBV抑制TLR7和TLR9 mRNA表达,推测可能机体对HBV表现出免疫耐受和免疫逃逸。
本研究中在PPV感染细胞后,TLR1、TLR3~ TLR 8和TLR10 mRNA水平在部分时段发生上调,其他时段均低于正常水平,而TLR2和TLR9在感染后发生有规律的显著上调。关于TLR9病毒识别的研究已报道许多,研究发现该过程与自身免疫性疾病性相关[18],但TLR9在PPV病毒的研究中尚未报道。本研究采用PPV感染PK-15细胞,发现PPV处理组的细胞内TLR2和TLR9 mRNA的表达量在处理后前6 h低于正常组细胞,12 h后TLR2及TLR9的mRNA表达量显著高于正常组细胞;因此后续试验研究时间点的设计可以集中在6 h及以后。这一研究结果与张月华等[21]在人细小病毒的研究结果一致。根据本研究可以推测,在感染前期细胞表现免疫耐受,随着细胞的增殖,PPV病毒得到扩增,大量的PPV病毒诱导细胞TLR2和TLR9 mRNA的显著上调;PPV可能通过上调TLR2和TLR9的表达改变机体的免疫应答,导致PPV持续感染。王强等[19]采用SYBR Green I实时荧光定量PCR方法检测传染性单核细胞增多症(Infectious Mononucleosis, IM),患者外周血单核细胞内TLR2和TLR9的表达量,结果发现IM患者体内TLR2和TLR9 mRNA表达量相对于正常人显著上调,而IM恢复期TLR2和TLR9的表达相对下调,推测TLR2与TLR9表达上调能够识别病原体,引发机体免疫应答反应。另有研究发现,TLR9缺陷小鼠的病毒滴度和死亡率较正常小鼠上升,表明TLR9在抗病毒免疫应答反应中发挥重要的作用[20]。因此我们推测,TLR2和TLR9可能能够识别PPV病毒,并通过一定配体活化TLR2和TLR9。试验结果显示,TLR2、TLR9可能在猪感染PPV 24 h后发挥抗病毒作用。
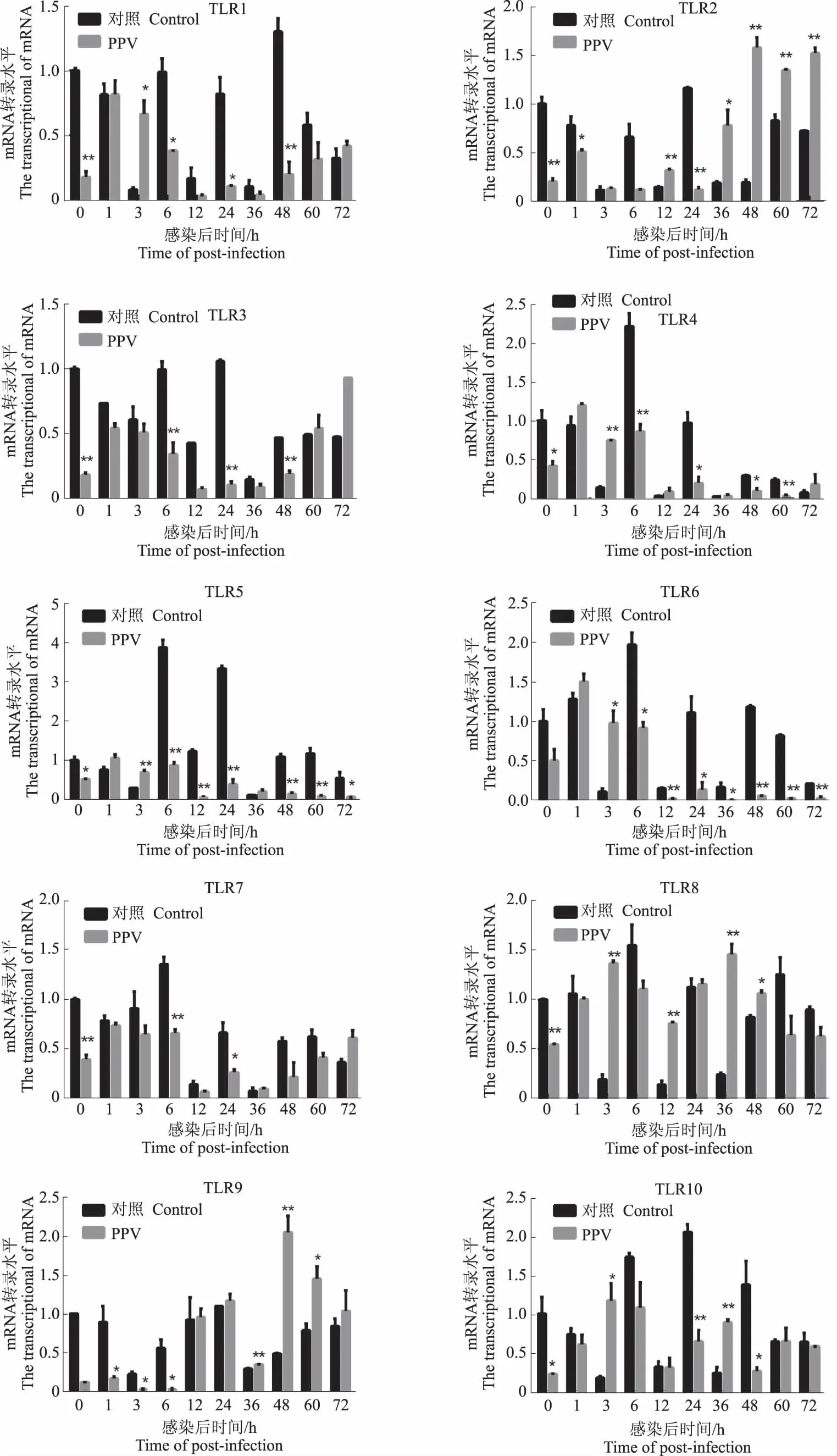
注:星号表示统计感染组和对照组差异显著,*P<0.05和**P<0.01。
Note: An asterisk indicates a statistically significant difference from infected and control cells, *P<0.05 and **P<0.01.
图2PPV感染PK-15后TLR1~TLR10mRNA水平表达情况
Fig.2ThemRNAexpressionofTLR1toTLR10inPK-15cellsafterPPVinfection
[1] XU Y G, CUI L C, WANG H W, et al. Characterization of the capsid proteinVP2 gene of a virulent strain NE/09 of porcine parvovirus isolated in China[J]. Research in Veterinary Science, 2013, 94(2): 219-224.
[2] SHARMA R, SAIKUMAR G. Porcine parvovirus and porcine circovirus 2-associated reproductive failure and neonatal mortality in crossbred Indian pigs[J]. Tropical animal health and production, 2010, 42(3): 515-522.
[3] 魏战勇, 王学兵, 陈红英, 等. 利用Real-time PCR技术检测猪细小病毒在PK-15细胞增殖动态研究[J].河南农业大学学报, 2009, 43(4): 398-401.
[4] 周庆, 郝璐, 周泽强. 固有免疫系统Toll样受体的研究进展[J]. 生物学杂志, 2016, 33(3): 83-87.
[5] TAKAHASI K, YONEYAMA M, NISHIHORI T, et al. Nonself RNA-sensing mechanism of RIG-I helicase and activation of antiviral immune responses[J]. Molecular cell, 2008, 29(4): 428-440.
[6] 杨永峰, 申焕君, 姜泓, 等. Toll样受体4介导的抗病毒固有免疫研究进展[J]. 细胞与分子免疫学杂志, 2016,32(6): 854-858.
[7] ONEILL A J, GOLENBOCK D, BOWIE A G. The history of Toll-like receptors [mdash] redefining innate immunity[J]. Nature Reviews Immunology, 2013, 13(6): 453-460.
[8] BARBER G N. Cytoplasmic DNA innate immune pathways[J]. Immunological reviews, 2011, 243(1): 99-108.
[9] SHIMOSATO T, KITAZAWA H, KATOH S, et al. Swine Toll-like receptor 9 recognizes CpG motifs of human cell stimulant[J]. Biochimica et Biophysica Acta (BBA)-Gene Structure and Expression, 2003, 162(1): 56-61.
[11] KURT-JONES E A, POPOVA L, KWINN L, et al. Pattern recognition receptors TLR4 and CD14 mediate response to respiratory syncytial virus[J]. Nature Immunology, 2000, 1(5): 398-401.
[12] 温立斌, 何孔旺, 杨汉春, 等. 类猪圆环病毒因子P1感染对外周血单个核细胞Toll样受体 mRNA转录的影响[J]. 华北农学报, 2010, 25(6): 9-13.
[13] 宋亚鹏, 孔雪旺, 李金磊, 等. 猪细小病毒感染对猪外周血淋巴细胞抗病毒相关因子转录时相的影响[J]. 河南农业大学学报, 2013,47 (2): 147-151.
[14] 殷震,刘景华.动物病毒学[M].2版.北京:科学出版社,1997.
[15] 李厚伟, 魏战勇, 尹海燕, 等. 猪细小病毒感染 PK-15 细胞抗病毒相关因子转录变化的分析[J]. 畜牧兽医学报, 2011, 42(1): 48-55.
[16] 徐春利, 吴珺, 郑昕, 等. Toll样受体参与慢性HBV感染免疫应答的研究进展[J]. 中华肝脏病杂志, 2014, 22(4): 318-320.
[17] XU N, YAO H P, SUN Z, et a1. Toll-like receptor 7 and 9 expression in penripheral blood mononuclear cells from patients with chronic hepatitis B and related hepatocellular carcinoma[J]. Acta Pharmacol Sin, 2008, 29: 239-244.
[18] DREXLER S K, FOXWELL B M. The role of toll-like receptors in chronic inflammation[J]. Int J Biochem Cell Biol, 2010, 42(4): 506-518.
[19] 王强, 王佐风, 曹玫, 等. TLR2、TLR9及T细胞亚群在传染性单核细胞增多症患儿中的变化及意义[J]. 中国小儿血液与肿瘤杂志, 2013, 18(6): 267-271.
[20] LAROSA D F, GELMAN A E, RAHMAN A H, et al. CpG DNA inhibits CD4+CD25+ Treg suppression through direct MyD88-dependent costimulation of effector CD4+ T cells[J]. Immunology Letters, 2007, 108(2): 182-188.
(责任编辑:蒋国良)
Changesoftoll-likereceptorstranscriptionalprofilesofPK-15cellculturesfollowinginfectionwithporcineparvovirus
ZHOU Yong1,2, JIN Xiaohui1,2, LI Bingxiao1,2, JING Yaxing1, HAN Li1, ZHANG Liwei1,2, WEI Zhanyong1,2
(1.College of Animal Husbandry and Veterinary Science, Henan Agricultural University, Zhengzhou 450002;2.Key Laboratory for Animal-derived Food Safety of Henan Province, Zhengzhou 450002, China)
This study was conducted to detect the expression of TLRs after PPV infected PK-15 cell, which aimed to explove the theoretical basis of proven PPV infection mechanism.The transcription of TLR1-10 in PPV infected PK-15 cells was detected by real-time PCR method. The results showed that TLR1 in PK-15 cells after PPV infection up-regulated in 3 hours and was about 3.1 times of the control group cells, other times were lower than the normal level; TLR3 and TLR7 mRNA expression in the initial stage of infection were lower than the normal level; the content of mRNA TLR4 and TLR8 were 3, 12 and 36 h after infection increased; TLR10 expression in 3 h and 36 h increased respectively, other times were reduced to varying degrees; while TLR2 and TLR9 expression level of mRNA in 24 h after infection began to increase, and reached the peak at 48 h, and respectively 10.1 times and 26.7 times higher than those in blank. Studies show that PPV infected PK-15 cells can induce the TLR2 and TLR9 in the mRNA level was significantly increased.PPV infection may be mediated by TLR2 and TLR9 receptors.
porcine parvovirus; Toll-loke receptor; PK-15 cell; transcriptional profiles
S858.28
:A
2016-11-25
国家自然科学基金项目(U140410985)
周 雍(1990-),女,河南周口人,硕士研究生,主要从事病原生物学和分子病毒学方面的研究。
魏战勇(1975-),男,河南安阳人,教授,博士。
1000-2340(2017)02-0201-06

