高效长链烷烃降解菌ZKNU01的选育及其降解特性
李 兵, 张 博
(1.周口师范学院生命科学与农学学院,河南 周口 466000; 2.周口师范学院稀土功能材料及应用重点实验室,河南 周口 466000)
高效长链烷烃降解菌ZKNU01的选育及其降解特性
李 兵1, 张 博2
(1.周口师范学院生命科学与农学学院,河南 周口 466000; 2.周口师范学院稀土功能材料及应用重点实验室,河南 周口 466000)
通过富集分离筛选出1株高效长链烷烃降解菌,采用形态学、生理生化试验、16S rDNA序列比对和BBL Crystal AutoReaders进行菌种鉴定,并通过UV和GC-MS检测菌株对长链烷烃的降解特性。结果表明,分离到的1株长链烷降解烃菌,经鉴定为AchromobacterxylosoxidansZKNU01。该菌能高效降解长链烷烃C15~C32,生长温度范围0~45 ℃,最适生长温度37 ℃,在接种量为106 CFU·mL-1,原油质量浓度为0.5 kg·L-1,振荡培养7 d时,降解率可达82.06%。石油中长链烷烃C15~C32以单末端氧化方式被完全降解。
长链烷烃;生物降解;Achromobacterxylosoxidans
目前,石油泄漏已给全球海洋和陆地带来严重的生态和环境问题[1-2]。生物技术在石油污染治理中具有经济、高效、无污染的特点,而长链烷烃是石油的主要组成部分,因此对微生物降解长链烷烃的研究至关重要[3-4]。WENTZEL等[5]报道Pseudomonas,Rhodococcusspp.等可利用n-C12~n-C36烷烃做为碳源和能源。近几年来,关于Achromobacterxylosoxidans对长链烷烃的微生物降解虽然也有研究,但还不够深入,特别是对长链烷烃降解机理还有待进一步探讨[6]。本研究筛选到1株高效长链烷烃降解菌,鉴定为AchromobacterxylosoxidansZNKU01,并对其对长链烷烃的降解特性进行研究。
1 材料与方法
1.1材料
1.1.1 试验材料 采自辽河油田钻井机旁被填埋的油泥、油砂和附近的土壤。
1.1.2 试剂 (NH4)2PO4、KH2PO4、K2HPO4、Na2SO4、CaCl2、KNO3、FeCl3、MgCl2、环已烷、正十六烷、二乙醚等为分析纯;琼脂、牛肉膏、蛋白胨等为生化试剂。
1.1.3 仪器 LRH生化培养箱,ZHWY-2102恒温培养摇床,UV-2600型可见紫外分光光度计,FEI Quanta 200扫描电子显微镜,BBL Crystal AutoReader,Agilent 7890A-5977B型GC-MS。
1.1.4 培养基[7]基础无机盐培养基:(NH4)2HPO40.825 g·L-1、KH2PO40.5 g·L-1、K2HPO43.815 g·L-1、Na2SO40.2 g·L-1、CaCl20.02 g·L-1、KNO31.262 5 g·L-1、FeCl30.002 g·L-1、MgCl20.02 g·L-1。
富集培养基:基础无机盐培养基加入原油5.0 g·L-1。
分离培养基:富集培养基加入2.0%琼脂。
菌种纯化培养基:LB培养基。
1.2方法
1.2.1 菌株分离纯化 取5 g石油污染样品加入装有l00 mL富集培养基的250 mL三角瓶中,37 ℃,150 r·min-1摇床培养7 d。取5 mL富集培养基同条件培养,重复2次。用接种环蘸取富集液在分离培养基上划线分离。挑取生长速度快且降解斑大的菌落进行纯化,对纯化的菌株编号,保存备用。
1.2.2 石油降解率测定 试验组以石油为唯一碳源和能源进行菌体培养,接种量106 CFU·mL-1,37 ℃,150 r·min-1摇床培养7 d;对照组以不接菌的处理为对照,与试验组同条件培养。用环己烷分别提取试验组和对照组培养物残油组分,按文献[7]的方法测算石油降解率,降解率计算公式如下:
降解率(%)= (W0-W1)/W0×100。
式中:W0为初始石油质量(g);W1为接菌样品的残油质量(g)。选取降解能力最强的菌株进行下一步研究。
1.2.3 菌株鉴定 通过形态学观察,生理生化试验,16S rDNA序列比对和系统进化树分析,BBL Crystal AutoReader微生物鉴定系统将菌株鉴定到种。
1.2.4 菌株降解特性分析 采用GC-MS分析试验组和对照组提取物组分差异[8]。以正十六烷为唯一碳源和能源进行菌体培养,待稳定期收集菌体,经生理盐水清洗,超声破碎和二乙醚提取,最后对提取物进行GC-MS分析,确定烷烃降解途径。
2 结果与分析
2.1菌株筛选
筛选到1株高效、稳定的长链烷烃降解菌,命名为ZKNU01,其生长温度范围0~45 ℃,最适生长温度为37 ℃。
2.2菌株鉴定
2.2.1 形态学和生理生化鉴定 将纯化获得的菌株ZKNU01进行形态观察及生理生化试验,结果见图1、图2和表1。
图1 菌株ZKNU01菌落照片Fig.1 Colony photo of strain ZKNU01

图2 菌株ZKNU01扫描电镜照片(×20 000)Fig.2 SEM of strain ZKNU01(×20 000)
2.2.2 16S rDNA序列分析 使用Blastn(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行序列同源性比较;MEGA4.0软件构建系统发育树(图3)。通过16s rDNA序列比对分析,菌株ZKNU01与AchromobacterxylosoxidansH的菌种有高度的同源性。本研究中所获序列已提交Genebank,序列号为KU254650。
综合菌株ZKNU01的形态特征、生理生化、16S rDNA序列比对分析和BBL Crystal AutoReader鉴定结果,将菌株ZKNU01鉴定为Achromobacterxylosoxidans。
2.3菌株降解特性
用环已烷提取对照组和试验组培养物残油组分,经测定接种量106 CFU·mL-1,37 ℃,振荡培养7 d ,菌株ZKNU01的降解率为82.06 %。经GC-MS分析,对照组含有C15~C3218种长链正构烷烃(图4),试验组中C15~C32这18种长链正构烷烃已被完全降解,其中未降解组分C18、C23、C25、C28为长链支链烷烃和杂环芳香烃(图5)。
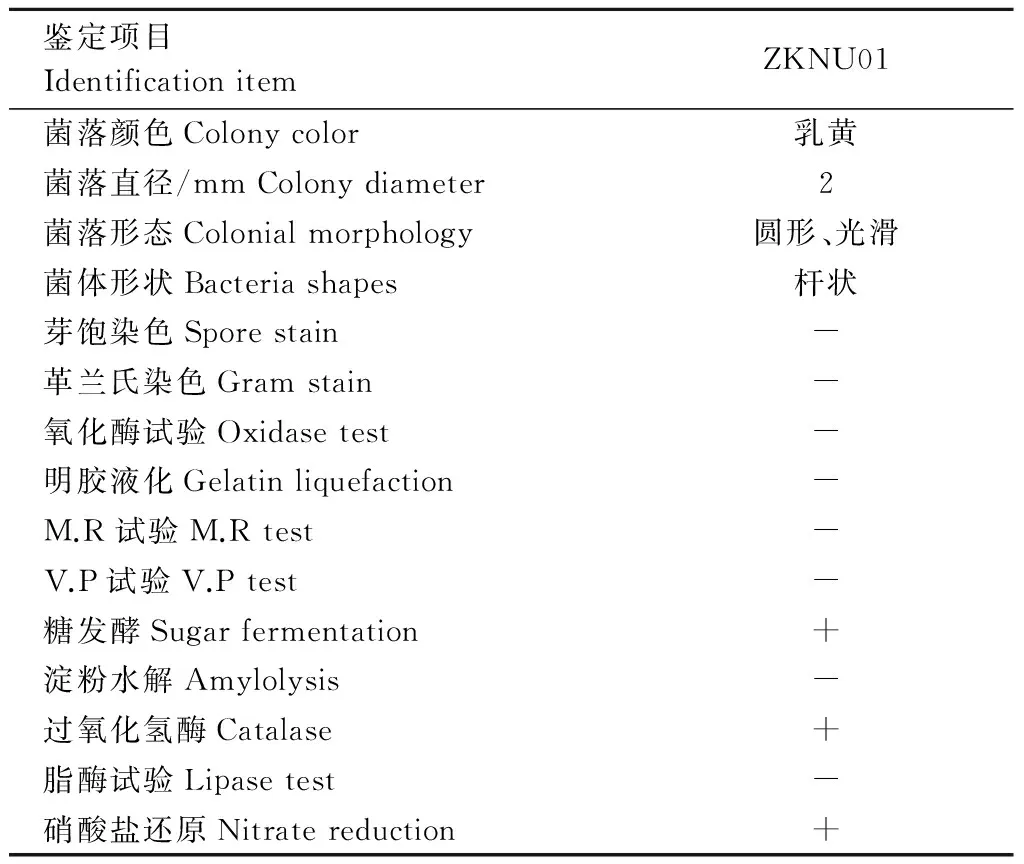
表1 菌株形态学观察和生理生化试验结果Table 1 Characteristics of strain ZKNU01
注:“+”为阳性,“-”为阴性。
Note: “+” is positive, “-” is negative
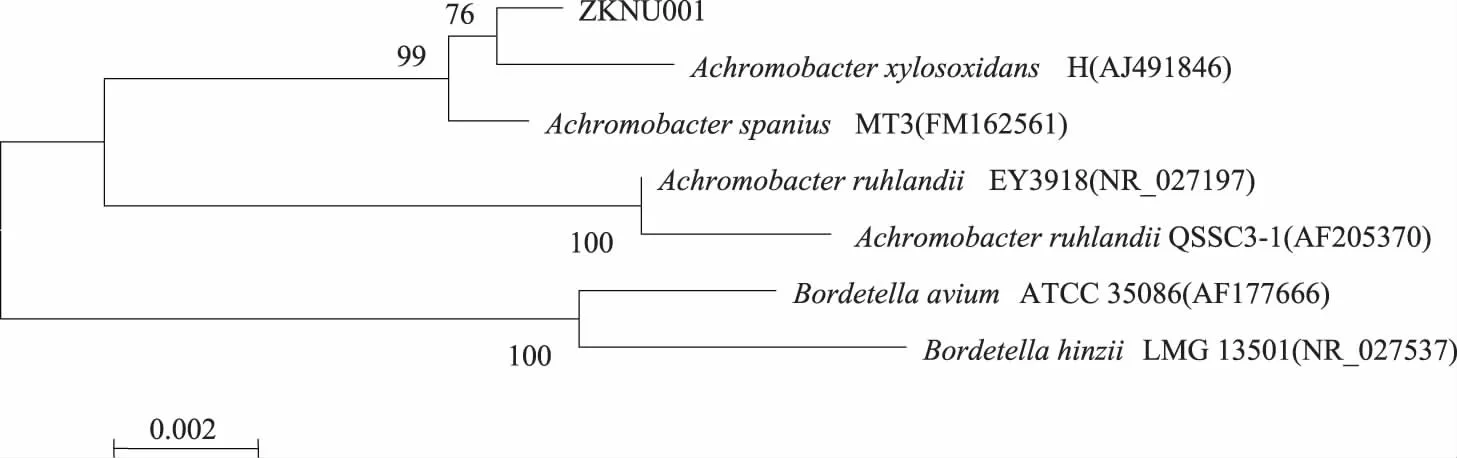
图3 菌株ZKNU01 16S rDNA系统发育树Fig.3 The phylogenetic dendrogram of strain ZKNU01 based on 16S rDNA
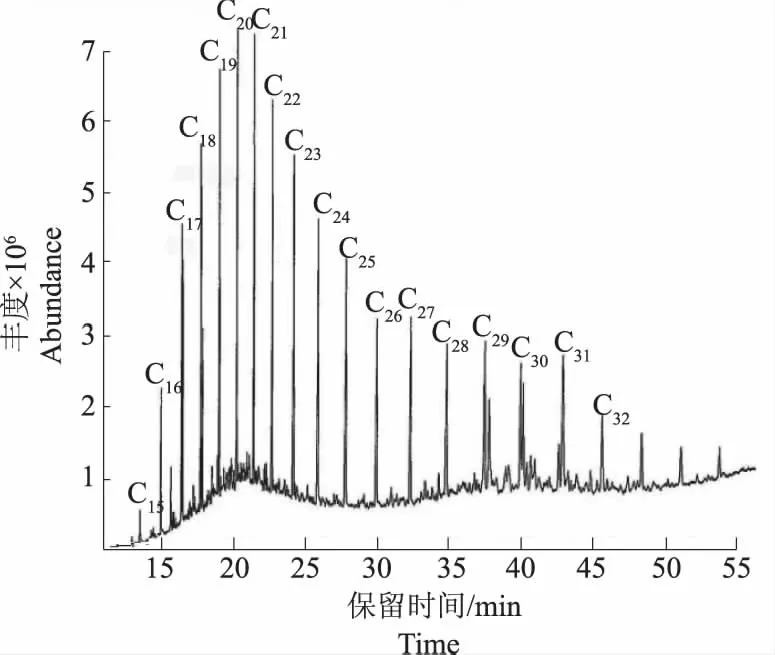
图4 对照组提取物TIC图谱Fig.4 Total ion chromatogram (TIC) of the extract of abiotic control
对处于稳定期的ZKNU01菌体进行提取和GC-MS检测,结果在提取物中不仅检测到正十六烷,还检测到它的氧化中间产物正十六醛(图6、图7),表明AchromobacterxylosoxidansZKNU01是通过单末端氧化途径来降解正链烷烃。
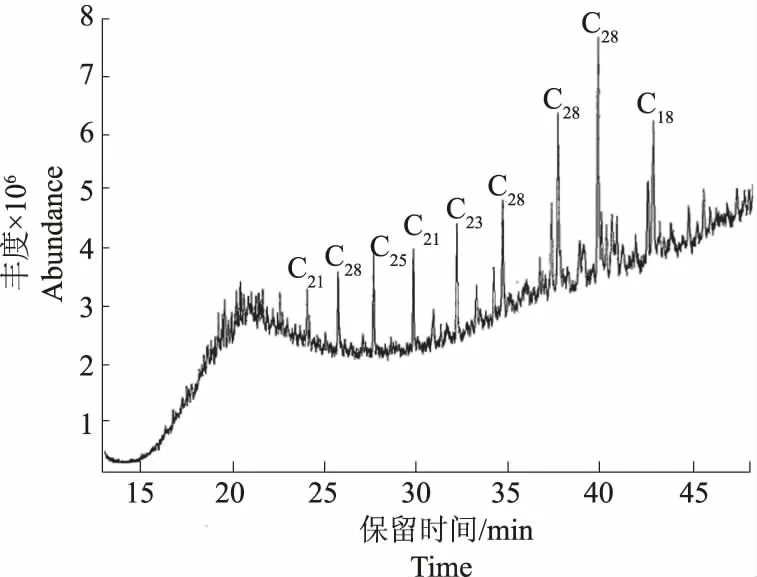
图5 试验组提取物TIC图谱Fig.5 TIC of the extract of experimental group
3 结论
本研究从辽河油田石油污染土壤样品中分离到1株菌株,鉴定为AchromobacterxylosoxidansZKNU01。该菌能够以长链烷烃为唯一碳源获得良好生长,生长温度范围0~45 ℃,最适生长温度37 ℃,在接种量为106 CFU·mL-1,原油质量浓度为0.5 kg·L-1, 振荡培养7 d时, 降解率可达82.06%。GC-MS分析表明,菌株ZKNU01对长链烷烃有较好的降解效果,石油中长链烷烃C15~C32已被完全降解。以正十六烷为唯一碳源对菌株ZKNU01进行培养,同时在ZKNU01的细胞提取物中检测到正十六烷及其中间产物正十六醛,结果证明AchromobacterxylosoxidansZKNU01是通过单末端氧化途径降解正链烷烃。在检测过程中并未发现正十六醇,我们推测菌株ZKNU01中烷烃羟化酶和乙醇脱氢酶活性比乙醛脱氢酶高。虽然AchromobacterxylosoxidansXL对长链烷烃降解也曾有报道[6],但其降解效率与本研究中的ZKNU01菌株相比仍有较大差距,且并未对长链烷烃降解机理进行研究。

图6 菌株ZKNU01提取物GC-MS分析结果Fig.6 GC-MS analysis of total crude extract of strain ZKNU01
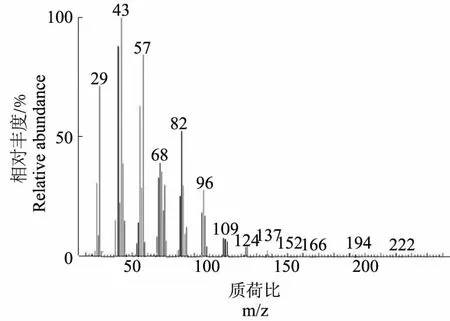
图7 正十六醛MS图谱Fig.7 MS spectrum of n-Hexadecanal
生物修复能够加速石油污染物的降解,在治理石油污染方面具有重大的经济、社会和环境效益[8-9]。研究表明,烷烃降解菌可以通过产生生物表面活性剂来有效提高疏水性有机污染物的生物可利用性,强化其生物降解过程[10]。因此,利用烷烃降解菌来协助解决石油污染问题具有广阔的应用前景。
[1] ATLAS R M, HAZEN T C. Oil biodegradation and bioremediation: a tale of the two worst spills in U.S. history [J]. Environmental Science & Technology,2011,45(16):6709-6715.
[2] XU H L, CHEN J N, WANG S D, et al. Oil spill forecast model based on uncertainty analysis: a case study of Dalian oil spill[J].Ocean Engineering,2012,54(9):206-212.
[3] BIHARI Z, SZABó Z, SZVETNIK A, et al. Characterization of a novel long-Chain n-alkane-degrading strain, Dietzia sp. E1[J]. Zeitschrift Für Naturforschung C Journal of Biosciences,2010,65 (11/12):693-700.
[4] YANTO D H Y, TACHIBANA S. Biodegradation of petroleum hydrocarbons by a newly isolated sp. NG007[J]. International Biodeterioration & Biodegradation,2013,85(11): 438-450.
[5] WENTZEL A, ELLINGSEN T E, KOTLAR H K, et al. Bacterial metabolism of long-chain n-alkanes[J]. Applied Microbiology & Biotechnology,2007,76(6):1209-1221.
[6] 司美茹,赵云峰,苏涛.高效降解烷烃的无色杆菌XL株的分离鉴定及其降解特性[J].土壤通报,2011, 42(3):562-567.
[7] GOPINATHAN R, PRAKASH M, BHARATHIRAJAN R. An experimental study for crude oil biodegradation in contaminated soil[J]. International Journal of Current Microbiology and Applied Sciences,2012,1(1):12-16.
[8] LIU H, XU J, LIANG R, et al. Characterization of the medium and long-chain n-alkanes degradingPseudomonasaeruginosastrain SJTD-1 and its alkane hydroxylase genes[J].Plos One.2014,9(8):e105506.
[9] BOUTHEINA G, FATMA K, NAJLA M, et al. Bioremediation of petroleum hydrocarbons-contaminated soil by bacterial consortium isolated from an industrial wastewater treatment plant[J]. Journal of Chemical Technology & Biotechnology,2014,89(7):978-987.
[10] GARCIA I N S, OLIVEIRA V M D. Microbial hydrocarbon degradation: efforts to understand biodegradation in petroleum reservoirs[M]//ROLANDO C, FRANCISCA R. Biodegradation. Engineering and Technology.London: InTech,2013,47-72.
(责任编辑:朱秀英)
Screeningofahigh-efficiencylong-chainalkane-degradingbacteriaZKNU01anditsdegradationcharacteristics
LI Bing1, ZHANG Bo2
(1.College of Life Science and Agiculture, Zhoukou Normal College, Zhoukou 466000,China; 2.The Key Laboratory of Rare Earth Functional Materials and Applications, Zhoukou Normal College, Zhoukou 466000, China)
A long-chain alkane-degrading bacteria was obtained by enriched culture, and identified based on morphological, physiological and biochemical tests,16S rDNA sequence alignment and BBL Crystal AutoReader tests. The degradation characteristics were determined by UV spectrophotometry and GC-MS. The results showed that, a newly isolated strain, identified asAchromobacterxylosoxidansZKNU01, proved to have an excellent ability to degrade n-C15~n-C32alkane components of crude oil. The temperature range for its growth was 0~45 ℃ (optimum at 37 ℃). Strain ZKNU01 could remove 82.06% of oil at 0.5 kg·L-1concentration and 106CFU·mL-1inoculum within 7 d at 37 ℃. n-alkanes C15~C32in oil were completely depleted via the monoterminal oxidation pathway.
long-chain alkane; biodegradation;Achromobacterxylosoxidans
X172
:A
2016-05-13
国家自然科学基金项目(21503285)
李 兵(1983-),男,河南周口人,硕士研究生,主要从事环境生物学方面的研究。
1000-2340(2017)02-0226-04

